扩展功能
文章信息
- 张霞, 郑佳, 赵东, 乔宗伟, 安明哲, 杨康卓, 罗青春
- ZHANG Xi, ZHENG Jia, ZHAO Dong, QIAO Zong-Wei, AN Ming-Zhe, YANG Kang-Zhuo, LUO Qing-Chun
- 多粮浓香型白酒中特征酵母菌与耐酸乳杆菌的关系
- Relationship between typical yeasts and Lactobacillus acetotolerans in multi-grain strong aroma Baijiu
- 微生物学通报, 2019, 46(7): 1571-1581
- Microbiology China, 2019, 46(7): 1571-1581
- DOI: 10.13344/j.microbiol.china.181015
-
文章历史
- 收稿日期: 2018-12-13
- 接受日期: 2019-02-20
- 网络首发日期: 2019-04-04
浓香型白酒是我国传统固态白酒中最重要的白酒香型之一,其酿造过程是一个多种微生物协同转化底物产生复杂风味成分的过程,研究微生物菌株之间的相互协作关系,尤其是功能菌株间相互关系,对认识白酒酿造机理以及调控白酒品质有重要意义[1]。
酿酒功能微生物主要包括酵母、霉菌和细菌三大类,尤其是酵母和细菌对白酒呈香物质的形成具有重要作用[2-3]。由于泥窖窖池内长期处于厌氧状态,酵母菌和细菌的代谢作用在浓香型糟醅发酵过程中很大程度上决定了白酒的产量和质量。传统白酒发酵过程中不同菌株之间的相互作用表现为共生、竞争、抑制等关系[4]。在厌氧条件下,乳酸菌代谢产生乳酸等有机酸,酵母菌代谢生成乙醇,而乳酸及脂肪酸又可与乙醇作用形成酯类等[5]。有研究认为,乳酸菌和酵母菌之所以能够在一个体系中共存,是因为在各自的发酵过程中能够为对方提供能量或营养物质(前者的代谢产物为后者提供能量,后者在发酵过程中又为前者提供氨基酸、维生素和等许多营养物质)[6-7]。耐酸乳杆菌是浓香型白酒糟醅发酵过程中一个较为优势的菌群。目前多菌种混合发酵的研究主要包括酵母菌和细菌的混合发酵[8-10],以及非酿酒酵母与酿酒酵母之间的混合发酵[11],而针对酿酒酵母与耐酸乳酸菌混合发酵的机理研究还未见报道。
因此,本研究从多粮浓香型糟醅中分离得到特征性酵母菌和耐酸乳酸菌,以五粮粉糖化液为发酵培养基,探究多粮浓香型白酒中特征性酵母菌和耐酸乳酸菌的互作关系,为更深入地认识多粮浓香型白酒发酵机理、实现发酵过程优化提供理论基础。
1 材料与方法 1.1 材料 1.1.1 糟醅采样样品采集自宜宾五粮液股份有限公司窖龄为20年的窖池,将采集的糟醅样品放入无菌袋并密封,及时送实验室进行微生物的分离筛选。
1.1.2 菌株酵母菌Kazachstania humilis Z1、Pichia kudriavzevii Z2、Candida ethanolica Z3、耐酸乳杆菌Lactobacillus acetotolerans W,均分离自上述发酵糟醅且由本实验室保藏。
1.1.3 培养基酵母菌分离筛选与培养分别使用麦芽汁琼脂培养基和YPD培养基,乳酸菌分离筛选与培养分别使用MRS琼脂培养基和MRS培养基。
麦芽汁琼脂培养基(g/L):麦芽膏粉130.0,氯霉素0.1,琼脂20.0,青霉素1.0。
YPD培养基(g/L):蛋白胨20.0,酵母膏10.0,葡萄糖20.0。
MRS培养基(g/L):蛋白胨10.0,牛肉粉5.0,酵母粉4.0,葡萄糖20.0,K2HPO4·7H2O 2.0,CH3COONa·3H2O 5.0,C6H5O7(NH4)3 2.0,MgSO4·7H2O 0.2,MnSO4·4H2O 0.05,吐温-80 1.00 mL。
MRS琼脂培养基为MRS培养基中添加2%琼脂和1 g/L制霉菌素。
共培养培养基:五粮粉[12]糖化液,将糖度终浓度调至12-13° Bx。
1.2 主要试剂和仪器葡萄糖(分析纯),国药集团化学试剂有限公司;青霉素、制霉菌素、Ezup柱式真菌基因组DNA抽提试剂盒、Ezup柱式细菌基因组DNA抽提试剂盒,生工生物工程(上海)股份有限公司;API 20A CUX鉴定试剂盒、API 50CHL鉴定试剂盒,生物梅里埃公司;乙醇(HPLC,纯度为99.8%),Honeywell公司;4-辛醇(GC),Sigma-Aldrich公司。
毛细管色谱柱TG-WAX (30.0 m×0.25 mm× 0.25 μm),Thermo公司;固相微萃取手柄和50 μm CAR/DVB/PDMS纤维萃取头,Supelco公司;气质联用仪(GC/MS)和液相色谱仪,Agilent公司;PAL RTC2多功能样品前处理平台(带有HS模块和SPME模块),CTC公司;离心机,Eppendorf公司;显微镜,Olympus公司;pH计,WTW公司;生化培养箱,上海一恒科技仪器有限公司。
1.3 方法 1.3.1 菌株筛选(1) 酵母菌的分离筛选[13]:将样品稀释液均匀涂布于麦芽汁琼脂培养基上,28 ℃培养,待菌落长出后挑选菌落形态不同的酵母单菌落于麦芽汁琼脂培养基中,编号并划线纯化,直至平板上的菌落都为同一形态。利用传代培养法,在4 ℃下进行斜面保存并编号。
(2) 乳酸菌的分离筛选:方法同酵母菌的分离筛选。平板使用的是MRS琼脂培养基,37 ℃培养。
1.3.2 菌株形态学研究菌落形态观察:酵母菌划线于YPD平板28 ℃培养2-3 d,单菌落观察并记录其大小、颜色、形状、质地、透明度、边缘、湿润程度等菌落特征;乳酸菌划线于MRS琼脂培养基37 ℃厌氧培养3-4 d,单菌落观察。
显微镜观察细胞形态:挑取单菌落于5 mL YPD液体培养基中28 ℃、120 r/min振荡培养24 h,显微镜下观察酵母菌细胞的形态特征;挑取单菌落于5 mL MRS液体培养基中,37 ℃厌氧培养3 d,显微镜下观察乳酸菌细胞的形态特征。
1.3.3 菌株生理生化鉴定酵母菌生理生化鉴定:按照API 20A CUX鉴定试剂盒所述方法测定酵母菌株的生理生化特征。假菌丝观察:将酵母接种于玉米粉琼脂培养基上,28 ℃培养3 d,观察酵母是否含有假菌丝。
乳酸菌生理生化鉴定:按照API 50CHL鉴定试剂盒所述方法测定乳酸菌株的生理生化特征。
1.3.4 菌株分子鉴定酵母菌基因组DNA的提取:将活化的酵母菌株接入40 mL麦芽汁培养基中,160 r/min、28 ℃培养24 h后,12 000 r/min离心5 min获得菌体,用Ezup柱式真菌基因组DNA抽提试剂盒提取酵母菌株的基因组DNA,置于-20 ℃备用。
乳酸菌基因组DNA的提取:乳酸菌接入MRS培养基,37 ℃厌氧培养2-3 d后,12 000 r/min离心5 min获得菌体,用Ezup柱式细菌基因组DNA抽提试剂盒提取乳酸菌的基因组DNA,置于-20 ℃备用。
酵母菌及乳酸菌的基因组DNA委托生工生物工程(上海)股份有限公司完成26S rRNA D1/D2区和16S rRNA基因克隆测序。
所有序列已在GenBank中注册并获得登录号:MK310149-MK310152。
1.3.5 菌株液态发酵培养菌株种子液以终浓度酵母菌活菌数105-106个/mL菌液、耐酸乳杆菌活菌数106-107个/mL菌液,按照如下方案接入到培养基中:纯培养体系包括酵母菌K. humilis Z1 (Z1)、P. kudriavzevii Z2 (Z2)、C. ethanolica Z3 (Z3)、耐酸乳杆菌L. acetotolerans W (W);共培养体系包括Z1 & W、Z2 & W和Z3 & W。
培养液装液量为80%,密封发酵,同一处理的样品做3组平行,最终的测定结果以平均值表示。培养周期为15 d,发酵第0、3、7、10、15天取出测定其活菌数、理化指标、有机酸和挥发性成分。
1.3.6 理化指标的测定发酵液pH:用pH计测定。
发酵液中乙醇的含量:使用顶空进样法检测纯培养和混合发酵体系中乙醇的含量,方法参照文献[14-15]。标准曲线:y=50 740 000x,相关系数:0.998 3,回收率:100.1%。
发酵液中乳酸的含量:使用高效液相色谱的方法检测纯培养和混合发酵体系中乳酸的含量,实验方法参照文献[16]。标准曲线:y=0.284x-3.044 6,相关系数:0.999 6,回收率:101.9%。
1.3.7 挥发性代谢物的测定使用顶空固相微萃取(HS-SPME)萃取挥发性代谢物,并利用GC-MS检测纯培养和混合发酵体系中挥发性代谢物的含量,方法参照文献[17-19]。
吸取2 mL发酵液于20 mL顶空样品瓶中,加入内标(4-辛醇,终浓度0.5 mg/L),60 ℃平衡15 min,插入萃取头吸附45 min,随后插入GC进样口热解析3 min。
利用GC/MS分析发酵液中的挥发性代谢物。色谱和质谱条件为:进样口温度230 ℃,载气(He)流速1 mL/min,不分流模式进样;气相色谱升温程序:起始炉温40 ℃,保持5 min,以4 ℃/min升至230 ℃,保持15 min。质谱EI源,电子轰击能量70 eV;离子源温度200 ℃,四级杆温度150 ℃,质量数扫描范围35-350 amu。
1.4 数据分析使用MeV软件[20]进行挥发性代谢物热图的绘制和分析。
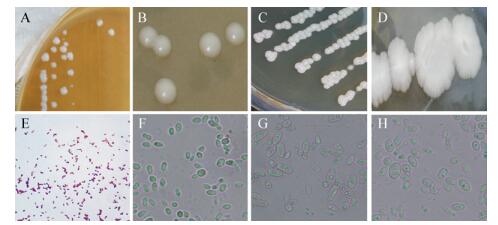
2 结果与分析 2.1 菌株形态特征根据高通量对浓香型糟醅样品中优势微生物菌群的测序结果[21-23],本研究共分离到3株优势特征性酵母菌和1株耐酸乳杆菌,菌落和显微镜形态结构如图 1所示。乳酸菌W菌落(图 1A)呈乳白色、表面湿润光滑、边缘整齐、中间凸起,微观形态(图 1E)为短杆状、2.0 μm、革兰氏染色阳性。酵母菌Z1菌落(图 1B)呈黄褐色、不透明、表面光滑、边缘整齐,微观形态(图 1F)为椭圆形、约2 μm-3 μm、单核、出芽。酵母菌Z2菌落(图 1C)呈浅黄色,表面干燥,边缘不整齐,微观形态(图 1G)为长圆形,约5 μm-6 μm、无核。酵母菌Z3菌落(图 1D)呈白色、中间光滑、边缘有白色圈、边缘干燥不整,微观形态(图 1H)为卵圆形、约2 μm-3 μm、单核或多核、出芽。
|
| 图 1 酵母菌和耐酸乳杆菌的菌落和微观形态 Figure 1 The colony morphologies and micromorphologies of yeast and Lactobacillus acetotolerans Note: A, B, C and D stand for the colony morphology of L. acetotolerans, K. humilis, P. kudriavzevii and C. ethanolica; E, F, G and H stand for the micromorphologies of L. acetotolerans, K. humilis, P. kudriavzevii and C. ethanolica. |
|
|
| 底物Substrate | Z1 | Z2 | Z3 |
| 阴性对照Negative control | - | - | - |
| 葡萄糖Glucose | + | + | + |
| 甘油Glycerin | + | + | - |
| 2-酮基-葡萄糖酸盐2-Keto-gluconate | - | - | - |
| L-阿拉伯糖L-Arabinose | - | - | - |
| D-木糖D-Xylose | - | - | - |
| 侧金盏花醇Adonitol | - | - | - |
| 木糖醇Xylitol | - | - | - |
| D-半乳糖D-Galactose | + | - | - |
| 肌醇Inositol | - | - | - |
| 山梨醇Sorbitol | - | - | - |
| Α-甲基-D-葡萄糖α-Methyl-D-glucose | - | - | - |
| N-乙酰氨基葡萄糖N-Acetylglucosamine | - | + | + |
| 纤维二糖Cellobiose | - | - | - |
| 乳糖Lactose | - | - | - |
| 麦芽糖Maltose | - | - | - |
| 蔗糖Sucrose | + | - | - |
| 海藻糖Trehalose | + | - | - |
| 松三糖Pine trisaccharide | - | - | - |
| 棉子糖Raffinose | + | - | - |
| 形态学试验Morphological test | - | - | - |
| 注:+:阳性;–:阴性. Note: +: Positive; –: Negative. | |||
| 底物Substrate | W |
| 阴性对照Negative control | - |
| 丙三醇Glycerol | - |
| 赤藻糖醇Erythritol | - |
| 阿拉伯糖D-Arabinose | - |
| L-阿拉伯糖L-Arabinose | - |
| D-核糖D-Ribose | + |
| D-木糖D-Xylose | - |
| L-木糖L-Xylose | - |
| D-核糖醇D-Ribitol | + |
| 甲基-β-D-吡喃木糖苷Methyl-β-D-pyranoside | - |
| D-半乳糖D-Galactose | + |
| D-葡萄糖D-Glucose | + |
| D-果糖D-Fructose | + |
| D-甘露糖D-Mannose | + |
| L-山梨糖L-Sorbose | + |
| 鼠李糖L-Rhamnose | - |
| 卫矛醇Dulcitol | - |
| 肌醇Inositol | + |
| 甘露醇Mannitol | + |
| 山梨醇Sorbitol | + |
| 甲基-α-D-吡喃甘露糖苷Methyl-α-D-mannopyranoside | - |
| 甲基-α-D-吡喃葡萄糖苷Methyl-α-D-glucopyranoside | - |
| N-乙酰葡萄糖胺N-acetyl-glucosamine | + |
| 苦杏仁苷Laetrile | + |
| 熊果苷Arbutin | + |
| 七叶灵柠檬酸铁Esculin and ferric citrate | + |
| 水杨苷Salicin | + |
| 纤维二糖D-Cellobiose | + |
| 麦芽糖D-Maltose | + |
| 乳糖D-Lactose | + |
| 蜜二糖D-Melibiose | - |
| 蔗糖D-Sucrose | + |
| 海藻糖D-Trehalose | + |
| 菊粉Inulin | - |
| 松三糖D-Melezitose | + |
| 棉子糖D-Raffinose | - |
| 淀粉Starch | - |
| 糖原Glycogen | - |
| 木糖醇Xylitol | - |
| 龙胆二糖D-Aentiobiose | + |
| 土伦糖D-Toulon sugar | + |
| 来苏糖D-Lyxose | - |
| 塔格糖D-Tagatose | + |
| 岩藻糖D-Fucose | - |
| 岩藻糖L-Fucose | - |
| 阿拉伯醇D-Arbaitol | - |
| 阿拉伯醇L-Arbaitol | - |
| 葡萄糖酸钾Potassium gluconate | + |
| 2-酮基葡萄糖酸钾2-Keto-potassium gluconate | - |
| 5-酮基葡萄糖酸钾5-Keto-potassium gluconate | - |
| 注:+:阳性;–:阴性. Note: +: Positive; –: Negative. | |
由表 1可知,3株酵母菌均可利用葡萄糖。菌株Z1还可以利用D-半乳糖、蔗糖、海藻糖和棉子糖4种糖,不可利用L-阿拉伯糖、D-木糖、N-乙酰氨基葡萄糖、纤维二糖、乳糖、麦芽糖和松三糖,以及所有醇类;菌株Z2除可利用葡萄糖外,仅可利用N-乙酰氨基葡萄糖;菌株Z3和Z2相似,都可利用葡萄糖和N-乙酰氨基葡萄糖作为碳源发酵,只是Z3不能利用甘油。形态学试验方面此3株酵母菌均未检测到菌丝。
由表 2可知,耐酸乳杆菌W可以利用的碳源比较多,不可利用D-乳糖、阿拉伯糖、木糖、淀粉、糖原。
2.3 菌株的分子鉴定结果将各菌株的测序数据导入NCBI数据库中进行相似序列搜索,选取相似度较高的典型菌株的26S rRNA D1/D2区域序列和16S rRNA基因序列作为参比对象;利用MEGA 5.0软件进行多序列比对,Kimura-2模型计算进化距离,最后采用邻接(Neighbor-Joining)法绘制系统发育树,其中进化树拓扑分析为1 000次重复取样的结果[24]。这4株菌构建系统发育树如图 2所示。Z1与K. humilis的相似性为100%,Z2与P. kudriavzevii相似性为100%,Z3与C. ethanolica和L. acetotolerans相似性分别为100%和97%,说明这些微生物与相应的模式微生物在特征基因序列上具有高度的相似性。同时,结合形态学、生理生化结果,将菌株Z1、Z2、Z3、W分别鉴定为K. humilis、P. kudriavzevii、C. ethanolica、L. acetotolerans。

|
| 图 2 菌株系统发育树 Figure 2 Phylogenetic tree of strains 注:采用邻接法对丰度大于1%的菌株序列构建系统发育树;分支点的数字为分子的Bootstrap值(%),标尺表示核酸距离,分支长度为相似度.树支末端信息包含分类的种名和NCBI登录号. Note: Construction of a phylogenetic tree for strain sequences with abundance greater than 1% using the Neighbor-Joining method. The number of the branch point is the molecular Bootstrap value (%), scale indicates nucleic acid distance, and branch length is similarity. End of branch information contains species name of the classification and the NCBI accession number. |
|
|
为了深入了解微生物间的相互关系,分别以酵母菌和耐酸乳杆菌的纯培养为对照,研究两者之间在共培养体系下的生长特征,从而定性两者之间的相互关系。由图 3可知,K. humilis Z1和L. acetotolerans W共培养中(Z1 & W)耐酸乳杆菌数量明显少于纯培养的耐酸乳杆菌(W)数量(图 3A),酵母菌数量明显高于纯培养酵母菌数量(图 3B),说明Z1 & W共培养过程形成了竞争关系,K. humilis Z1占生长优势,使得共培养中L. acetotolerans W在第3天后数量逐渐减少,提前进入了衰亡期。

|
| 图 3 纯培养和共培养体系中活菌数的变化情况 Figure 3 The viable counts in single culture and co-culture systems Note: W: L. acetotolerans; Z1: K. humilis; Z2: P. kudriavzevii; Z3: C. ethanolica; Z1 & W: Co-culture of K. humilis with L. acetotolerans; Z2 & W: Co-culture of P. kudriavzevii with L. acetotolerans; Z3 & W: Co-culture of C. ethanolica with L. acetotolerans. |
|
|
由图 3A可知,P. kudriavzevii Z2和C. ethanolica Z3分别与L. acetotolerans W共培养时,第7天耐酸乳杆菌数量达到最大值,Z2 & W和Z3 & W分别大于和等于纯培养(W)中耐酸乳杆菌数量;第7天到发酵结束,体系中耐酸乳杆菌的数量逐渐减少;发酵结束时,Z3 & W中耐酸乳杆菌数量大于纯培养,而Z2 & W中耐酸乳杆菌数量小于纯培养。说明在共培养的后期(10 d以后) P. kudriavzevii Z2的生长受到抑制。
值得注意的是,图 3B中,除Z1 & W中酵母菌的数量大于Z1外,Z2 & W和Z3 & W均分别小于其对应的纯培养酵母菌(Z2和Z3),说明在该两种共培养体系中可能某些因素抑制了酵母菌在共培养体系中的生长。
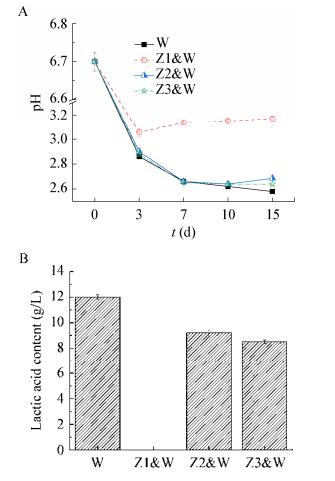
2.5 纯培养和共培养体系中理化指标的变化 2.5.1 pH及乳酸变化图 4是酵母菌与耐酸乳杆菌分别在纯培养和共培养体系下pH和乳酸的变化情况。由图 4A可知,Z1 & W共培养体系的pH从发酵开始先降低,第3天后逐渐升高至所有体系最高pH 3.1;而其他体系中pH在第10天之前始终是降低的趋势,15 d时,纯培养耐酸乳杆菌的pH值最低,Z2 & W中pH最高(2.7)。结合发酵结束时乳酸的含量(图 4B)可知,Z1 & W体系中,由于Z1与W形成的竞争性生长导致W在整个发酵期间没有产生乳酸,而整个体系的pH仍维持在pH 3.1左右(图 4A)。
|
| 图 4 纯培养和共培养体系中pH (A)和乳酸(B)的变化 Figure 4 The viable count of pH (A) and lactic acid (B) in single culture and co-culture systems Note: W: L. acetotolerans; Z1: K. humilis; Z2: P. kudriavzevii; Z3: C. ethanolica; Z1 & W: Co-culture of K. humilis with L. acetotolerans; Z2 & W: Co-culture of P. kudriavzevii with L. acetotolerans; Z3 & W: Co-culture of C. ethanolica with L. acetotolerans. |
|
|
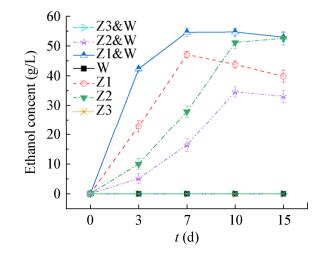
分析发酵体系中乙醇的含量,共培养与纯培养体系中乙醇的产量相差较大(图 5)。与纯培养W相比,Z1 & W共培养体系中乙醇含量明显升高,而Z2 & W共培养体系中乙醇含量明显降低,说明L. acetotolerans W促进K. humilis Z1产乙醇,但抑制P. kudriavzevii Z2产乙醇。此外,本研究的结果进一步证实了耐酸乳杆菌L. acetotolerans W对乙醇具有一定的耐受性[25],当乙醇含量超过一定限度后也会抑制耐酸乳杆菌的生长[9];同时,酵母菌与耐酸乳杆菌共培养时,耐酸乳杆菌对酵母代谢乙醇能力的影响与酵母菌株显著相关(有促进也有抑制)。熊君燕等[10]认为L. plantarum JMRS4对P. kudriavzevii MJ14产乙醇抑制较小,这与本研究的结果类似。而张艳等[26]认为L. homohiochii和L. buchneri能促进酱香酒发酵中3株酵母(Saccharomyces cerevisiae、Zygosaccharomyces bailii和P. galeiformis)的生长。
|
| 图 5 纯培养和共培养体系中乙醇含量变化情况 Figure 5 The concentration of ethanol in single culture and co-culture systems Note: W: L. acetotolerans; Z1: K. humilis; Z2: P. kudriavzevii; Z3: C. ethanolica; Z1 & W: Co-culture of K. humilis with L. acetotolerans; Z2 & W: Co-culture of P. kudriavzevii with L. acetotolerans; Z3 & W: Co-culture of C. ethanolica with L. acetotolerans. |
|
|
众所周知,复杂微量风味成分的类别和量比关系是决定白酒感官品质的关键,这些复杂而又微量的风味化合物在白酒发酵过程中往往是微生物酶促反应的产物,如乙酸乙酯、丁酸乙酯、己酸乙酯等酯类物质贡献典型的水果香气,乙酸、己酸、乳酸等有机酸类能赋予白酒厚重的口感[26]。浓香型白酒发酵过程是多菌种在厌氧条件下的协同代谢过程,从体系中筛选出某种或某类特征性或优势菌种,并将其独立出来研究纯培养及共培养体系中代谢产物的差异性,将有助于更直观地了解微生物的代谢物质及菌株间代谢的相互关系。
本研究将上述酵母菌与耐酸乳杆菌的纯培养及共培养体系中的发酵液进行了挥发性代谢产物的半定量分析,共检出挥发性代谢产物20种,其中,酯类8种,醇类3种,酸类5种,酚类1种,酮类2种。聚类分析后绘制挥发性代谢产物的热图(图 6)。由图 6可知,W的主要挥发性代谢产物包括异戊醇、苯乙醇、戊酸乙酯、庚酸、辛酸和2-甲基己酸;Z1与Z1 & W的挥发性代谢产物的构成相似(主要的风味物质包括异戊醇、苯乙醇),进一步确认了Z1 & W共培养时L. acetotolerans W处于优势地位(图 3B);C. ethanolica Z3与K. humilis Z1的共培养生理代谢行为相似;Z2与Z2 & W的挥发性代谢产物差异明显,主要表现为Z2 & W共培养时酯类物质含量明显减少,进一步说明L. acetotolerans W对P. kudriavzevii Z2有一定抑制作用,但发酵过程中由于P. kudriavzevii Z2分泌出能合成脂肪酸乙酯的酯化酶,从而在发酵过程中利用部分乙酸、乳酸产生乙酸乙酯和乳酸乙酯,相应地提高了体系的pH值(图 4A),进而缓解了发酵末期乳酸对P. kudriavzevii Z2的胁迫作用(图 3A,10-15 d)。另外,Z2 & W共培养时酵母菌的特征代谢产物——异戊醇和苯乙醇的含量也与纯培养Z2时的含量无明显差异;而过去的研究发现L. plantarum JMRS4对P. kudriavzevii MJ14产乙酸乙酯和异戊醇有促进作用[10],说明不同种属的乳酸菌对P. kudriavzevii的影响差异显著。

|
| 图 6 纯培养和共培养条件下特征挥发性代谢产物热图 Figure 6 Heat map of main volatile metabolites during single cultures and co-culture conditions Note: W: L. acetotolerans; Z1: K. humilis; Z2: P. kudriavzevii; Z3: C. ethanolica; Z1 & W: Co-culture of K. humilis with L. acetotolerans; Z2 & W: Co-culture of P. kudriavzevii with L. acetotolerans; Z3 & W: Co-culture of C. ethanolica with L. acetotolerans. |
|
|
通过对多粮浓香型白酒糟醅中3株特征性酵母菌和1株优势乳酸菌(耐酸乳杆菌)发酵过程中相互关系的研究,初步阐述了多粮浓香型白酒糟醅中特征性酵母菌和耐酸乳杆菌之间的相互作用关系。在共培养体系中,K. humilis Z1和L. acetotolerans W形成了竞争关系,K. humilis Z1为竞争优势菌而抑制L. acetotolerans W产乳酸,且L. acetotolerans W能促进K. humilis Z1产乙醇;L. acetotolerans W对P. kudriavzevii Z2表现出明显的抑制作用,共培养体系中乙醇含量显著降低,而P. kudriavzevii Z2的酯化酶系能利用乳酸和乙酸合成乳酸乙酯和乙酸乙酯,进而缓解共培养体系中的酸胁迫;L. acetotolerans W和C. ethanolica Z3之间的相互作用关系不明显。
通过对五粮粉培养基发酵的挥发性代谢物进行分析,发现各菌株代谢产生的所有挥发性组分在白酒中均有检出且部分是白酒的优势呈香呈味组分,如己酸、乙酸、异戊醇、乳酸乙酯、乙酸乙酯等[27]。在浓香型白酒糟醅发酵过程中,其他微生物如芽孢杆菌、乳酸菌、己酸菌以及非酿酒酵母等利用五粮粉的挥发性代谢物组成及量比关系也是进一步研究的重点。
浓香型白酒的发酵采用典型的“续糟发酵、泥窖发酵”方式[28],因而浓香型白酒的发酵过程可以理想地认为包括两个方面的发酵:一方面是糟醅与窖泥接触界面发生的糟醅微生物与窖泥微生物互动代谢;另一方面是糟醅中优势微生物之间的互动代谢。本研究中,上述相互作用关系的差异与乳酸菌及酵母菌的环境耐受能力相关,因此接下来可以从环境耐受性方面进一步了解乳酸菌和酵母菌混合培养时的相互关系。
| [1] |
Zheng XW, Tabrizi MR, Nout MJR, et al. Daqu-A traditional Chinese liquor fermentation starter[J]. Journal of the Institute of Brewing, 2011, 117(1): 82-90. DOI:10.1002/(ISSN)2050-0416 |
| [2] |
Pu C, Hu YH, Jia YW, et al. Screening of ester-producing yeast strains and study on its fermenting properties[J]. Liquor-Making Science & Technology, 2013(3): 47-49, 53. (in Chinese) 蒲春, 胡沂淮, 贾亚伟, 等. 产酯酵母的筛选及其发酵特性研究[J]. 酿酒科技, 2013(3): 47-49, 53. |
| [3] |
Meng X, Wu Q, Wang L, et al. Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(12): 1601-1608. |
| [4] |
Xu W, Zhang XJ, Li Q, et al. Application of microbial molecular ecology techniques in research on traditional fermented food industry[J]. Food Science, 2007, 28(12): 521-525. (in Chinese) 许伟, 张晓君, 李崎, 等. 微生物分子生态学技术在传统发酵食品行业中的应用研究进展[J]. 食品科学, 2007, 28(12): 521-525. DOI:10.3321/j.issn:1002-6630.2007.12.125 |
| [5] |
Frey-Klett P, Burlinson P, Deveau A, et al. Bacterial-fungal interactions: hyphens between agricultural, clinical, environmental, and food microbiologists[J]. Microbiology and Molecular Biology Reviews, 2011, 75(4): 583-609. DOI:10.1128/MMBR.00020-11 |
| [6] |
Roostita R, Fleet GH. The occurrence and growth of yeasts in Camembert and blue-veined cheeses[J]. International Journal of Food Microbiology, 1996, 28(3): 393-404. DOI:10.1016/0168-1605(95)00018-6 |
| [7] |
Qiu BS. Effect of mixed culture on fermentation efficiency and flavor compounds in Chinese liquor[J]. Microbiology China, 2014, 41(7): 1477-1478. (in Chinese) 邱并生. 混菌发酵对白酒液态发酵效率和风味物质的影响[J]. 微生物学通报, 2014, 41(7): 1477-1478. |
| [8] |
Wu XD, Li Z, Zhou SS. Interaction of Saccharomyces cerevisiae and Acetobacter pasteurianus in liquor brewing[J]. Modern Food Science and Technology, 2017, 33(12): 61-67. (in Chinese) 吴轩德, 李洲, 周世水. 白酒酿造中酿酒酵母与巴氏醋杆菌相互作用的研究[J]. 现代食品科技, 2017, 33(12): 61-67. |
| [9] |
Liu CX, Guo XW, Li LL, et al. Interactions of high ester producing Saccharomyces cerevisiae and lactic acid bacteria during co-fermentation[J]. Modern Food Science and Technology, 2017, 33(7): 79-84. (in Chinese) 刘彩霞, 郭学武, 李玲玲, 等. 高产酯酿酒酵母与乳酸菌共发酵过程中的相互作用研究[J]. 现代食品科技, 2017, 33(7): 79-84. |
| [10] |
Xiong JY, Li XD, Xie SK, et al. Interaction between lactic acid bacteria and yeasts in light-aroma liquor[J]. Microbiology China, 2017, 44(8): 1767-1776. (in Chinese) 熊君燕, 李小东, 谢圣凯, 等. 清香型白酒中乳酸菌和酵母菌的相互作用[J]. 微生物学通报, 2017, 44(8): 1767-1776. |
| [11] |
Tang J, Wang HY, Xu Y. Effect of mixed culture of Saccharomyces cerevisiae and Pichia anomala on fermentation efficiency and flavor compounds in Chinese liquor[J]. Microbiology China, 2012, 39(7): 921-930. (in Chinese) 唐洁, 王海燕, 徐岩. 酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J]. 微生物学通报, 2012, 39(7): 921-930. |
| [12] |
Peng ZF, Zhao D, Zheng J, et al. Comparison of odor-active compounds in distillates of five grains between first time and second time distillation using AEDA[J]. Food and Fermentation Industries, 2017, 43(11): 1-8. (in Chinese) 彭智辅, 赵东, 郑佳, 等. 利用AEDA比较五粮粉一次蒸煮与二次蒸煮中的香气活性成分[J]. 食品与发酵工业, 2017, 43(11): 1-8. |
| [13] |
Shen P, Fan XR, Li GW. Microbiology Experiment[M]. 3rd ed. Beijing: Higher Education Press, 1999. (in Chinese) 沈萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999. |
| [14] |
Zhao D, Zheng J, Peng ZY, et al. Identification of volatile compounds in rice husk by head-space solid-phase microextraction, liquid-liquid extraction and flavor fractionation[J]. Liquor-Making Science & Technology, 2016(12): 31-39. (in Chinese) 赵东, 郑佳, 彭志云, 等. 利用顶空固相微萃取、液液萃取和香气分馏技术鉴定糠壳的挥发性成分[J]. 酿酒科技, 2016(12): 31-39. |
| [15] |
Watanabe T, Watanabe I, Yamamoto M, et al. A UV-induced mutant of Pichia stipitis with increased ethanol production from xylose and selection of a spontaneous mutant with increased ethanol tolerance[J]. Bioresource Technology, 2011, 102(2): 1844-1848. DOI:10.1016/j.biortech.2010.09.087 |
| [16] |
Wang F, Liao QJ, An MZ, et al. HPLC for detecting the content of four main acids in Baijiu simultaneously[J]. Liquor-Making Science & Technology, 2018(5): 114-116. (in Chinese) 王芳, 廖勤俭, 安明哲, 等. 高效液相色谱同时检测白酒中四大酸的方法[J]. 酿酒科技, 2018(5): 114-116. |
| [17] |
Zhao D, Zheng J, Peng ZY, et al. Prokaryotic microbial community in Wuliangye pit mud using NextSeq high-throughput sequencing technology[J]. Food and Fermentation Industries, 2017, 43(9): 1-8. (in Chinese) 赵东, 郑佳, 彭志云, 等. 高通量测序技术解析五粮液窖泥原核微生物群落结构[J]. 食品与发酵工业, 2017, 43(9): 1-8. |
| [18] |
Fan WL, Hu GY, Xu Y. Quantification of volatile terpenoids in Chinese medicinal liquor using headspace-solid phase microextraction coupled with gas chromatography-mass spectrometry[J]. Food Science, 2012, 33(14): 110-116. (in Chinese) 范文来, 胡光源, 徐岩. 顶空固相微萃取-气相色谱-质谱法测定药香型白酒中萜烯类化合物[J]. 食品科学, 2012, 33(14): 110-116. |
| [19] |
Kong Y, Wu Q, Zhang Y, et al. In situ analysis of metabolic characteristics reveals the key yeast in the spontaneous and solid-state fermentation process of Chinese light-style liquor[J]. Applied and Environmental Microbiology, 2014, 80(12): 3667-3676. DOI:10.1128/AEM.04219-13 |
| [20] |
Yao HR. Bioinformatics and preliminary expression analysis of Eucalyptus grsmdis WRKY genes family[D]. Haikou: Master's Thesis of Hainan University, 2017 (in Chinese) 姚海荣.巨桉WRKY基因家族的生物信息学及其初步表达分析[D].海口: 海南大学硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10589-1017184248.htm |
| [21] |
Deng J, Huang ZG, Wei CH, et al. High-throughput sequencing reveals bacterial structure in the mud pits of heavy-fragrance Baijiu[J]. Modern Food Science and Technology, 2015, 31(7): 50-55. (in Chinese) 邓杰, 黄治国, 卫春会, 等. 基于高通量测序的浓香型白酒窖池细菌群落结构分析[J]. 现代食品科技, 2015, 31(7): 50-55. |
| [22] |
Liu KH, Zhang B, Ding XW, et al. Microbial community and salt-tolerant genes of hypersaline sediment from Huama lake revealed by metagenomic sequencing[J]. Acta Microbiologica Sinica, 2018, 58(10): 1743-1753. (in Chinese) 刘开辉, 张波, 丁小维, 等. 基于高通量测序的花马盐湖原核微生物及其耐盐基因[J]. 微生物学报, 2018, 58(10): 1743-1753. |
| [23] |
Liu KH, Ding XW, Zhang B, et al. High-throughput sequencing to reveal fungal diversity in hot springs of Rehai at Tengchong in Yunnan[J]. Acta Microbiologica Sinica, 2017, 57(9): 1314-1322. (in Chinese) 刘开辉, 丁小维, 张波, 等. 高通量测序分析云南腾冲热海热泉真菌多样性[J]. 微生物学报, 2017, 57(9): 1314-1322. |
| [24] |
Hui FL, Ke T, Chu XY, et al. Analysis on community composition and diversity of yeast isolated from Daqu[J]. Journal of Food Science and Biotechnology, 2009, 28(1): 102-106. (in Chinese) 惠丰立, 柯涛, 褚学英, 等. 大曲中酵母菌种群结构及多样性分析[J]. 食品与生物技术学报, 2009, 28(1): 102-106. DOI:10.3321/j.issn:1673-1689.2009.01.021 |
| [25] |
Jin D, Jiang AT, Qiao CL, et al. Study on ethanol tolerance and protease properties of lactic acid bacteria from koumiss in Xinjiang areas[J]. Science and Technology of Food Industry, 2017, 38(13): 136-139, 152. (in Chinese) 金丹, 蒋艾廷, 乔传丽, 等. 新疆酸马奶中乳酸菌的乙醇耐受性及蛋白酶性质研究[J]. 食品工业科技, 2017, 38(13): 136-139, 152. |
| [26] |
Zhang Y, Du H, Wu Q, et al. Impacts of two main lactic acid bacteria on microbial communities during Chinese Maotai-flavor liquor fermentation[J]. Microbiology China, 2015, 42(11): 2087-2097. (in Chinese) 张艳, 杜海, 吴群, 等. 酱香型白酒发酵中两株主要乳酸菌对酿造微生物群体的影响[J]. 微生物学通报, 2015, 42(11): 2087-2097. |
| [27] |
Peng ZF, Zhao D, Zheng J, et al. Comparison of flavor characteristics between low-alcohol and high-alcohol Wuliangye by using modern flavor chemistry technology[J]. Liquor-Making Science & Technology, 2018(12): 17-22. (in Chinese) 彭智辅, 赵东, 郑佳, 等. 现代风味化学技术比较低度与高度五粮液的风味特征[J]. 酿酒科技, 2018(12): 17-22. |
| [28] |
Shen YF. Handbook of Liquor-Making Technology[M]. Beijing: China Light Industry Press, 1998. (in Chinese) 沈怡方. 白酒生产技术全书[M]. 北京: 中国轻工业出版社, 1998. |
 2019, Vol. 46
2019, Vol. 46




