扩展功能
文章信息
- 许文龙, 胡凤仙, 刘婷, 韦柳静, 花强
- XU Wen-Long, HU Feng-Xian, LIU Ting, WEI Liu-Jing, HUA Qiang
- 适应性进化与甜菜碱的添加促进安丝菌素的生产
- Adaptive evolution and addition of betaine to promote ansamitocin production
- 微生物学通报, 2019, 46(7): 1561-1570
- Microbiology China, 2019, 46(7): 1561-1570
- DOI: 10.13344/j.microbiol.china.180667
-
文章历史
- 收稿日期: 2018-08-28
- 接受日期: 2018-11-16
- 网络首发日期: 2018-12-24
安丝菌素(Ansamitocin)是一类由珍贵束丝放线菌橙色亚种(Actinosynnema pretiosum ssp. auranticum ATCC31565)产生的大环内酰胺类抗生素,具有很强的抗肿瘤活性,在所有安丝菌素衍生物中,安丝菌素P-3(AP-3)的活性最高[1],通常作为发酵的目标产物。目前已上市的治疗HER-2阳性晚期转移性乳腺癌的Kadcyla (T-DM1)是由曲妥珠单抗和美登素衍生物DM1偶联生成的[2],而安丝菌素即是一类美登素,当前安丝菌素的产量较低,高纯度的安丝菌素极为昂贵,严重限制了其进一步的药理研究和应用。
适应性进化是生物学研究中一种极为常见的方法,该方法是在特定的生长条件下,经过长期的进化筛选获得适应特定环境的微生物菌落,并能针对性地提高微生物次级代谢物的产量。近年来,针对适应性进化方法的研究变得愈加火热。相对于传统的遗传工程,适应性进化能在未知基因组信息的情况下,定向提高相应代谢物的产量,并进一步探明产量提高的机理。本研究将采用适应性进化的策略,针对珍贵束丝放线菌橙色亚种筛选高产安丝菌素的突变菌株。
据研究发现,某种核糖体的突变能极大地刺激抗生素的生产,通过调控核糖体蛋白和rRNA极大地改变细菌内基因的表达,最终激活某些沉默基因。因此,可使用核糖体工程来充分地刺激微生物的过量生产抗生素。核糖体的功能是通过合成细菌的信号分子(ppGpp)来刺激自身基因的表达,即“严谨反应”作为微生物的某一重要的适应系统能响应营养缺陷,抑制稳定的RNA合成[3],然而ppGpp是由ATP和GTP在ppGpp合成酶的作用下产生的,追根溯源,ppGpp合成酶是由relA基因表达的[4],当细胞的生长进入稳定期时,ppGpp就会刺激细胞的次级代谢途径,进而提高其次级代谢产物的产量。Hu等针对Streptomyces coelicolor A3(2)进行了多种抗性的叠加交叉筛选,获得了同时具有利福平、链霉素、庆大霉素3种抗性的突变菌株,其产量比亲本菌株提高了48倍[5]。随后Wang等利用链霉素、庆大霉素、利福平、巴龙霉素、遗传霉素、夫地西酸、硫链丝菌素和林可霉素8种抗生素的叠加突变使天蓝色链霉菌的放线菌紫素产量提高至1.63 g/L,相比出发菌株提高了180倍[6]。与核糖体工程相关的抗生素很多,本研究选用链霉素和巴龙霉素作为胁迫压力,对珍贵橙色束丝放线菌进行适应性进化。
作为一种无毒的渗透调节剂[7]和甲基化供体[8],甜菜碱在微生物和动植物领域都具有重要的实用价值和科研前景。对于维持微生物和植物细胞内的渗透压平衡,抵抗外界环境中变化的盐浓度(特别是高浓度环境)具有重要作用,同时还能促进微生物次级代谢产物。如陈昌发等针对游动放线菌Actinoplanes sp. SIPI-8011添加不同浓度的甜菜碱,发现当甜菜碱的添加量为0.1%时,能大幅度提高雷帕霉素的效价[9];李华等在林可链霉菌发酵的不同时期添加0.1%的甜菜碱,发现在林可链霉菌发酵后期添加甜菜碱能有效降低副产物林可霉素B的含量[10]。本研究对于得到适应性进化的菌株进行甜菜碱添加实验,以期进一步提高进化菌株产生安丝菌素的浓度。
1 材料与方法 1.1 材料 1.1.1 菌株所用菌株为珍贵束丝放线菌橙色亚种(Actinosynnema pretiosum ssp. auranticum ATCC31565),来自上海交通大学钟建江实验室。
1.1.2 引物实验所用引物见表 1。
| 引物 Primers |
序列 Sequences (5′→3′) |
长度 Size (bp) |
| asm9-F | GGCCCCGTTCCCGACAACCT | 20 |
| asm9-R | TGCCGTCCTGCTCCACCACC | 20 |
| asm10-F | CGGACCTGCTGGGGTTCAA | 19 |
| asm10-R | CACCAGGTCGGCCAAGCAG | 19 |
| asm24-F | CAGCAGCAGACCGAC | 15 |
| asm24-R | GGGACCTGGAACATG | 15 |
| asm44-F | TTCCTGGAGAAGCCGCTGTG | 20 |
| asm44-R | TTGGACCGCACCCAGGACAC | 20 |
| asm8-F | CCGCCGTTGGGCTTCTC | 17 |
| asm8-R | CGCACAGCAGCGGAAAGAG | 19 |
| asm34-F | TCGCCCTGCTGGAACTGC | 18 |
| asm34-R | GGTCGGGGAGGGTGAGGC | 18 |
| asm39-F | ACCAGACGCCCGACCCCG | 18 |
| asm39-R | CCGCCGCAGGAGACGACG | 18 |
| relA-F | CCCAAGAAGTACGACGAGAT | 20 |
| relA-R | CGATGTAGTCCTTGAACCG | 19 |
| 16S rRNA-F | CAGAAGAAGCACCGGCTAAC | 20 |
| 16S rRNA-R | TTAAGCCCCAAGTTTTCACG | 20 |
硫酸链霉素、硫酸巴龙霉素,上海思域化工科技有限公司;98%盐酸甜菜碱与磷酸甜菜碱,成都瑞芬思生物科技有限公司;RNA小量提取试剂盒,上海莱枫生物科技有限公司;Fast Quant RT (with gdnase)试剂盒,天根生化科技有限公司;AceQ qPCR SYBR Green Master mix试剂盒,诺维赞生物科技有限公司。高效液相色谱仪,岛津公司;干燥/培养两用箱,上海一恒科技公司;PCR扩增仪、实时荧光定量PCR仪,Bio-Rad公司。
1.1.4 培养基及培养条件TSBY培养基(g/L):胰酪胨大豆肉汤30.0,蔗糖103.0,酵母提取物5.0。T1种子培养基(g/L):葡萄糖10.0,甘油10.0,酵母提取物5.0,蛋白胨10.0,pH 7.4。YMG固体培养基(g/L):葡糖糖4.0,麦芽提取物10.0,酵母提取物4.0,氯化镁1.0,琼脂1.5%-2.0%。最优发酵培养基[11](g/L):果糖9.37,甘油26.79,可溶性淀粉3.03,酵母提取物7.0,荞麦粉20.0,七水合硫酸镁0.50,七水合硫酸亚铁0.01,磷酸二氢钾0.25,氯化铵1.0,碳酸钙5.0,pH 7.4。
1.2 适应性进化以珍贵束丝放线菌橙色亚种为出发菌株,分别以链霉素和巴龙霉素为胁迫压力,添加浓度为最低抑菌浓度,添加时间为菌株的对数生长期,以5%的比例在TSBY液体培养基中不断转接,直至筛选出AP-3产量最高的菌株(图 1)。
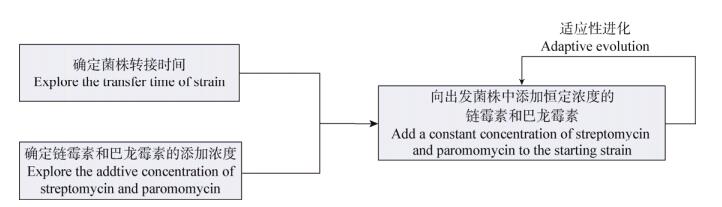
|
| 图 1 适应性进化方案 Figure 1 Scheme of adaptive evolution |
|
|
以0.1%的体积比接种珍贵束丝放线菌橙色亚种种子液至50 mL的T1培养基中,培养2 d得一级种子;再以1%的比例取一级种子接种于50 mL的T1培养基中培养1 d,得二级种子;然后以1%的比例取二级种子接种于最优发酵培养基中发酵7 d,取样检测AP-3含量。
1.4 代谢产物AP-3的检测取发酵上清液于EP管中,乙酸乙酯萃取3次,混匀,12 000 r/min离心5 min,旋转蒸发将萃取液蒸干,用HPLC级的甲醇溶解,过滤后进行高效液相色谱检测,检测条件:流动相为85%甲醇+15%超纯水,流速0.6 mL/min,柱温30 ℃,紫外波长254 nm。
1.5 实时荧光定量PCR (RT-qPCR)取二级种子离心后收集种子,于液氮中研磨,用RNA小量提取试剂盒提取菌体总RNA。放线菌总RNA用gDNase 42 ℃孵育3 min,去除基因组DNA,随后用FastQuant RT (with gDNase)试剂盒制备cDNA。以所得放线菌cDNA为模板,利用AceQ qPCR SYBR Green Master Mix (without ROX)试剂盒进行实时荧光定量PCR,所用引物见表 1。以16S rRNA为内参基因,基因表达变化计算以2-ΔΔCt法。
2 结果与分析 2.1 确定适应性进化的抗生素浓度及转接时间胁迫压力值指适应性进化过程中链霉素或巴龙霉素的添加浓度。据报道,菌株在最低抑菌浓度(Minimal inhibitory concentration,MIC)下突变率最高[12],因而本研究以菌株在链霉素或巴龙霉素下的最低抑菌浓度作为适应性进化的胁迫压力值,考虑到本实验的适应性进化在TSBY液体培养基中进行,以及珍贵橙色束丝放线菌在液体培养基中呈颗粒状生长,不能通过分光光度计的测定方法了解其生长状况,因此采用测定TSBY液体培养基中菌体干重的方法来确定其MIC。
如图 2所示,随着链霉素和巴龙霉素的浓度递增,菌体的干重逐渐降低,3条曲线的交汇点表示菌株在6 d内生长受到完全抑制,所以3条曲线的首次交汇点即为其最低抑菌浓度,因此,链霉素的最低抑菌浓度MIC (Str)=10 mg/L,巴龙霉素的最低抑菌浓度MIC (Par)=50 mg/L (图 2A和2B)。可见作为珍贵橙色束丝放线菌适应性进化的胁迫压力,链霉素和巴龙霉素的添加浓度分别为10 mg/L和50 mg/L。
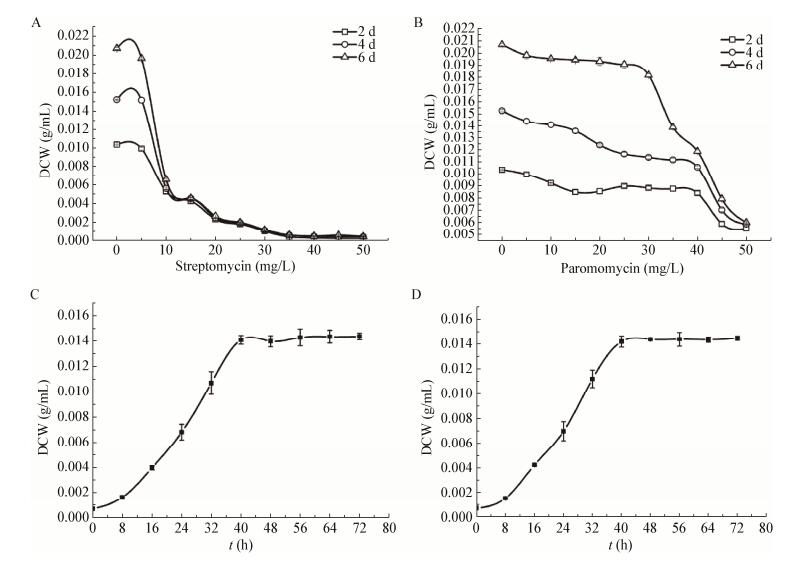
|
| 图 2 出发菌株的生长与胁迫压力的关系 Figure 2 The correlation between growth and forcing stress of the wild strain 注:A、C:链霉素;B、D:巴龙霉素. Note: A, C: Streptomycin; B, D: Paromomycin. |
|
|
由适应性进化的原理可知,菌株的转接时间必须在稳定期之前,通常在菌体生长的对数中后期,因为该时期菌种的自发突变性最强,有助于筛选出所需的突变菌株[12]。为挑选适应胁迫压力的高产突变菌株,选择菌株在该选择压力下生长的对数中后期进行转接。
在10 mg/L链霉素或50 mg/L巴龙霉素的选择压力下,珍贵束丝放线菌橙色亚种的对数中后期为32-40 h,因此菌株的最佳转接时间定为36 h左右(图 2 C和2D)。
2.2 链霉素和巴龙霉素胁迫下进化菌株的筛选如图 3所示,胁迫压力为链霉素时,前8次转接进化菌株的AP-3产量均低于出发菌株,随着适应性进化的进行,1、4两组菌株的AP-3产量逐渐提高,转接至第16和24次时,产量高于出发菌株,但随后产量急剧下降。其中AP-3产量最高的菌株是第16次转接第4组进化菌株(Str16-4),其AP-3产量提高了22.9%。胁迫压力为巴龙霉素时,第2组进化菌株的AP-3产量高于出发菌株,随着适应性进化的进行,菌株产量仍有继续增长的趋势,图中共有3株菌的AP-3产量高于出发菌株,分别为第12次转接第2组(Par12-2)、第16次转接第2组(Par16-2)以及第12次转接第1组(Par12-1),其中AP-3产量最高的菌株为Par16-2,相比出发菌株提高了22.6%。

|
| 图 3 进化菌株的AP-3产量 Figure 3 The AP-3 production of the evolved strains after various forcing stress 注:A:链霉素;B:巴龙霉素. Note: A: Streptomycin; B: Paromomycin. |
|
|
由于菌株在抗性压力环境下进化了很多代,菌株性状复杂,所以取AP-3产量最高的进化突变菌株(Str16-4和Par16-2)在相应的胁迫压力下进行单菌落筛选,逐一测量其AP-3产量,发现Str16-4-4与Par16-2-1的AP-3产量最高,分别相较于出发菌株提高了33.4%和31.7% (图 4)。
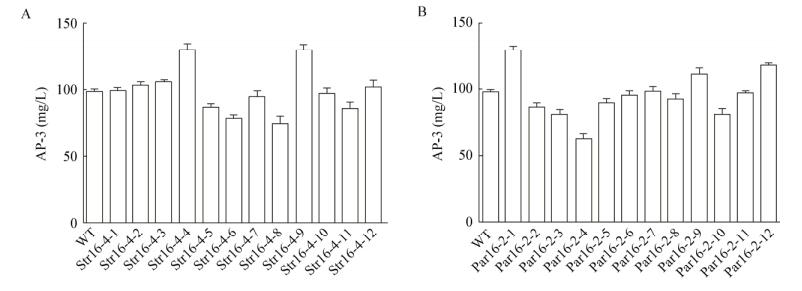
|
| 图 4 胁迫压力下进化菌株的AP-3产量稳定性比较 Figure 4 Compared of the AP-3 accumulation stability in evolved strains after various forcing stress 注:A:链霉素;B:巴龙霉素. Note: A: Streptomycin; B: Paromomycin. |
|
|
针对筛选所得2株进化菌株Str16-4-4和Par16-2-1的AP-3产量进行稳定性的验证。表 2中珍贵束丝放线菌连续4次传代培养,进化菌株Str16-4-4与Par16-2-1的AP-3产量基本保持稳定,说明适应性进化菌株具有高效稳定的AP-3生产能力。
| Strains | 1st subculture |
2nd subculture |
3rd subculture |
4th subculture |
| WT | 85.1±3.2 | 87.2±2.8 | 86.5±3.8 | 79.5±4.2 |
| Str16-4-4 | 113.5±4.1 | 117.8±5.2 | 116.4±3.2 | 105.8±5.2 |
| Par16-2-1 | 112±2.1 | 110±3.1 | 114±3.9 | 102±5.1 |
由于进化菌株的AP-3产量较高,因而针对适应性进化菌株Str16-4-4与Par16-2-1,选取了进化菌株次级代谢过程中安丝菌素生物合成的一些结构基因(asm9、asm10、asm24及asm44)和有代表性的正调控基因(asm8、asm34及asm39)。由于适应性进化的胁迫压力是核糖体工程相关的抗生素,因而选取参与核糖体工程中信号因子ppGpp的合成基因relA (图 5)。与出发菌株相比,进化菌株在所选安丝菌素生物合成的结构基因和部分调控基因的表达水平提高显著,表明代谢流量偏向AP-3的生物合成。某些正调控基因的表达增强,进一步促进了AP-3的生产。进化菌株的relA基因表达水平大幅度增强,表明该过程中ppGpp的合成量相比出发菌株有所提高,也可能是促进珍贵橙色束丝放线菌次级代谢产物(AP-3)合成量增加的原因之一。

|
| 图 5 AP-3生物合成代谢途径 Figure 5 The pathway for AP-3 biosynthesis in A. pretiosum |
|
|
对进化菌株和出发菌株AP-3合成相关基因转录水平的比较结果如下:
(1) 比较安丝菌素生物合成基因簇上一些关键结构基因的表达水平。图 6中asm9、asm10、asm24和asm44的转录水平相较于出发菌株均有不同程度的提高。其中,asm44编码氧化还原酶,催化氨基莽草酸途径的第一步反应,即UDPG的氧化[13],Str16-4-4与Par16-2-1中asm44的转录水平分别提高了5.4倍和5.8倍,表达水平升高明显,表明进化菌株的UDPG氧化过程较为彻底;asm24编码AHBA合成酶,催化氨基莽草酸途径的最后一步反应,即AHBA的合成[14],Str16-4-4与Par16-2-1中asm24的转录水平分别是出发菌株的2.6倍和2.3倍,因此推测出发菌株AP-3产量不高的原因可能是AHBA的供应不足,进化突变导致该酶的合成增加;asm9编码酰胺合酶负责PKS途径中前体安丝菌素形成酰胺键,Par16-2-1中asm9的转录水平提高了3倍,其表达增强,表明Par16-2-1中该酰胺合酶的合成量增加,可能是进化菌株安丝菌素合成能力提高的原因之一;asm10编码甲基转移酶,负责PKS后修饰过程中AP-3的形成[15],两株进化菌株中该基因的转录水平明显提高,表明在AP-3合成过程中的甲基转移反应进行得比较彻底。总之,进化突变菌株Str16-4-4与Par16-2-1在安丝菌素生物合成的3个重要途径(氨基莽草酸途径、PKS途径、后修饰过程)上,安丝菌素合成的结构基因表达水平有明显提高,代谢流量均有所增强。

|
| 图 6 进化菌株AP-3合成相关基因的转录水平 Figure 6 Genes expression relative to AP-3 biosynthesis in evolved strains Note: *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
|
|
(2) 比较安丝菌素生物合成基因簇上的一些重要调控基因的转录水平。由图 6可见,asm8和asm39的转录水平相比出发菌株都有不同程度的提高,其中asm8是AHBA合成途径上的正调控基因,阻断该基因可使AHBA合成的相关基因转录水平下调,进而使菌株丧失AP-3的合成能力[16]。进化菌株中asm8基因的转录水平提高明显,这可能促进了AHBA合成途径上相关基因的表达,增加了前体物质AHBA的供应进而促进了AP-3的生产;asm39是安丝菌素合成基因簇上的σ调控子,Ng等采用整合型载体过表达asm2和asm39可明显提高AP-3的产量[17],说明asm39是AP-3合成中的正向调控子,Str16-4-4中该基因的转录水平明显上调正好验证了该结论。总之,在链霉素进化突变菌株中正向调控基因的转录水平均有所上调,从而促进了AP-3的生物合成。
(3) 比较核糖体工程中relA的表达水平。RelA负责编码ppGpp合成酶,当细胞的生长进入稳定期时,ppGpp就会刺激细胞的次级代谢途径,进而提高其次级代谢产物抗生素的产量[4]。进化菌株中relA的转录水平显著增强(图 6),表明该过程中ppGpp的合成量相比出发菌株有所提高,可能也成为促进珍贵橙色束丝放线菌的次级代谢产物(AP-3)合成量增加的原因之一。
综上所述,不论是安丝菌素合成基因簇上的一些关键结构基因和正向调控基因,还是核糖体工程相关基因relA,它们的转录水平均有一定程度的提高,这也进一步解释了适应性进化珍贵橙色束丝放线菌次级代谢产物(AP-3)的原因。
2.5 甜菜碱对菌株AP-3生产的影响 2.5.1 甜菜碱对出发菌株AP-3生产的影响甜菜碱作为重要的甲基化供体和胞内渗透压维持剂,能应对微生物细胞周围环境盐离子浓度的激变。据报道,甜菜碱的适量添加使微生物在高盐环境中的生长和生产均有一定程度的提高[18]。同时甜菜碱又是一种季铵型阳离子表面活性剂,具有一定的杀菌效果,不可过量添加[19]。
考察了不同浓度盐酸甜菜碱与磷酸甜菜碱的添加对出发菌株AP-3生产的影响,由图 7结果可知,甜菜碱的最适添加量为0.1%,浓度过高或过低都不利于AP-3的合成,同时甜菜碱的类型(盐酸甜菜碱和磷酸甜菜碱)不影响AP-3的产量。
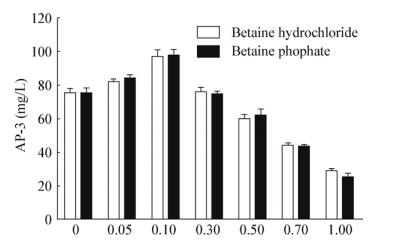
|
| 图 7 不同浓度的甜菜碱对AP-3产量的影响 Figure 7 Effect of different concentration of betaine on AP-3 production |
|
|
在发酵初始向发酵培养基中添加0.1%甜菜碱能一定程度地促进菌株生产AP-3,将0.1%的甜菜碱加入到进化突变菌株发酵过程中,以期进一步提高进化菌株的AP-3的产量。分别向Par16-2-1和Str16-4-4两株高产进化菌株的发酵培养基中添加0.1%的甜菜碱,发酵7 d,检测菌株的生理数据,发现发酵初始添加0.1%的盐酸甜菜碱和磷酸甜菜碱,进化菌株的AP-3产量有一定的提高,但提高的比例小于出发菌株,同时甜菜碱的类型也不影响进化菌株AP-3的生产。其中添加盐酸甜菜碱后Par16-2-1和Str16-4-4两株菌株的AP-3产量均提高16%左右,而相对未添加甜菜碱的出发菌株,AP-3产量提高的比例分别为46.3%和54.5% (图 8)。

|
| 图 8 甜菜碱对进化菌株AP-3产量的影响 Figure 8 Effect of betaine on AP-3 production of evolved mutants |
|
|
本课题在适应性进化的胁迫压力选择中使用纯化的AP-3,如果其提纯产率能满足进化过程的添加要求,自抗性适应性进化的可行性很大,筛选出高抗且高产AP-3的菌株也具备理论的可行性。
使用氨基糖苷类抗生素链霉素和巴龙霉素作为胁迫压力进行适应性进化时,虽然可以筛选出稳定高产AP-3的突变菌株,但是产量提升并不明显。欲使AP-3产量进一步提高,可采用多种抗生素进行多种抗性的叠加进化,如链霉素和巴龙霉素的双抗进化等。Wang等采用利福平、链霉素、庆大霉素等8种抗生素进行抗性的叠加筛选出高产放线菌紫素(Act)的天蓝色链霉菌,高产突变菌株的最终产量可达1.63 g/L,相比于出发菌株提高了180多倍[6]。因此,将链霉素、巴龙霉素以及利福平在珍贵橙色束丝放线菌上进行叠加抗性的适应性进化具有理论指导及实际的可行性。
除此之外,向出发菌株中添加甜菜碱可使AP-3高产,但原因并未探明。可能是由于甜菜碱是重要的甲基化供体,也可能是因为甜菜碱能缓和激变的渗透压,其深入机理依然有待研究,后续的实验可进一步分析。
最后,对链霉素和巴龙霉素高产进化菌株进行相关基因的转录分析,可见安丝菌素的生物合成基因簇上的基因转录水平均有不同程度的提高,同时参照奇迹束丝放线菌relA的基因序列设计引物进行转录水平分析,发现该基因的转录水平大幅度提高,但ppGpp的合成量并未做进一步的检测,后续实验可以证明该基因的功能,同时对relA基因可做进一步的研究,有望获得高产AP-3的深入机理,并为获取高产安丝菌素的珍贵橙色束丝放线菌开辟新的道路。
4 结论本文采用核糖体工程相关抗生素(链霉素和巴龙霉素)对珍贵束丝放线菌橙色亚种进行适应性进化,筛选出安丝菌素产量提高的两株进化菌株Par16-2-1和Str16-4-4,AP-3产量提高了31%-33%,随后向其发酵培养基中添加0.1%的甜菜碱,使进化菌株的产量进一步提高至46%-54%;最后考察了相关基因的转录水平,初步解释了安丝菌素产量提高的原因。本研究对指导AP-3的过量生产提供了新思路,而且为适应性进化策略提高目标产物的产量提供了新的例证。
| [1] |
Okamoto K, Harada K, Ikeyama S, et al. Therapeutic effect of ansamitocin targeted to tumor by a bispecific monoclonal antibody[J]. Japanese Journal of Cancer Research, 1992, 83(7): 761-768. DOI:10.1111/cas.1992.83.issue-7 |
| [2] |
Martínez MT, Pérez-Fidalgo JA, Martín-Martorell P, et al. Treatment of HER2 positive advanced breast cancer with T-DM1: A review of the literature[J]. Critical Reviews in Oncology/Hematology, 2016, 97: 96-106. DOI:10.1016/j.critrevonc.2015.08.011 |
| [3] |
Brown DR, Barton G, Pan ZS, et al. Nitrogen stress response and stringent response are coupled in Escherichia coli[J]. Nature Communications, 2014, 5: 4115. DOI:10.1038/ncomms5115 |
| [4] |
Artsimovitch I, Patlan V, Sekine SI, et al. Structural basis for transcription regulation by alarmone ppGpp[J]. Cell, 2004, 117(3): 299-310. DOI:10.1016/S0092-8674(04)00401-5 |
| [5] |
Hu HF, Ochi K. Novel approach for improving the productivity of antibiotic-producing strains by inducing combined resistant mutations[J]. Applied and Environmental Microbiology, 2001, 67(4): 1885-1892. DOI:10.1128/AEM.67.4.1885-1892.2001 |
| [6] |
Wang GJ, Hosaka T, Ochi K. Dramatic activation of antibiotic production in Streptomyces coelicolor by cumulative drug resistance mutations[J]. Applied and Environmental Microbiology, 2008, 74(9): 2834-2840. DOI:10.1128/AEM.02800-07 |
| [7] |
Hagemann M. Molecular biology of cyanobacterial salt acclimation[J]. Fems Microbiology Reviews, 2011, 35(1): 87-123. |
| [8] |
Löest CA, Titgemeyer EC, St-Jean G, et al. Methionine as a methyl group donor in growing cattle[J]. Journal of Animal Science, 2002, 80(8): 2197-2206. |
| [9] |
Chen CF, Huang H, Zhang CQ, et al. Improvement of fermentation technology of rapamycin by Actinoplanes sp.[J]. Chinese Journal of Pharmaceuticals, 2014, 45(10): 925-928. (in Chinese) 陈昌发, 黄鹤, 张长清, 等. 游动放线菌产雷帕霉素的发酵工艺改进[J]. 中国医药工业杂志, 2014, 45(10): 925-928. |
| [10] |
Li H, Zhang L, Wang X, et al. Lincomycin fermentation process optimization to reduce part B[J]. Shandong Chemical Industry, 2016, 45(8): 63-64. (in Chinese) 李华, 张立, 王鑫, 等. 林可霉素发酵工艺优化降低B组分[J]. 山东化工, 2016, 45(8): 63-64. DOI:10.3969/j.issn.1008-021X.2016.08.024 |
| [11] |
Fan YX, Gao Y, Zhou J, et al. Process optimization with alternative carbon sources and modulation of secondary metabolism for enhanced ansamitocin P-3 production in Actinosynnema pretiosum[J]. Journal of Biotechnology, 2014, 192: 1-10. DOI:10.1016/j.jbiotec.2014.10.020 |
| [12] |
Jansen G, Barbosa C, Schulenburg H. Experimental evolution as an efficient tool to dissect adaptive paths to antibiotic resistance[J]. Drug Resistance Updates, 2013, 16(6): 96-107. DOI:10.1016/j.drup.2014.02.002 |
| [13] |
Guo JT, Frost JW. Biosynthesis of 1-deoxy-1-imino-D-erythrose 4-phosphate: a defining metabolite in the aminoshikimate pathway[J]. Journal of the American Chemical Society, 2002, 124(4): 528-529. DOI:10.1021/ja016963v |
| [14] |
Guo JT, Frost JW. Synthesis of aminoshikimic acid[J]. Organic Letters, 2004, 6(10): 1585-1588. DOI:10.1021/ol049666e |
| [15] |
Spiteller P, Bai LQ, Shang GD, et al. The post-polyketide synthase modification steps in the biosynthesis of the antitumor agent ansamitocin by Actinosynnema pretiosum[J]. Journal of the American Chemical Society, 2003, 125(47): 14236-14237. DOI:10.1021/ja038166y |
| [16] |
Pan WQ, Kang QJ, Wang L, et al. Asm8, a specific LAL-type activator of 3-amino-5-hydroxybenzoate biosynthesis in ansamitocin production[J]. Science China Life Sciences, 2013, 56(7): 601-608. DOI:10.1007/s11427-013-4502-4 |
| [17] |
Ng D, Chin HK, Wong VVT. Constitutive overexpression of asm2 and asm39 increases AP-3 production in the actinomycete Actinosynnema pretiosum[J]. Journal of Industrial Microbiology and Biotechnology, 2009, 36(11): 1345-1351. DOI:10.1007/s10295-009-0619-7 |
| [18] |
Zhang L, Guo LZ, Lu WD. Construction of salt sensitive mutants from Halomonas sp. TTW4 and cloning of the gene involved in cellular osmoregulation[J]. Journal of Qingdao Agricultural University (Natural Science), 2013, 30(3): 204-210. (in Chinese) 张琳, 郭立忠, 卢伟东. Halomonas sp. TTW4盐敏感突变株的筛选与耐盐基因克隆[J]. 青岛农业大学学报:自然科学版, 2013, 30(3): 204-210. |
| [19] |
Qiu LJ, Shen W, Shen ZL, et al. Experimental observation on germicidal efficacy and toxicity of betaine[J]. Chinese Journal of Disinfection, 1999, 16(4): 230-231. (in Chinese) 邱立军, 沈芄, 沈宗林, 等. 甜菜碱杀灭微生物效果及毒性的试验观察[J]. 中国消毒学杂志, 1999, 16(4): 230-231. DOI:10.3969/j.issn.1001-7658.1999.04.010 |
 2019, Vol. 46
2019, Vol. 46




