扩展功能
文章信息
- 任浩锋, 蔡杏华, 林日辉, 蒋满州, 杨慧, 唐乾玉
- REN Hao-Feng, CAI Xing-Hua, LIN Ri-Hui, JIANG Man-Zhou, YANG Hui, TANG Qian-Yu
- 低频电磁场对酿酒酵母蛋白质表达及酶活性的影响
- Effects of low frequency electromagnetic field on protein synthesis and enzyme activity of Saccharomyces cerevisiae
- 微生物学通报, 2019, 46(6): 1452-1460
- Microbiology China, 2019, 46(6): 1452-1460
- DOI: 10.13344/j.microbiol.china.180530
-
文章历史
- 收稿日期: 2018-07-09
- 接受日期: 2018-12-06
- 网络首发日期: 2018-12-24
2. 广西民族大学海洋与生物技术学院 广西 南宁 530006;
3. 广西壮都生物科技有限公司 广西 南宁 530007
2. School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning, Guangxi 530006, China;
3. Guangxi Zhuangdu Biological Technology Co. Ltd., Nanning, Guangxi 530007, China
低频电磁场(Low frequency electromagnetic field,LF-EMF)是指频率较低,一般处于0-300 Hz的电磁场,主要由输电线路、变压器、家用电器产生[1]。随着现代电子信息科技的不断发展,用电设备越来越多,所以LF-EMF在现代化社会中分布十分广泛,Wertheimer研究发现LF-EMF辐射可导致白血病、淋巴瘤、神经系统肿瘤的发病率明显提高[2],此后,LF-EMF所导致的健康效应开始受到人们的广泛关注,并于2002年被国际癌症研究所列为可疑致癌物之一[3]。
近年来,关于LF-EMF的健康效应研究已逐步深入到细胞和分子水平[4]。刘赟等[5]的研究发现,LF-EMF可促进大豆萌发过程中超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)和过氧化物酶(Peroxidase,POD)的表达,还有研究报道[6-7]指出,LF-EMF可改变小鼠大脑中谷胱甘肽水平,并影响SOD和CAT的活性。然而,LF-EMF对酶活性的影响可能表现为空间结构或酶的表达量两个方面,尽管目前的研究[8-9]表明LF-EMF可在一定程度上促进或抑制酶的活性且影响其表达水平,但并没有具体的数据证明LF-EMF对酶活性的影响是源于结构的改变或是表达量的变化。
为了进一步研究LF-EMF辐射对完整生物体在蛋白质水平的影响,并探索其相关作用机理,本文以酿酒酵母作为实验对象,采用频率为50 Hz、强度为3 kV/m、2.5 mT的LF-EMF对其进行持续暴露辐射,通过紫外分光光度计和SDS-PAGE电泳等技术手段,探究辐射前后酿酒酵母在蛋白质表达、部分相关酶活性等方面的变化,以期进一步解释LF-EMF导致健康效应的作用机理,为LF-EMF辐射的风险评估与合理开发应用提供数据支撑。
1 材料与方法 1.1 材料 1.1.1 菌株、主要试剂和培养基 酿酒酵母(Saccharomyces cerevisiae) CY3079购自河北马利食品有限公司。SOD、CAT、ADH (乙醇脱氢酶,Alcohol dehydrogenase)、MDH (苹果酸脱氢酶,Malate dehydrogenase)、LDH (乳酸脱氢酶,Lactate dehydrogenase)试剂盒均购自北京索莱宝公司;TPCK-胰蛋白酶、M5酵母蛋白提取试剂盒均购自北京康维世纪公司;BCA (Bicinchoninic acid)蛋白浓度测定试剂盒购自南京建成生物工程研究所;其他所有常规试剂均为国产分析纯。
葡萄糖蛋白胨培养基(Yeast extract peptone dextrose medium,YEDP) (g/L):酵母粉10.0,葡萄糖20.0,蛋白胨20.0,氯化钠10.0。
1.1.2 主要仪器 电场发生装置,日本株式会社;紫外分光光度计,北京普析公司;凝胶电泳成像分析系统,Bio-Rad公司;Triple-TOF5600质谱仪,AB SCIEX公司。 1.2 方法 1.2.1 比浊法测定酿酒酵母生长曲线 使用YEPD培养基对酿酒酵母进行发酵培养,接种量为2%。培养基随机分为两组(每组3个平行),分别置于LF-EMF辐射环境下生长和自然生长。在培养过程中,每间隔4 h吸取菌液1 mL,经过无菌水稀释10倍,在OD600下测定样品的吸光值,空白对照为稀释10倍后的新鲜培养基。以横坐标为培养时间,纵坐标为培养基的吸光度值绘制酿酒酵母的生长曲线,并计算酿酒酵母在两种生长条件下的比生长速率μ。计算公式为[10]:

|
式中,μ代表酿酒酵母的比生长速率;n则表示经过t时间后细胞增加的世代数;N0为培养初始时的OD600;Nt表示经过t时间的OD600值;Tt与T0表示时间t和起始时间。
1.2.2 酿酒酵母总胞内可溶性蛋白质的提取与浓度测定 设置LF-EMF辐射培养及自然培养两种培养条件(每组3个平行),培养时间分别为12、16、20、24、48、72 h,取培养物100 mL于4 ℃、12 000 r/min离心20 min收集菌体,用Tris-HCl缓冲液洗涤菌体3次,将菌体15 000 r/min离心20 min收集于5 mL离心管中,4 ℃条件下采用M5酵母蛋白抽提试剂盒对酿酒酵母胞内的总可溶性蛋白质进行抽提,实验按照说明书进行。蛋白质浓度的测定采用BCA试剂盒参考Bradford法[11]完成,并通过酶标仪进行快速检测。 1.2.3 酿酒酵母胞内蛋白质的聚丙烯酰胺电泳分析(SDS-PAGE) 分别取辐射培养及自然培养16 h酿酒酵母的胞内可溶蛋白质提取物(每组2个平行样品),稀释至浓度约为3 mg/mL进行SDS-PAGE电泳分析。分离胶的浓度为12% (分子量分离范围处于12-150 kD),上样量10 μL,电泳起始电压设置为100 V,20 min后增加电压至200 V加速电泳。经过染色、脱色处理,脱色至条带清晰后,采用凝胶电泳成像分析系统(GelDOC XR)进行拍照分析。 1.2.4 酿酒酵母胞内5种关键酶的活性测定 以上述抽提所得的蛋白质溶液为粗酶液,分别测定其中ADH、SOD、CAT、LDH和MDH的酶活性(酶活性测定实验均重复3次)。ADH的活性测定参考文献[12]方法,反应体系为1 mL。在0.7 mL浓度为50 mmol/L的Tris-HCl缓冲液(pH 8.8)中加入0.1 mL浓度为1 mol/L的乙醇溶液,0.1 mL浓度为0.2 mol/L的β-NAD溶液,最后加入0.1 mL的待测酶液开始反应,在340 nm下进行时间扫描,记录吸光值的变化量,并根据标准曲线y=0.099 9x+ 0.004 5 (R2=0.999 9)计算ADH的活力。ADH的酶活力单位定义为:在最佳条件下,每分钟催化乙醇脱氢生成1 μmol NADH所需的酶量。其余4种酶的活性分别采用SOD、CAT、LDH和MDH试剂盒进行测定,操作按照试剂盒说明书进行。SOD的酶活力单位定义为:在酶的最佳反应条件下,每分钟对氧自由基抑制率达到50%的酶量。CAT的酶活力单位定义为:在酶的最适条件下,每分钟转化1 μmol H2O2的酶量。LDH的酶活力单位定义为:在酶的最佳反应条件下,每分钟催化产生1 nmol丙酮酸的酶量。MDH的酶活力单位定义为:在酶的最佳反应条件下,每分钟消耗1 nmol NADH所需的酶量[13]。
1.2.5 蛋白质组学分析 将上述1.2.2所提取到的培养16 h的菌体胞内可溶性蛋白质,用Tris-HCl缓冲液稀释至浓度为5 mg/mL,加入TPCK胰蛋白酶(终浓度为0.1 mg/mL)于37 ℃下恒温水浴振荡(转速100 r/min) 24 h进行酶解消化,沸水浴加热15 min终止反应,随后用0.45 μm微孔滤膜过滤除去不溶物,经真空冷冻干燥得到蛋白质组学分析样品。样品的蛋白质组学分析实验均使用与Triple- TOF5600质谱仪串联的Eksigent NanoLC-Ultra系统进行[14]。在分析柱(75 μm×15 cm)上以0.3 mL/min的流速将肽段分离(缓冲液A:2%乙腈,0.1%甲酸混合液;缓冲液B:98%乙腈,0.1%甲酸混合液)。操作质谱仪的MS扫描参数为350-1 250 m/z,积聚时间250 ms,TOF分析的分辨率为30 000 dpi,然后进行20次数据相关性采集,MS/MS扫描参数为100-1 800 m/z,累积时间50 ms,以20 000的分辨率进行TOF分析。数据信息使用Protein Pilot软件V.4.5b (AB SCIEX)进行SWATH采集,数据的错误发现率(False discovery rate,FDR)设置为1%,蛋白质数据采集的参数范围设置为:蛋白质得分 > 0.05,10%的置信阈值。通过Peak View V.2.0 (AB SCIEX)软件和MDM光谱数据库处理SWATH采集的样品数据,只有在FDR < 1%处鉴定的肽段才被纳入分析范围[15]。酿酒酵母的肽段鉴定采用UniProt Swiss-Prot数据库进行匹配[16],差异的统计学检验通过Fisher精确测试算法[17]完成。
2 结果与分析 2.1 LF-EMF对酿酒酵母生长的影响LF-EMF对酿酒酵母生长的影响结果如图 1所示。辐射生长的酿酒酵母在4 h后开始进入对数生长期,与自然生长的酿酒酵母相比提前了2 h。此外,酿酒酵母的对数生长期(4-20 h)在LF-EMF辐射条件下的生长速率显著加快,比生长速率为0.276 h-1,比自然生长下的比生长速率(0.241 h-1)提高了14.52%。当培养时间达到20 h后,辐射生长的酿酒酵母已到达稳定期,而自然生长的酿酒酵母在24 h后才达到生长稳定期。这说明LF-EMF可显著加速酿酒酵母的生长过程(P < 0.05),缩短其生长迟滞期,使其更快到达稳定期。

|
| 图 1 酿酒酵母的生长曲线 Figure 1 Growth curve of S. cerevisiae 注:图中的数据取值为3个平行样品的平均值,偏差线来源于平均值的上下差异(P < 0.05). Note: The taken data in the figure were the average of the three parallel samples, the deviation line was derived from the upper and lower differences of the average (P < 0.05). |
|
|
每克菌体(湿重)的胞内可溶性蛋白质含量随时间变化曲线如图 2所示。由图 2可知,随着培养时间的延长(12-72 h),辐射生长与自然生长的酿酒酵母其胞内可溶性蛋白质均呈先增加后减小的趋势,当培养时间为16 h时,两者的可溶性蛋白质含量差距最大,辐射条件下为9.95±0.06 mg/g,自然生长条件下为9.07±0.09 mg/g,差距达到9.70%。然而当培养时间达到24 h时,两者可溶性蛋白质的含量均达到最大值,其中辐射条件为10.68±0.08 mg/g,自然生长为10.89±0.12 mg/g,前者比后者降低了1.93%。由此可知,在酿酒酵母达到稳定期前(12-24 h),LF-EMF的辐射作用可促进酿酒酵母胞内可溶性蛋白质的合成,使其出现显著的上调现象(P < 0.05)。当酿酒酵母的培养时间超过24 h后,其胞内可溶性蛋白质的含量开始逐渐下降,且辐射条件下酿酒酵母胞内可溶性蛋白质的含量均低于对照,这可能是由于酿酒酵母达到稳定期后,LF-EMF加速了细胞的衰亡过程,从而加快了可溶性蛋白质不断下降的趋势[18]。

|
| 图 2 低频电磁场对酿酒酵母胞内可溶性蛋白质含量的影响 Figure 2 Effects of LF-EMF on the intracellular soluble protein content of S. cerevisiae 注:图中的数据取值为3个平行样品的平均值,偏差线来源于平均值的上下差异(P < 0.05). Note: The taken data in the figure were the average of the three parallel samples, the deviation line was derived from the upper and lower differences of the average (P < 0.05). |
|
|
鉴于两种培养条件下酿酒酵母胞内可溶性蛋白质含量最大差距的时间点为16 h,对此时的胞内可溶性蛋白质进一步进行了SDS-PAGE电泳分析,结果如图 3所示。由图 3可知,LF-EMF辐射处理的酿酒酵母胞内蛋白质在12-20 kD范围出现了新的蛋白质条带,在20-30 kD范围内存在蛋白质浓度差异或条带弥散,在50-80 kD范围内部分条带消失。这表明LF-EMF在一定程度上影响了酿酒酵母胞内可溶性蛋白质的表达水平,既促进了某些蛋白质的表达,同时又抑制了另一些蛋白质的合成,导致酿酒酵母蛋白质种类或含量发生变化。这与Chen等[19]报道LF-EMF对细胞蛋白质表达的影响结果相似。

|
| 图 3 酿酒酵母胞内可溶性蛋白质的SDS-PAGE电泳分析(16 h) Figure 3 SDS-PAGE analysis of the intracellular soluble protein (16 h) 注:M:标准品;1、2:自然生长;3、4:辐射生长. Note: M: Standard; 1, 2: Natural growth; 3, 4: Radiation growth. |
|
|
酿酒酵母胞内5种关键酶的活性测定结果如图 4-6所示。由图 4可知,两种生长条件下的ADH活性均呈先增大后减小的趋势。当培养时间达到24 h后,酿酒酵母达到生长稳定期,ADH的活性接近最高值;此后,ADH的活性逐渐下降,但整体趋势却未观察到其活性的显著差异(P > 0.05)。因此,LF-EMF辐射可能并不会直接影响酿酒酵母胞内ADH的活力,表现为不显著效应。
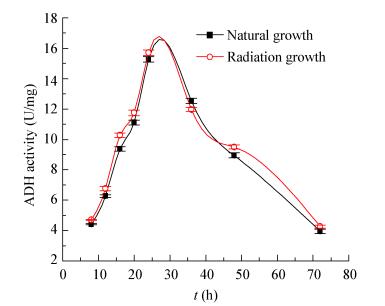
|
| 图 4 酿酒酵母ADH活性的变化趋势 Figure 4 The change trend of ADH activity in S. cerevisiae 注:图中的数据取值为3个平行样品分别重复检测3次的平均值,偏差线来源于平均值的上下差异(P > 0.05). Note: The taken data in the figure were the average of triple assaying of the three parallel samples, the deviation line was derived from the upper and lower differences of the average (P > 0.05). |
|
|
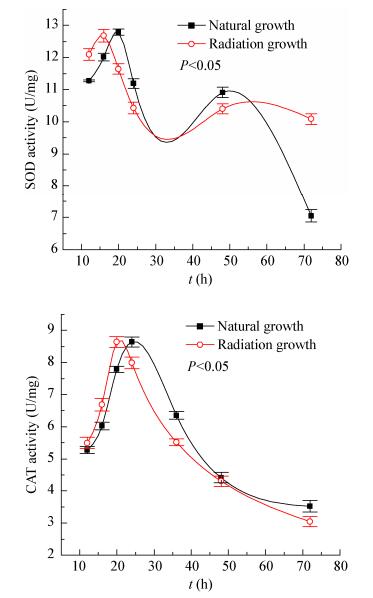
|
| 图 5 酿酒酵母SOD和CAT的活性变化趋势 Figure 5 The change trend of SOD and CAT activity in S. cerevisiae 注:图中的数据取值为3个平行样品分别重复检测3次的平均值,偏差线来源于平均值的上下差异. Note: The taken data in the figure were the average of triple assaying of the three parallel samples, the deviation line was derived from the upper and lower differences of the average. |
|
|
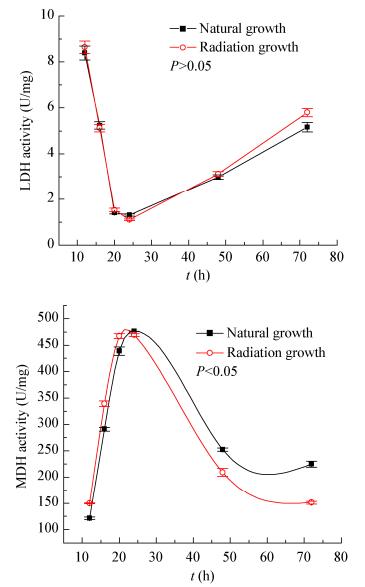
|
| 图 6 酿酒酵母LDH和MDH的活性变化趋势 Figure 6 The change trend of LDH and MDH activity in S. cerevisiae 注:图中的数据取值为3个平行样品分别重复检测3次的平均值,偏差线来源于平均值的上下差异. Note: The taken data in the figure were the average of triple assaying of the three parallel samples, the deviation line was derived from the upper and lower differences of the average. |
|
|
然而不同的是,LF-EMF辐射显著影响了酿酒酵母胞内SOD和CAT的活性,由图 5可知,SOD的活性呈现两次先增后减的现象,最大活性差距达到43.18% (P < 0.05),CAT的活性则呈现先升高后下降的趋势,最大活性差距达到12.22% (P < 0.05)。当培养时间约为16 h时,辐射生长的SOD活性达到最大值12.68±0.19 U/mg,自然生长的SOD活性在20 h时达到最大值12.79±0.12 U/mg。尽管辐射与自然生长组的SOD最大活性差距较小,但当培养时间小于16 h时,酿酒酵母处于生长繁殖阶段,此时可观察到辐射条件的SOD和CAT的活性均高于自然生长条件的活性。SOD和CAT均与细胞的生长、代谢和氧化应激过程密切相关[20],其活性的提高预示着细胞内的氧自由基代谢活动旺盛。
酿酒酵母胞内LDH和MDH的活性变化趋势如图 6所示。由图 6可知,无论是辐射或自然生长的酿酒酵母,其LDH活性均呈先迅速下降后回升的趋势,且当培养时间为24 h时,LDH的活性最低,但两者却未观察到显著的差异(P > 0.05)。然而,LF-EMF对酿酒酵母的MDH活性却存在显著的影响(P < 0.05)。当培养时间低于24 h时,辐射生长的酿酒酵母MDH活性均高于自然生长条件,其活性在20 h提高了12.90% (P < 0.05);然而,当培养时间大于24 h时,辐射条件的MDH活性下降更为显著。当培养时间达到72 h,辐射组的MDH活性仅为150.87 U/mg,与自然生长的酿酒酵母MDH活性(224.73 U/mg)相比,下降了32.87% (P < 0.05)。MDH是细胞内苹果酸循环、TCA循环的关键酶之一,MDH酶活力的先促进后抑制变化趋势与LF-EMF对酿酒酵母生长曲线的影响趋势高度吻合,说明LF-EMF对酿酒酵母生长的影响与其胞内相关酶的活性及代谢水平变化密切相关[21]。
2.4 酿酒酵母的蛋白质组学分析蛋白质组学分析表明,LF-EMF辐射可改变酿酒酵母胞内部分蛋白质的表达水平。如表 1所示,经过LF-EMF辐射处理16 h后的酿酒酵母,其胞内可溶性蛋白质中有3种蛋白质发生了显著的上调表达现象;9种胞内可溶性蛋白质出现了显著的下调表达现象。其中上调表达的SOD与细胞中自由基代谢和氧化应激过程密切相关,泛素-60S核糖体蛋白L40主要参与酿酒酵母对不良环境的抗逆性过程,并且与核糖体亚基的生物合成和调控有关[20-22]。二羟基丙酮激酶催化二羟丙酮进行磷酸化反应,与葡萄糖代谢密切相关[23]。在下调表达的可溶性蛋白质中,肌醇-3-磷酸合成酶的下降比例最大,达到40.59%,主要催化葡萄糖-6-磷酸转化为肌醇-3-磷酸的反应,参与了细胞的抗应激反应、生长、代谢等多种调节功能[24]。Zhong等[25]的研究发现,酿酒酵母肌醇-3-磷酸合酶影响了细胞内肌动蛋白的合成,对维持细胞骨架和细胞结构的完整性具有重要作用。本研究组蔡杏华在研究低频静电场辐射对酿酒酵母生长代谢的影响中发现,细胞经过LF-EMF持续暴露辐射后产生不同程度的凹陷甚至被击穿的现象,推测可能与肌醇-3-磷酸合酶的显著下调表达有关[26]。
| 差异肽段 Differential peptide |
数据库比对结果 Database comparison result |
上调或下调 Up or down |
比例 Proportion (%) |
P值 P-value |
| sp|P0CH09|RL402 | Ubiquitin-60S ribosomal protein L40 | Up | 34.21 | 0.021 6 |
| sp|P54838|DAK1 | Dihydroxyacetone kinase 1 | Up | 19.28 | 0.028 5 |
| sp|P00445|SODC | Superoxide dismutase [Cu-Zn] | Up | 15.78 | 0.005 4 |
| sp|P11986|INO1 | Inositol-3-phosphate synthase | Down | 40.59 | 0.008 9 |
| sp|P49723|RIR4 | Ribonucleoside-diphosphate reductase small chain 2 | Down | 38.31 | 0.018 5 |
| sp|Q12118|SGT2 | Small glutamine-rich tetratricopeptide repeat-containing protein 2 | Down | 32.79 | 0.020 1 |
| sp|Q04344|HNT1 | Hit family protein 1 | Down | 25.97 | 0.029 1 |
| sp|P07262|DHE4 | NADP-specific glutamate dehydrogenase 1 | Down | 21.37 | 0.022 5 |
| sp|Q01532|BLH1 | Cysteine proteinase 1, mitochondrial | Down | 20.08 | 0.041 2 |
| sp|P54839|HMCS | Hydroxymethylglutaryl-CoA synthase | Down | 19.04 | 0.021 1 |
| sp|Q05905|HRI1 | Protein HRI1 | Down | 18.51 | 0.026 2 |
| sp|P07267|CARP | Saccharopepsin | Down | 14.43 | 0.027 2 |
目前关于LF-EMF健康效应的研究结论尚不统一,争议主要有以下几点:(1)研究对象不同。LF-EMF对不同生物体的影响可能大相径庭,且不同生物体LF-EMF的影响程度千差万别,这可能是导致LF-EMF的生物学效应争议较大的主要原因。(2)以离体实验研究为主。离体实验的研究本身会产生多种环境影响因素,与体内研究可能存在较大差异,且不可控因素较多,因此离体实验的研究结论较难反映LF-EMF在一个完整生物体内的影响机制。(3) LF-EMF对不同生物体的影响都是一个错综复杂的过程,其是否具有靶向性或是随机性都难以确定,因此仍然需要在分子水平进行更系统和深入的研究。
本文为了减少不可控因素和环境因素对实验结论的影响,选择了真核细胞生物中的酿酒酵母作为研究对象,首先研究了LF-EMF对酿酒酵母生长趋势、蛋白质表达及酶活性等方面的影响,并进一步研究其蛋白质组学的变化,探索LF-EMF引起生物学效应的作用机制。研究发现,LF-EMF可加速酿酒酵母的生长过程,同时在酿酒酵母的生长阶段(生长稳定期前),其部分与生长和代谢相关的酶活性(SOD、CAT和MDH)同样受到了LF-EMF的促进作用,当酿酒酵母进入生长稳定期后部分酶活性又受到了LF-EMF的抑制作用。此外,LF-EMF辐射还显著改变了酿酒酵母胞内部分蛋白质的表达水平,这意味着调控这些蛋白质表达的基因也可能发生了相应的变化,且可能直接影响酿酒酵母的部分生物学功能。综合前期的研究结果[26],LF-EMF辐射对于酿酒酵母的影响作用是一个先促进后抑制的过程。即短时间的LF-EMF辐射,有利于酿酒酵母的生长和新陈代谢,然而长时间的辐射则逐渐表现为对酿酒酵母的危害作用,使细胞产生形变和部分酶活性受到显著抑制,并加速细胞的凋亡过程。这可能就是LF-EMF辐射的持续时间越长,导致细胞病变率越高的重要原因之一。
本文关于LF-EMF辐射对酿酒酵母部分酶的活性及胞内蛋白质表达的影响,可为进一步研究LF-EMF辐射的作用机理提供基础。然而,关于LF-EMF辐射是如何影响酿酒酵母的蛋白质表达,LF-EMF辐射导致这一系列效应的先后顺序如何,其作用是广谱性或者靶向性等问题都有待进一步深入研究。因此,继续研究LF-EMF辐射引起细胞生物学效应的分子机制,仍然是今后该领域研究的重要课题。
4 结论本文通过对LF-EMF辐射影响酿酒酵母胞内蛋白质表达及相关酶活性的研究表明,LF-EMF辐射可以加速酿酒酵母的生长过程,这种加速作用可能是源于LF-EMF促进了酿酒酵母胞内SOD、CAT和MDH酶活性的提高。当酿酒酵母进入生长稳定期后,LF-EMF辐射对其SOD、CAT和MDH的酶活性又表现为抑制作用,整体过程表现为先促进后抑制的过程。此外,LF-EMF辐射改变了酿酒酵母胞内部分蛋白质的表达水平,其中3种蛋白质的表达发生显著上调,9种蛋白质的表达发生显著下调(P < 0.05)。因此,LF-EMF辐射对酿酒酵母胞内蛋白质表达及相关酶活性的影响是导致多种生物学效应的重要原因之一。
| [1] |
Bao JL. Health effects of extremely low frequency electromagnetic fields[J]. High Voltage Engineering, 2015, 41(8): 2550-2561. (in Chinese) 包家立. 极低频电磁场的健康效应[J]. 高电压技术, 2015, 41(8): 2550-2561. |
| [2] |
Wertheimer N, Leeper E. Electrical wiring configurations and childhood cancer[J]. American Journal of Epidemiology, 1979, 109(3): 273-284. DOI:10.1093/oxfordjournals.aje.a112681 |
| [3] |
IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Non-Ionizing Radiation, Part 1: Static and Extremely Low-Frequency (ELF) Electric and Magnetic Fields[M]. Lyon, France: IARC, 2002: 285
|
| [4] |
Zhang PP, Yin RC, Wu LF, et al. Non-thermal bioeffects of static and extremely low frequency electromagnetic fields[J]. Journal of Biomedical Engineering, 2007, 24(6): 1411-1415. (in Chinese) 张萍萍, 尹若春, 吴丽芳, 等. 静态和极低频电磁场非热生物效应的研究动态[J]. 生物医学工程学杂志, 2007, 24(6): 1411-1415. DOI:10.3321/j.issn:1001-5515.2007.06.045 |
| [5] |
Liu Y, Weng EQ, Dai YQ, et al. Biological effects of extremely low frequency electromagnetic fields on soybean seeds during germination[J]. Chinese Journal of Applied & Environmental Biology, 2002, 8(5): 482-484. (in Chinese) 刘赟, 翁恩琪, 戴雅奇, 等. 极低频电磁场对萌发期大豆的生物学效应[J]. 应用与环境生物学报, 2002, 8(5): 482-484. DOI:10.3321/j.issn:1006-687X.2002.05.007 |
| [6] |
Amara S, Douki T, Garrel C, et al. Effects of static magnetic field and cadmium on oxidative stress and DNA damage in rat cortex brain and hippocampus[J]. Toxicology and Industrial Health, 2011, 27(2): 99-106. DOI:10.1177/0748233710381887 |
| [7] |
Panagopoulos DJ, Karabarbounis A, Lioliousis C. ELF alternating magnetic field decreases reproduction by DNA damage induction[J]. Cell Biochemistry and Biophysics, 2013, 67(2): 703-716. DOI:10.1007/s12013-013-9560-5 |
| [8] |
Cappelli S, Penco A, Mannini B, et al. Effect of molecular chaperones on aberrant protein oligomers in vitro: super- versus sub-stoichiometric chaperone concentrations[J]. Biological Chemistry, 2016, 397(5): 401-415. |
| [9] |
Patruno A, Tabrez S, Pesce M, et al. Effects of extremely low frequency electromagnetic field (ELF-EMF) on catalase, cytochrome P450 and nitric oxide synthase in erythro-leukemic cells[J]. Life Sciences, 2015, 121: 117-123. DOI:10.1016/j.lfs.2014.12.003 |
| [10] |
Song J, Lin JQ, Jin Y, et al. A new population growth model based on the time dependent changes of the specific growth rate[J]. Microbiology China, 2007, 34(5): 836-838. (in Chinese) 宋健, 林建群, 金燕, 等. 以比生长速率时间曲线为基础的生物群体生长数学模型[J]. 微生物学通报, 2007, 34(5): 836-838. DOI:10.3969/j.issn.0253-2654.2007.05.002 |
| [11] |
Carlsson N, Borde A, Wölfel S, et al. Quantification of protein concentration by the Bradford method in the presence of pharmaceutical polymers[J]. Analytical Biochemistry, 2011, 411(1): 116-121. DOI:10.1016/j.ab.2010.12.026 |
| [12] |
Fibla J, Gonzàlez-Duarte R. Colorimetric assay to determine alcohol dehydrogenase activity[J]. Journal of Biochemical and Biophysical Methods, 1993, 26(1): 87-93. DOI:10.1016/0165-022X(93)90025-J |
| [13] |
Zhang HF. Discussion on definition of activity unit of enzyme[J]. Chinese Science and Technology Terms Journal, 2005, 7(1): 38. (in Chinese) 张华峰. 关于酶活力单位定义[J]. 科技术语研究, 2005, 7(1): 38. |
| [14] |
Petschnigg J, Groisman B, Kotlyar M, et al. The mammalian- membrane two-hybrid assay (MAMTH) for probing membrane-protein interactions in human cells[J]. Nature Methods, 2014, 11(5): 585-592. DOI:10.1038/nmeth.2895 |
| [15] |
Xiong Y, Tang XF, Meng QS, et al. Differential expression analysis of the broiler tracheal proteins responsible for the immune response and muscle contraction induced by high concentration of ammonia using iTRAQ-coupled 2D LC-MS/MS[J]. Science China Life Sciences, 2016, 46(11): 1166-1176. (in Chinese) 熊嫣, 唐湘方, 孟庆石, 等. 高氨刺激下参与免疫应答和肌肉收缩过程的肉鸡气管蛋白差异表达——基于iTRAQ标记技术的差异蛋白质组学研究[J]. 中国科学:生命科学, 2016, 46(11): 1267-1276. |
| [16] |
Boutet E, Lieberherr D, Tognolli M, et al. UniProtKB/Swiss-Prot, the manually annotated section of the UniProt knowledgebase: how to use the entry view[A]//Edwards D. Plant Bioinformatics: Methods and Protocols[M]. New York, NY: Humana Press, 2016: 23-54
|
| [17] |
Wang BH. Simulation comparison of two fisher exact test algorithms[J]. Chinese Journal of Health Statistics, 2005, 22(2): 114-115. (in Chinese) 王斌会. 两种Fisher精确检验算法的模拟比较[J]. 中国卫生统计, 2005, 22(2): 114-115. DOI:10.3969/j.issn.1002-3674.2005.02.019 |
| [18] |
Sadeghipour R, Ahmadian S, Bolouri B, et al. Effects of extremely low-frequency pulsed electromagnetic fields on morphological and biochemical properties of human breast carcinoma cells (T47D)[J]. Electromagnetic Biology and Medicine, 2012, 31(4): 425-435. DOI:10.3109/15368378.2012.683844 |
| [19] |
Chen GD, Xu ZP. Global protein expression in response to extremely low frequency magnetic fields[A]//Leszczynski D. Radiation Proteomics: the Effects of Ionizing and Non-Ionizing Radiation on Cells and Tissues[M]. Dordrecht: Springer, 2013: 107-110
|
| [20] |
Ciejka E, Kleniewska P, Skibska B, et al. Effects of extremely low frequency magnetic field on oxidative balance in brain of rats[J]. Journal of Physiology and Pharmacology: An Official Journal of the Polish Physiological Society, 2011, 62(6): 657-661. |
| [21] |
Morelli A, Ravera S, Panfoli I, et al. Effects of extremely low frequency electromagnetic fields on membrane-associated enzymes[J]. Archives of Biochemistry and Biophysics, 2005, 441(2): 191-198. DOI:10.1016/j.abb.2005.07.011 |
| [22] |
Qiao GH, Li T, Wang KR. Molecular cloning and analysis of ubiquitin and ribosomal protein L40 fusion protein from Cryphonectria parasitica[J]. Jiangsu Journal of Agricultural Sciences, 2009, 25(4): 758-762. (in Chinese) 乔广行, 李涛, 王克荣. 栗疫病菌泛素核糖体L40融合蛋白基因的克隆与分析[J]. 江苏农业学报, 2009, 25(4): 758-762. DOI:10.3969/j.issn.1000-4440.2009.04.008 |
| [23] |
Erni B, Siebold C, Christen S, et al. Small substrate, big surprise: fold, function and phylogeny of dihydroxyacetone kinases[J]. Cellular and Molecular Life Sciences CMLS, 2006, 63(7/8): 890-900. |
| [24] |
Ju SL, Shaltiel G, Shamir A, et al. Human 1-D-myo-inositol-3-phosphate synthase is functional in yeast[J]. Journal of Biological Chemistry, 2004, 279(21): 21759-21765. DOI:10.1074/jbc.M312078200 |
| [25] |
Zhong Q, Greenberg ML. Regulation of phosphatidylglycerophosphate synthase by inositol in Saccharomyces cerevisiae is not at the level of PGS1 mRNA abundance[J]. Journal of Biological Chemistry, 2003, 278(36): 33978-33984. DOI:10.1074/jbc.M305242200 |
| [26] |
Cai XH, Ren HF, Meng YS, et al. Effects of low frequency electrostatic field radiation on growth and metabolism of Saccharomyces cerevisiae[J]. Science and Technology of Food Industry, 2018, 39(2): 124-127, 133. (in Chinese) 蔡杏华, 任浩锋, 蒙永双, 等. 低频静电场辐射对酿酒酵母生长代谢的影响[J]. 食品工业科技, 2018, 39(2): 124-127, 133. |
 2019, Vol. 46
2019, Vol. 46




