扩展功能
文章信息
- 刘威, 王晓阳, 高晓春
- LIU Wei, WANG Xiao-Yang, GAO Xiao-Chun
- 共生表皮葡萄球菌促进果蝇胚后发育
- Commensal Staphylococcus epidermidis promoted postembryonic development of Drosophila melanogaster
- 微生物学通报, 2019, 46(6): 1404-1412
- Microbiology China, 2019, 46(6): 1404-1412
- DOI: 10.13344/j.microbiol.china.180552
-
文章历史
- 收稿日期: 2018-07-17
- 接受日期: 2018-11-05
- 网络首发日期: 2018-11-13
2. 山西医科大学汾阳学院临床医学系 山西 汾阳 032200;
3. 山西省汾阳医院 山西 汾阳 032200
2. Department of Clinical Medical, Fenyang College, Shanxi Medical University, Fenyang, Shanxi 032200, China;
3. Shanxi Fenyang Hospital, Fenyang, Shanxi 032200, China
包括昆虫和人类在内后生生物的肠道栖息着大量微生物,其中主要包括细菌、真菌和病毒,这些微生物与宿主之间形成了共生关系,能够帮助宿主提高免疫和增强代谢,有利于神经系统发育。哺乳动物的胃肠道为微生物提供了丰富营养和适宜的温度和pH值,而微生物组则使后生生物在适应和进化过程中受益[1]。所以,动物的表型是在宿主基因组和微生物组的共同作用下形成的。人类微生物组是基因多样性的自然来源,其基因数量是人类基因的150倍,并且人类微生物组作为一个整体影响人的表型[2],但是微生物组作为人体基因的重要组成部分却常常被忽略。传统上,宿主表现型是在相对微生物群的环境下进行评估的,微生物群的影响很少被关注。由于基因的多样性,微生物通过降解不可消化的碳水化合物、产生短链脂肪酸和维生素、抑制病原体的感染等方式影响宿主的生理机能[3-4]。此外,肠道微生物还可维持疾病与健康之间的平衡,包括腹泻、糖尿病、情绪障碍、动脉粥样硬化等均与肠道微生物有关[5]。共生关系对于研究人类健康、生态和遗传变异是必不可少的,但由于微生物的多样性和复杂性,其深入的机制还有待于进一步的研究。
葡萄球菌最初被发现于脓液中,但也是人类和其他哺乳动物皮肤黏膜的常见菌[6]。根据分类学标准,葡萄球菌可分为金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)和腐生葡萄球菌(Staphylococcus saparophytics) 3种。其中表皮葡萄球菌是最常见于人类体表的一种革兰阳性球菌,主要定殖于腋窝、头部、鼻孔和肠道[7]。在生物界,表皮葡萄球菌扮演着多种角色。对于人而言,表皮葡萄球菌是一种常见的人体皮肤共生菌,几乎存在于健康人体每个部位,与人保持共生关系。表皮葡萄球菌的有益作用表现为可抑制致病性金黄色葡萄球菌的定殖能力。表皮葡萄球菌可分泌丝氨酸蛋白酶Esp,抑制金黄色葡萄球菌的生物膜形成和定殖[8]。同时,它还可以产生一种具有杀菌活性的蛋白质化合物——细菌素,以限制病原菌的定殖[9-10]。表皮葡萄球菌不仅存在于人体体表,而且能够进入某些体腔。例如,葡萄球菌是人类鼻腔中具有支配地位的共生细菌。可以推测,通过取食和呼吸等,葡萄球菌可以进入口腔和消化道,所以葡萄球菌也出现在多种动物消化道内。鉴于果蝇经常采食环境中食物,所以表皮葡萄球菌可能作为腐生动物的一种肠道共生菌。除此之外,基因组分析结果表明,表皮葡萄球菌含有大量的基因,能够保护定殖环境免受损坏,并逃逸宿主的免疫反应[11-12]。总之,葡萄球菌在大多数情况下与宿主形成了密切的共生关系。
近年来,随着肠道微生物研究的兴起,果蝇以其易饲养、繁殖周期短、易建立无菌和悉菌果蝇模型、肠道结构与人类相似和菌群高度保守等优点,成为研究微生物与宿主关系的热点模型。在自然界,果蝇多以腐烂的水果为食,而腐烂的食物常常含有多种微生物,这就意味着果蝇不可避免地会接触到微生物,从而不断补充肠道菌群。本次实验尝试使用CEM培养基(Carotenoid expression medium)从野生果蝇肠道内分离葡萄球菌,最终分离得到一株表皮葡萄球菌,进一步研究了该菌对果蝇生长发育的影响。
1 材料与方法 1.1 实验材料实验所用菌株表皮葡萄球菌(Staphylococcus epidermidis)为本实验室分离、鉴定和保存。
次氯酸钠、Triton,Sigma公司;多聚甲醛,Merck公司;Taq酶、RT-PCR试剂盒,TaKaRa公司;兔源一抗PH3,Millipore公司;抗兔二抗-568、反转录试剂盒、4′, 6-二脒基-2-苯基吲哚(DAPI)、Trizol,Invitrogen公司。实时定量PCR仪,Bio-Rad公司;分光光度仪,岛津公司;厌氧装置系统和冷冻离心机,上海力申公司。基因测序由生工生物工程(上海)股份有限公司完成。
酵母玉米培养基(g/L):琼脂13.00,氯化钙0.83,蔗糖31.60,葡萄糖63.20,玉米粉77.70,酵母浸出粉24.00,双蒸水1.35 L。CEM培养基(g/L):蛋白胨10.00,牛肉膏10.00,盐酸半胱氨酸0.50,乙酸钠3.00,酵母浸出粉3.00,葡萄糖5.00,氯化钠5.00, 可溶性淀粉1.00,琼脂0.50,双蒸水1 L。
1.2 果蝇品系和饲养实验用野生型果蝇品系为Oregon R,来源于中国科学院遗传与发育生物学研究所张永清课题组。果蝇在25 ℃、50%湿度、12 L:12 D的光照周期条件下培养。如无特殊说明,果蝇常规饲养食物为标准的酵母玉米培养基。
1.3 细菌的分离和鉴定解剖取出10只野生型果蝇的肠道,浸于磷酸盐缓冲液中30 min,然后用75%的乙醇清洗3次,再用磷酸盐缓冲液清洗3次,最后加入100 μL磷酸盐缓冲液并研磨。将研磨液稀释到10-5-10-7,均匀涂布于CEM培养基,37 ℃培养过夜,挑出单菌克隆并纯化一次。热裂解法提取细菌的DNA[13],利用16S rRNA基因通用引物(上游引物8f:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物1510r:5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增[14]。PCR扩增产物送去测序。将测得的16S rRNA基因序列提交到GenBank并获得登录号。利用MEGA 5.2制作进化树并分析其同源性。
1.4 常规果蝇、无菌果蝇和悉菌果蝇模型的建立把表层中央涂有酵母的葡萄汁板置于收集器底部,将羽化4 d内的果蝇收集至该收集器,饲养过夜。将8 h之内的卵收集到EP管中,依次使用Walch消毒液消毒3次、次氯酸钠消毒1次,75%乙醇消毒2次,每次时长1 min,即可获得无菌卵。然后将其转移到无菌培养基内,建立无菌体系(Germ free,GF)。在无菌体系基础上,于第2天在果蝇培养基中加入OD580为1.0 (约108 CFU)的单株菌或者混合菌,建立悉菌果蝇模型。在无菌体系基础上,于第2天在果蝇培养基中加入OD580为1.0 (约108 CFU)的常规饲养的Oregon R果蝇肠道研磨液,建立常规果蝇模型(Conventional reared,CR)。
1.5 表皮葡萄球菌在果蝇体内的定殖建立表皮葡萄球菌的悉菌果蝇模型,用4%酵母浓度的食物饲养。分别取3龄幼虫、蛹、成虫果蝇各6只,用75%的乙醇消毒2遍后,加入200 μL磷酸盐缓冲液研磨,取100 μL稀释至10–3–10–7后,取100 μL的稀释液涂布到CEM固体培养基,计数果蝇体内菌落数。取相应龄期的果蝇食物100 mg,加入1 mL磷酸盐缓冲液稀释并研磨,涂板计数法统计果蝇食物中的菌落数目。
1.6 果蝇生长速率和发育历期测定分别用0.25%、0.5%、1.0%酵母浓度的培养基建立CR、GF和悉菌果蝇模型,每日记录成蛹和羽化成虫的数量(以总量30只为标准),分别计算成蛹和羽化成虫的时间(即发育历期)。利用公式如下:T=(T1×N1+T2×N2+…+Tm×Nm)/(N1+N2+…+Nm),T代表发育历期,Tm代表从卵产生到蛹形成或成虫形成所需要的时间,Nm代表第m天出现的蛹或者成虫的数量。同样的方法,分别用0.5%、2.0%酵母浓度的培养基建立CR、GF和悉菌果蝇模型,每日随机取10只果蝇幼虫置于载玻片上,放入-20 ℃冰箱速冻2 h后,在显微镜下拍照,用ImageJ软件计算体表面积。
1.7 实时定量PCR用0.5%酵母浓度的培养基建立CR、GF和悉菌果蝇模型,从3 d幼虫到蛹形成后3 d,每天随机挑取10只果蝇,用Trizol法提取总RNA,以2 mg的RNA为模板,利用Oligo-dT引物反转录成mRNA,并合成cDNA[15]。以合成的cDNA为模板,分别用相应引物检测PTTH和InR的转录水平(引物序列见表 1),以rp49作为参照基因,分别计算两者的相对表达量,计算公式如下:ΔCt=Ct (目的基因)-Ct (参照基因),相对表达量=2-ΔΔCt。
| Genes name | Primers sequence (5′→3′) |
| PTTH | CACTCCACATCCCACAGAGATGGCGATGG |
| CCACGAGCTCATTCGTAACTTTGC | |
| InR | AACAGTGGCGGATTCGGTT |
| TACTCGGAGCATTGGAGGCAT | |
| rp49 | GACGCTTCAAGGGACAGTATCTG |
| AAACGCGGTTCAGCATGA |
表皮葡萄球菌在果蝇体内的定殖实验,果蝇生长速率和发育历期测定实验,实时定量PCR实验,均重复至少3次,以每组数据的平均值进行数据统计,采用方差分析(ANOVA)或者t检验(t-test)进行分析。
2 结果与分析 2.1 细菌的分离与鉴定用CEM培养基从野外捕获的黑腹果蝇体内分离出一株细菌,该菌可在琼脂平板上形成不透明圆形凸起、表面光滑、边缘整齐的菌落。形态学鉴定为革兰阳性球菌,该菌成葡萄状聚集,无鞭毛和荚膜,与葡萄球菌的形态特征类似。该菌生理生化实验结果为:可分解葡萄糖、麦芽糖和蔗糖,不能分解甘露醇和乙醇,产酸不产气。为了进一步探究该菌的系统发育和生物学分类,提取细菌基因组DNA,并利用16S rRNA基因的通用引物8f和1510r扩增该基因,测序获得16S rRNA基因序列长度为1 460 bp。在GenBank上进行序列比对,该菌与Staphylococcus epidermidis亲缘关系最近,因此将该菌命名为Staphylococcus epidermidis FY,登录号为MH546126。图 1为该细菌与相关细菌和常见肠道菌的进化树,菌株FY与Staphylococcus epidermidis strain H44 (KU922314.1)相似性最高,相似性达99.5% (1 432/1 439)。与同属的金黄色葡萄球菌Staphylococcus aureus strain FFL34 (JN092619.1)、Staphylococcus aureus strain S33 R (NR037007.2)和腐生葡萄球菌Staphylococcus saprophyticus strain 3m-14 (JX188023.1)、Staphylococcus saprophyticus strain ATCC 15305 (NR074999.2)的相似性也较高,说明其亲缘关系很近。与肠道益生菌乳酸菌Leuconostoc pseudomesenteroides (LC223100.1)、Lactococcus lactis strain FY (MF281053)亲缘关系较近,暗示该菌可能是一种肠道共生菌。但与一些常见的肠道杆菌(如大肠杆菌、蜂房哈夫尼菌)亲缘关系较远,这显示了果蝇肠道菌群的多样性和复杂性。

|
| 图 1 表皮葡萄球菌与其相关细菌基于16S rRNA基因序列的系统进化树 Figure 1 Phylogenetic tree of S. epidermidis and relatives based on 16S rRNA gene sequence 注:标尺:序列差异的分支长度;标注的数字代表引导百分比;括号内为GenBank登录号. Note: Bar: Nucleotide divergence; Number at notes present bootstrap percentages; Those numbers in parentheses are GenBank accession number. |
|
|
如图 2A所示,在3龄幼虫和蛹期,果蝇体内表皮葡萄球菌的载菌量超过了105 CFU,在成虫期的载菌量则接近106 CFU,载菌量超过了已知的果蝇共生菌乳植杆菌(Lactobacillus plantarum)[16],这说明表皮葡萄球菌可以和乳植杆菌一样有效地定殖在果蝇肠道。为了进一步证明表皮葡萄球菌是黑腹果蝇的共生菌,检测了果蝇食物的载菌量。如图 2B所示,在3龄幼虫、蛹和成虫期,每克果蝇食物中表皮葡萄球菌的含量均达到了109 CFU,也高于乳植杆菌在食物中的量,说明表皮葡萄球菌能够稳定存在于果蝇食物中。以上结果表明,表皮葡萄球菌为黑腹果蝇的共生菌,与其宿主有着紧密的联系。

|
| 图 2 表皮葡萄球菌在果蝇肠道和培养基中定殖 Figure 2 Colonization of S. epidermidis in the gut of D. melanogaster and medium 注:A:表皮葡萄球菌和乳植杆菌在果蝇肠道内定殖;B:表皮葡萄球菌和乳植杆菌在培养基中增殖. 3rd-instar:3龄幼虫;Adult:新羽化的成虫.数据代表包含6只个体的3次重复试验的平均值±标准误. Note:A: Colonization of S. epidermidis and L. plantarum in the gut of D. melanogaster; B: Colonization of S. epidermidis and L. plantarum in the medium. 3rd-instar: 3rd instar stage larva; Adult: Newly emergence adult. Data represent the mean of 3 biological replicates containing 6 individuals each±SEM. |
|
|
果蝇发育到不同阶段所需要的时间是衡量果蝇生长状况的重要指标,该指标同时受到食物中营养成分的影响。表皮葡萄球菌是果蝇的共生菌,它对果蝇发育的影响如图 3A所示。随着食物中酵母浓度的增加,果蝇成蛹时间明显缩短,这表明酵母浓度影响果蝇的生长发育,高酵母浓度的食物提供充足营养来维持果蝇的生长发育。在0.25%和1.00%酵母浓度的食物中,CR卵发育成蛹所需要的时间分别为6.8±0.4 d和4.9±0.2 d,而GF卵发育成蛹分别需要17.9±0.3 d和11.8±0.2 d。由此可见,在0.25%和1.00%酵母浓度的食物中,GF卵发育成蛹的时间和CR相比有明显差异,分别延迟约11 d (P < 0.001)和7 d (P < 0.001),并且这种差异与食物酵母浓度呈负相关。同样地,在0.25%和1.00%酵母浓度的食物中,与CR相比,表皮葡萄球菌悉生果蝇成蛹时间分别延迟了1.5 d (P < 0.01)和1 d (P < 0.01),与GF相比却提前了9 d (P < 0.01)和5 d (P < 0.01),与乳植杆菌极为相似。这些数据显示果蝇共生菌能够缩短果蝇的发育历期,促进果蝇的发育,而且这种促发育效果在营养不良条件下更明显。表皮葡萄球菌的加入显著改善了GF在营养不良条件下的发育状况(图 3),表明表皮葡萄球菌能够加速宿主的发育,但并非是满足果蝇营养需求的唯一共生菌。由图 3B可见表皮葡萄球菌在果蝇羽化方面起着同样重要的作用。

|
| 图 3 表皮葡萄球菌促进果蝇蛹的形成和羽化 Figure 3 S. epidermidis promoted the timing of fly development 注:A:CR、GF、表皮葡萄球菌果蝇和乳植杆菌果蝇在不同浓度酵母食物中蛹形成的时间;B:CR、GF、表皮葡萄球菌果蝇和乳植杆菌果蝇在不同浓度酵母食物中成虫形成的时间.数据代表包含30只个体的5次重复试验的平均值±标准误,经t检验检测差异的显著性. ***:P < 0.001;**:P < 0.01;*:P < 0.05.柱状图上的星号表示与CR的比较,实线上的星号表示设计组的比较. Note: A: The timing of pupa formation of CR, GF, S. epidermidis-associated flies and L. plantarum-associated flies in food with different yeast concentrations; B: The timing of adult emergence of CR, GF, S. epidermidis-associated flies and L. plantarum-associated flies in fly food with different yeast concentrations. Data represent the mean of 5 biological replicates containing at least 30 individuals each ± SEM, and significant different was test by t test. ***: P < 0.001; **: P < 0.01; *: P < 0.05, the asterisks above bar charts denote the comparison with CR, while the ones above solid lines denote the comparision of designed group. |
|
|
已有研究证明,GF成虫的体重与CR相比没有明显差异[17]。然而,表皮葡萄球菌能够显著缩短果蝇的发育历期(图 3),提示表皮葡萄球菌可能是通过提高果蝇的生长速率以缩短生长历期。为了量化果蝇生长速率,测量并比较CR、GF、表皮葡萄球菌和乳植杆菌悉菌1龄至蛹期的幼虫体表面积。如图 4A所示,根据线性回归分析,在营养条件丰富(4%酵母浓度)的情况下,CR、GF、表皮葡萄球菌悉生果蝇和乳植杆菌悉生果蝇的生长速率分别为7.626×105、6.507×105、7.296×105和7.226×105 μm2/d,无明显差异。然而在营养不良的情况下(图 4B),CR、GF、表皮葡萄球菌悉生果蝇和乳植杆菌悉生果蝇的生长速率分别为7.011×105、3.552×105、5.936×105和5.296×105 μm2/d,CR和表皮葡萄球菌悉生果蝇与GF相比分别快2.0倍和1.7倍,乳植杆菌悉生果蝇生长速率也是GF的1.5倍,表明表皮葡萄球菌能够提高营养不良条件下果蝇的生长速率。结合上述生长发育的结果可以证明,表皮葡萄球菌通过提高生长速率加速了果蝇的生长发育。
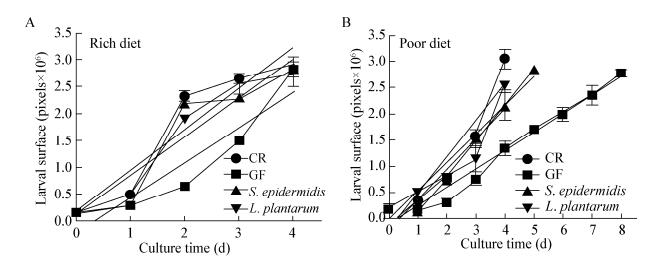
|
| 图 4 表皮葡萄球菌提高果蝇的生长速率 Figure 4 S. epidermidis association promoted larval growth rate 注:A:丰富营养(2%酵母浓度)条件下,CR、GF、表皮葡萄球菌果蝇和乳植杆菌果蝇的体表面积回归曲线;B:贫瘠营养(0.5%酵母浓度)条件下,CR、GF、表皮葡萄球菌果蝇和乳植杆菌果蝇的体表面积回归曲线.数据代表包含10只个体的3次重复试验的平均值±标准误. Note: A: Larval surface area of CR, GF, S. epidermidis-associated larvae and L. plantarum-associated larvae over time when grown on rich diet (2% yeast). Linear regression curves are included (CR, y=0.762 6x–0.237 2; GF, y=0.650 7x–0.335 8; S. epidermidis, y=0.729 6x–0.124 4; L. plantarum, y=0.722 6x–0.159 2); B: Larval surface area of CR, GF, S. epidermidis-associated larvae and L. plantarum-associated larvae over time when grown on poor diet (0.5% yeast). Linear regression curves are included (CR, y=0.701 1x–0.218 6; GF, y=0.355 2x–0.134 4; S. epidermidis, y=0.593 6x–0.236 4; L. plantarum, y=0.529 6x–0.0295 4). Data represent the mean of 3 biological replicates containing at least 10 individuals each±SEM. |
|
|
蜕皮激素是果蝇体内的一种甾体类激素,它能够加速果蝇从3龄幼虫到蛹期的转化[18]。已有研究表明,大脑分泌的促胸腺激素(Prothoracicotropic hormone,PTTH)在蜕皮激素的产生和释放过程中发挥着重要作用[19]。在果蝇体内,PTTH的表达受果蝇发育时间的影响,其含量在3龄幼虫期和蛹的早期达到峰值,PTTH因而成为评价果蝇发育状况的分子指标。如图 5A所示,CR中PTTH含量在7 d时达到峰值,而在GF中10 d时才达到峰值,且CR中的表达量明显高于GF,这表明肠道菌群的联合作用激发了果蝇体内激素的分泌,该结果与前文所述的CR果蝇发育比GF快的情况相符。另一方面,在表皮葡萄球菌悉生果蝇体内,PTTH含量在8 d时达高峰,并且它的表达量比GF高但比CR低,表明共生表皮葡萄球菌能够显著改善GF果蝇发育延迟的状况,加快幼虫向蛹期的过渡。
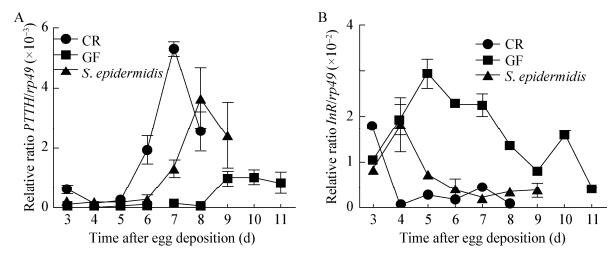
|
| 图 5 表皮葡萄球菌促进果蝇激素分泌和调节果蝇胰岛素信号通路 Figure 5 S. epidermidis promoted the expression of hormonal and regulation of insulin signals 注:A:CR、GF和表皮葡萄球菌果蝇的脑促前胸腺激素mRNA的转录水平,实时定量PCR检测PTTH相对于rp49的表达量;B:CR、GF和表皮葡萄球菌果蝇的脑促前胸腺激素mRNA的转录水平,实时定量PCR检测InR相对于rp49的表达量.图中的数据代表平均值±标准误. Note: A: The PTTH mRNA level of CR, GF and S. epidermidis-associated D. melanogaster. PTTH expression relative to rp49 was analyzed by quantitative RT-PCR; B: The InR mRNA level of CR, GF and S. epidermidis-associated D. melanogaster. InR expression relative to rp49 was analyzed by quantitative RT-PCR. Data in figures are mean±SEM. |
|
|
已有研究表明,共生菌能够通过激活胰岛素信号通路来加速果蝇的发育[20]。为了检验表皮葡萄球菌对胰岛素通路的作用,借助实时定量PCR检测了InR的表达量。InR是胰岛素信号通路的负调控相关基因,也就是说较低的InR表达量意味着胰岛素信号通路的高活性。如图 5B所示,在CR果蝇的幼虫期和蛹的早期InR的表达水平较低,反映了CR果蝇体内胰岛素通路活跃。相反地,GF果蝇幼虫早期体内的InR表达量较高,在3龄幼虫后期有所下降,表明在GF果蝇体内胰岛素信号通路的激活存在延迟现象,这与前文所述的GF发育较CR缓慢的现象相符,说明共生菌能够在宿主发育早期激活其胰岛素信号通路。类似地,InR在表皮葡萄球菌悉生果蝇体内的表达量比GF果蝇低,但比CR果蝇略高,表明表皮葡萄球菌能够提高胰岛素信号通路的活性来提高果蝇的生长速率。
3 讨论与结论包括人类在内的所有后生动物都与共生微生物有着错综复杂的联系,这些微生物影响着宿主的健康和疾病。表皮葡萄球菌是滋生于生物体表皮上的一种细菌,可在人体的皮肤、阴道等部位寄生,属正常菌群类型。共生菌通常会形成特定的机制来逃避宿主的免疫反应,从而使宿主的肠道细菌得以稳定[21]。本次实验从果蝇肠道内分离得到了一株表皮葡萄球菌(图 1)。本实验数据显示,表皮葡萄球菌能够有效地定殖在果蝇肠道,表明表皮葡萄球菌是果蝇的肠道共生菌(图 2)。肠道细菌群落的组成和数量随食物、环境和宿主物理活动的变化而呈现动态波动[22]。果蝇属于腐生生物,主要以腐烂的水果为食。在此过程中,多种细菌和植物性食物的混合物进入果蝇肠道补充了肠道菌群的丰富度。此外,表皮葡萄球菌进入果蝇肠道后,在果蝇发育早期,载菌量从无到有,呈现快速增加,但三龄幼虫及其以后,载菌量趋于稳定,达到动态平衡。反过来,果蝇作为微生物的载体,有效地促进了微生物在环境中的扩散。因此,表皮葡萄球菌与果蝇形成了一种互利的关系。
在本实验中,表皮葡萄球菌显示出了相似的作用(图 3和4),能够通过提高果蝇的生长速率来缩短果蝇的发育历期,这进一步支持了“表皮葡萄球菌是果蝇共生菌”的观点。已有研究表明,乳植杆菌能够在营养不良的条件下通过促进幼虫生长速率和缩短生长期的持续时间来促进宿主的整体发育[17]。本实验与之前其他实验均显示微生物对于果蝇的生长发育是必需的[23]。肠道共生细菌能够刺激宿主消化道内消化酶的分泌,帮助宿主消化复杂的食物,合成营养物质[24]。因此,对于果蝇而言,饮食中含有细菌更有利于果蝇的生长发育。在本次实验中,表皮葡萄球菌能够明显改显GF果蝇生长缓慢的状态(图 3和4)。然而,相对于CR果蝇而言,表皮葡萄球菌悉生果蝇的发育历期依旧有延迟,表明表皮葡萄球菌虽然是果蝇的共生菌,但其作为单株细菌在刺激果蝇生长发育方面的作用并不能完全替代共生菌群,这也就意味着表皮葡萄球菌必须与其他共生菌合作来促进果蝇生长发育。试验中高浓度的酵母浸出物能够改善CF果蝇的发育状况,说明微生物能够通过蛋白质富集和维生素合成等营养功能加速宿主的发育。
蜕皮激素是果蝇体内可以刺激羽化的一种激素,而脑促胸腺激素则可以调控蜕皮激素的产生和释放。胰岛素信号通路在葡萄糖摄取、动态调控蛋白质转录和翻译、促进细胞分裂增殖、调控机体生长发育和代谢全过程都发挥着重要作用。本实验数据显示,在分子水平上,表皮葡萄球菌一方面可以在果蝇变态期激发体内脑促胸腺激素的表达,另一方面可以激活胰岛素信号通路(图 5)。表皮葡萄球菌能够在果蝇发育前期降低InR基因的表达量,表明该细菌能够在早期激发果蝇体内的胰岛素信号通路,从而促进果蝇的生长发育。另外,微生物可以促进宿主体内肠肽酶的表达,进而促进蛋白质消化[25],表皮葡萄球菌对果蝇生长发育的作用机制有待于进一步探索。
综上所述,表皮葡萄球菌作为果蝇的共生菌能够促进宿主的生长,果蝇则提供了一个极好的模型来破译微生物和宿主之间错综复杂的关系,从而有利于更好地了解微生物和宿主世界之间的生态关系。
| [1] |
Staubach F, Baines JF, Künzel S, et al. Host species and environmental effects on bacterial communities associated with Drosophila in the laboratory and in the natural environment[J]. PLoS One, 2013, 8(8): e70749. DOI:10.1371/journal.pone.0070749 |
| [2] |
Shin SC, Kim SH, You H, et al. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling[J]. Science, 2011, 334(6056): 670-674. DOI:10.1126/science.1212782 |
| [3] |
Ren CL, Webster P, Finkel SE, et al. Increased internal and external bacterial load during Drosophila aging without life-span trade-off[J]. Cell Metabolism, 2007, 6(2): 144-152. DOI:10.1016/j.cmet.2007.06.006 |
| [4] |
Venema K. Role of gut microbiota in the control of energy and carbohydrate metabolism[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2010, 13(4): 432-438. DOI:10.1097/MCO.0b013e32833a8b60 |
| [5] |
Bäckhed F, Fraser CM, Ringel Y, et al. Defining a healthy human gut microbiome: current concepts, future directions, and clinical applications[J]. Cell Host & Microbe, 2012, 12(5): 611-622. |
| [6] |
Gabrieli P, Smidler A, Catteruccia F. Engineering the control of mosquito-borne infectious diseases[J]. Genome Biology, 2014, 15(11): 535. DOI:10.1186/s13059-014-0535-7 |
| [7] |
Kloos WE, Musselwhite MS. Distribution and persistence of Staphylococcus and Micrococcus species and other aerobic bacteria on human skin[J]. Applied Microbiology, 1975, 30(3): 381-385. |
| [8] |
Iwase T, Uehara Y, Shinji H, et al. Staphylococcus epidermidis Esp inhibits Staphylococcus aureus biofilm formation and nasal colonization[J]. Nature, 2010, 465(7296): 346-349. DOI:10.1038/nature09074 |
| [9] |
Cotter PD, Ross RP, Hill C. Bacteriocins — a viable alternative to antibiotics[J]. Nature Reviews Microbiology, 2013, 11(2): 95-105. DOI:10.1038/nrmicro2937 |
| [10] |
Heng NCK, Wescombe PA, Burton JP, et al. The diversity of bacteriocins in gram-positive bacteria[A]//Riley MA, Chavan MA. Bacteriocins: Ecology and Evolution[M]. Berlin, Heidelberg: Springer, 2007: 45-92
|
| [11] |
Rogers KL, Fey PD, Rupp ME. Coagulase-negative staphylococcal infections[J]. Infectious Disease Clinics of North America, 2009, 23(1): 73-98. DOI:10.1016/j.idc.2008.10.001 |
| [12] |
Chu VH, Miro JM, Hoen B, et al. Coagulase-negative staphylococcal prosthetic valve endocarditis — a contemporary update based on the international collaboration on endocarditis: prospective cohort study[J]. Heart, 2009, 95(7): 570-576. |
| [13] |
Su LT, Liang JL, Guo XJ, et al. Comparison of methods for DNA extraction in Staphylococcus aureus[J]. Journal of Zhongkai University of Agriculture and Engineering, 2011, 24(1): 15-19. (in Chinese) 苏丽婷, 梁景龙, 郭小建, 等. 金黄色葡萄球菌基因组DNA提取方法的比较[J]. 仲恺农业工程学院学报, 2011, 24(1): 15-19. DOI:10.3969/j.issn.1674-5663.2011.01.004 |
| [14] |
Yao W, Zhu WY, Mao SY. Tracking of the development of fecal bacterial community of diarrhea piglets by 16S rDNA techniques[J]. Acta Microbiologica Sinica, 2006, 46(1): 150-153. (in Chinese) 姚文, 朱伟云, 毛胜勇. 16S rDNA技术研究新生腹泻仔猪粪样细菌区系的多样性变化[J]. 微生物学报, 2006, 46(1): 150-153. DOI:10.3321/j.issn:0001-6209.2006.01.032 |
| [15] |
Zhou W, Zhang WQ, Fu Y, et al. SYBR Green I fluorescence quantitative PCR detection of Escherichia coli in raw milk[J]. China Dairy Industry, 2009, 37(11): 39-42. (in Chinese) 周微, 张伟钦, 付宇, 等. 荧光定量PCR方法快速检测原料乳中的大肠杆菌[J]. 中国乳品工业, 2009, 37(11): 39-42. DOI:10.3969/j.issn.1001-2230.2009.11.011 |
| [16] |
Storelli G, Defaye A, Erkosar B, et al. Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-dependent nutrient sensing[J]. Cell Metabolism, 2011, 14(3): 403-414. DOI:10.1016/j.cmet.2011.07.012 |
| [17] |
Li YJ, Su WZ, Hu KK, et al. Lactobacillus plantarum promotes the growth and development of Drosophila melanogaster[J]. Acta Entomologica Sinica, 2017, 60(5): 544-552. (in Chinese) 李玉娟, 苏琬真, 胡坤坤, 等. 植物乳杆菌促进黑腹果蝇生长发育[J]. 昆虫学报, 2017, 60(5): 544-552. |
| [18] |
Garelli A, Gontijo A M, Miguela V, et al. Imaginal discs secrete insulin-like peptide 8 to mediate plasticity of growth and maturation[J]. Science, 2012, 336(6081): 579-582. DOI:10.1126/science.1216735 |
| [19] |
Rybczynski R. 3.2-Prothoracicotropic hormone[J]. Comprehensive Molecular Insect Science, 2005, 3: 61-123. |
| [20] |
Richard DS, Rybczynski R, Wilson TG, et al. Insulin signaling is necessary for vitellogenesis in Drosophila melanogaster independent of the roles of juvenile hormone and ecdysteroids: female sterility of the chico1 insulin signaling mutation is autonomous to the ovary[J]. Journal of Insect Physiology, 2005, 51(4): 455-464. DOI:10.1016/j.jinsphys.2004.12.013 |
| [21] |
Sharon G, Segal D, Ringo JM, et al. Commensal bacteria play a role in mating preference of Drosophila melanogaster[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(46): 20051-20056. DOI:10.1073/pnas.1009906107 |
| [22] |
Blum JE, Fischer CN, Miles J, et al. Frequent replenishment sustains the beneficial microbiome of Drosophila melanogaster[J]. mBio, 2013, 4(6): e00860. |
| [23] |
Cao Y, Wang YY, Zheng XF, et al. RevEcoR: an R package for the reverse ecology analysis of microbiomes[J]. BMC Bioinformatics, 2016, 17: 294. DOI:10.1186/s12859-016-1088-4 |
| [24] |
Chaston JM, Dobson AJ, Newell PD, et al. Host genetic control of the microbiota mediates the Drosophila nutritional phenotype[J]. Applied and Environmental Microbiology, 2015, 82(2): 671-679. |
| [25] |
Erkosar B, Storelli G, Mitchell M, et al. Pathogen virulence impedes mutualist-mediated enhancement of host juvenile growth via inhibition of protein digestion[J]. Cell Host & Microbe, 2015, 18(4): 445-455. |
 2019, Vol. 46
2019, Vol. 46




