扩展功能
文章信息
- 曹润洁, 何宏魁, 葛向阳, 袁志强, 胡传旺, 李冬冬, 刘国英, 李安军
- CAO Run-Jie, HE Hong-Kui, GE Xiang-Yang, YUAN Zhi-Qiang, HU Chuan-Wang, LI Dong-Dong, LIU Guo-Ying, LI An-Jun
- 芝麻香型酒醅堆积过程中微生物结构变化分析
- Change of microbial community during stacking fermentation of sesame-flavor Jiupei
- 微生物学通报, 2019, 46(6): 1371-1380
- Microbiology China, 2019, 46(6): 1371-1380
- DOI: 10.13344/j.microbiol.china.180482
-
文章历史
- 收稿日期: 2018-06-15
- 接受日期: 2018-10-11
- 网络首发日期: 2018-11-09
2. 安徽省固态发酵工程技术研究中心 安徽 亳州 236820
2. Anhui Solid-State Fermentation of Engineering Technology Research Center, Bozhou, Anhui 236820, China
芝麻香型白酒生产过程中的一个重要环节是高温堆积发酵过程,芝麻香型白酒的酒醅堆积过程相当于“二次制曲”,高温堆积工艺促使微生物大量生长繁殖,丰富微生物的种类和质量,促进酒醅中淀粉和蛋白质的分解转化,是形成酒的香气成分或其前体物质的重要过程,为“美拉德反应”提供前驱物质和反应条件[1-2]。芝麻香型白酒之所以兼具“酱、浓、清”三大香型白酒的优点[3],是因为在堆积过程中将高温大曲、河内白曲、生香酵母曲、细菌曲混合在一起,以此作为芝麻香型白酒堆积过程中的糖化发酵剂,这种堆积过程是芝麻香型白酒典型风格形成的关键工序,该过程直接影响酒醅入池后的发酵过程,进而影响最终所产出酒的质量和产量[4-6],因此,解析堆积过程中细菌和真菌微生物群落的演替规律对探究此工艺意义重大。
近几年,国内酿酒领域已有越来越多的报道将高通量测序技术应用于浓香型、清香型白酒酿造微生物的研究中[7-10]。对于酱香型、芝麻香型白酒酒醅的研究主要集中在发酵过程,而对芝麻香型白酒酒醅堆积过程中的生物学机理研究相对较少[11-14]。跟踪堆积发酵过程,解析堆积发酵过程中微生物群落组成和发酵前后细菌和真菌微生物区系的结构组成和变化规律,可为白酒堆积发酵的机理研究提供一定的理论依据。随着现代分子生物学技术的发展,高通量测序技术(High-throughput sequencing)能够快速对数百万个DNA分子同时进行测序,获得大量数据[15-16],已被广泛运用到奶酪等传统发酵食品的微生物群落结构分析中[17-18]。
本研究以芝麻香型白酒酿造过程中堆积不同时间段的酒醅为样本,使用高通量测序技术分析酒醅细菌16S rDNA的V3−V4区序列和真菌ITS2区序列,从真核微生物和原核微生物两个方面对芝麻香型白酒酒醅堆积工序的微生态进行解析,并结合相应的理化分析数据,如堆积过程的温度、水分、酸度、淀粉、还原糖等变化情况,初步解析堆积过程中微生物的作用机理,探究堆积过程中的主体功能微生物及其演变规律,及其对堆积发酵参数的影响机制,为实现堆积可控化提供参数依据,为实际生产应用提供一定的指导。
1 材料与方法 1.1 主要试剂和仪器用于理化参数测定的试剂均为国产分析纯;氢氧化钠、斐林试剂、葡萄糖,国药集团化学试剂有限公司;土壤DNA提取试剂盒,Omega公司。PCR仪,Thermo Scientific公司;核酸微量测定仪,Maestro Nano公司;高通量测序仪MiSeq,Illumina公司。
1.2 取样方法酒醅样品源自古井贡酒调味酒生产车间,根据实验目的,取样方法如下:取样时间为0 (开始堆积)、6、12、16、20、24、28、32、36、40、44 (堆积结束) h,20 h后对堆积的酒醅进行倒堆(倒堆,是操作工艺中的一个环节,对堆积的酒醅翻倒),每个时间点的样品为堆积各个面的混合样,选取同时生产的两组(编号分别为Z2和Z4),每组中的各样品一式两份,一份用于理化实验分析,一份用于高通量测序,共计22个酒醅样品。用于理化分析的样品4 ℃保存,用于高通量测序的样品−20 ℃保存。
1.3 高通量测序高通量测序中的扩增子测序采用Illumina MiSeq的MiSeqPE300,委托北京奥维森生物科技有限公司进行。
细菌16S rDNA V3−V4区的PCR扩增引物为:F:5′-GTACTCCTACGGGAGGCAGCA-3′;R:5′-GTGGACTACHVGGGTWTCTAAT-3′。
真菌ITS2区域的PCR扩增引物为:F:5′-GCAT CGATGAAGAACGCAGC-3′;R:5′-TCCTCCGCTT ATTGATATGC-3′。
PCR反应体系:DNA样品30 ng,F和R引物(5 µmol/L)各1 µL,BSA (2 ng/µL) 3 µL,2×Taq PCR MasterMix 12.5 µL,ddH2O补足至25 µL。
PCR反应条件:95 ℃ 5 min;95 ℃ 45 s,50 ℃ 50 s,72 ℃ 45 s,共25个循环;72℃ 10 min。
构建MiSeq文库用的是测序得到的双端序列数据,首先对测得的fq数据进行过滤处理,过滤Read尾部质量值20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的Reads;然后根据PE测序的Overlap关系将成对的序列拼接(Merge)成一条序列。使用的软件为Trimmomatic、Flash、Pear和USEARCH。OTU聚类分析使用软件QIIME和UPARSE,得出反映微生物群落丰富度的Chaol指数以及反映物种多样性的Shannon指数等。
1.4 理化分析堆积开始时记录温度数值,固定温度计直到堆积结束,此后跟踪记录不同取样时间的温度。参照文献[19]中的方法,水分直接用干燥法测定,酸度用氢氧化钠滴定法测定,淀粉用酸水解法测定,还原糖用直接滴定法测定。利用SPSS 20.0软件对酒醅样品堆积过程中的理化指标与微生物多样性进行相关性分析。
2 结果与分析 2.1 测序结果两组堆积过程中共计22个样本中,原核微生物16S rDNA测序共产生539个OTU,真核微生物ITS测序共产生64个OTU,其中16S rDNA共检测出5个门7个纲12个目17个科18个属,ITS共检测出4个门4个纲4个目6个科8个属。Chaol和Shannon指数均表明原核微生物的丰富度高于真核微生物。
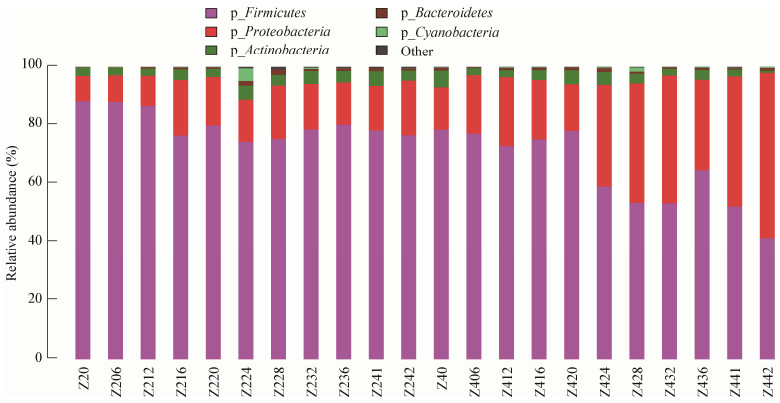
2.2 原核微生物群落多样性与群落组成 2.2.1 门水平上的原核微生物多样性 整个堆积过程中,16S rDNA中原核微生物主要是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),其中绝对优势菌群为厚壁菌门(Firmicutes)。相对丰度比例Z2组厚壁菌门占80.33%、变形菌门14.6%、放线菌门3.49%;在Z4组中厚壁菌门63.51%、变形菌门32.24%、放线菌门3.08%。由图 1可见,在堆积过程中随堆积时间的变化,厚壁菌门含量呈下降的趋势,而变形菌门呈升高的趋势,厚壁菌门类微生物大量减少,变形菌门类微生物大量生长繁殖,直到堆积结束。
|
| 图 1 堆积发酵过程中门水平上的优势原核微生物菌群 Figure 1 Dominant prokaryotic microbial communities of the samples at the phylum level during the stacking fermentation |
|
|

|
| 图 2 堆积发酵过程中属水平上的优势原核微生物菌群 Figure 2 Dominant prokaryotic microbial communities of the samples at the genus level during the stacking fermentation |
|
|

|
| 图 3 堆积发酵过程中门水平上的优势真核微生物菌群 Figure 3 Dominant eukaryotic microorganism communities of the samples at the phylum level during the stacking fermentation |
|
|
| Generic | Percentage content of Z2 | Percentage content of Z4 |
| Pichia | 45.14 | 49.32 |
| Saccharomyces | 30.23 | 24.98 |
| Aspergillus | 21.83 | 21.06 |
| Rhizopus | 1.15 | 2.41 |
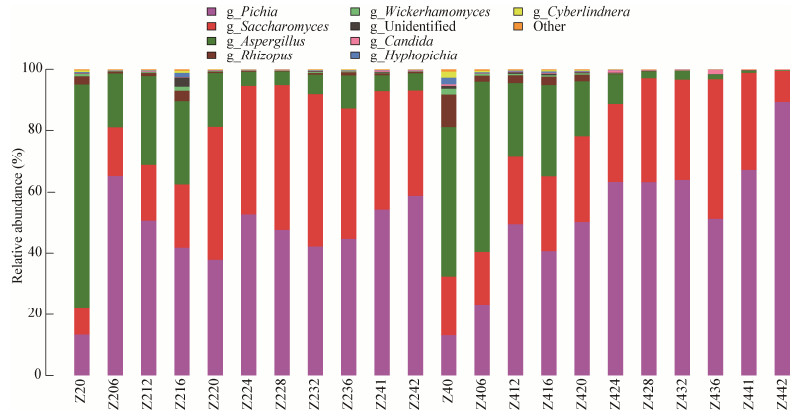
以Z2组为例具体分析堆积发酵过程中属水平上的优势真核微生物菌群(图 4),Z2组真菌占比由堆积时的Aspergillus 72.84%、Pichia 13.35%、Saccharomyces 8.88%、Rhizopus 2.67%、Wickerhamomyces 0.79%、Cyberlindnera 0.48%、Hyphopichia 0.36%和Candida 0.13%,到堆积结束时的Aspergillus 5.58%、Pichia 58.9%、Saccharomyces 34.28%、Rhizopus 0.46%、Wickerhamomyces 0.13%、Hyphopichia 0.11%和Candida 0.34%。堆积开始时曲霉比例最高,曲霉能在酸性酿造环境条件下正常生长代谢,分解原料中的淀粉与蛋白质,为发酵提供持续性的动力[22]。堆积6 h后,曲霉比例大幅下降,表明霉菌类营养物质被消耗分解,毕赤酵母开始大量增多,直到堆积结束时一直占据主要优势,说明它是主要功能微生物,是后续酒醅入池发酵提供产酒产香味物质及其前提物质的菌源。
|
| 图 4 堆积发酵过程中属水平上的优势真核微生物菌群 Figure 4 Dominant eukaryotic microorganism communities of the samples at the genus level during the stacking fermentation |
|
|
从图 5细菌和真菌的Shannon指数关系来看,堆积开始后,物种数量逐渐增多,物种越来越丰富。在堆积16 h左右时,细菌和真菌的物种丰富度达到较高水平,尤其是真菌的丰富度达到一个峰值;随后真菌的物种丰度显著减少,可能与部分真菌类微生物被消耗分解有关,酵母类主要有产酒产香功能,霉菌类能够分泌酶并降解淀粉、蛋白质等;在堆积后期,32 h后就能达到一个相对稳定的平衡,可进一步再结合堆积过程中的理化指标进行分析,综合考虑把控堆积时间。

|
| 图 5 Z2组细菌和真菌的Shannon指数关系 Figure 5 Shannon index relationship of bacteria and fungi in Z2 group |
|
|
堆积过程中温度(图 6)整体呈上升趋势,在20 h倒堆后有降低并再次升高,淀粉的含量在堆积过程中呈下降趋势,堆积初期酒醅营养丰富,微生物代谢较为旺盛,淀粉分解速度较快。还原糖含量从后期所测数据反映出堆积36 h前微生物糖化迅速,之后保持平稳,整个堆积过程的酸度变化波动差约为0.3。

|
| 图 6 Z2 (A)、Z4 (B)组温度、淀粉、酸度、还原糖随堆积时间的变化曲线 Figure 6 Curve for temperature, starch, acidity, reducing sugar in Z2 (A), Z4 (B) group |
|
|
由酒醅样品堆积过程中理化指标与微生物多样性的相关性(表 2)可知,细菌的多样性与水分成显著正相关,与温度、酸度成极显著正相关,与淀粉成极显著负相关。而真菌多样性与其相关性不显著,堆积过程中,细菌将淀粉分解为还原糖。
| 相关性 Correlation |
水分 Water content (%) |
温度 Temperature (℃) |
淀粉 Starch content (%) |
还原糖 Reducing sugar (%) |
酸度 Acidity (mmol/g) |
| 细菌多样性 Bacterial diversity |
0.762* | 0.873** | −0.915** | −0.698 | 0.777** |
| 真菌多样性 Fungal diversity |
−0.061 | −0.080 | 0.186 | 0.540 | −0.300 |
| 注:*:相关达显著水平(P < 0.05);**:相关达极显著水平(P < 0.01). Note: *: Significant correlation (P < 0.05); **: Extremely significant correlation (P < 0.01). |
|||||
堆积工序理化指标的分析表明,堆积结束时酒醅还原糖含量达到5%左右,这在另一方面表明堆积工序也是边糖化与边发酵的双边过程,糖化过程为堆积工序中的微生物生长提供碳源,也为后续的窖池高温发酵提供条件。
3 讨论与结论堆积发酵是芝麻香型白酒生产过程中非常关键的生产工艺过程,整个堆积过程能够大量富集环境中微生物,为入窖发酵创造良好条件,也为芝麻香型白酒的酒体风格形成提供香味成分或香味前体物质。近两年对堆积过程的研究中,2017年江苏洋河酒厂利用顶空固相微萃取与气相色谱-质谱联用技术对芝麻香型不同位置堆积酒醅的风味成分进行了研究,发现堆积中层与底层酒醅的风味变化[23]。山其木格等[24]采用较为传统的PCR-DGGE技术研究酱香型白酒酿造中所有的糟醅堆积过程,对堆积糟醅中的微生物种群变化进行跟踪,揭示微生物种群在各个轮次糟醅堆积过程的变换规律,发现堆积发酵过程细菌种类多于真菌种类。2018年陈建新课题组[25]通过在实验室模拟芝麻香型白酒实际堆积发酵和入窖发酵过程,研究不同堆积发酵条件下微生物菌群演替对入窖发酵过程及原酒品质的影响,发现堆积温度的高低对酒质产生的影响较大。
截至目前对堆积过程中微生态的结构及功能研究仍然在逐步认识阶段,且多数基于传统的生物手段,而不同厂家在堆积方式方面又存在差异,环境微生物也在一定程度上影响堆积工序关键功能微生物群系的结构和功能,进而生产出风格各异的芝麻香型风格白酒。古井是主要的浓香型白酒的代表,但其利用芝麻香型白酒作为调味酒是白酒企业发展的创新模式,对于古井所生产的芝麻香型白酒目前尚无相关研究报道。本研究基于高通量测序技术对古井酒厂所生产的芝麻香型白酒堆积工序过程中的微生态进行了解析,分别针对原核和真核微生物对堆积过程中的主体功能微生物及其演变规律进行了跟踪探究,解析了堆积前后细菌、酵母菌、霉菌等微生物的变化规律。与原核微生物相比,真菌微生物的结构逐步集中,到发酵结束时,毕赤酵母和酵母两者占真菌总量的93%以上,在一定程度上为后续的高温发酵奠定了微生物基础。结合温度变化及水分、酸度、淀粉、还原糖等变化情况的分析结果表明,在堆积过程中,原核微生物丰度多样性高于真核微生物。
堆积过程中原核微生物的结构一直保持较高的丰富度,固态堆积过程是一种存在氧气浓度和温度梯度变化的体系,表层氧气较为丰富,深层氧气含量相对较少,表层温度偏低,深层温度偏高,而不同细菌也存在对氧气和温度不同程度的偏好性,所以堆积工序为多种功能性细菌的生长提供了广泛的空间。前期的研究表明,以吡嗪为代表的杂环类化合物大部分是在堆积过程中生成的,所以堆积过程的高温是合成杂环类化合物的基础,而高温也是功能微生物代谢活动旺盛的表现,更是堆积过程中微生态结构调整的推动力。
堆积过程中微生物的优势菌种随堆积时间的推移也相应有显著性的改变,堆积开始时和结束后物种分布的比例变化较为显著。堆积后期的主要功能微生物为后续酒醅入池发酵提供产酒产香味物质及其前提物质提供菌源。当微生物的相对比例达到相对平衡时,已经起到相应的功能作用,在实际生产中,在保证酒醅微生物发酵达到一定的程度时,可以减少实际的堆积时间,降低生产运营的成本。本研究为实际生产上的工艺优化提供科学依据,有效调控堆积发酵过程,能够进一步清晰芝麻香典型风格形成的核心与基础。
| [1] |
Huang YL, Zhang B, Wu JH. Discussion on Sesame-flavor liquor[J]. Liquor-Making Science & Technology, 2007(10): 116-119. (in Chinese) 黄业立, 张彬, 武金华. 试论芝麻香型白酒[J]. 酿酒科技, 2007(10): 116-119. DOI:10.3969/j.issn.1001-9286.2007.10.033 |
| [2] |
Qi YM. Investigation on Sesame-flavor liquor production[J]. Liquor-Making Science & Technology, 2009(8): 140-142. (in Chinese) 戚元民. 对芝麻香型白酒生产的认识[J]. 酿酒科技, 2009(8): 140-142. |
| [3] |
Xu Y. Scientific heritage and integrated innovation for sustainable development of liquor-making techniques — viewpoints of Sesame-flavor liquor[J]. Liquor-Making Science & Technology, 2013(4): 17-20. (in Chinese) 徐岩. 科学传承、集成创新走中国白酒技术持续发展的道路—对芝麻香酒的看法和认识[J]. 酿酒科技, 2013(4): 17-20. |
| [4] |
Liu MM, Wang JG, Sun PP, et al. Application of bran starter in the production of Sesame-flavor liquor[J]. Liquor-Making Science & Technology, 2013(3): 69-70, 74. (in Chinese) 刘明明, 王君高, 孙朋朋, 等. 麸曲在芝麻香型白酒生产中的应用[J]. 酿酒科技, 2013(3): 69-70, 74. |
| [5] |
Zhang B. Production and application of distiller's yeast production of Sesame-flavor used especially for the liquor[J]. Liquor Making, 2012, 39(6): 38-41. (in Chinese) 张彬. 芝麻香型白酒专用曲的生产及应用[J]. 酿酒, 2012, 39(6): 38-41. DOI:10.3969/j.issn.1002-8110.2012.06.013 |
| [6] |
Wu Q, Ling J, Xu Y. Starter culture selection for making Chinese sesame-flavored liquor based on microbial metabolic activity in mixed-culture fermentation[J]. Applied and Environmental Microbiology, 2014, 80(14): 4450-4459. DOI:10.1128/AEM.00905-14 |
| [7] |
Tao Y, Rui JP, Li JB, et al. Microbial community compositions and diversity in pit mud of Chinese Luzhou-flavor liquor[J]. CIESC Journal, 2014, 65(5): 1800-1807. (in Chinese) 陶勇, 芮俊鹏, 李家宝, 等. 浓香型白酒窖泥中细菌和古菌的组成与多样性[J]. 化工学报, 2014, 65(5): 1800-1807. DOI:10.3969/j.issn.0438-1157.2014.05.034 |
| [8] |
Deng J, Huang ZG, Wei CH, et al. High-throughput sequencing reveals bacterial structure in the mud pits of heavy-fragrance Baijiu[J]. Modern Food Science and Technology, 2015, 31(7): 50-55. (in Chinese) 邓杰, 黄治国, 卫春会, 等. 基于高通量测序的浓香型白酒窖池细菌群落结构分析[J]. 现代食品科技, 2015, 31(7): 50-55. |
| [9] |
Li KY, Wen Z, Deng B, et al. High-throughput sequencing using in research for community diversity of prokaryotes in pit mud of different ages[J]. The Food Industry, 2016(6): 121-125. (in Chinese) 李克亚, 文章, 邓斌, 等. 不同窖龄窖泥原核生物多样性的高通量测序研究[J]. 食品工业, 2016(6): 121-125. |
| [10] |
Zhao D, Zheng J, Peng ZY, et al. Prokaryotic microbial community in Wuliangye pit mud using NextSeq high-throughput sequencing technology[J]. Food and Fermentation Industries, 2017, 43(9): 1-8. (in Chinese) 赵东, 郑佳, 彭志云, 等. 高通量测序技术解析五粮液窖泥原核微生物群落结构[J]. 食品与发酵工业, 2017, 43(9): 1-8. |
| [11] |
Xu ZJ, Meng Z, Zhong QD, et al. Microbial community changes during stacking fermentation in the production of Sesame-flavor liquor using PLFA[J]. Food and Fermentation Industries, 2012, 38(4): 20-24. (in Chinese) 徐泽江, 孟镇, 钟其顶, 等. 芝麻香型白酒堆积过程微生物群落结构特征的PLFA分析[J]. 食品与发酵工业, 2012, 38(4): 20-24. |
| [12] |
Chen SJ, Wang JW. Influence of stacking conditions on temperature and liquor quality of Sesame-flavor liquor[J]. Qingdao University of Science and Technology (Natural Science Edition), 2015, 36(S2): 116-117, 120. (in Chinese) 陈燊君, 王京伟. 芝麻香型白酒堆积条件对升温及酒质的影响[J]. 青岛科技大学学报:自然科学版, 2015, 36(S2): 116-117, 120. |
| [13] |
Guo M, Huang YG, Qiu SY, et al. Application of high-throughput sequencing in microbial diversity of Moutai-flavor Baijiu[J]. China Brewing, 2017, 36(5): 146-151. (in Chinese) 郭敏, 黄永光, 邱树毅, 等. 高通量测序在酱香白酒微生态多样性研究中的应用[J]. 中国酿造, 2017, 36(5): 146-151. |
| [14] |
Wan QH, Xie SK, Gao DY, et al. Effects of two kinds of accumulated grains on fermentation characteristics and aroma quality of sesame-flavor liquor[J]. Food and Fermentation Industries, 2017, 43(11): 9-15. (in Chinese) 万清徽, 谢圣凯, 高大禹, 等. 两种堆积醅对芝麻香型白酒发酵特性和香气品质的影响[J]. 食品与发酵工业, 2017, 43(11): 9-15. |
| [15] |
Li RQ, Zhu HM, Ruan J, et al. De novo assembly of human genomes with massively parallel short read sequencing[J]. Genome Research, 2010, 20(2): 265-272. DOI:10.1101/gr.097261.109 |
| [16] |
Yang F, Zeng XW, Ning K, et al. Saliva microbiomes distinguish caries-active from healthy human populations[J]. The ISME Journal, 2012, 6(1): 1-10. DOI:10.1038/ismej.2011.71 |
| [17] |
de Pasquale I, Di Cagno R, Buchin S, et al. Microbial ecology dynamics reveal a succession in the core microbiota involved in the ripening of pasta filata Caciocavallo Pugliese cheese[J]. Applied and Environmental Microbiology, 2014, 80(19): 6243-6255. DOI:10.1128/AEM.02097-14 |
| [18] |
Michel E, Monfort C, Deffrasnes M, et al. Characterization of relative abundance of lactic acid bacteria species in French organic sourdough by cultural, qPCR and MiSeq high-throughput sequencing methods[J]. International Journal of Food Microbiology, 2016, 239: 35-43. DOI:10.1016/j.ijfoodmicro.2016.07.034 |
| [19] |
Wang XD, Zhang XL, Chen MQ. Study on the change trend of the bacteria and the physicochemical indexes in fermented grains in Maotai-flaver liquor pits[J]. Liquor Making, 2013, 41(3): 21-24. (in Chinese) 王晓丹, 张小龙, 陈孟强. 酱香型白酒窖内发酵过程中酒醅理化指标与细菌的变化趋势研究[J]. 酿酒, 2013, 41(3): 21-24. DOI:10.3969/j.issn.1004-7360.2013.03.007 |
| [20] |
Yang GH, Qiu SY, Huang YG. Microbiology research of liquor production[J]. China Brewing, 2011(4): 24-27. (in Chinese) 杨国华, 邱树毅, 黄永光. 酱香白酒生产中产香微生物研究[J]. 中国酿造, 2011(4): 24-27. DOI:10.3969/j.issn.0254-5071.2011.04.006 |
| [21] |
Li X. Screening of high yield of α-amylase Bacillus licheniformis and construction of a recombinant plasmid[D]. Wuhan: Master's Thesis of Hubei University of Technology, 2014 (in Chinese) 李习.高产α-淀粉酶地衣芽孢杆菌的筛选及重组质粒的构建[D].武汉: 湖北工业大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/article/cdmd-10500-1014038434.htm |
| [22] |
Sun JQ, Liu WW, Zang W, et al. Community composition of moulds from fermented grains of Maotai-flavor liquor and their enzyme activities[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(8): 239-247. (in Chinese) 孙剑秋, 刘雯雯, 臧威, 等. 酱香型白酒酒醅中霉菌群落组成与功能酶活性[J]. 中国食品学报, 2013, 13(8): 239-247. |
| [23] |
Yan QM, Shen XB, Song B, et al. Study on flavor compounds in different accumulation position of Sesame fermented grains[J]. Liquor Making, 2017, 44(6): 50-53. (in Chinese) 严启梅, 沈晓波, 宋宝, 等. 芝麻香型不同位置堆积酒醅风味成分的研究[J]. 酿酒, 2017, 44(6): 50-53. DOI:10.3969/j.issn.1002-8110.2017.06.016 |
| [24] |
Shan QMG, Liang HZ, Zhang CX, et al. Changes of microbial diversity in stacked fermentation for the production of Moutai flavor liquor[J]. Journal of Food Science and Biotechnology, 2016, 35(3): 330-335. (in Chinese) 山其木格, 梁慧珍, 张长霞, 等. 糟醅堆积过程中微生物种群的变化规律[J]. 食品与生物技术学报, 2016, 35(3): 330-335. DOI:10.3969/j.issn.1673-1689.2016.03.017 |
| [25] |
Li XD, Gao DY, Tian QZ, et al. Effects of Sesame-flavor liquor accumulation on cellar fermentation process and liquor quality[J]. Food and Fermentation Industries, 2018, 44(5): 63-69. (in Chinese) 李小东, 高大禹, 田庆贞, 等. 芝麻香型白酒堆积发酵对入窖发酵过程及原酒品质的影响[J]. 食品与发酵工业, 2018, 44(5): 63-69. |
 2019, Vol. 46
2019, Vol. 46




