扩展功能
文章信息
- 冯光志, 邹颜霓, 王月琳, 吴玉婷, 石玉
- FENG Guang-Zhi, ZOU Yan-Ni, WANG Yue-Lin, WU Yu-Ting, SHI Yu
- 小龙虾肠道产木聚糖酶细菌的分离与鉴定
- Screening and identification of xylanase-producing strains isolated from crayfish intestine
- 微生物学通报, 2019, 46(6): 1364-1370
- Microbiology China, 2019, 46(6): 1364-1370
- DOI: 10.13344/j.microbiol.china.180699
-
文章历史
- 收稿日期: 2018-09-07
- 接受日期: 2019-02-26
- 网络首发日期: 2019-03-19
木聚糖酶是一组可降解植物半纤维素成分的水解酶系,在自然界中分布于各种微生物、植物、动物瘤胃等环境[1]。随着生物技术在工业中的发展,木聚糖酶被广泛应用于食品加工、饲料生产、制浆造纸、能源工业等行业,具有很大的经济价值和应用前景[2]。由于微生物产生的天然木聚糖酶在产量、酶活性、温度稳定性、pH值稳定性等方面存在着不同的缺陷[3-4],阻碍了木聚糖酶在诸多领域的高效应用,因此需要进一步挖掘新的木聚糖酶菌株资源和基因资源,以拓宽木聚糖酶的应用。
克氏原螯虾(Procambarus clarkii),俗称小龙虾,属甲壳纲(Crustacea)、十足目(Decapoda)、蝲蛄科(Cambaridae)、原螯虾属(Procambarus)动物[5]。小龙虾为杂食性动物,在天然条件下主要摄食有机物碎屑、藻类、水生植物的根、叶及碎片,特别喜食汁多肥嫩的绿色植物,如水浮莲、绿萍和水葫芦等,可见小龙虾具有很强的纤维素降解能力。小龙虾肠道微生物是小龙虾降解纤维素和半纤维素的主要驱动力,因此,在小龙虾肠道内有望筛选到高产木聚糖酶的优良菌株。
目前,国内外对克氏原螯虾的研究主要集中于其行为学[6-7]、种群结构与分布[8-9]及疾病与免疫方面[10-12],对营养饲料方面的研究也主要集中在蛋白质、脂肪等方面[13],而对于小龙虾肠道细菌的相关研究却鲜有报道。本文采用纯培养法,从小龙虾肠道中分离筛选产木聚糖酶的细菌,进行形态学和分子生物学初步鉴定,同时利用16S rRNA基因高通量测序,研究小龙虾肠道内细菌的物种组成,一方面有望分离到全新的高产木聚糖酶的优良菌株,另一方面,也为研究小龙虾肠道菌群结构和纤维素的降解机制提供理论支撑,为创制新型小龙虾饲料开辟新途径。
1 材料与方法 1.1 材料市售小龙虾,在实验室条件下饲养。
1.2 主要试剂、仪器及培养基木聚糖,Sigma-Aldrich公司;2×Taq MasterMix,北京宝日医生物技术有限公司;16S rRNA基因序列扩增引物,上海桑尼生物科技有限公司。PCR仪,Bio-Rad公司;电泳仪,北京六一生物科技有限公司。富集培养基(g/L):木聚糖10.0,KH2PO4 1.0,MgSO4 0.5,pH 8.0,1×105 Pa灭菌20 min。筛选培养基(g/L):胰蛋白胨5.0,NaCl 5.8,木聚糖8.0,酵母膏1.0,葡萄糖1.0,柠檬酸三钠4.5,pH 8.0,琼脂粉20.0,1×105 Pa灭菌20 min。
1.3 产木聚糖酶菌的筛选选取10只小龙虾,用70%酒精、无菌水依次清洗体表。拉出整个肠道,放于无菌离心管中。用灭菌的匀浆棒匀浆,充分匀浆后的液体即为小龙虾全肠菌悬液。吸取小龙虾全肠菌悬液倒入富集培养基中,37 ℃、120 r/min培养24 h。将富集培养基中的菌液稀释涂平板,涂到筛选培养基中。梯度从10−2到10−7,每个梯度涂2个平行。在28 ℃的恒温箱中进行倒置培养2 d。将筛选培养基上长出的菌分类标记后,用牙签点在筛选培养基上,于28 ℃的恒温箱中倒置培养24 h。用沾了酒精的纸板轻轻刮去培养基表面的菌体,刚果红染色15 min,NaCl脱色30 min,观察水解圈的形成。将有水解圈的菌落在筛选培养基的平板上进行分离纯化。记录水解圈直径和菌落直径大小,并将纯化的菌种−80 ℃甘油保藏。
1.4 菌株的表型特征鉴定对所筛选菌株进行个体形态观察,参照《伯杰细菌鉴定手册》[14]和《常见细菌系统鉴定手册》[15],对Z-3、Z-4、Z-29和Z-30分别进行明胶液化、V-P试验、接触酶试验、耐10% NaCl试验、丙酸盐利用、柠檬酸盐利用、D-木糖产酸试验、D-甘露醇产酸试验。
1.5 菌株的分子生物学鉴定采用细菌通用引物27F和1492R进行16S rRNA基因的PCR扩增[16]。PCR反应体系(50 μL):DNA模板1 μL,上、下游引物(10 μmol/L)各2 μL,2×Taq MasterMix 25 μL,双蒸水补足到50 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 7 min;15 ℃保存。PCR结束后,进行琼脂糖凝胶电泳检测PCR扩增结果,送至上海桑尼生物科技有限公司测序。
1.6 小龙虾肠道16S rRNA基因高通量测序采用CTAB方法提取小龙虾肠道总DNA,利用1%琼脂糖凝胶电泳检测纯度和浓度,送至武汉基诺塞克科技有限公司进行16S rRNA基因高通量测序。
2 结果与分析 2.1 小龙虾肠道产木聚糖酶细菌的分离与筛选在筛选培养基平板中以及28 ℃的环境条件下,菌株能够利用培养基中的营养物质进行生长并产生木聚糖酶,使培养基中的玉米芯木聚糖水解并形成透明圈。水解圈直径与菌落直径之比较大的菌株产木聚糖酶能力比较强,反之较弱。从表 1中可以看出Z-3产酶能力最大,其次是Z-4,Z-29、Z-30产酶能力最小。
| 菌株 Strains |
水解圈直径D
Diameter of the clear zone (cm) |
菌落直径d
Diameter of the colony (cm) |
D/d |
| Z-3 | 1.28 | 0.38 | 3.37 |
| Z-4 | 1.23 | 0.58 | 2.12 |
| Z-29 | 0.97 | 0.62 | 1.56 |
| Z-30 | 0.68 | 0.63 | 1.08 |
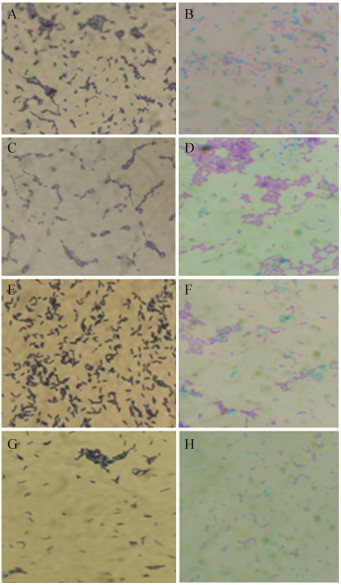
|
| 图 1 形态学鉴定结果(1 000×) Figure 1 Results of morphological identification (1 000×) 注:A:菌株Z-3,革兰氏阳性菌;B:菌株Z-3的芽孢染色,绿色为芽孢,红色为菌体;C:菌株Z-4,革兰氏阳性菌;D:菌株Z-4的芽孢染色,绿色为芽孢,红色为菌体;E:菌株Z-29,革兰氏阳性菌;F:菌株Z-29的芽孢染色,绿色为芽孢,红色为菌体;G:菌株Z-30,革兰氏阳性菌;H:菌株Z-30的芽孢染色,绿色为芽孢,红色为菌体. Note: A: Strain Z-3, Gram positive bacterium; B: Spore staining of strain Z-3, green is spore, red is a bacterium; C: Strain Z-4, Gram positive bacterium; D: Spore staining of strain Z-4, green is spore, red is a bacterium; E: Strain Z-29, Gram positive bacterium; F: Spore staining of strain Z-29, green is spore, red is a bacterium; G: Strain Z-30, Gram positive bacterium; H: Spore staining of strain Z-30, green is spore, red is a bacterium. |
|
|
| Test items | Z-3 | Z-4 | Z-29 | Z-30 |
| Gram stain | + | + | + | + |
| Protease | + | + | + | + |
| Amylase | + | − | + | + |
| Gelatin liquefaction test | + | + | + | + |
| V-P | + | − | + | − |
| Catalase | + | + | + | + |
| Growth in 10% NaCl | + | − | + | − |
| Citrate | + | + | + | − |
| Proodate | − | − | − | − |
| D-Xylose | + | − | − | + |
| D-Mannitol | + | + | − | + |
| 注:+:阳性反应;−:阴性反应. Note: +: Positive; −: Negative. |
||||

|
| 图 2 PCR产物扩增结果 Figure 2 Results of amplify for PCR products 注:M:DNA Marker;Z-3、Z-4、Z-29、Z-30:16S rRNA基因扩增序列. Note: M: DNA Marker; Z-3, Z-4, Z-29, Z-30: 16S rRNA gene amplified fragments. |
|
|
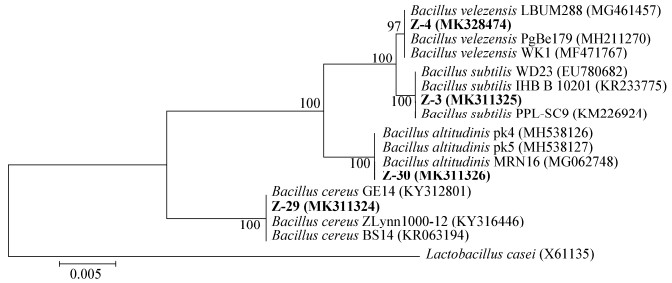
|
| 图 3 菌株Z-3、Z-4、Z-29、Z-30的16S rRNA基因系统发育树 Figure 3 Phylogenetic tree of strains Z-3, Z-4, Z-29 and Z-30 based on the 16S rRNA gene sequence 注:节点左边的数值是基于邻接法1 000次重复取样数据集的Bootstrap支持率;比例尺0.005表示1 000个核苷酸中有5个被替换;括号内的序号表示相应序列在GenBank的登录号. Note: The values on the left side of the node were Bootstrap support rates based on the neighboring method by 1 000 repeated sampling; The scale bar, 0.005, represented five out of 1 000 nucleotides were replaced; Numbers in the parentheses indicated GenBank accession number of the sequence. |
|
|
小龙虾肠道细菌在属水平上的分类(图 4),Candidatus Bacilloplasma和拟杆菌属细菌数量最多,Candidatus Bacilloplasma占24.93%,拟杆菌属细菌占23.44%,弧菌属细菌占10.11%,不动杆菌属细菌占3.81%,Dysgonomonas占2.99%,Tyzzerella 3占2.06%,气单胞菌属细菌占1.13%,希瓦氏菌属细菌占1.05%,其余的未知菌属细菌占30.48%。
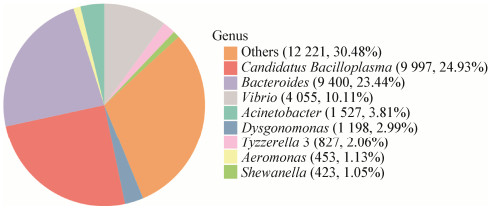
|
| 图 4 小龙虾肠道细菌在属水平上的群落结构组分图 Figure 4 The community composition of intestinal bacteria at the genus level of crayfish 注:括号内的数字表示物种的序列数;百分数代表物种的百分比. Note: Numbers in the parentheses indicated the number of sequences of species and the percentage of species. |
|
|
木聚糖酶具有重要的应用价值,在饲料、食品医药、制浆造纸等行业中有着广阔的应用前景[17]。目前工业应用的木聚糖酶存在着不同的缺陷,阻碍了木聚糖酶在诸多领域的高效应用,进一步挖掘新的木聚糖酶菌株资源和基因资源,仍然显得十分重要[18]。细菌木聚糖酶具有稳定的酶学特性,发掘和研究高产菌株资源对促进木聚糖酶工业发展具有十分重要的意义[19]。小龙虾以植物根、叶为食,肠道中生存着大量的纤维素降解细菌,然而目前,小龙虾肠道微生物的相关研究还很少,对小龙虾肠道菌群的种群组成和功能都知之甚少,从小龙虾肠道中筛选产木聚糖酶细菌,有望获得全新的木聚糖酶菌株资源和基因资源,同时对小龙虾肠道菌群进行多样性分析,有助于了解宿主与菌群间的相互作用关系,揭示小龙虾降解纤维素的机制。
利用Illumina平台对16S rRNA基因的一个或多个高变区测序,具有测序深度高、利于鉴定低丰度群落物种的特点,但是高通量测序读长有限,不可能将16S rRNA基因的9个可变区全部测序,所以往往只选择1−3个可变区作为测序区域,单端测序长度为250 bp,双端测序长度为500 bp,测序片段越短,后续对序列进行物种注释时的分辨度越低,只能将微生物注释到属的分类水平[20]。本论文采用高通量测序研究了小龙虾肠道菌群结构,结果表明小龙虾肠道核心菌群包括Candidatus Bacilloplasma、拟杆菌属、弧菌属、不动杆菌属、Dysgonomonas、Tyzzerella 3、气单胞菌属细菌,为小龙虾肠道菌群多样性研究、纤维素在肠道内的降解机制研究以及小龙虾肠道内功能菌的定向选育提供指导。
本实验从小龙虾肠道中筛选出4株产木聚糖酶菌株,分别编号为Z-3、Z-4、Z-29、Z-30。对4株菌株进行表型和分子生物学鉴定,判定4株菌均属于革兰氏阳性的芽孢杆菌科芽孢杆菌属。其中菌株Z-3为枯草芽孢杆菌(Bacillus subtilis),菌株Z-4为贝莱斯芽孢杆菌(Bacillus velezensis),菌株Z-29为蜡状芽孢杆菌(Bacillus cereus),菌株Z-30为高地芽孢杆菌(Bacillus altitudinis),形态学鉴定结果也相吻合。芽孢杆菌属(Bacillus)是一类产芽孢的革兰氏阳性细菌,好氧或兼性厌氧生活[21],芽孢杆菌属的微生物能够形成芽孢的特性使得他们能够抵抗各种极端环境,而且对各种杀菌剂也具有一定的抵抗力,他们在各种自然环境中都能被分离到[22]。本实验筛选到的菌株并不是小龙虾肠道中的优势菌群,在属的水平上,小龙虾肠道中的优势菌群为Candidatus Bacilloplasma、拟杆菌属和弧菌属。这与本研究采用的筛选方法以及小龙虾肠道本身的菌群结构有关,芽孢杆菌属多为好氧菌,较易于实验室培养。Candidatus Bacilloplasma被定义为软壁菌门柔膜菌纲,有关Candidatus Bacilloplasma在肠道内的作用研究很少,在肠道内的作用尚不清楚[23]。拟杆菌属(Bacteroides)是无芽孢、专性厌氧的革兰氏阴性菌。研究发现,许多拟杆菌属菌株具有降解纤维素类的多酶体系,该多酶复合体具有纤维素酶和木聚糖酶活性,可影响纤维素晶体和木质纤维素的降解[24],也有研究表明拟杆菌还有助于增强机体免疫力[25]。弧菌属于弧菌科弧菌属,是一类革兰氏阴性、具极生鞭毛、能运动、无芽孢的短杆状细菌,是引起海、淡水养殖鱼类细菌性疾病最重要的病原菌之一[26-27]。通过对小龙虾肠道物种组成结构及功能的分析,可以发现小龙虾肠道内还含有大量未知的未分离到(含大量厌氧菌)或者不可培养的纤维素降解菌,这也指示我们对筛选方法进行改进以及通过其他的生物技术手段广泛获得木聚糖酶基因资源。通过认识小龙虾肠道菌群的相互联系,以及微生物与宿主的共生关系,一方面,可以了解肠道菌群与小龙虾疾病和免疫的关系,为小龙虾养殖用益生菌的开发和饲料配方的优化提供依据;另一方面,也为小龙虾纤维素降解机制的研究提供参考。
| [1] |
Liu CC, Liu B, Lan JL, et al. Screening of xylanase-producing Bacillus sp. and optimization of fermentation process[J]. Fujian Journal of Agricultural Sciences, 2014, 29(8): 757-767. (in Chinese) 刘程程, 刘波, 蓝江林, 等. 产木聚糖酶芽胞杆菌的筛选及产酶条件优化[J]. 福建农业学报, 2014, 29(8): 757-767. DOI:10.3969/j.issn.1008-0384.2014.08.011 |
| [2] |
Hu FJ, Yu JH, Zhang QH, et al. Cloning, expression and optimization of xylanase Xyn2441 from Clostridium clariflavum DSM19732[J]. Food and Fermentation Industries, 2016, 42(7): 16-22. (in Chinese) 胡方觊, 余嘉慧, 张庆华, 等. Clostridium clariflavum DSM19732木聚糖酶Xyn2441的克隆表达及条件优化[J]. 食品与发酵工业, 2016, 42(7): 16-22. |
| [3] |
Meng DD, Ying Y, Chen XH, et al. Distinct roles for carbohydrate-binding modules of glycoside hydrolase 10 (GH10) and GH11 xylanases from Caldicellulosiruptor sp. strain F32 in thermostability and catalytic efficiency[J]. Applied and Environmental Microbiology, 2015, 81(6): 2006-2014. DOI:10.1128/AEM.03677-14 |
| [4] |
Mattéotti C, Bauwens J, Brasseur C, et al. Identification and characterization of a new xylanase from Gram-positive bacteria isolated from termite gut (Reticulitermes santonensis)[J]. Protein Expression and Purification, 2012, 83(2): 117-127. |
| [5] |
He YD, Hua XM, Zhao CY, et al. Fat requirement and optimal dietary fat to carbohydrate ratio for red swamp crayfish (Procambarus clarkii)[J]. Chinese Journal of Animal Nutrition, 2013, 25(5): 1017-1024. (in Chinese) 何亚丁, 华雪铭, 赵朝阳, 等. 克氏原螯虾的脂肪需求量及饲料中脂肪与糖类适宜比例研究[J]. 动物营养学报, 2013, 25(5): 1017-1024. DOI:10.3969/j.issn.1006-267x.2013.05.017 |
| [6] |
James J, Davidson KE, Richardson G, et al. Reduced aggression and foraging efficiency of invasive signal crayfish (Pacifastacus leniusculus) infested with non-native branchiobdellidans (Annelida: Clitellata)[J]. Parasites & Vectors, 2015, 8(1): 596. |
| [7] |
Nishijima S, Nishikawa C, Miyashita T. Habitat modification by invasive crayfish can facilitate its growth through enhanced food accessibility[J]. BMC Ecology, 2017, 17(1): 37. DOI:10.1186/s12898-017-0147-7 |
| [8] |
Stern DB, Breinholt J, Pedraza-Lara C, et al. Phylogenetic evidence from freshwater crayfishes that cave adaptation is not an evolutionary dead-end[J]. Evolution, 2017, 71(10): 2522-2532. DOI:10.1111/evo.13326 |
| [9] |
Cai W, Ma Z, Yang C, et al. Using eDNA to detect the distribution and density of invasive crayfish in the Honghe-Hani rice terrace World Heritage site[J]. PLoS One, 2017, 12(5): e0177724. DOI:10.1371/journal.pone.0177724 |
| [10] |
Huang SW, Yang WC, Zhu H, et al. Cloning and expression of red swamp crayfish major allergen tropomyosin gene and identification of its immunoglogic activity[J]. Chinese Journal of Immunology, 2011, 27(7): 642-647. (in Chinese) 黄素文, 杨文潮, 朱海, 等. 淡水小龙虾主要过敏原原肌球蛋白基因的克隆、表达及其免疫活性鉴定[J]. 中国免疫学杂志, 2011, 27(7): 642-647. DOI:10.3969/j.issn.1000-484X.2011.07.015 |
| [11] |
Lan JF, Li XC, Sun JJ, et al. Prohibitin interacts with envelope proteins of white spot syndrome virus and prevents infection in the red swamp crayfish, Procambarus clarkii[J]. Journal of Virology, 2013, 87(23): 12756-12765. DOI:10.1128/JVI.02198-13 |
| [12] |
Song JH, Dai F, Bai X, et al. Recent incidence of Paragonimus westermani metacercariae in freshwater crayfish, Cambaroides similis, from two enzootic sites in Jeollanam-do, Korea[J]. Korean Journal of Parasitology, 2017, 55(3): 347-350. DOI:10.3347/kjp.2017.55.3.347 |
| [13] |
Li Q, Xie LL, Lin YC, et al. Dietary phosphorus requirement of juvenile red swamp crayfish, Procambarus clarkii[J]. Journal of Huazhong Agricultural University, 2013, 32(2): 109-115. (in Chinese) 李强, 谢玲玲, 林郁葱, 等. 克氏原螯虾对饲料中磷的需求量[J]. 华中农业大学学报, 2013, 32(2): 109-115. DOI:10.3969/j.issn.1000-2421.2013.02.019 |
| [14] |
Buchanan RE, Gibbons NE. Bergeyʼs Manual of Determinative Bacteriology[M]. Translation Group of Berger Bacterial Identification Manual, Institute of Microbiology, Chinese Academy of Sciences, trans. Beijing: Science Press, 1984: 729-758 (in Chinese) 布坎南RE, 吉本斯NE.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译.北京: 科学出版社, 1984: 729-758 |
| [15] |
Dong XZ, Cai MY. Manual of Systematic Determinative General Bacteriology[M]. Beijing: Science Press, 2001: 349-412. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 349-412. |
| [16] |
Weisburg WG, Barns SM, Pelletier DA, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 173(2): 697-703. DOI:10.1128/jb.173.2.697-703.1991 |
| [17] |
Zhang QF, Xu J, Yang XL, et al. Screening of a xylanase-producing strain and optimization in fermentation conditions[J]. Chemistry & Bioengineering, 2017, 34(10): 20-24, 31. (in Chinese) 张庆芳, 许晶, 杨旭立, 等. 一株产木聚糖酶菌株的筛选及发酵产酶条件优化[J]. 化学与生物工程, 2017, 34(10): 20-24, 31. DOI:10.3969/j.issn.1672-5425.2017.10.005 |
| [18] |
Sun MZ, Zheng HC, Sun JS, et al. Screening of thermostable xylanase producing strains and its condition optimization for xylanase production[J]. China Brewing, 2013, 32(8): 15-20. (in Chinese) 孙明哲, 郑宏臣, 孙君社, 等. 产耐高温木聚糖酶菌株的筛选及其产酶条件优化[J]. 中国酿造, 2013, 32(8): 15-20. DOI:10.3969/j.issn.0254-5071.2013.08.004 |
| [19] |
Gao ZQ, Li X, Xu YS, et al. Isolation and identification of a xylanase-producing bacterium and its enzymatic characteristics[J]. Chinese Journal of Applied and Environmental Biology, 2017, 23(3): 443-447. (in Chinese) 高志强, 李茜, 徐岳松, 等. 高产木聚糖酶细菌的筛选、鉴定及其部分酶学特性[J]. 应用与环境生物学报, 2017, 23(3): 443-447. |
| [20] |
Chen ZB, Li B, Wang DK, et al. Diversity of endophytic bacteria in walnut analyzed by Illumina MiSeq high-throughput sequencing technology[J]. Jiangsu Journal of Agricultural Sciences, 2015, 31(5): 1129-1133. (in Chinese) 陈泽斌, 李冰, 王定康, 等. Illumina MiSeq高通量测序分析核桃内生细菌多样性[J]. 江苏农业学报, 2015, 31(5): 1129-1133. DOI:10.3969/j.issn.1000-4440.2015.05.029 |
| [21] |
Liu GH, Liu B, Lin NQ, et al. Phyletic evolution and taxonomic characteristics of Bacillus[J]. Fujian Journal of Agricultural Sciences, 2008, 23(4): 436-449. (in Chinese) 刘国红, 刘波, 林乃铨, 等. 芽孢杆菌的系统进化及其属分类学特征[J]. 福建农业学报, 2008, 23(4): 436-449. DOI:10.3969/j.issn.1008-0384.2008.04.021 |
| [22] |
Wang L, Qu Q, Li L. Review on microbiologically influenced corrosion by Bacillus genus[J]. Total Corrosion Control, 2013, 27(10): 55-60. (in Chinese) 王蕾, 屈庆, 李蕾. 芽抱杆菌属微生物腐蚀研究进展[J]. 全面腐蚀控制, 2013, 27(10): 55-60. DOI:10.3969/j.issn.1008-7818.2013.10.017 |
| [23] |
Huang QC, Tan BP, Dong XH, et al. Effect of chitosan oligosaccharide and mycotoxin adsorbents on intestinal mucosa structure and gut flora of Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2018, 25(2): 373-383. (in Chinese) 黄钦成, 谭北平, 董晓慧, 等. 饲料中添加壳寡糖和霉菌毒素吸附剂对凡纳滨对虾肠道黏膜形态及菌群结构的影响[J]. 中国水产科学, 2018, 25(2): 373-383. |
| [24] |
Liu QQ, Zheng JT, Liu HC. Isolation and characterization of a Bacteroides strain from Tideland of East China Sea[J]. China Biogas, 2013, 31(6): 3-8. (in Chinese) 刘全全, 郑经堂, 刘海昌. 一株拟杆菌的分离鉴定及代谢特征分析[J]. 中国沼气, 2013, 31(6): 3-8. DOI:10.3969/j.issn.1000-1166.2013.06.001 |
| [25] |
Xue B, Li ST, Peng XC. Effect of aqueous extracts of six flavoring mterials on the construction of two rats' colonic bacteria[J]. Modern Food Science and Technology, 2013, 29(7): 1501-1504, 1490. (in Chinese) 薛斌, 李少艇, 彭喜春. 六种香辛料水提取物对大鼠中两类主要肠道菌分布的影响[J]. 现代食品科技, 2013, 29(7): 1501-1504, 1490. |
| [26] |
Sun Y, Liu Y, Wang HL, et al. Designing of vibrio 16S rDNA specific primers and analysis of seawater vibrio community structure[J]. Periodical of Ocean University of China (Natural Science Edition), 2010, 40(S1): 122-130. (in Chinese) 孙颖, 刘泳, 王华磊, 等. 弧菌16S rRNA基因特异引物设计及海洋弧菌菌群结构分析[J]. 中国海洋大学学报:自然科学版, 2010, 40(S1): 122-130. |
| [27] |
Liu YP, Huang GJ, Liu TQ, et al. Establishment and application of PCR assay for dection of Vibrio spp[J]. Freshwater Fisheries, 2015, 45(3): 88-92. (in Chinese) 刘衍鹏, 黄冠军, 刘天强, 等. 弧菌属PCR检测方法的建立与应用[J]. 淡水渔业, 2015, 45(3): 88-92. DOI:10.3969/j.issn.1000-6907.2015.03.015 |
 2019, Vol. 46
2019, Vol. 46




