扩展功能
文章信息
- 刘缨, 王梦雨, 陈国参, 王继雯, 幕琦, 徐文洪, 李健强, 刘志培
- LIU Ying, WANG Meng-Yu, CHEN Guo-Can, WANG Ji-Wen, MU Qi, XU Wen-Hong, LI Jian-Qiang, LIU Zhi-Pei
- DDT降解菌株Chryseobacterium sp. PYR2对小麦的促生作用及其机理
- Plant growth-promoting effect and its mechanism of the DDT-degrading strain PYR2
- 微生物学通报, 2019, 46(6): 1346-1355
- Microbiology China, 2019, 46(6): 1346-1355
- DOI: 10.13344/j.microbiol.china.181041
-
文章历史
- 收稿日期: 2018-12-20
- 接受日期: 2019-03-22
- 网络首发日期: 2019-03-27
2. 中国农业大学植物保护学院 北京 100083;
3. 河南省科学院微生物研究所有限责任公司 河南 郑州 450008;
4. 河南省科学技术信息研究院 河南 郑州 450003
2. College of Plant Protection, China Agricultural University, Beijing 100083, China;
3. Institute of Biology Co., Ltd., Henan Academy of Sciences, Zhengzhou, Henan 450008, China;
4. Henan Provincial Institute of Scientific and Technical Information, Zhengzhou, Henan 450003, China
双对氯苯基三氯乙烷(DDT)是一类有机氯杀虫剂,也是一种持久性有机污染物,化学性质十分稳定,在土壤中的半衰期较长。DDT残留对生态环境和人体健康造成潜在危害,尽管已禁用多年,但在农田土壤中仍然常检出DDT残留,在我国东部地区农田土壤中的浓度高于西部地区,其中京津冀地区DDT浓度最高[1-2]。
国内外围绕DDT污染现状及其生物修复技术做了大量的研究,分离到一批能够降解DDT的微生物菌株,研究了相关菌株的降解机理、代谢途径等[3-5]。迄今为止分离到的DDT降解菌主要通过共代谢方式降解DDT,在降解过程中需要利用其它碳源作为能源,只有少数菌株能够以DDT作为唯一碳源,通过降解DDT进行生长[6-7]。本课题组从长期有机氯农药污染的土壤样品中,通过富集培养和驯化分离筛选出一株DDT降解菌株Chryseobacterium sp. PYR2,该菌株能够以DDT为唯一碳源进行生长,并将DDT彻底降解脱毒[8]。接种PYR2菌株的污染土壤生物修复实验结果显示,PYR2能显著促进污染土壤中DDT的去除,经过45 d的修复,PYR2修复组土壤中80.4%的DDT被降解。上述结果表明,菌株PYR2在今后可能应用于有机氯农药污染土壤的微生物修复,具有潜在的应用价值。
在污染环境的微生物生物修复过程中,接种的降解菌与土著微生物、植物之间存在着极为复杂的相互作用,需要综合考虑土壤修复菌和环境之间的关系。Liu等研究发现,植物根系分泌物可以增强根际微生物活性,同时微生物活动也有助于释放根系分泌物,二者共同作用促进污染物的降解[9]。张超兰等对有机氯农药六六六污染土壤的研究发现,植物根部释放的酶和根际区微生物的共同作用是土壤中有机氯农药降解的主要原因[10]。目前,国内外关于DDT降解菌在土壤中对植物的影响鲜有报道,而同时具有降解农药如DDT和植物促生双重功效的菌株尚未见报道。菌株PYR2属于金黄杆菌属(Chryseobacterium),有报道表明,该属成员属于植物促生菌(Plant growth promoting rhizobacteria,PGPR),有些如Chryseobacterium hispalense能合成吲哚-3-乙酸(Indole-3-acetic acid,IAA)促进植物根系生长[11-12],有些能分泌蛋白酶、果胶酶、几丁质酶、铁载体,有些还能拮抗植物真菌性病害[13-14]。本研究以DDT降解菌株Chryseobacterium sp. PYR2为对象,在已有的DDT降解特性研究的基础上,进一步研究该菌株对植物的促生作用及其机理,包括对小麦种子的萌发、小麦植株生长的影响、菌株的植物促生物质及其生物合成途径分析等,以期为开发DDT降解和植物促生双效微生物菌剂与应用提供基础。
1 材料与方法 1.1 材料 1.1.1 材料来源 菌株Chryseobacterium sp. PYR2由本课题组从受有机氯农药高度污染土壤中分离获得[8]。作物种子小麦采用新乡58品种,由中国农业科学院植物保护研究所提供,当年收获。
1.1.2 主要试剂和仪器 L-色氨酸,上海麦克林生化科技有限公司;吲哚-3-乙酸(IAA)等标准品,上海阿拉丁生化科技股份有限公司;BactoTM Tryptic Soy Broth,BD公司。多功能微孔板检测仪,Bio-Tek公司;液相色谱-质谱联用仪,Agilent公司;智能人工气候箱,宁波江南仪器厂。 1.1.3 培养基 1/10稀释TSB液体培养基:BactoTM Tryptic Soy Broth 3 g/L,用1 mol/L的NaOH调pH至7.0,1×105 Pa高压灭菌20 min。 1.2 方法 1.2.1 PYR2菌株的培养 将PYR2菌株接种于含有L-色氨酸(50 mg/L)的1/10稀释的TSB液体培养基中,按1% (体积比)接种量接种菌株,30 ℃、160 r/min培养过夜后,8 000 r/min离心10 min分离菌体和上清,将菌体用无菌水洗涤重悬,菌悬液检测活菌数,并调至1×109、2×108、2×107 CFU/mL 3个不同浓度。 1.2.2 PYR2菌株对植物促生效果 种子萌发实验:选取籽粒饱满的小麦种子,用70%的酒精消毒1 min,用蒸馏水反复冲洗干净,再用2%的次氯酸钠溶液消毒30 min,用蒸馏水反复冲洗干净。将消毒处理后的小麦种子分别浸泡在浓度为1×109 CFU/mL菌悬液(A1处理)、2×108 CFU/mL菌悬液(A2处理)、2×107 CFU/mL菌悬液(A3处理),以及无菌水阴性对照(CK1处理)的溶液中,浸种2 h,用纸卷发芽方法,光照培养箱恒温25 ℃,12 h光照/12 h黑暗条件下培养。每个处理组重复4次,每个重复使用100粒种子。小麦种子萌发后第4天统计发芽势,第8天小心取出小麦植株,统计发芽率,观察植株根系发育形态,统计畸变率,分别测定各处理组幼苗的苗高、根长和侧根数。小麦盆栽实验:实验用盆直径约20 cm,每盆加土1.5−2.0 kg,小麦每盆7−8棵苗,播种后取长势一致的幼苗作为研究对象,分别用1×108、1×107、1×106 CFU/mL浓度的菌悬液灌根处理,并设置无菌水对照处理(CK1),每个处理组重复3次,分别于种子出苗后第18、28、34、40天进行灌溉接种,第65天进行检测,并统计幼苗株高、鲜重、干重。
1.2.3 菌株PYR2产植物促生物质条件研究 不同培养条件对菌株生长及产IAA的影响:分别设置不同培养温度(4、11、20、30、37、40 ℃)、不同初始pH (5.0、6.0、7.0、7.5、8.0、8.5、9.0)、不同盐度(0%、0.5%、1%、2%、3%)、不同色氨酸底物浓度(0、50、100、150、200 mg/L)接种菌株PYR2,30 ℃、160 r/min培养48 h后测定菌株的生长情况和IAA的含量,每个处理设置3个重复。优化条件下菌株生长及IAA合成研究:将PYR2菌株接种于pH 7.0、盐浓度0.5%、L-色氨酸底物浓度50 mg/L的1/10稀释TSB液体培养基中,按1% (体积比)接种量接种菌株后,30 ℃、160 r/min培养,每8 h动态取样,测定菌株的生长情况及IAA含量,每个处理设置3个重复。
1.2.4 PYR2菌株植物促生物质及其生物合成途径研究 将100 mL 1/10稀释TSB液体培养基(含色氨酸50 mg/L)灭菌后接种活化的PYR2菌,以30 ℃、160 r/min的速率振荡培养,分别在接种后20 h及24 h取样,样品用8 000 r/min离心10 min沉淀菌体,上清用0.22 μm的微孔滤膜过滤后,滤液用稀甲酸调pH 2.5−3.0,用乙酸乙酯萃取,室温下干燥后再用甲醇溶液溶解,微孔滤膜过滤后用HPLC测定滤液中植物促生物质及其中间代谢产物。标准品色胺(TAM)、色醇(TOL)、吲哚-3-乙酰胺(IAM)和吲哚-3-乙腈(IAN)分别用甲醇溶解后配制成混合标样,混合标样中每种标准品含量为5×10−7 g/L。IAA及其中间代谢产物的提取按参考文献[15]所述进行:菌株PYR2发酵液离心去除菌体,上清液用0.22 μm的微孔滤膜过滤后,用乙酸乙酯萃取2次,收集、合并有机相,真空干燥后用甲醇溶解,用于LC-MS分析。
LC-MS仪器为安捷伦1260/6460,配电子喷雾电离(ESI)离子阱Mass Spectrometer。运行条件为:二级质谱碰撞电压85 V,碰撞能量25 eV,电喷雾电离(ESI),正离子模式。检测方式:MRM模式。
数据分析采用统计软件SPASS V16.0进行分析,计算样本平均值及标准差;用单因素方差分析方法进行差异性分析,最小显著差(Least significant difference,LSD)在0.05概率水平,确定各个平均值之间的差异显著性。
2 结果与分析 2.1 PYR2菌株对植物的促生效果用纸卷发芽法研究PYR2菌株的不同浓度菌悬液处理对小麦(新乡58)种子萌发的结果表明,3个处理组的苗高与对照组相比均有显著提高(P < 0.05);采用1×109、2×108 CFU/mL菌悬液处理组的侧根数指标显著高于对照组,比对照组提高了8.7%;但发芽势、发芽率和畸变率指标上,处理组和对照组差异不显著(表 1)。
| Experiment group | Germination potential (%) |
Germination rate (%) |
Abnormal rate (%) |
Root length (cm) |
Seedling height (cm) |
Lateral root number |
| CK1 (Sterile water) | 67.5±4.5a | 73.8±8.2a | 1.8±1.0a | 8.8±1.6ab | 8.1±0.8b | 4.6±0.7b |
| A1 (1×109 CFU/mL) | 69.5±16.1a | 76.5±10.8a | 2.5±3.7a | 9.0±1.3a | 9.0±1.0a | 5.0±0.9a |
| A2 (2×108 CFU/mL) | 71.3±9.0a | 73.5±21.1a | 0.5±1.0a | 7.7±1.4c | 9.0±0.8a | 5.0±0.7a |
| A3 (2×107 CFU/mL) | 71.3±10.1a | 75.8±11.1a | 0.8±0.5a | 8.1±2.1bc | 9.1±0.9a | 4.8±0.7ab |
| 注:误差值为标准差;表中数据为平均值;小写字母表示处理在5%水平显著差异. Note: Error value is the standard deviation; Data in the table are the average of replicates; Lowercase letters logo treatment at 5% level remarkable. |
||||||
进一步采用盆栽试验法探讨了PYR2菌株不同浓度菌悬液处理对小麦植株生长的影响。菌悬液处理与无菌水对照组相比,1×107 CFU/mL菌悬液处理组小麦的株高、鲜重、干重指标和对照组有显著差异,分别比对照组提高了4.1%、24.7%、36.9%;1×108、1×106 CFU/mL菌悬液处理组和对照组相比差异不显著(表 2)。
| Experiment group | Plant height (cm) | Fresh weight of 5 seedlings (g) | Dry weight of 5 seedlings (g) |
| CK1 (Sterile water) | 43.4±1.2b | 10.59±1.98ab | 1.60±0.10b |
| A1 (1×108 CFU/mL) | 41.7±2.1b | 9.86±1.32b | 1.22±0.27b |
| A2 (1×107 CFU/mL) | 45.2±2.0a | 13.21±1.56a | 2.19±0.37a |
| A3 (1×106 CFU/mL) | 43.1±3.2b | 10.62±1.10a | 1.61±0.04b |
| 注:误差值为标准差;表中数据为平均值;小写字母表示处理在5%水平差异显著. Note: Error value is the standard deviation; Data in the table are the average of replicates; Lowercase letters logo treatment at 5% level remarkable. |
|||
为了分析PYR2菌株所产植物促生作用物质的种类,特别是是否产生了常见的植物生长激素IAA,将该菌株接种到含50 mg/L L-色氨酸的1/10稀释TSB液体培养基中,培养2 d后上清液用Salkowski比色液[16]检测呈红色,而不接菌的对照则没有这种反应,说明PYR2菌株能利用色氨酸产生IAA。另外,不含色氨酸的培养上清液在比色反应中颜色变化不明显,说明培养基中加入色氨酸能明显增加PYR2菌株合成IAA的量。
采用单因素实验法研究了各培养条件,包括温度、pH、盐度以及底物浓度对PYR2菌株生长和IAA产量的影响,结果如图 1所示。图 1A表明,菌株生长温度在10−37 ℃之间,20 ℃菌株生长最好;但IAA产量与菌株的生长不同,在30 ℃达到最大值11.9 mg/L;当生长温度高于30 ℃,菌体生长量和IAA产量均减少。图 1B表明,初始pH < 6.0时菌株几乎不生长;pH为7.0−8.0时菌株生长良好,pH 7.5时OD600值最高为0.720;pH > 8.0时菌株生长呈下降趋势。IAA产量则在pH > 6.0时随pH上升而缓慢提高,在pH 8.5左右达到最大值10.9 mg/L。图 1C表明,PYR2菌株在盐浓度 < 0.5% (质量体积比)时,菌体生长量及IAA产量最高,随盐度提高而逐渐下降;当盐浓度 > 3%时,菌体几乎不生长,也几乎不合成IAA。图 1D表明,在添加不同浓度色氨酸底物时,菌生长几乎不受影响,而IAA的量则在色氨酸浓度 < 50 mg/L时随其浓度的增大而直线提高,从不加色氨酸时的2.8 mg/L提高到50 mg/L色氨酸时的9.9 mg/L,继续提高色氨酸底物浓度后,IAA的合成量并未随着底物浓度的增大而提高。

|
| 图 1 培养条件对菌株生长及产IAA的影响 Figure 1 Effect of cultivation conditions on cell growth and IAA production of strain PYR2 注:A:温度;B:pH;C:盐浓度;D:底物浓度. Note: A: Temperature; B: pH; C: NaCl concentration; D: L-Trp concentration. |
|
|
PYR2菌株合成IAA的量受到温度、pH、盐浓度及色氨酸底物的影响,菌株的最佳生长条件为:温度30 ℃,pH 7.0−8.0,盐浓度≤0.5%;培养基中添加50 mg/L的色氨酸底物对IAA的合成有明显提高作用。
进一步探讨了优化培养条件下菌株生长及IAA产生情况,如图 2所示。结果表明,优化条件下培养8 h后,PYR2菌株进入对数生长期,16 h菌体生长OD600值达到最大值0.940,随后进入稳定期,OD600值有缓慢下降趋势,菌体数量逐渐减少,进入衰退期;随着培养时间的延长,IAA含量则不断增多,培养16 h以后IAA浓度大于10 mg/L,培养48 h时培养液中IAA为16.4 mg/L,相比上文不同培养条件下的IAA最大产量,优化培养条件后IAA产量提高了约1.5倍;菌体培养至64 h左右,IAA产量达到最大值,浓度为18.3 mg/L。
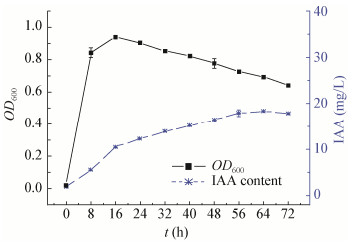
|
| 图 2 优化培养条件下菌株PYR2的生长及IAA产量 Figure 2 Strain growth and IAA production of strain PYR2 under optimized conditions |
|
|
LC-MS检测中,标准品和样品的MRM总离子流图见图 3,其中标样(图 3A) TAM保留时间为4.553 min,IAM保留时间为11.031 min,IAA保留时间为12.166 min,TOL保留时间为12.170 min,IAN保留时间12.933 min;20 h样品(图 3B)和24 h样品(图 3C)在TAM、IAM、IAA、TOL保留时间位置都有对应的峰,与标样出峰时间基本一致;样品在IAN保留时间段没有检测到出峰信号。

|
| 图 3 标准品和样品的LC-MS总离子流图(Total ion chromatography,TIC) Figure 3 LC-MS analysis of standards and cell extracts 注:A:标准品;B:20 h发酵液;C:24 h发酵液. Note: A: Standard; B: Sample cultured after 20 h; C: Sample cultured after 24 h. |
|
|
根据IAA的相对分子质量和特征官能团的峰值,利用LC-MS定性测定吲哚类化合物,然后与标样比较进行样品的定性分析。LC-MS/MS-MRM检测上清液中的中间代谢产物的特征离子质谱图(图 4)结果表明,标准品TAM和样品在质荷比(m/z)为117.2、144.1处都有对应的特征峰值;标准品IAM和样品在质荷比(m/z)为130.1、158.1处都有对应的特征峰值;标准品IAA和样品在质荷比(m/z)为103.1、130.1处都有对应的特征峰值;标准品TOL和样品在质荷比(m/z)为117.1、144.1处都有对应的特征峰值,表明上清液中含有IAA、TAM、IAM和TOL四种化合物。

|
| 图 4 样品在MRM模式下的二级质谱图 Figure 4 EIC MS (2) of cell extracts Note: A: IAA; B: TAM; C: IAM; D: TOL. |
|
|
对小麦的促生实验结果表明,PYR2菌株无论是对小麦种子的发芽,还是对小麦植株的生长都具有明显的促进作用,实验组在很多指标上,如苗高、侧根数、株高、鲜重、干重等,相比对照组都显著提高(P < 0.05)。需要强调的是,在用该菌株菌悬液浸泡小麦种子时,2×107 CFU/mL的菌悬液即可达到良好的效果;同样,以1×108 CFU/mL菌悬液浇灌小麦新乡58,对其生长的促生效果也最为显著,鲜重、干重指标分别比对照组提高了24.7%、36.9%,这些结果充分说明了该菌株对于小麦促生作用的高效性。另外,前期工作表明,该菌株的发酵液细胞密度可以达到约1010 CFU/mL (数据未给出),如果用于小麦种子浸泡,则可以稀释约1 000倍,如果用于浇灌则只需0.01%的接种量即可,这些都说明该菌株不论是使用量还是使用成本上都是可以接受的,表明其具有良好的实际应用前景。
3.2 菌株PYR2产植物促生物质条件的研究单因素实验研究表明,PYR2菌株合成IAA的量受到温度、pH、盐浓度及色氨酸底物的影响,菌体的最适生长温度、pH和合成IAA的条件并不完全一致。张振等研究耐盐节杆菌(Arthrobacter pascens) ZZ21的产IAA条件也发现了类似现象[17]。菌株PYR2在偏碱性条件下能稳定分泌IAA,其结果和张东艳等[18]报道的特基拉芽孢杆菌(Bacillus tequilensis) HS10菌株最适积累IAA的条件为偏碱性环境一致。本研究发现,盐浓度对菌株PYR2的生长及IAA合成量影响很大,PYR2菌株在盐浓度0.5%以下时,菌体生长量及IAA产量最高,在2% NaCl的培养基中生长状况良好,但IAA的合成受到明显抑制;当盐浓度达到3%以上时,菌体几乎不生长,也几乎不合成IAA。微生物的耐盐性和菌株自身特性有关,菌株PYR2属于Chryseobacterium属,已报道该属虽然只有两个种来源于海洋环境,但该属大部分菌株可以耐受一定浓度的盐,在含NaCl 1.95%的Difco海洋2216培养基上生长[19]。本实验中,在添加不同浓度色氨酸底物的培养条件下,菌体的OD600值在0.7−0.8之间,表明菌体的生长基本不受添加色氨酸底物浓度的影响;IAA产量和色氨酸底物浓度有关,在不加入色氨酸底物的培养基中,菌株产IAA的量为2.8 mg/L,在添加50 mg/L的L-色氨酸后,IAA合成量约为9.9 mg/L,是前者的3.5倍,继续提高色氨酸底物浓度后,IAA的合成量并未随着底物浓度的增加而提高,可能的原因是实验中采用的是1/10稀释的TSB液体培养基,培养基中含有的碳源和氮源较少,属于寡营养培养基,随着菌株的生长,碳源和氮源耗尽,限制了菌株合成IAA的能力。
优化条件后,IAA产量提高了约1.5倍;IAA主要积累于菌体生长的稳定期后期,这是由于IAA是细菌的次级代谢产物,而菌体在进入稳定期后会产生大量的次级代谢产物。菌体培养64 h后,IAA在培养液中增长量逐渐趋于平缓,IAA含量基本没有出现下降的趋势,这和张东艳等报道的Bacillus tequilensis HS10积累IAA的特性[18]有所不同,HS10菌株在稳定期大量积累,在稳定期后期IAA含量逐渐减少,产生明显下降趋势,分析认为HS10在菌体生长稳定期后期,由于细胞死亡产生降解游离IAA的酶,使IAA含量下降。
已报道的一些IAA产生菌的IAA产量较高,如Arthrobacter pascens ZZ21的IAA最大产量为92.31 mg/L[17],Bacillus tequilensis HS10的IAA最大产量为52.03 mg/L[18],产酸克雷伯氏菌(Klebsiella oxytoca) SG-11的IAA最大产量为47.4 mg/L[15]。与已报道的IAA产生菌相比,PYR2菌株在IAA产量方面并无优势,优化培养条件后IAA最大产量为18.3 mg/L,但上述这几株菌都是采用营养丰富的LB培养基培养,而本研究采用的是寡营养培养基,寡营养培养基中营养物质的缺乏会极大限制菌株产IAA的能力。与已报道菌株采用营养丰富的LB培养基相比,寡营养条件下细胞具有更灵活的基因调控机制和酶活控制策略,细胞衰老死亡及产生的IAA降解酶分泌较少[20]。考虑到土壤属于寡营养环境,因此,采用寡营养培养基可能会更接近土壤的培养环境。要强调的是,菌株PYR2在不添加色氨酸的培养基中也能较好合成IAA,产量可达2.8 mg/L,明显高于其他已报道的菌株,如产酸克雷伯氏菌SG-11 (1.2 mg/L)和巴西固氮菌Sp7 (0.5 mg/L)[15],说明菌株PYR2在实际应用中更具有优势。
3.3 PYR2菌株生物合成IAA的代谢途径据报道,一种微生物体内可能存在一条或多条IAA合成途径[21-22]。IPyA途径是植物合成IAA的重要途径,在多种细菌中也发现了该途径,包括成团泛菌(Pantoea agglomerans)、阴沟肠杆菌(Enterobacter cloacae)、根瘤菌(Rhizobium sp.)、慢生根瘤菌(Bradyrhizobium sp.)、固氮螺菌(Azospirillum)、蓝细菌(Cyanobacteria)等。IPyA途径中,L-色氨酸先在色氨酸氨基转移酶的作用下脱去氨基转变为IPyA,接着由吲哚丙酮酸脱羧酶(IPDC)催化生成吲哚乙醛(IAA1d),后者在吲哚乙醛氧化酶的作用下生成最终产物IAA[23-24]。本实验利用LC-MS和LC-MS/MS-MRM对PYR2菌的代谢产物进行了定性分析,结果表明,PYR2菌能产生IAA,并且检测到TAM、IAM和TOL三种中间代谢产物。在细菌体内,除IAA生物合成过程中能形成TAM、IAM和TOL外,其它代谢过程不形成这几种产物,其中TAM和IAM是IAA生物合成途径中的直接中间产物,表明菌株能以TAM及IAM这两条途径合成IAA,而TOL是IAA生物合成途径中的间接中间产物,IPyA代谢途径中产生的IPyA和IAAld很不稳定,难以检测,但IAAld能可逆性地转化为TOL,因此,TOL的存在同样证明了菌株能以IPyA代谢途径合成IAA[15]。本研究根据LC-MS及MRM实验结果,推测PYR2体内存在3条IAA合成途径,分别是IPyA途径、TAM途径和IAM途径。
| [1] |
Guo YJ, Li HE, Yan AH. Microorganisms repair of organo-chlorine pesticides in soil[J]. Journal of Hebei Agricultural Sciences, 2016, 20(5): 84-89. (in Chinese) 郭玉洁, 李慧恩, 阎爱华. 土壤有机氯农药的微生物修复[J]. 河北农业科学, 2016, 20(5): 84-89. |
| [2] |
Niu LL. Persistent toxic substances in soils and tree bark across Chinese agricultural regions: residue characteristics and associated health risks[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2015 (in Chinese) 牛丽丽.我国农田土壤和周边树皮中持久性有毒物质的残留特征及健康风险[D].杭州: 浙江大学博士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10335-1015320366.htm |
| [3] |
Sudharshan S, Naidu R, Mallavarapu M, et al. DDT remediation in contaminated soils: a review of recent studies[J]. Biodegradation, 2012, 23(6): 851-863. DOI:10.1007/s10532-012-9575-4 |
| [4] |
Wang GL, Zhang J, Wang L, et al. Co-metabolism of DDT by the newly isolated bacterium, Pseudoxanthomonas sp. wax[J]. Brazilian Journal of Microbiology, 2010, 41(2): 431-438. DOI:10.1590/S1517-83822010000200025 |
| [5] |
Xiao PF, Mori T, Kamei I, et al. A novel metabolic pathway for biodegradation of DDT by the white rot fungi, Phlebia lindtneri and Phlebia brevispora[J]. Biodegradation, 2011, 22(5): 859-867. DOI:10.1007/s10532-010-9443-z |
| [6] |
Kamanavalli CM, Ninnekar HZ. Biodegradation of DDT by a Pseudomonas species[J]. Current Microbiology, 2004, 48(1): 10-13. |
| [7] |
Bidlan R, Manonmani HK. Aerobic degradation of dichlorodiphenyltrichloroethane (DDT) by Serratia marcescens DT-1P[J]. Process Biochemistry, 2002, 38(1): 49-56. DOI:10.1016/S0032-9592(02)00066-3 |
| [8] |
Qu J, Xu Y, Ai GM, et al. Novel Chryseobacterium sp. PYR2 degrades various organochlorine pesticides (OCPs) and achieves enhancing removal and complete degradation of DDT in highly contaminated soil[J]. Journal of Environmental Management, 2015, 161: 350-357. DOI:10.1016/j.jenvman.2015.07.025 |
| [9] |
Liu R, Xiao N, Wei SH, et al. Rhizosphere effects of PAH-contaminated soil phytoremediation using a special plant named Fire Phoenix[J]. Science of the Total Environment, 2014, 473-474: 350-358. DOI:10.1016/j.scitotenv.2013.12.027 |
| [10] |
Zhang CL, Wang XY, Jiang W, et al. Phytoremediation of HCH-contaminated soils[J]. Ecology and Environment, 2007, 16(5): 1436-1440. (in Chinese) 张超兰, 汪小勇, 姜文, 等. 有机氯农药六六六污染土壤的植物修复研究[J]. 生态环境, 2007, 16(5): 1436-1440. DOI:10.3969/j.issn.1674-5906.2007.05.022 |
| [11] |
Gandhi Pragash M, Narayanan KB, Naik PR, et al. Characterization of Chryseobacterium aquaticum strain PUPC1 producing a novel antifungal protease from rice rhizosphere soil[J]. Journal of Microbiology and Biotechnology, 2009, 19(1): 99-107. |
| [12] |
del Carmen Montero-Calasanz M, G ker M, Rohde M, et al. Chryseobacterium hispalense sp. nov., a plant-growth-promoting bacterium isolated from a rainwater pond in an olive plant nursery, and emended descriptions of Chryseobacterium defluvii, Chryseobacterium indologenes, Chryseobacterium wanjuense and Chryseobacterium gregarium[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(12): 4386-4395. |
| [13] |
Shin DS, Park MS, Jung S, et al. Plant growth-promoting potential of endophytic bacteria isolated from roots of coastal sand dune plants[J]. Journal of Microbiology and Biotechnology, 2007, 17(8): 1361-1368. |
| [14] |
Glick BR. Introduction to plant growth-promoting bacteria[A]//Glick BR. Beneficial Plant-Bacterial Interactions[M]. Cham: Springer, 2015: 1-28
|
| [15] |
Lü ZX, Song W. Research of indole-3-acetic acid biosynthetic pathway of Klebsiella oxytoca SG-11 by HPLC and GC-MS[J]. Chinese Journal of Chromatography, 2000, 18(4): 328-331. (in Chinese) 吕泽勋, 宋未. 高效液相色谱和质谱法对产酸克雷伯氏菌SG-11生物合成吲哚-3-乙酸代谢途径的研究[J]. 色谱, 2000, 18(4): 328-331. DOI:10.3321/j.issn:1000-8713.2000.04.012 |
| [16] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796. |
| [17] |
Zhang Z, Li HX, Chen X, et al. Isolation and characterization and fluoranthene degrading of an IAA secreting bacterial strain[J]. Chinese Journal of Environmental Engineering, 2014, 8(11): 5041-5048. (in Chinese) 张振, 李辉信, 陈雄, 等. 一株具有荧蒽降解能力的产吲哚乙酸菌的筛选鉴定及其特性[J]. 环境工程学报, 2014, 8(11): 5041-5048. |
| [18] |
Zhang DY, Liu Y, Wu Y, et al. Isolation and identification of IAA-producing strains from peanut rhizosphere and its promoting effects on peanut growth[J]. Chinese Journal of Oil Crop Sciences, 2016, 38(1): 104-110. (in Chinese) 张东艳, 刘晔, 吴越, 等. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报, 2016, 38(1): 104-110. DOI:10.7505/j.issn.1007-9084.2016.01.016 |
| [19] |
Bernardet JF, Hugo C, Bruun B. The genera Chryseobacterium and Elizabethkingia[A]//Dworkin M, Falkow S, Rosenberg E, et al. The Prokaryotes[M]. 3rd ed. New York: Springer, 2006: 638-676
|
| [20] |
Zhou N, Jiang CY, Liu SJ. Cultivation of microorganisms from environments: nutrient level of the culture medium is of great importance[J]. Microbiology China, 2016, 43(5): 1075-1081. (in Chinese) 周楠, 姜成英, 刘双江. 从环境中分离培养微生物:培养基营养水平至关重要[J]. 微生物学通报, 2016, 43(5): 1075-1081. |
| [21] |
Manulis S, Haviv-Chesner A, Brandl MT, et al. Differential involvement of indole-3-acetic acid biosynthetic pathways in pathogenicity and epiphytic fitness of Erwinia herbicola pv. gypsophilae[J]. Molecular Plant-Microbe Interactions, 1998, 11(7): 634-642. DOI:10.1094/MPMI.1998.11.7.634 |
| [22] |
Luo K, Rocheleau H, Qi PF, et al. Indole-3-acetic acid in Fusarium graminearum: identification of biosynthetic pathways and characterization of physiological effects[J]. Fungal Biology, 2016, 120(9): 1135-1145. DOI:10.1016/j.funbio.2016.06.002 |
| [23] |
Patten CL, Glick BR. Bacterial biosynthesis of indole-3-acetic acid[J]. Canadian Journal of Microbiology, 1996, 42(3): 207-220. DOI:10.1139/m96-032 |
| [24] |
Pollmann S, Müller A, Weiler EW. Many Roads lead to "Auxin": of nitrilases, synthases, and amidases[J]. Plant Biology, 2006, 8(3): 326-333. DOI:10.1055/s-2006-924075 |
 2019, Vol. 46
2019, Vol. 46




