扩展功能
文章信息
- 史国英, 曾泉, 农泽梅, 叶雪莲, 岑贞陆, 李杨瑞, 胡春锦
- SHI Guo-Ying, ZENG Quan, NONG Ze-Mei, YE Xue-Lian, CEN Zhen-Lu, LI Yang-Rui, HU Chun-Jin
- 一株高效甘蔗内生固氮菌NN08200的鉴定及其对甘蔗的促生长作用
- Identification of an endophytic nitrogen-fixing bacterium NN08200 from sugarcane and its growth promotion of sugarcane
- 微生物学通报, 2019, 46(6): 1336-1345
- Microbiology China, 2019, 46(6): 1336-1345
- DOI: 10.13344/j.microbiol.china.180523
-
文章历史
- 收稿日期: 2018-07-05
- 接受日期: 2018-09-26
- 网络首发日期: 2018-11-13
2. 广西甘蔗遗传改良重点实验室 广西 南宁 530007;
3. 广西大学农学院 广西 南宁 530005
2. Guangxi Key Laboratory of Sugarcane Genetic Improvement, Nanning, Guangxi 530007, China;
3. College of Agriculture, Guangxi University, Nanning, Guangxi 530005, China
内生固氮菌是指那些定殖在植物内部与宿主植物联合固氮的微生物,主要是细菌,它们的部分或整个生活周期寄居在植物组织,特别是营养繁殖的组织中生存、繁衍、传播而不会对植物引起明显的损害[1-2]。对内生固氮菌最早的认识来自于禾本科作物和牧草。如20世纪80年代末以来,Boddey等[3]先后从甘蔗体内分离得到几种具有特殊生理生化特性的固氮菌,包括Gluconacetobacter (Acetobacter)diazotrophicus、Herbaspirillum seropedicae、Herbaspirillum rubrisubalbicans和Burkholderia spp.[3];这些属的固氮菌相继在巴西之后从美洲其他国家、澳洲[4]和亚洲[5-7]的甘蔗体内被分离。近年国内外的研究者先后对不同地域的甘蔗、水稻、小麦、燕麦、玉米、大麦、高粱、甘薯及卡拉草等植物的内生固氮菌进行了分离研究,证明植物内生固氮菌资源非常丰富,包括醋酸杆菌属(Acetobacter)[8]、草螺菌属(Herbaspirillum)[9]、肠杆菌属(Enterobacter)[10]、泛菌属(Pantoea)、假单胞属(Pseudommonas)、芽孢杆菌属(Bacillus)、伯克霍尔德氏菌属(Burkholderia)[11]、克雷伯氏菌属(Klebesilla)[11-12]、Methylobacterium[13]、Raoultella terrigena[14]、Mangrovibacter[15]、土壤杆菌属(Agrobacterium)、红球菌属(Rhodococcus)、固氮弧菌属(Azoarcus)等[16]。研究证明,内生固氮菌避免了化合态氮的抑制及土著微生物的竞争,更有利于充分发挥固氮效能,分泌固氮产物直接供给植物吸收,表现出更高的固氮效率[17]。植物内生固氮菌除了能为宿主提供氮素以外,同时具有分泌生长素、溶磷、增强植株抗病性、抗逆境等多方面的促进植物生长作用,具有很大的应用潜力[17-20]。近年来,大量施用化肥造成的肥料浪费及土壤、地下水体污染已引起了世界各国的广泛重视,减少化肥施用、提高氮肥利用率是当前农业生产的重要任务[17, 21]。随着生态农业和绿色食品的发展,植物内生菌逐渐应用于生物有机肥,因其具有消减化肥和农药过量使用引起的环境质量、食品安全和公众健康的弊端等优势,成为了国内外的研究热点。利用生物固氮是减少氮肥施用量最为有效的途径,生物固氮资源的研究、开发和利用在我国农业可持续发展中占有重要地位[22]。本文对前期从甘蔗组织上分离筛选获得的一株内生固氮细菌NN08200菌株的固氮促生长特性进行研究,通过菌落和菌体形态特征分析、Biolog细菌鉴定系统和16S rRNA基因序列分析确定菌株的分类地位,测定该菌株的固氮酶活性和溶磷能力,同时测定菌株对甘蔗幼苗的促生长作用,并利用15N同位素稀释法测定其相对固氮效率,以期为该菌株的进一步研究和应用提供参考。
1 材料与方法 1.1 材料 1.1.1 供试菌株 供试菌株NN08200从广西南宁糖厂甘蔗种植基地的甘蔗品种新台糖22号植株茎基部组织分离筛选获得,是具有较高固氮酶活性的内生固氮菌,该菌株目前保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC 5438。供试对照菌株为巴西甘蔗内生固氮菌Gluconacetobacter diazotrophicus PAL5,由浙江大学农业与生物技术学院提供。
1.1.2 主要试剂和仪器及培养基 蔗糖、葡萄糖、NaCl、KH2PO4、MgSO4、CaSO4、CaCO3、Ca3(PO4)2,国药集团化学试剂有限公司;蛋白胨、酵母提取物,北京索莱宝科技有限公司;15%的(15NH4)2SO4,上海化工研究院;BUGTM琼脂,Biolog Inc.公司。PCR仪,北京东胜创新生物科技有限公司;Biolog微生物自动鉴定仪,广州市华粤行仪器有限公司。
培养基按有关参考文献配制:肉汁胨培养基(NA)[20],Pikovaskaia培养基(PKO)[23],LB培养基和阿须贝无氮培养基(Ashby)[24],C2培养基[10]。BUG琼脂培养基:57 g BUGTM琼脂加入到950 mL ddH2O,调pH至7.3。
1.1.3 供试土壤 盆栽接种试验用土壤为甘蔗试验地栽培土,土壤基本情况:全氮0.147%,全磷0.104%,全钾1.229%,速效氮78.6 mg/kg,速效磷98 mg/kg,有机质28.8 g/kg,pH 6.1。 1.1.4 甘蔗组培苗 供试甘蔗品种为巴西引进品种RB 92-8064 (简称B9),其组培苗由广西作物遗传改良生物技术重点开放实验室提供。 1.2 方法 1.2.1 菌株活化培养及固氮酶活性测定 菌株的活化培养采用Ashby无氮培养基,固氮酶活性的测定采用乙炔还原法,具体测定方法参照胡春锦等[11]、孙建光等[25]的方法进行,以甘蔗内生固氮模式菌株G. diazotrophicus PAL5为阳性对照。 1.2.2 菌株培养性状及菌体形态观察 以平板划线法将NN08200菌株培养于NA和Ashby无氮培养基上,置30 ℃培养箱中培养2 d。观察并记录菌落的颜色、大小、形状。菌株NN08200活化后接种至5 mL LB培养液,在摇床中30 ℃、200×g培养过夜至对数中后期。取1 mL菌液10 000×g离心5 min,除去上清,然后用无菌水重悬后10 000×g离心5 min洗菌2次,用无菌水悬浮,取10 µL菌液滴在铜网上,用滤纸吸干水分;取一滴1%醋酸双氧铀滴在铜网上染色20−30 s,用滤纸吸干水分后,用电子显微镜观察细菌形态。
1.2.3 菌株的nifH扩增与序列分析 采用菌落PCR方法进行菌株nifH基因的扩增,参照Lin等[10]的方法进行。培养供试菌株18−20 h,挑取少许菌落作为PCR模板。利用已报道nifH基因扩增通用引物PolyF (5′-TGCGAYCCSAARGCB GACTC-3′)和PolyR (5′-ATSGCCATCATYTCR CCGGA-3′)扩增NN08200的nifH部分序列,以G. diazotrophicus PAL5菌株为阳性对照,以大肠杆菌E. coli DH5α菌株为阴性对照。将nifH扩增产物回收后克隆到pMDTM18-T载体上,通过PCR验证的阳性克隆送生工生物工程(上海)股份有限公司测序,测序结果提交GenBank获得登录号并在NCBI进行BLAST比对分析。 1.2.4 菌株的16S rRNA基因序列分析 16S rRNA基因的扩增同样采用菌落PCR方法,扩增产物测序及菌株系统发育分析参照胡春锦等[11]的方法进行。扩增产物送生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI进行BLAST同源性比对,并用软件MEGA 4.0构建菌株的系统发育树。 1.2.5 菌株的Biolog检测 挑取菌株NN08200的单菌落至BUG琼脂培养基,28 ℃培养16−24 h。用无菌棉签将BUG琼脂培养基上的菌体悬浮于0.85% NaCl溶液,调节菌悬液OD600为0.2,取150 µL菌液加入Biolog-GN2板,28 ℃培养。分别在4−6 h和16−24 h用Biolog微生物自动鉴定仪及Biolog Microstation 4.20.05系统检测和分析代谢指数。 1.2.6 菌株对无机磷的降解能力测定 参考史国英等[20]的方法,将供试菌株NN08200以及对照菌株G. diazotrophicus PAL5分别接种到无机磷液体培养基,接种量为1%活化菌液,对照接种等量灭活菌液,于28 ℃、120×g培养5 d后,参照文献[26]采用磷钼蓝比色法测定菌株发酵液中的有效磷含量。 1.2.7 接种效果及联合固氮效率测定 甘蔗栽培前土壤的处理:栽培土经晒干、细化过筛后,向栽培土样中加入丰度为15%的(15NH4)2SO4并混合均匀,使土样中纯氮含量终浓度达到120 mg/kg。甘蔗品种B9组培苗的移栽及接种方法参考胡春锦等[11]。将炼苗后生长基本一致的甘蔗组培苗移栽至上述栽培土中,每桶种3个单株。将菌株NN08200、PAL5活化后分别在LB和C2液体培养基中培养48 h,6 000×g离心15 min收集菌体,用无菌水悬浮后6 000×g离心15 min,清洗2次后稀释到每毫升1×108−2×108个细胞作为接种菌剂。甘蔗移栽当天以上述菌剂进行灌根接种1次,移栽7、14、21 d后分别用同样的菌剂再灌根接种3次,对照接等量无菌水。90 d时整株收获甘蔗植株,将植株解析成根、茎、叶并烘干至恒重,分别测定菌株对甘蔗的接种效应和联合固氮效率。
参考文献[27]完成植株株高、干物质分析。样品含氮量及15N同位素含量由河海大学环境学院用碳氮稳定同位素质谱(Sercon Integra-CN)测定。固氮效率根据公式:Ndfa=(1−15Nfx−15Nnfx)×100%计算[28]。式中Ndfa为固氮百分率,15Nfx为处理样品中15N原子百分超,15Nnfx为对照样品中15N原子百分超。
1.3 数据分析利用Excel 2003和DPS 9.50分析软件进行数据统计分析,采用Duncan’s新复极差法进行比较。
2 结果与分析 2.1 菌株的联合固氮能力菌株NN08200在无氮培养基上生长良好,固氮酶活性测定结果显示该菌株固氮酶的乙炔还原乙烯活性约为2 445 nmol C2H4/(h·mL),高于阳性对照巴西甘蔗内生固氮菌模式菌株G. diazotrophicus PAL5的固氮酶活性1.68 µmol C2H4/(h·mL)。
利用引物PolyF/PolyR对NN08200菌株进行了PCR扩增,获得了一条大小约400 bp的片段,测序分析结果表明该扩增片段为339 bp的nifH基因序列,证明NN08200菌株含有钼铁固氮酶铁蛋白基因,该菌株为内生固氮菌。该序列已在NCBI登录,登录号为KX539264。利用软件MEGA 4.0构建基于该菌株nifH基因序列的系统发育树(图 1),结果表明NN08200菌株与甘蔗内生固氮醋酸杆菌G. diazotrophicus PAL5菌株的遗传距离较近,相似性达到99%。
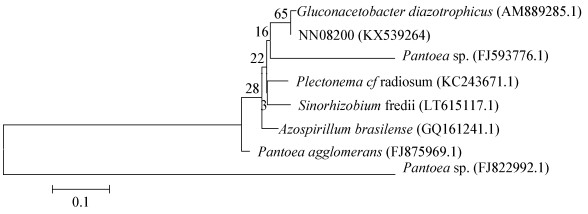
|
| 图 1 邻接法构建菌株NN08200的nifH基因系统发育树 Figure 1 Phylogenetic tree of strain NN08200 based on nifH gene sequences by Neighbor-Joining method 注:括号中为相关细菌的GenBank的登录号;分支位置中的数字表示Boostrap支持率;标尺表示每个位点的碱基置换率.下同. Note: The numbers in parentheses represent the sequence accession numbers in GenBank. The numbers in each branch points denote the percentages supported by bootstrap. The scale bar represents substitutions of per nucleotide position. The same below. |
|
|

|
| 图 2 菌株NN08200的形态特征 Figure 2 Morphological characteristics of strain NN08200 注:A:菌体;B:菌落. Note: A: Bacterial cells. Scale bar=2 µm; B: Colonies. |
|
|

|
| 图 3 基于16S rRNA基因序列用邻接法构建菌株NN08200的系统发育树 Figure 3 Phylogenetic tree based on 16S rRNA gene sequence of strain NN08200 by Neighbor-Joining method |
|
|
综合菌株的培养性状和菌体形态、16S rRNA基因的序列分析和Biolog鉴定系统分析结果,将菌株NN08200鉴定为肠菌科泛菌属(Pantoea)细菌。
2.3 菌株的溶磷能力分析研究结果表明,接种菌株NN08200在常用无机磷液体培养基上培养5 d,发酵液中水溶性磷含量最高可达到152.30 mg/L,而接种G. diazotrophicusPAL5菌株发酵液中水溶性磷含量为131.35 mg/L,NN08200在液体培养条件下降解无机磷的效果明显优于PAL5菌株,差异达极显著水平(图 4)。

|
| 图 4 菌株NN08200不同处理发酵液中可溶性磷含量测定结果 Figure 4 The concentration of soluble phosphorus in fermentative liquid of strain NN08200 注:不同字母表示处理间差异在0.05、0.01水平上差异显著.下同. Note: Different letters mean significant different at 0.05 and 0.01 level. The same below. |
|
|
菌株接种效应及15N同位素稀释法测定菌株相对固氮效率分析结果见表 1。甘蔗组培苗移栽在含有15N的基质中生长90 d,相比不接种的对照,接种NN08200提高了甘蔗组培苗B9的株高以及根、茎、叶的干重,分别比对照增加23.43%、9.47%、22.04%和27.03%;接种PAL5对B9的促生长作用略低于接种菌株NN08200。两个菌株对甘蔗B9的促生长效果表现在提高植株株高以及根、茎的干重。
| Treatment | 平均株高 Average height (cm) |
平均干重 Average dry weight (g) |
平均固氮效率 Average fixation efficiency (%) |
|||||
| 根Root | 茎Stalk | 叶Leaf | 根Root | 茎Stalk | 叶Leaf | |||
| NN08200 | 58.56±4.98Aa | 2.16±0.19Aa | 3.42±0.27Aa | 10.01±0.56Aa | 7.49 | 15.02 | 10.79 | |
| PAL5 | 57.73±7.00Aa | 1.94±0.15Aab | 4.19±0.27Bb | 9.41±0.63Aa | 3.53 | 9.44 | 4.87 | |
| CK | 47.44±5.61Bb | 1.97±0.10Ab | 2.81±0.21Cc | 7.87±0.52Bb | 0 | 0 | 0 | |
接种NN08200菌株的供试B9甘蔗组培苗中15N浓度低于没有接种的对照甘蔗苗,差异在5%的置信水平显著。接种NN08200菌株甘蔗组培苗的根、茎和叶从空气中获得氮的百分率分别为7.49%、15.02%和10.79%,其联合固氮效率显著优于甘蔗固氮模式菌株G. diazotrophicus PAL5,利用后者接种的甘蔗根、茎和叶从空气中获得氮的百分率分别为3.53%、9.44%和4.87%。
3 讨论与结论甘蔗是我国最重要的糖料作物,而我国甘蔗主产区蔗地90%以上为旱坡地,土壤保水、保肥能力差,化肥利用率很低,其中生产上氮肥的施用量比世界平均水平高出一倍以上,因此国内甘蔗生产成本明显偏高,缺乏国际竞争力。近年来,受国际糖业的冲击,我国甘蔗和蔗糖产业已呈现下滑趋势[30]。造成甘蔗产业萎缩的主要原因是甘蔗种植收益近年来已大幅下降,蔗农的积极性受到影响,而造成收益下降的原因除了市场的冲击因素以外,甘蔗种植成本总体过高也是一个重要的原因。我国甘蔗生产上氮肥施用量为500−700 kg/hm2,是巴西平均施氮量的8−10倍,是印度推荐施氮量280 kg/hm2的2倍多[31]。减少氮肥施用量最为有效的途径是利用生物固氮。生物固氮是地球上固氮作用的重要途径之一,每年的总固氮量中约有60%来自生物固氮,在解决氮素来源问题上有巨大的潜力,生物固氮资源的研究、开发和利用在我国农业可持续发展中占有重要地位[22]。充分发挥蔗地生态系统中联合固氮菌的固氮促生潜力,对提高我国甘蔗的生产能力和保护并改善甘蔗的生态环境,以及促进我国甘蔗产业的可持续发展具有重要的经济和社会意义[11]。
本研究筛选到的甘蔗内生固氮菌株NN08200具有较高的固氮酶活性,nifH基因分析结果从遗传型上证明了该菌株的固氮功能,15N同位素稀释法分析结果显示该菌株与甘蔗的联合固氮效率显著优于甘蔗固氮模式菌株G. diazotrophicus PAL5;同时,菌株NN08200具有良好的溶磷效果,对于缓解我国甘蔗主产区红壤土中的磷素缺乏问题具有潜在的应用价值;盆栽接种试验结果表明该菌株对甘蔗具有显著的促生长作用,接菌处理甘蔗植株的株高以及干重均比对照增长20%以上,这些研究结果均预示了菌株NN08200具有成为固氮生物肥料优良菌种的光明前景。菌株的分类鉴定结果显示菌株NN08200属于泛菌属(Pantoea)细菌。近年来我国研究工作者从不同生态条件、不同植物上均分离筛选获得了内生固氮泛菌属细菌,并且证明该菌属细菌对植物具有良好的固氮促生长作用。如张磊等[32]从马铃薯上分离获得的内生固氮菌株Pantoea spp. GWR2、GWR3具有极高的产IAA能力,分别为186.07、162.21 μg/mL,GWR2兼具产ACC脱氨酶活性和溶解无机磷的能力;陈静等[33]研究证明泛菌属细菌为烤烟内生固氮菌的优势菌群;李艳星等[34]从胡萝卜、白萝卜、紫甘蓝、山药、莲藕、芋头、红薯、生姜、甜菜等多种块根块茎类作物的根、茎部也分离获得了泛菌属内生固氮菌;傅蕾[35]研究证明从象草中分离筛选获得的内生菌Pantoea sp. PP04也能够显著促进杂交狼尾草生长;覃姚红[36]研究证明玉米种子内生固氮泛菌属细菌能显著促进小麦生长并提高植株的抗旱能力;此外,泛菌属细菌作为内生固氮菌还从野生稻[37]、辣椒[38]、荒漠灌木[39]、兰科植物等多种植株组织中分离筛选得到[40]。泛菌属细菌同时也是土壤固氮细菌种群中的重要成员,同时具有固氮、溶磷、解钾和拮抗植物病原菌的功能[41]。本研究获得的甘蔗内生固氮菌Pantoea sp. NN08200相对于甘蔗固氮模式菌株G. diazotrophicus PAL5还具有容易培养、菌体生长量较大、促生长效果更加明显的特性,具有作为揭示甘蔗联合固氮菌机理研究模式菌株的潜力,该菌株的进一步研究和应用可为建立适应我国生态条件下稳定有效的甘蔗联合固氮体系提供基础。
| [1] |
Guan XQ, Du QY, Yu JZ. Isolation and characteristics of N2- fixers from rhizosphere of plant Leymus chinensis in the rangeland of inner Mongolia[J]. Acta Agrestia Sinica, 1997, 5(2): 101-107. (in Chinese) 关秀清, 杜千有, 于井朝. 内蒙古草原羊草根际联合固氮菌的分离鉴定及其生理生化特性研究[J]. 草地学报, 1997, 5(2): 101-107. |
| [2] |
Zhang HF, Hu JC, Huang JF. Application and prospect of biological nitrogen fixation on agriculture[J]. Nature Magazine, 2002, 24(3): 135-138. (in Chinese) 张华峰, 胡建成, 黄巨富. 生物固氮在农业中的应用现状与展望[J]. 自然杂志, 2002, 24(3): 135-138. DOI:10.3969/j.issn.0253-9608.2002.03.002 |
| [3] |
Boddey RM, D bereiner J. Nitrogen fixation associated with grasses and cereals: recent progress and perspectives for the future[J]. Fertilizer Research, 1995, 42(1/3): 241-250. |
| [4] |
Baldani JI, Baldani VLD. History on the biological nitrogen fixation research in graminaceous plants: special emphasis on the Brazilian experience[J]. Anais da Academia Brasileira de Ciências, 2005, 77(3): 549-579. DOI:10.1590/S0001-37652005000300014 |
| [5] |
Muthukumarasamy R, Revathi G, Lakshminarasimhan C. Influence of N fertilization on the isolation of Acetobacter diazotrophicus and Herbaspirillum spp. from Indian sugarcane varieties[J]. Biology and Fertility of Soils, 1999, 29: 157-164. DOI:10.1007/s003740050539 |
| [6] |
Xing YX, Yang LT, Huang SL, et al. The 16S rRNA gene sequences and growth characteristics of two nitrogen fixing Endo-bacteria strains from sugarcane stalk[J]. Microbiology China, 2008, 35(11): 1732-1737. (in Chinese) 邢永秀, 杨丽涛, 黄思良, 等. 甘蔗茎内两个内生菌株16S rRNA序列分析及其生长特性[J]. 微生物学通报, 2008, 35(11): 1732-1737. DOI:10.3969/j.issn.0253-2654.2008.11.010 |
| [7] |
Asis Jr CA, Kubota M, Ohta H, et al. Isolation and partial characterization of endophytic diazotrophs associated with Japanese sugarcane cultivar[J]. Soil Science and Plant Nutrition, 2000, 46(3): 759-765. DOI:10.1080/00380768.2000.10409142 |
| [8] |
Reis VM, Olivares FL, D bereiner J. Improved methodology for isolation of Acetobacter diazotrophicus and confirmation of its endophytic habitat[J]. World Journal of Microbiology and Biotechnology, 1994, 10(4): 401-405. |
| [9] |
Wang HR, Peng GX, Zhang GX, et al. Characterization of endophytic diazotrophs isolated from molasses grass[J]. Acta Ecologica Sinica, 2006, 26(8): 2566-2571. (in Chinese) 王华荣, 彭桂香, 张国霞, 等. 糖蜜草(Melinis minutiflora Beauv.)内生固氮菌分离鉴定[J]. 生态学报, 2006, 26(8): 2566-2571. DOI:10.3321/j.issn:1000-0933.2006.08.019 |
| [10] |
Lin L, Li ZY, Hu CJ, et al. Plant growth-promoting nitrogen-fixing enterobacteria are in association with sugarcane plants growing in Guangxi, China[J]. Microbes and Environments, 2012, 27(4): 391-398. DOI:10.1264/jsme2.ME11275 |
| [11] |
Hu CJ, Lin L, Shi GY, et al. Screening and identification of associative nitrogen fixation bacteria in rhizosphere of sugarcane in Guangxi[J]. Acta Ecologica Sinica, 2012, 32(15): 4745-4752. (in Chinese) 胡春锦, 林丽, 史国英, 等. 广西甘蔗根际高效联合固氮菌的筛选及鉴定[J]. 生态学报, 2012, 32(15): 4745-4752. |
| [12] |
Wei CY, Lin L, Luo LJ, et al. Endophytic nitrogen-fixing Klebsiella variicola strain DX120E promotes sugarcane growth[J]. Biology and Fertility of Soils, 2014, 50(4): 657-666. DOI:10.1007/s00374-013-0878-3 |
| [13] |
Madhaiyan M, Chan KL, Ji LH. Draft genome sequence of Methylobacterium sp. strain L2-4, a leaf-associated endophytic N-fixing bacterium isolated from Jatropha curcas L.[J]. Genome Announcements, 2014, 2(6): e01306-14. |
| [14] |
Schicklberger M, Shapiro N, Loqué D, et al. Draft genome sequence of Raoultella terrigena R1Gly, a diazotrophic endophyte[J]. Genome Announcements, 2015, 3(3): e00607-15. |
| [15] |
Behera P, Vaishampayan P, Singh NK, et al. The draft genome sequence of Mangrovibacter sp. strain MP23, an endophyte isolated from the roots of Phragmites karka[J]. Genomics Data, 2016, 9: 128-129. DOI:10.1016/j.gdata.2016.07.007 |
| [16] |
Hu CJ, Shi GY, Zeng Q, et al. The diversity of culturable endogenous nitrogen-fixing bacteria of sugarcane in two different soil conditions[J]. Soil and Fertilizer Sciences in China, 2017(2): 141-148. (in Chinese) 胡春锦, 史国英, 曾泉, 等. 两种不同土壤条件下可培养甘蔗内生固氮菌的多样性[J]. 中国土壤与肥料, 2017(2): 141-148. |
| [17] |
Gao C, Huang SF, Hu L, et al. Diversity and plant growth promotion of endophytic bacteria isolated from Oryza nivara[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(1): 33-38. (in Chinese) 郜晨, 黄淑芬, 胡莉, 等. 尼瓦拉野生稻内生菌多样性和促生作用[J]. 应用与环境生物学报, 2018, 24(1): 33-38. |
| [18] |
Zhang GX, Mao Q, He ZY, et al. Detection of nitrogenase activity and phosphorus dissolving ability of endophytic isolates from Oryza rufipogon in Lingshui[J]. Chinese Journal of Applied & Environmental Biology, 2006, 12(4): 457-460. (in Chinese) 张国霞, 茅庆, 何忠义, 等. 陵水普通野生稻(Oryza rufipogon)内生菌的固氮及溶磷特性[J]. 应用与环境生物学报, 2006, 12(4): 457-460. DOI:10.3321/j.issn:1006-687X.2006.04.003 |
| [19] |
Wang QS, Shi GY, Su LT, et al. Growth-promoting effect by inoculating 3 strains of associative nitrogen-fixing bacteria in sugarcane[J]. Journal of Southern Agriculture, 2013, 44(3): 397-402. |
| [20] |
Shi GY, Mo YM, Cen ZL, et al. Identification of an inorganic phosphorus-dissolving bacterial strain BS06 and analysis on its phosphate solubilization ability[J]. Microbiology China, 2015, 42(7): 1271-1278. (in Chinese) 史国英, 莫燕梅, 岑贞陆, 等. 一株高效解无机磷细菌BS06的鉴定及其解磷能力分析[J]. 微生物学通报, 2015, 42(7): 1271-1278. |
| [21] |
Wang ZW, Ji YL, Chen YG. Studies and biological significances of plant endophytes[J]. Microbiology China, 2015, 42(2): 349-363. (in Chinese) 王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2): 349-363. |
| [22] |
Chen WX, Chen WF. Exertion of biological nitrogen fixation in order to reducing the consumption of chemical nitrogenous fertilizer[J]. Review of China Agricultural Science and Technology, 2004, 6(6): 3-6. (in Chinese) 陈文新, 陈文峰. 发挥生物固氮作用减少化学氮肥用量[J]. 中国农业科技导报, 2004, 6(6): 3-6. DOI:10.3969/j.issn.1008-0864.2004.06.001 |
| [23] |
Yao T. Associative nitrogen-fixing bacteria in the rhizosphere of Avena sativa in an alpine region Ⅱ phosphate-solubilizing power and auxin production[J]. Acta Prataculturae Sinica, 2004, 13(3): 85-90. (in Chinese) 姚拓. 高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定[J]. 草业学报, 2004, 13(3): 85-90. DOI:10.3321/j.issn:1004-5759.2004.03.015 |
| [24] |
Wu X, Gan BC, Jia DH, et al. Isolation and identification of a free living nitrogen-fixing bacteria[J]. Southwest China Journal of Agricultural Sciences, 2013, 26(1): 255-258. (in Chinese) 吴翔, 甘炳成, 贾定洪, 等. 一株自生固氮细菌的分离和鉴定[J]. 西南农业学报, 2013, 26(1): 255-258. DOI:10.3969/j.issn.1001-4829.2013.01.053 |
| [25] |
Sun JG, Xu J, Hu HY, et al. Collection and investigation on asymbiotic nitrogen-fixing microbial resources from 13 provinces over China[J]. Plant Nutrition and Fertilizer Science, 2009, 15(6): 1450-1465. (in Chinese) 孙建光, 徐晶, 胡海燕, 等. 中国十三省市土壤中非共生固氮微生物菌种资源研究[J]. 植物营养与肥料学报, 2009, 15(6): 1450-1465. DOI:10.3321/j.issn:1008-505X.2009.06.030 |
| [26] |
Yi Y. Screening of phosphorus-solubilizing strain and its phosphate dissolving mechanism[D]. Dalian: Masterʼs Thesis of Dalian University of Technology, 2011 (in Chinese) 伊鋆.高效解磷细菌的筛选及解磷机理的研究[D].大连: 大连理工大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10141-1011108943.htm |
| [27] |
Lu RK. The Analysis Method of Soil Agricultural Chemistry[M]. Beijing: Chinese Agricultural Science and Technology Press, 2000: 312-314. (in Chinese) 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 312-314. |
| [28] |
Fried M, Broeshart H. An independent measurement of the amount of nitrogen fixed by a legume crop[J]. Plant and Soil, 1975, 43(1/3): 707-711. |
| [29] |
Dong XZ, Cai MY. Common Bacterial System Identification Manual[M]. Beijing: Science Press, 2001: 365. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 365. |
| [30] |
Li YR, Yang LT, Tan HW, et al. Development and progress of sugarcane farming technologies in Guangxi, China[J]. Journal of Southern Agriculture, 2014, 45(10): 1770-1775. (in Chinese) 李杨瑞, 杨丽涛, 谭宏伟, 等. 广西甘蔗栽培技术的发展进步[J]. 南方农业学报, 2014, 45(10): 1770-1775. DOI:10.3969/j:issn.2095-1191.2014.10.1770 |
| [31] |
Tan YM, Wang LW, Wang TS, et al. Study on the sensitivity to nitrogen of sugarcane nitrogen-fixed variety RB72-454 in the field[J]. Guangxi Sugarcane & Canesugar, 2002(1): 12-15. (in Chinese) 谭裕模, 王伦旺, 王天算, 等. 固氮甘蔗品种RB72-454田间肥料敏感试验[J]. 广西蔗糖, 2002(1): 12-15. DOI:10.3969/j.issn.1007-4732.2002.01.005 |
| [32] |
Zhang L, Yuan M, Sun JG, et al. Isolation and functional characterizations of potato endogenous nitrogen-fixing bacteria[J]. Soil and Fertilizer Sciences in China, 2016(6): 139-145. (in Chinese) 张磊, 袁梅, 孙建光, 等. 马铃薯内生固氮菌的分离及其促生特性研究[J]. 中国土壤与肥料, 2016(6): 139-145. |
| [33] |
Chen J, Li B, Zeng QB, et al. Diversity of culturable endophytic diazotrophic bacteria in flue-cured tobacco in Panzhihua[J]. Microbiology China, 2017, 44(2): 428-437. (in Chinese) 陈静, 李斌, 曾庆宾, 等. 攀枝花地区烤烟可培养内生固氮菌的多样性[J]. 微生物学通报, 2017, 44(2): 428-437. |
| [34] |
Li YX, Guo PY, Sun JG. Isolation, identification, phylogeny and growth promoting characteristics of endophytic diazotrophs from tuber and root crops[J]. Scientia Agricultura Sinica, 2017, 50(1): 104-122. (in Chinese) 李艳星, 郭平毅, 孙建光. 块根块茎类作物内生固氮菌分离鉴定、系统发育与促生特性[J]. 中国农业科学, 2017, 50(1): 104-122. |
| [35] |
Fu L. The mechanism of endophyte Pantoea sp. PP04 promoting growth and enhancing salinity tolerance of hybrid Pennisetum[D]. Zhenjiang: Master's Thesis of Jiangsu University, 2017 (in Chinese) 傅蕾.植物内生菌Pantoea sp. PP04促进杂交狼尾草生长及提高其耐盐能力的作用机制研究[D].镇江: 江苏大学硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10299-1017717618.htm |
| [36] |
Qin YH. Identification of endophytic diazotroph bacteria from maize seeds and research of its effects on wheat growth and drought resistance[D]. Yangling: Master's Thesis of Northwest A & F University, 2014 (in Chinese) 覃姚红.玉米种子内生固氮菌的鉴定及其对小麦生长及抗旱能力影响的研究[D].杨凌: 西北农林科技大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10712-1014420040.htm |
| [37] |
Yuan HJ, Yan H, Yang F, et al. Molecular characterization and phylogenetic analysis of endophytic nitrogen-fixing bacteria in Oryza australiensis[J]. Chinese Journal of Applied & Environmental Biology, 2014, 20(4): 571-577. (in Chinese) 原红娟, 严慧, 杨芳, 等. 澳洲野生稻(Oryza australiensis)内生固氮菌的分子鉴定及发育分析[J]. 应用与环境生物学报, 2014, 20(4): 571-577. |
| [38] |
Luo N, Xiao HL, Lu S, et al. The isolation of pepper endogenous nitrogen-fixing bacteria identification and diversity analysis[J]. Crops, 2014(6): 52-56. (in Chinese) 罗娜, 肖海兰, 鲁颂, 等. 辣椒内生固氮菌的分离鉴定与多样性分析[J]. 作物杂志, 2014(6): 52-56. |
| [39] |
Xu ZJ, Luo M, Wang WX, et al. The molecular diversity of endophytic diazotrophic bacteria from three typical desert shrubs and PCR-RFLP analysis of their nitrogenase gene nifH[J]. Journal of Desert Research, 2014, 34(2): 472-480. (in Chinese) 徐正金, 罗明, 王卫霞, 等. 3种典型荒漠灌木内生固氮菌及固氮酶基因nifH多样性分析[J]. 中国沙漠, 2014, 34(2): 472-480. |
| [40] |
Zhang FF. Screen and growth-promoting effect of endophytic bacteria from Phalaenopsis pulcherrima roots[D]. Haikou: Master's Thesis of Hainan University, 2015 (in Chinese) 张芳芳.五唇兰根部内生细菌筛选及其促生效应研究[D].海口: 海南大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10589-1015587455.htm |
| [41] |
Liu CX, Jiao RZ, Zhao JJ. Screening and functional research of broad spectrum antagonistic strains against forest pathogenic fungi[J]. Current Biotechnology, 2018, 8(1): 63-70. (in Chinese) 刘彩霞, 焦如珍, 赵京京. 林木病原菌广谱拮抗菌株的筛选及功能研究[J]. 生物技术进展, 2018, 8(1): 63-70. |
 2019, Vol. 46
2019, Vol. 46




