扩展功能
文章信息
- 王玉, 付丽红, 鞠建松, 王丽敏, 于波
- WANG Yu, FU Li-Hong, JU Jian-Song, WANG Li-Min, YU Bo
- 拉达克轮丝菌TGase在大肠杆菌中的分子改造
- Molecule evolution of TGase from Streptoverticillium ladakanum in Escherichia coli
- 微生物学通报, 2019, 46(6): 1320-1326
- Microbiology China, 2019, 46(6): 1320-1326
- DOI: 10.13344/j.microbiol.china.180521
-
文章历史
- 收稿日期: 2018-07-05
- 接受日期: 2018-10-29
- 网络首发日期: 2018-12-13
2. 中国科学院微生物研究所 北京 100101
2. Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
谷氨酰胺转氨酶(Transglutaminase,TGase)广泛存在于动植物以及微生物中,它能够催化酰基转移反应,通过胺的结合和交联修饰蛋白质[1],由于它特殊的安全交联性质使其在食品、医药和纺织等领域得到广泛应用[2-4]。谷氨酰胺转氨酶根据来源不同可以分为组织谷氨酰胺转氨酶(Tissue transglutaminase,tTG)和微生物谷氨酰胺转氨酶(Microbial transglutaminase,MTG)[5]。其中MTG属于胞外酶,可直接分泌到体外,相较于tTG分离纯化较简单,且微生物发酵成本低、周期短,目前已成为商业化TGase的主要来源[6]。
目前已发现多种微生物中含有TGase基因,例如枯草芽孢杆菌(Bacillus subtilis)[7]、拉达克轮丝菌(Streptoverticillium ladakanum)[8]和茂原链轮丝菌(S. mobaraense)[9]等,其中来自茂原链轮丝菌的TGase已被广泛研究[9]。来自链霉菌的TGase以pro-TGase的形式合成初级酶原,通过切去N端的前导肽(pro)形成有活性的TGase,有研究表明在大肠杆菌中单独表达TGase时仅以包涵体的形式存在[10],将pro-TGase融合表达可以获得大量可溶性蛋白,通过后期处理切除前导肽获得活性的TGase,这说明前导肽可以提高TGase在大肠杆菌中的溶解度[11]。Liu等发现前导肽可以帮助TGase在大肠杆菌中正确折叠,通过在大肠杆菌中共用T7启动子,以pelB信号肽按照pro、TGase的顺序共表达时,可以直接在胞内产生有活性的TGase,其酶活达到0.13 U/(mL•OD600)[12],这种表达策略方便了TGase的生产。
近年来,有许多研究者对谷氨酰胺转氨酶进行了分子改造,以期获得高酶活的TGase,其中基因突变是较常见的一种研究方法。Shimba等利用随机突变从突变库中筛到一株突变菌M16T,其突变体酶活为野生型的1.6倍[13]。Chen等利用饱和突变将前导肽α-螺旋的37G–42S替换为3个甘氨酸或3个丙氨酸,其酶活都有明显提高[14]。Buettner等分析了对TGase热稳定性有重要影响的氨基酸位点,分别选择S2、S23和K269进行饱和突变,其中突变体S2M、S23V和K269的热稳定性有明显提高[15]。可见TGase的N端区域对其催化活性有着重要影响。
本研究室获得了一株含有高TGase酶活的拉达克轮丝菌(S. ladakanum) B1,并以其总DNA为模板克隆了pro-TGase基因,以大肠杆菌为表达宿主菌构建了两种不同表达模式的载体,实现了TGase在大肠杆菌中的可溶性异源表达,并在此基础上利用全质粒PCR法对两种表达模式定点突变。其中共表达模式可以直接产生有活性的TGase,在融合表达基础上将TGase N端前3个氨基酸DSD突变为3个丙氨酸,酶活有明显提高,这为后期对该酶的研究奠定了基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒 S. ladakanum B1由中国科学院微生物研究所娄春波实验室提供;Escherichia coli TOP10、E. coli BL21(DE3)购自天根生化科技(北京)有限公司;表达载体pET-22b为本实验室保存。 1.1.2 培养基和培养条件 用于构建重组质粒的E. coli TOP10接种于LB培养基[16](含100 mg/L氨苄青霉素)中,37 ℃、200 r/min摇床培养。含有重组质粒的E. coli BL21(DE3)接种于TB培养基[16](含100 mg/L氨苄青霉素)用于发酵培养,培养条件为37 ℃、200 r/min。 1.1.3 主要试剂和仪器 限制性内切酶、T4 DNA连接酶、pMD19-T载体、PrimeSTAR DNA聚合酶等均购自北京六合通经贸有限公司;质粒小提试剂盒、纯化试剂盒购自Omega公司;Ni-Agarose His标签蛋白纯化试剂盒购自北京康为世纪生物科技有限公司。PCR仪购自北京六合通经贸有限公司;紫外/可见分光光度计购自北京瑞利分析仪器有限公司。 1.2 方法 1.2.1 目的基因的克隆 根据基因组信息设计引物PTG-F和PTG-R (表 1)以S. ladakanum B1基因组DNA为模板,使用PrimeSTAR DNA聚合酶扩增含有前导肽区的TGase (pro-TGase)的编码基因。PCR反应体系(50 μL):模板50 ng,2×PrimeSTAR 25 μL,上、下游引物各400 nmol/L,添加ddH2O至50 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 50 s,30个循环;72 ℃ 10 min。将基因片段采用1%的琼脂糖凝胶回收,连接至pMD19-T载体,得到的质粒proTG-19T由北京睿博公司测序。| 引物名称 Primers name |
引物序列 Primers sequence (5′→3′) |
| PTG-F | GGCCATGGCCACCGGCAGTGGCAGTGG |
| PTG-R | GTGCTCGAGCGGCCAGCCCTGTGTCACCTT |
| pro-NcoI-F | TGGCCATGGCCACCGGCAGTGGCAGTG |
| pro-BamHI-R | TCGGATCCGGGGGCCCGGAAGGACGGACCG |
| TG-NcoI-F | TGGCCATGGACTCCGACGAGCGGGTGACTC |
| TG-BamHI-R | TCGGATCCCCCGGCCAGCCCTGTGTCACCTTGTCG |
| gTG-F | GGTCCGTCCTTCCGGGCCCCCTAAGGATCCCTTGAAGGAGATATACATATGAAATACCTG |
| gTG-R | GTGGTGGTGCTCGAGTGCGGCCGCAAGCTTGGGCCAGCCCTGTGTCACCTTGTCGGGG |
| AAA-FO1 | GTCCTTCCGGGCCCCCGCAGCAGCAGAGCGGGTGACTCCTCCCGC |
| AAA-RO1 | GCGGGAGGAGTCACCCGCTCTGCTGCTGCGGGGGCCCGGAAGGAC |
| DSD-FO1 | GTCCGTCCTTCCGGGCCCCCGAGCGGGTGACTCCTCCCGC |
| DSD-RO1 | GCGGGAGGAGTCACCCGCTCGGGGGCCCGGAAGGACGGAC |
| ED-FO1 | TTCCGGGCCCCCGACTCCGACGACCGGGTGACTCCT |
| ED-RO1 | AGGAGTCACCCGGTCGTCGGAGTCGGGGGCCCGGAA |
| AAA-2FO1 | TGGCCATGGCAGCAGCAGAGCGGGTGACTCCTCCCGCCGA |
| AAA-2RO1 | TCGGCGGGAGGAGTCACCCGCTCTGCTGCTGCCATGGCCA |
| DSD-2FO1 | TGGCCATGGAGCGGGTGACTCCTCCCGCCGAGCCGCTCGA |
| DSD-2RO1 | TCGAGCGGCTCGGCGGGAGGAGTCACCCGCTCCATGGCCA |
| ED-2FO1 | TGGCCATGGACTCCGACGACCGGGTGACTCCTCCCGCCGA |
| ED-2RO1 | TCGGCGGGAGGAGTCACCCGGTCGTCGGAGTCCATGGCCA |
用20 mL磷酸盐缓冲液(PBS,0.1 mol/L,pH 7.0)悬浮菌体,超声波破碎,5 000 r/min离心10 min,收集上清用于胞内酶活测定和重组蛋白的纯化。由于重组蛋白含有组氨酸标签His-Tag,因此使用Ni-Agarose His标签蛋白纯化试剂盒纯化。纯化方法参照试剂盒手册进行。杂蛋白用洗脱液Ⅰ (pH 7.9 Tris-HCl 4 mmol/L,咪唑60 mmol/L,NaCl 0.1 mol/L)进行洗脱,目的蛋白用洗脱液Ⅱ (pH 7.9 Tris-HCl 4 mmol/L,咪唑300 mmol/L,NaCl 0.1 mol/L)洗脱并通过超滤管脱盐、浓缩后于−80 ℃保存。收集各阶段的洗脱液进行SDS-PAGE (13%分离胶,4%浓缩胶)电泳和考马斯亮蓝(R-250)染色分析[17]。
1.2.5 酶活力测定 按照比色法[18]测定酶活,TGase酶活定义为:37 ℃反应条件下,1 min生成1 μmol氧肟酸所需要的酶量。发酵液上清用于测量蛋白的胞外酶活,粗酶液用于测量胞内酶活。纯化后的蛋白用于计算比酶活,采用Bradford方法计算蛋白浓度。对于前导肽和TGase共表达的蛋白要加入终浓度为0.08 g/L的分散酶37 ℃处理20 min,再用于酶活的测量。 2 结果与分析 2.1 proTGase的克隆根据链霉菌基因组DNA设计引物PTG-F和PTG-R。以S. ladakanum B1基因组DNA为模板,扩增得到大小与目的基因基本一致的片段。片段大小在1 200−2 000 bp之间,经测序验证该片段为proTGase的序列,将其连到pMD19-T载体上构建得到质粒proTG-19T,保存质粒。
2.2 重组质粒的构建通过使用表达载体pET-22b的T7启动子和pelB信号肽构建了两种表达模式(图 1),proTG-22b以T7启动子和pelB信号肽融合表达proTGase。pro-pelB-TG-22b以T7启动子按pro、TGase的顺序共表达。
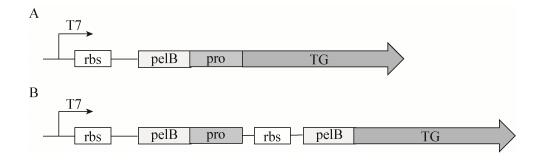
|
| 图 1 TGase的两种表达模式 Figure 1 Two expressions of TGase Note: A: proTG-22b; B: pro-pelB-TG-22b. |
|
|
将不同表达模式的重组质粒以及突变质粒分别转化E. coli BL21(DE3)进行诱导表达。用Ni-Agarose His标签蛋白纯化试剂盒进行蛋白纯化。利用SDS-PAGE检测纯化后的蛋白。根据基因信息,前导肽和TGase共表达的蛋白以及在共表达基础上构建的3种突变体蛋白大小为42.3 kD左右,前导肽和TGase融合表达的蛋白以及在融合表达基础上构建的3种突变体蛋白大小为46.3 kD左右。由图 2可以看出目的蛋白均大小正确,收集纯化后的蛋白用于后期酶活测定。
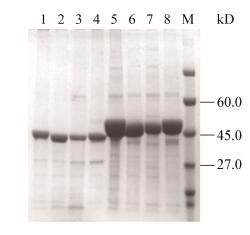
|
| 图 2 重组蛋白SDS-PAGE分析 Figure 2 Analysis of purified proteins by SDS-PAGE Note: M: Protein marker; 1: pro-pelB-TG-22b; 2: AAA-pelB- TG-22b; 3: DSD-pelB-TG-22b; 4: ED-pelB-TG-22b; 5: proTG-22b; 6: AAA-proTG-22b; 7: DSD-proTG-22b; 8: ED-proTG-22b. |
|
|
研究表明前导肽可以使TGase正确折叠,但是前导肽的存在抑制了TGase和底物的结合,因此必须切掉前导肽才能使TGase发挥功能。根据Liu等的研究结果构建了两种表达模式proTG-22b和pro-pelB-TG-22b[12]。第1种表达方式中,前导肽和TGase融合表达,被信号肽输送到周质空间,再通过周质渗透分泌到胞外;在第2种表达方式中,前导肽和TGase分别被信号肽输送到周质空间,在周质空间中前导肽帮助TGase正确折叠使TGase形成活性形式。分别检测这两种表达模式在胞内外的酶活(表 2),发现前导肽和TGase共表达的形式(pro-pelB-TG-22b)在胞内表现出较高的酶活,比酶活达到37.71 U/mg,是第1种表达方式的3.06倍。这种表达方式的优点是TGase直接表现为活性形式,且不需要后期切除N端前导肽,这也为工业化生产提供了便利。
| 表达质粒 Expression plasmids |
胞外酶活 Extracellular enzymatic activity of TGase (U/mL) |
胞内酶活 Intracellular enzymatic activity of TGase (U/mL) |
比酶活 Specific activity (U/mg) |
| proTG-22b | 1.07±0.60 | 1.34±1.20 | 12.31±0.30 |
| pro-pelB-TG-22b | 0.42±0.40 | 2.27±0.80 | 37.71±0.90 |
虽然采用前导肽和TGase共表达的形式(pro-pelB-TG-22b)可以直接得到有活性的TGase,但大部分积累在胞内。Chen等对来自吸水链霉菌TGase的N端区域的前4个氨基酸DAAD进行缺失突变,同时将第5位氨基酸E突变为D,得到的突变体Del1-4/E62D比酶活为野生酶的1.8倍[16]。因此我们根据Chen等的研究在第1种表达模式的基础上构建了3种突变体,将TGase N端前3个氨基酸DSD突变为3个丙氨酸(AAA-proTG-22b)或全部缺失(DSD-proTG-22b),将N端第4个氨基酸E突变为D (ED-proTG-22b)。通过比较胞内外的酶活(表 3),发现突变体AAA-proTG-22b胞内外酶活都明显提高,相较于原始表达方式比酶活提高了14.05%。而其他两种突变体比酶活显著降低,但胞外酶活并未受到影响,这可能是由于突变增加了TGase蛋白的分泌量,具体机制还需要后期的研究。
| 表达质粒 Expression plasmids |
胞外酶活 Extracellular enzymatic activity of TGase (U/mL) |
胞内酶活 Intracellular enzymatic activity of TGase (U/mL) |
比酶活 Specific activity (U/mg) |
| proTG-22b | 1.07±0.60 | 1.34±1.20 | 12.31±0.30 |
| AAA-proTG-22b | 1.14±0.80 | 2.08±0.70 | 14.04±0.90 |
| DSD-proTG-22b | 1.01±1.20 | 0.83±0.60 | 10.63±0.50 |
| ED-proTG-22b | 1.07±0.50 | 0.77±1.30 | 10.83±0.80 |
在融合表达基础上构建的突变体AAA-proTG- 22b比酶活相较于原始表达方式提高了14.05%,但是依然远低于共表达模式。为了得到更高的酶活,在共表达的基础上做了与融合表达相同位点的突变,测定TGase酶活(表 4)。与融合表达突变不同的是,将TGase N端前3个氨基酸DSD突变为AAA得到的突变体(AAA-pelB-TG-22b),比酶活不仅没有提高,反而仅为原始共表达模式的56.4%。根据Liu等[12]的研究,在共表达模式中前导肽和TGase分别被pelB信号肽输送到大肠杆菌的周质空间,在周质空间中前导肽帮助TGase正确折叠,使其具有活性。猜测这种突变形式可能不利于前导肽帮助TGase在周质空间中正确折叠,以至于活性降低。
| 表达质粒 Expression plasmids |
胞外酶活 Extracellular enzymatic activity of TGase (U/mL) |
胞内酶活 Intracellular enzymatic activity of TGase (U/mL) |
比酶活 Specific activity (U/mg) |
| pro-pelB-TG-22b | 0.42±0.40 | 2.27±0.80 | 37.71±0.90 |
| AAA-pelB-TG-22b | 0.25±0.80 | 1.09±0.90 | 19.91±0.50 |
| DSD-pelB-TG -22b | 0.42±1.20 | 2.01±0.60 | 36.54±0.80 |
| ED-pelB-TG -22b | 0.30±0.60 | 1.98±1.30 | 36.32±0.80 |
谷氨酰胺转氨酶作为一种重要的酶制剂,自1993年投放食品工业市场以来,市场需求量也越来越高。微生物来源的谷氨酰胺转氨酶是TGase获取的主要渠道,近年来许多研究者致力于提高该酶的产酶水平,主要方法有诱变育种筛选高产菌株及利用基因工程技术表达TGase。然而诱变育种获得的菌株不够稳定,传代培养后容易发生退变[5],利用基因工程技术则可以解决这一问题,但是目前我国构建的基因工程菌产酶量尚未达到商业化水平,因此在基因工程技术上提高产酶量依然是我们研究的重点。
本研究成功克隆了拉达克轮丝菌(S. ladakanum) B1的谷氨酰胺转氨酶基因,构建了融合表达和共表达两种表达模式,均可实现其在大肠杆菌中的可溶性表达。在融合表达模式中,TGase以proTGase的形式在大肠杆菌中可溶性表达,但是前导肽的存在会抑制TGase的活性,经过后期分散酶处理将前导肽切除,使TGase获得活性。在融合表达基础上构建的突变体AAA-proTG-22b比酶活达到14.04 U/mg,相较于原始融合表达模式提高了14.05%。在前导肽和TGase共表达模式中,前导肽和TGase依次被分泌到周质空间中,TGase在前导肽的帮助下获得活性构型,纯化后的比酶活达到37.71 U/mg。而在共表达基础上的突变体酶活均未提高,这可能是由于TGase N端的突变影响了后期前导肽对TGase的加工,从而使酶活降低。本研究构建的两种表达模式均实现了TGase的可溶性表达,同时利用基因工程技术提高了TGase酶活,为以后的研究奠定了基础。
| [1] |
Folk JE. Transglutaminases[J]. Annual Review of Biochemistry, 1980, 49: 517-531. DOI:10.1146/annurev.bi.49.070180.002505 |
| [2] |
Li QZ, Gui P, Huang Z, et al. Effect of transglutaminase on quality and gel properties of pork and fish mince mixtures[J]. Journal of Texture Studies, 2018, 49(1): 56-64. DOI:10.1111/jtxs.12281 |
| [3] |
Sárdy M, Kárpáti S, Merkl B, et al. Epidermal transglutaminase (TGase 3) is the autoantigen of dermatitis herpetiformis[J]. Journal of Experimental Medicine, 2002, 195(6): 747-757. DOI:10.1084/jem.20011299 |
| [4] |
Han X, Yu YY, Wang Q, et al. Facilitation of pretreatment for TGase catalyzing ε-PLL grafted wool fabrics[J]. New Chemical Materials, 2015, 43(3): 92-95. (in Chinese) 韩雪, 余圆圆, 王强, 等. 预处理对TGase催化羊毛接枝ε-PLL的促进作用[J]. 化工新型材料, 2015, 43(3): 92-95. |
| [5] |
Zhao HM, Wang MX, Mou ZC, et al. Study on transglutiminase in food industry[J]. Food Science and Technology, 2008, 33(9): 137-141. (in Chinese) 赵华梅, 王曼霞, 牟志春, 等. 食品工业中的谷氨酰胺转氨酶及其酶制剂[J]. 食品科技, 2008, 33(9): 137-141. DOI:10.3969/j.issn.1005-9989.2008.09.039 |
| [6] |
Yokoyama K, Nio N, Kikuchi Y. Properties and applications of microbial transglutaminase[J]. Applied Microbiology and Biotechnology, 2004, 64(4): 447-454. DOI:10.1007/s00253-003-1539-5 |
| [7] |
Kobayashi K, Hashiguchi K, Yokozeki K, et al. Molecular cloning of the transglutaminase gene from Bacillus subtilis and its expression in Escherichia coli[J]. Bioscience, Biotechnology, and Biochemistry, 1998, 62(6): 1109-1114. DOI:10.1271/bbb.62.1109 |
| [8] |
Lin YS, Chao ML, Liu CH, et al. Cloning and expression of the transglutaminase gene from Streptoverticillium ladakanum, in Streptomyces lividans[J]. Process Biochemistry, 2004, 39(5): 591-598. DOI:10.1016/S0032-9592(03)00134-1 |
| [9] |
Ando H, Adachi M, Umeda K, et al. Purification and characteristics of a novel transglutaminase derived from microorganisms[J]. Agricultural and Biological Chemistry, 2006, 53(10): 2613-2617. |
| [10] |
Kawai M, Takehana S, Takagi H. High-level expression of the chemically synthesized gene for microbial transglutaminase from Streptoverticillium in Escherichia coli[J]. Bioscience, Biotechnology, and Biochemistry, 2014, 61(5): 830-835. |
| [11] |
Yu YJ, Wu SC, Chan HH, et al. Overproduction of soluble recombinant transglutaminase from Streptomyces netropsis in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2008, 81(3): 523-532. DOI:10.1007/s00253-008-1688-7 |
| [12] |
Liu S, Zhang DX, Wang M, et al. The order of expression is a key factor in the production of active transglutaminase in Escherichia coli by co-expression with its pro-peptide[J]. Microbial Cell Factories, 2011, 10(1): 112. DOI:10.1186/1475-2859-10-112 |
| [13] |
Shimba N, Shinohara M, Yokoyama KI, et al. Enhancement of transglutaminase activity by NMR identification of its flexible residues affecting the active site[J]. FEBS Letters, 2002, 517(1/3): 175-179. |
| [14] |
Chen KK, Liu S, Ma JL, et al. Deletion combined with saturation mutagenesis of N-terminal residues in transglutaminase from Streptomyces hygroscopicus results in enhanced activity and thermostability[J]. Process Biochemistry, 2012, 47(12): 2329-2334. DOI:10.1016/j.procbio.2012.09.013 |
| [15] |
Buettner K, Hertel TC, Pietzsch M. Increased thermostability of microbial transglutaminase by combination of several hot spots evolved by random and saturation mutagenesis[J]. Amino Acids, 2012, 42(2/3): 987-996. |
| [16] |
Chen KK. The study on the molecular modificatuion of Streptomyces hygroscopicus transglutaminase for enhanced catalytic properties[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2013 (in Chinese) 陈康康.分子改造强化Streptomyces hygroscopicus谷氨酰胺转胺酶催化性能研究[D].无锡: 江南大学博士学位论文, 2013 |
| [17] |
Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [18] |
Grossowicz N, Wainfan E, Borek E, et al. The enzymatic formation of hydroxamic acids from glutamine and asparagine[J]. Journal of Biological Chemistry, 1950, 187(1): 111-125. |
 2019, Vol. 46
2019, Vol. 46




