扩展功能
文章信息
- 周翔宇, 吴海珍
- ZHOU Xiang-Yu, WU Hai-Zhen
- 48株爱德华氏菌糖酵解持家酶的胞外分泌
- Extracellular secretion of glycolytic housekeeping enzymes in 48 strains of Edwardsiella
- 微生物学通报, 2019, 46(6): 1282-1290
- Microbiology China, 2019, 46(6): 1282-1290
- DOI: 10.13344/j.microbiol.china.180559
-
文章历史
- 收稿日期: 2018-07-18
- 接受日期: 2018-11-05
- 网络首发日期: 2018-11-08
糖酵解酶普遍存在于生物体内,参与基础代谢,不同物种间同源度高。众多研究表明,病原菌的糖酵解途径中多种酶蛋白均为兼职功能蛋白(Moonlight protein)[1-2],除了参与糖代谢相关过程,还能定位在细胞膜表面或分泌到胞外,与病原菌的毒力相关,并具有一定的免疫原性。3-磷酸甘油醛脱氢酶(Glyceraldehyde 3-phosphate dehydrogenase,GAPDH)是糖酵解途径中关键酶之一,在胞质中将催化3-磷酸甘油醛生成1, 3-二磷酸甘油酸。在众多病原中均发现该酶蛋白能定位于细胞表面或者分泌到细胞外基质,在多房棘球绦虫(Echinococcus multilocularis)、盘尾丝虫(Onchocerca volvulus)、乳房链球菌(Streptococcus uberis)、肺炎链球菌(S. pneumoniae)、金黄色葡萄球菌(S. aureus)、牛支原体(Mycoplasma bovis)、炭疽芽孢杆菌(Bacillus anthracis)、牛布氏杆菌(Brucella abortus)、猪附红细胞体(Mycoplasma suis)、哈氏弧菌(V. harveyi)、迟钝爱德华氏菌(Edwardsiella tarda)和海豚链球菌(S. iniae)等在内的病原中均具有良好的免疫原性[3],可用于疫苗的开发。
果糖1, 6-二磷酸醛缩酶(Fructose-1, 6-bisphosphate aldolases,FBA)同GAPDH一样,也是糖酵解途径中的关键酶之一,在胞质中将二磷酸果糖分解成磷酸二羟丙酮和三磷酸甘油醛。众多研究也发现该蛋白具有良好的免疫原性,例如,盘尾丝虫的FBA重组表达免疫小鼠后,幼虫攻毒实验表明免疫组相比对照组幼虫存活率降低了50%[4];曼氏血吸虫的FBA重组表达后免疫小鼠,攻毒实验表明免疫组的相对免疫保护率达57%[5];肺炎链球菌的FBA重组表达后免疫小鼠,对照组小鼠攻毒后5 d全部死亡,而免疫组小鼠在攻毒后21 d死亡率仅为36%[6]。
糖酵解途径中的磷酸丙糖异构酶(Triose phosphate isomerase,TPI),催化丙糖磷酸甘油醛转化形成二羟丙酮磷酸甘油醛,在马来丝虫(Brugia malayi)被证明是一个潜在的免疫靶点[7]。磷酸甘油酸激酶(Phosphoglycerate kinase,PGK)催化1, 3-二磷酸甘油酸转化为3-磷酸甘油酸,在真菌白色念珠菌(Candida albicans)中被证实是一种新型的抗原蛋白[8]。烯醇化酶(Enolase,ENO)催化2-磷酸-D-甘油酸生成磷酸烯醇式丙酮酸,远缘链球菌(S. sobrinus)的ENO在侵染过程中能抑制宿主细胞的特异性免疫反应[9],其重组蛋白具有良好的免疫保护力[10]。
我们的研究还发现,来源于迟钝爱德华氏菌(现命名为杀鱼爱德华氏菌)的GAPDH[11-12]、FBA[13]、PGK和ENO[14]均具有良好的免疫保护作用,重组蛋白免疫大菱鲆后,免疫鱼体的抗血清和嗜水气单胞菌、鳗弧菌、溶藻弧菌和哈氏弧菌均呈阳性反应,表明糖酵解持家酶蛋白具有较好的广谱性,可用于多种病原的免疫防治[14]。
爱德华氏菌是重要的经济鱼类致病菌,已经在包括大菱鲆、牙鲆罗非鱼等多种鱼类中引起了病害,给水产养殖业造成了巨大损失。前期研究中,我们针对来源于杀鱼爱德华氏菌的多个糖酵解持家酶重组蛋白进行了免疫保护分析,基于它们良好的免疫保护作用,本文针对48株爱德华氏菌(Edwardsiella sp.)的胞外蛋白的含量进行了定量分析,以研究其胞外分泌的含量与病原菌的毒力及种属等是否存在一定的相关性,为后续糖酵解持家酶作为疫苗开发的新靶点奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒与培养基 48株不同来源的爱德华氏菌均为本实验室保藏菌株,如表 1所示。部分毒株感染宿主引起的死亡率(Mortality)的分析由本实验王亚敏博士等完成[15],死亡率越高表示该毒株的毒力越强。大肠杆菌(Escherichia coli)感受态细胞DH5α和BL21(DE3),天根生化科技(北京)有限公司。pMD 19-T Simple Vector,宝生物工程(大连)有限公司,pET-28a(+),Novagen公司。LB培养基(g/L):NaCl 10.0、胰蛋白胨10.0 (Oxoid,赛默飞世尔科技有限公司)、酵母提取物(Oxoid) 5.0,固体培养基加入琼脂粉(上海捷倍思基因技术有限公司) 17.5,用去离子水配置,1×105 Pa灭菌20 min,用于爱德华氏菌和大肠杆菌的培养。DHL固体培养基(g/L):DHL培养基粉末64.6 (上海盛思生化科技有限公司),用去离子水配置,微波炉加热至沸腾3次,用于爱德华氏菌的筛查培养。| 菌株 Strains |
宿主 Host |
来源 Origin |
死亡率 Mortality (%) |
| E. anguillarum ET081126R | American eel | Fujian, China | 100 |
| E. anguillarum BYK00685 | Unknown | Jiangxi, China | − |
| E. anguillarum BYK00691 | Unknown | Jiangxi, China | − |
| E. anguillarum ET070829 | Marbled eel | Fujian, China | − |
| E. anguillarum ET080729 | Marbled eel | Fujian, China | 73.7 |
| E. anguillarum ET080813 | Japanese eel | Fujian, China | 46.2 |
| E. anguillarum ET080814 | Japanese eel | Fujian, China | |
| E. piscicida BYK00679 | Olive Flounder | Anhui, China | 52.4 |
| E. piscicida BYK00680 | Unknown | Anhui, China | − |
| E. piscicida CGH9 | African catfish | India | − |
| E. piscicida CGK1 | African catfish | India | − |
| E. piscicida CW7 | Mediterranean Turbot | Shandong, China | − |
| E. piscicida EIB2 | Olive Flounder | Shandong, China | − |
| E. piscicida EIB11 | Olive Flounder | Shandong, China | − |
| E. piscicida EIB12 | Olive Flounder | Shandong, China | − |
| E. piscicida EIB17 | Olive Flounder | Shandong, China | − |
| E. piscicida EIB18 | Olive Flounder | Shandong, China | − |
| E. piscicida TX-1 | Olive Flounder | Shandong, China | 40.0 |
| E. piscicida TX-42 | Olive Flounder | Shandong, China | − |
| E. piscicida EIB05-1 | Olive Flounder | Shandong, China | 92.8 |
| E. piscicida EIB103 | Mediterranean Turbot | Shandong, China | − |
| E. piscicida EIB107 | Mediterranean Turbot | Shandong, China | − |
| E. piscicida EIB15 | Mediterranean Turbot | Shandong, China | − |
| E. piscicida EIB202 | Mediterranean Turbot | Shandong, China | 59.7 |
| E. piscicida EIB203 | Mediterranean Turbot | Shandong, China | − |
| E. piscicida EIB306 | Mediterranean Turbot | Shandong, China | − |
| E. piscicida EIB307 | Mediterranean Turbot | Shandong, China | − |
| E. piscicida ET-Mo | Mediterranean Turbot | Shandong, China | 35.1 |
| E. piscicida ET-Wang | Mediterranean Turbot | Shandong, China | − |
| E. piscicida WY28 | Mediterranean Turbot | Shandong, China | 52.6 |
| E. piscicida WY37 | Mediterranean Turbot | Shandong, China | − |
| E. piscicida LTB4 | Mediterranean Turbot | Shandong, China | 94.1 |
| E. piscicida ET080805 | Marbled eel | Fujian, China | − |
| E. piscicida ETG | Korean catfish | South Korean | − |
| E. piscicida L-49231 | Turbot | Liaoning, China | 32.4 |
| E. piscicida PB46 | Pangas catfish | India | − |
| E. piscicida PPD130/91 | Serpae tetra | Singapore | 77.6 |
| E. tarda ATCC15947 | Human feces | Kentucky, USA | 13.5 |
| E. tarda ATCC23692 | Human feces | USA | 5.42 |
| E. tarda DT | Oscar fish | Guangdong, China | 2.94 |
| E. tarda ET13 | Human feces | USA | − |
| E. tarda ET14 | Human feces | USA | − |
| E. tarda ET19 | Human feces | USA | − |
| E. tarda ET20 | Human feces | USA | − |
| E. tarda ET7 | Human feces | USA | − |
| E. tarda TL1m | Unknown | Zhejiang, China | − |
| E. tarda TL5m | Unknown | Zhejiang, China | − |
| HLY1 | Unknown | Unknown | − |
| LN091124 | Unknown | Unknown | − |
镍柱,GE Healthcare公司;MasterCycler pro梯度PCR仪,艾本德中国有限公司;核酸定量仪,赛默飞世尔科技有限公司;多功能酶标仪,伯乐生命医学产品(上海)有限公司。
1.1.3 引物合成与测序 引物合成由上海捷瑞生物工程有限公司完成,测序工作由苏州金唯智生物科技有限公司完成,引物列表见表 2。| 引物 Primers |
基因 Gene |
引物序列 Primer sequence (5′→3′) |
| M13-F | − | CGCCAGGGTTTTCCCAGTCACGAC |
| M13-R | − | CAGGAAACAGCTATGACC |
| T7 | − | TAATACGACTCACTATAGGG |
| T7-Ter | − | TGCTAGTTATTGCTCAGCGG |
| fba-F | fba | CGCGGATCCATGTCTAAAATCTTTGACTTT |
| fba-R | CCGCTCGAGCAGCACGTCGATGCAG | |
| gapdh-F | gapdh | GTGGGATCCATGACTATCAAAGTAGGTAT |
| gapdh-R | TGCTCTCGAGCTTAGAGATGTGTGC | |
| tpi-F | tpi | CGCGGATCCATGCGTCAACC44AGTTAT |
| tpi-R | CCGCTCGAGTTAGGCTTTAGCGGCAGCGG | |
| pgk-F | pgk | CGCGGATCCATGTCCAAAATCGTTAAAGTC |
| pgk-R | CCGCTCGAGTTACTGCTTGGCGCGCTCTTC | |
| eno-F | eno | CGCGGATCCATGTCCAAAATCGTTAAAGTC |
| eno-R | CCGCTCGAGTTAATGCTGGCCTTTCACTTCTT |
利用细菌基因组提取试剂盒提取EIB202基因组,测定浓度,按比例稀释到100 ng/μL,作为PCR的模板。按照如下体系和条件进行PCR扩增。PCR反应体系(50 μL):正、反向引物(5 μmol/L)各1 μL,模板(100 ng/L) 1 μL,2×Pfu Mix 25 μL,ddH2O 22 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,按照引物Tm值设定,退火30 s;72 ℃,按照目的片段长度设定(大约1 min/kb),35个循环;72 ℃ 7 min;4 ℃ 10 min。PCR产物通过琼脂糖凝胶电泳分离并利用DNA回收试剂盒进行目的片段回收。回收后的片段在16 ℃下与pMD 19-T Simple Vector连接3 h后,热激法转化至DH5α感受态细胞中,37 ℃培养12−16 h。挑选阳性克隆37 ℃、190 r/min培养,利用质粒抽提试剂盒提取重组质粒和pET-28a(+)质粒,将二者分别进行双酶切(BamH I/Xho I)并电泳,割胶回收后得到有相同粘性末端的载体与外源DNA片段,利用DNA连接酶将二者连接构成重组质粒。将重组质粒转化至BL21(DE3)感受态细胞中,挑取单克隆运用T7引物进行菌落PCR验证,将阳性克隆送苏州金唯智生物科技有限公司测序。
1.2.2 糖酵解酶蛋白的重组表达与纯化 将测序准确的菌株在37 ℃、190 r/min培养2 h后,加IPTG诱导(终浓度1 mmol/L)表达3 h。4 ℃、5 000×g离心10 min收菌,Binding buffer (咪唑20 mmol/L,pH 7.4)洗涤2遍后经超声破碎取上清,镍柱亲和层析纯化,并进行SDS-PAGE分析。 1.2.3 多克隆抗体制备 将1.2.2纯化后的5种重组蛋白送上海吉尔生化公司进行多克隆抗体的制备。 1.2.4 不同来源爱德华氏菌的胞外分泌情况 多克隆抗体制备成功后,利用ELISA的方法对不同来源爱德华氏菌的胞外蛋白中糖酵解酶含量进行定量分析。爱德华氏菌培养:首先进行活化培养,48株菌均先吸取100 μL保种管中的菌液涂布于DHL平板上,30 ℃培养24 h。然后进行一级和二级培养,其中一级用LB培养基,30 ℃、190 r/min培养14 h,二级种按1%接种量用DMEM培养基在30 ℃下静置培养24 h。一级和二级培养均使用容积为50 mL的锥形瓶进行培养。
胞外蛋白的提取:菌体二级培养完成后取等菌体量的培养菌液(约1 mL)至Eppendorf管中,5 000×g离心20 min。吸取800 μL上清至新Eppendorf管中,再次5 000×g离心20 min,上清液即为胞外蛋白组分。
酶联免疫吸附试验(ELISA):在酶标板的孔中加入200 μL胞外蛋白(n=3),DMEM为空白对照,4 ℃包被过夜;倒掉包被液,PBST洗涤3次;每孔加入200 μL PBSTB,37 ℃封闭2 h;倒掉封闭液,PBST洗涤3次;按1:1 000的比例将一抗稀释在PBSTB中,每孔中加入100 μL一抗稀释液,37 ℃孵育3 h;倒掉一抗,PBST洗涤5次;按照二抗说明书上的比例将其稀释在PBSTB中,每孔中加入100 μL二抗稀释液,37 ℃孵育3 h;倒掉二抗,PBST洗涤5次;每孔加入100 μL TMB底物,37 ℃避光放置10 min;每孔加入50 μL 2 mol/L硫酸终止,在酶标仪中检测OD450。
2 结果与分析 2.1 5种糖酵解酶重组表达载体的构建按照1.2.1构建重组表达质粒,转化至大肠杆菌BL21(DE3)后,挑选单克隆,利用T7引物进行菌落PCR验证,结果如图 1所示。由于T7 promoter和T7 terminator之间还有360 bp的距离,因此图 1中所示的条带大小与目的片段fba (1 077 bp)、gapdh (996 bp)、tpi (783 bp)、pgk (1 182 bp)和eno (1 320 bp)一致,说明挑选的克隆为阳性克隆。进一步经测序分析发现碱基序列与杀鱼爱德华氏菌EIB202基因组序列完全一致,表明重组表达载体构建成功。

|
| 图 1 5种糖酵解持家酶重组表达质粒的菌落PCR鉴定 Figure 1 Colony PCR products of five different glycolytic housekeeping enzyme recombination expressing plasmids Note: M: 5 000 bp DNA Maker. A: FBA, 1 077 bp; B: GAPDH, 996 bp; C: TPI, 783 bp; D: PGK, 1 182 bp; E: ENO, 1 320 bp; 1: pET28a-FBA; 2: pET28a-GAPDH; 3: pET28a-TPI; 4: pET28a-PGK; 5: pET28a-ENO. |
|
|
按照1.2.2的方法对5种重组蛋白进行了表达与纯化。诱导前、诱导后和纯化后的蛋白经过SDS-PAGE和考马斯亮蓝染色,结果如图 2所示。以FBA为例,第1泳道为FBA重组表达菌株在IPTG诱导前的全菌蛋白,第2泳道为FBA重组表达菌株在IPTG诱导后的全菌蛋白,可见在37 kD附近的蛋白量明显增加;第3泳道为经镍柱纯化后的FBA重组蛋白,其条带大小与预期大小一致。其他4种重组蛋白纯化后的大小也符合预期,且蛋白条带单一,因此获得了5种糖酵解酶蛋白的重组蛋白,用于后续多克隆抗体的制备。
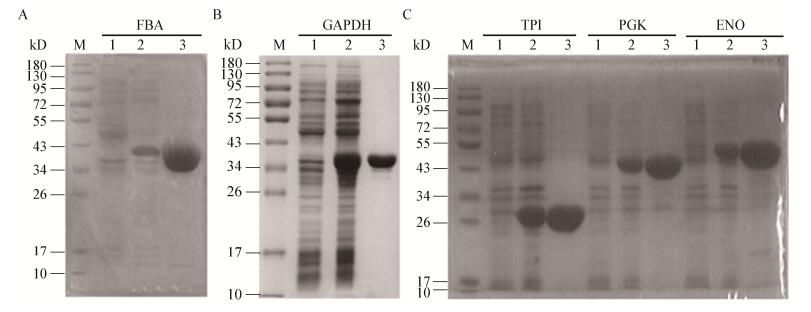
|
| 图 2 5种糖酵解持家酶重组表达与纯化结果 Figure 2 SDS-PAGE analysis of five different recombinant proteins from Edwardsiella piscicida EIB202 注:A:FBA,40 kD;B:GAPDH,37 kD;C:TPI,26 kD;PGK,40 kD;ENO,45 kD;1:诱导前全菌蛋白;2:诱导后全菌蛋白;3:Ni2+亲和层析纯化蛋白. M:蛋白标准分子量. Note: A: FBA, 40 kD; B: GAPDH, 37 kD; C: TPI, 26 kD; PGK, 40 kD; ENO, 45 kD; 1−3: Whole-cell protein of recombinant proteins before induced, after induced and after purified by Ni2+ affinity chromatography, respectively; M: Protein Marker. |
|
|
将纯化后的重组蛋白送至上海吉尔生化公司制备多克隆抗体,对得到的抗体进行稀释倍数的优化,用于后续利用ELISA定量分析不同来源爱德华氏菌胞外蛋白中的糖酵解酶含量。
优化实验中按照1.2.4方法进行实验,采用E. piscicida EIB202的胞外蛋白进行包板,多克隆抗体稀释500、1 000和2 000倍。结果如图 3所示选定Anti-FBA和Anti-GAPDH的稀释倍数为500倍,Anti-TPI、Anti-PGK和Anti-ENO的稀释倍数为1 000倍,进行后续的ELISA分析。
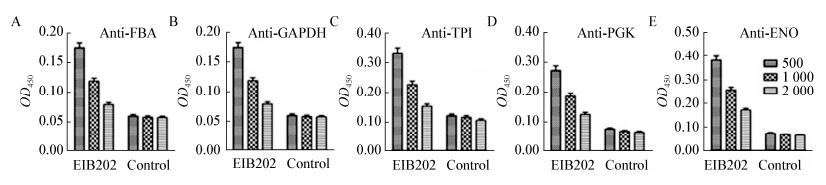
|
| 图 3 基于ELISA实验的5种糖酵解酶多克隆抗体稀释倍数的优化 Figure 3 Optimization for dilution ratio of polyclonal antibodies of five glycolytic enzymes based on ELISA assay Note: A: Anti-FBA; B: Anti-GAPDH; C: Anti-TPI; D: Anti-PGK; E: Anti-ENO. |
|
|
为了探究不同来源爱德华氏菌胞外蛋白中糖酵解酶的含量与其毒力、种属等是否有相关性,提取表 1中全部菌株的胞外蛋白后,运用ELISA对其中5种糖酵解蛋白进行了含量分析。结果如图 4所示,作为胞内发挥作用的糖酵解持家酶,在胞外蛋白中普遍存在,推测可能发挥一些非糖酵解的功能。另一方面不同菌株间糖酵解酶蛋白在胞外的分泌量存在一定差距,且分泌量与各毒株间的毒力并无明显相关性;同一种属的菌株,其胞外的分泌量较相似。而E. tarda ET7菌株的糖酵解酶蛋白的胞外分泌量则明显高于其他菌株。

|
| 图 4 48株爱德华氏菌胞外蛋白中5种糖酵解酶的含量分析 Figure 4 The OD450 of five glycolytic enzymes in extracellular protein of 48 different strains of Edwardsiella |
|
|
众多的研究发现糖酵解途径中GAPDH、FBA和TPI等酶蛋白具有良好的免疫原性,其正逐渐成为疫苗设计的新靶点。对于这些持家酶蛋白的胞外分泌及在病原菌中对毒力与致病机制的研究也逐渐被人们所关注。
Terao等发现生脓链球菌(Pyogenic streptococcus)中GAPDH定位在细胞表面,并与免疫逃脱密切相关[16];Egea等发现在大肠杆菌EPEC中,GAPDH分泌到胞外的同时也存在于细胞膜表面,而在非致病的大肠杆菌中则不分泌到胞外[17],且Alves等证实其通过III型分泌系统分泌到胞外,分泌过程需要分子伴侣的帮助[18];Oliveira等则发现B群链球菌中GAPDH存在于细胞表面是先通过菌体裂解的方式进入到胞外后又以一种未知的机制重新定位到细胞表面[19];后续的研究陆续发现该蛋白在众多链球菌属病原菌中均能定位于细胞表面或者分泌到细胞外基质环境,与病原的粘附、内化等毒力密切相关,在芽胞杆菌、大肠杆菌、脑膜炎奈瑟菌等病原菌的致病机制和乳杆菌免疫增益作用研究中也发现其能定位于细胞表面,同时该蛋白也能定位于阿米巴等病原虫细胞表面[3, 20]。
相对于GAPDH胞外分泌和非糖酵解功能的深入研究,其他持家酶蛋白的研究报道较少。其中Tunio等发现脑膜炎双球菌中的FBA虽缺少可鉴定的分泌信号,但是其可分泌到细胞表面,在细胞粘附方面具有重要作用[21]。Yamaguchi等通过实验证明TPI存在于金黄色葡萄球菌的表面,识别葡萄糖醛酸木糖甘露聚糖并与之绑定[22]。ENO在嗜水气单胞菌中发现定位于细胞膜表面,能与宿主的纤维蛋白溶酶原结合[23];在幼虫芽孢杆菌(Paenibacillus larvae)也发现其能分泌到胞外,是感染蜜蜂幼虫过程中的重要毒力因子[24]。本工作则第一次较全面地调研了爱德华氏菌中5个持家酶蛋白GAPDH、FBA、TPI、PGK和ENO的胞外分泌情况,研究中还针对RNA聚合酶[25]这一胞内蛋白进行了Western blotting,证实了这些胞外分泌不是由病原菌裂解而产生的假象。相较于目前文献报道中多个病原菌仅单个糖酵解持家酶蛋白的胞外分泌,我们的研究发现爱德华氏菌中糖酵解持家酶蛋白分泌到胞外是普遍现象,未来将对这些持家酶胞外分泌等非糖酵解功能进行系统深入的调研,以期了解它们在病原菌致病机制中的作用。
| [1] |
Henderson B, Martin A. Bacterial virulence in the moonlight: multitasking bacterial moonlighting proteins are virulence determinants in infectious disease[J]. Infection and Immunity, 2011, 79(9): 3476-3491. DOI:10.1128/IAI.00179-11 |
| [2] |
Henderson B. An overview of protein moonlighting in bacterial infection[J]. Biochemical Society Transactions, 2014, 42(6): 1720-1727. DOI:10.1042/BST20140236 |
| [3] |
Perez-Casal J, Potter AA. Glyceradehyde-3-phosphate dehydrogenase as a suitable vaccine candidate for protection against bacterial and parasitic diseases[J]. Vaccine, 2016, 34(8): 1012-1017. DOI:10.1016/j.vaccine.2015.11.072 |
| [4] |
McCarthy JS, Wieseman M, Tropea J, et al. Onchocerca volvulus glycolytic enzyme fructose-1, 6-bisphosphate aldolase as a target for a protective immune response in humans[J]. Infection and Immunity, 2002, 70(2): 851-858. DOI:10.1128/IAI.70.2.851-858.2002 |
| [5] |
Marques HH, Zouain CS, Torres CBB, et al. Protective effect and granuloma down-modulation promoted by RP44 antigen a fructose 1, 6 bisphosphate aldolase of Schistosoma mansoni[J]. Immunobiology, 2008, 213(5): 437-446. DOI:10.1016/j.imbio.2007.10.002 |
| [6] |
Ling E, Feldman G, Portnoi M, et al. Glycolytic enzymes associated with the cell surface of Streptococcus pneumoniae are antigenic in humans and elicit protective immune responses in the mouse[J]. Clinical & Experimental Immunology, 2004, 138(2): 290-298. |
| [7] |
Hewitson JP, Rückerl D, Harcus Y, et al. The secreted triose phosphate isomerase of Brugia malayi is required to sustain microfilaria production in vivo[J]. PLoS Pathogen, 2014, 10(2): e1003930. DOI:10.1371/journal.ppat.1003930 |
| [8] |
Calcedo R, Ramirez-Garcia A, Abad A, et al. Phosphoglycerate kinase and fructose bisphosphate aldolase of Candida albicans as new antigens recognized by human salivary IgA[J]. Revista Iberoamericana de Micologia, 2012, 29(3): 172-174. DOI:10.1016/j.riam.2011.07.004 |
| [9] |
Veiga-Malta I, Duarte M, Dinis M, et al. Enolase from Streptococcus sobrinus is an immunosuppressive protein[J]. Cellular Microbiology, 2004, 6(1): 79-88. |
| [10] |
Dinis M, Tavares D, Veiga-Malta I, et al. Oral therapeutic vaccination with Streptococcus sobrinus recombinant enolase confers protection against dental caries in rats[J]. The Journal of Infectious Disease, 2009, 199(1): 116-123. DOI:10.1086/594372 |
| [11] |
Li X, Wu H, Zhang M, et al. Secreted glyceraldehyde-3-phosphate dehydrogenase as a broad spectrum vaccine candidate against microbial infection in aquaculture[J]. Letters of Applied Microbiology, 2012, 54(1): 1-9. |
| [12] |
Liang SQ, Wu HZ, Liu B, et al. Immune response of turbot (Scophthalmus maximus L.) to a broad spectrum vaccine candidate, recombinant glyceraldehyde-3-phosphate dehydrogenase of Edwardsiella tarda[J]. Veterinary Immunology and Immunopathology, 2012, 150(3/4): 198-205. |
| [13] |
Sun ZY, Shen BB, Wu HZ, et al. The secreted fructose 1, 6-bisphosphate aldolase as a broad spectrum vaccine candidate against pathogenic bacteria in aquaculture[J]. Fish & Shellfish Immunology, 2015, 46(2): 638-647. |
| [14] |
Liu XH, Sun JM, Wu HZ. Glycolysis-related proteins are broad spectrum vaccine candidates against aquacultural pathogens[J]. Vaccine, 2017, 35(31): 3813-3816. DOI:10.1016/j.vaccine.2017.05.066 |
| [15] |
Wang YM, Wang QY, Xiao JF, et al. Genetic relationships of Edwardsiella strains isolated in China aquaculture revealed by rep-PCR genomic fingerprinting and investigation of Edwardsiella virulence genes[J]. Journal of Applied Microbiology, 2011, 111(6): 1337-1348. DOI:10.1111/j.1365-2672.2011.05166.x |
| [16] |
Terao Y, Yamaguchi M, Hamada S, et al. Multifunctional glyceraldehyde-3-phosphate dehydrogenase of Streptococcus pyogenes is essential for evasion from neutrophils[J]. Journal of Biological Chemistry, 2006, 281(20): 14215-14223. DOI:10.1074/jbc.M513408200 |
| [17] |
Egea L, Aguilera L, Giménez R, et al. Role of secreted glyceraldehyde-3-phosphate dehydrogenase in the infection mechanism of enterohemorrhagic and enteropathogenic Escherichia coli: interaction of the extracellular enzyme with human plasminogen and fibrinogen[J]. The International Journal of Biochemistry & Cell Biology, 2007, 39(6): 1190-1203. |
| [18] |
Alves J, Madureira P, Baltazar MT, et al. A safe and stable neonatal vaccine targeting GAPDH confers protection against Group B streptococcus infections in adult susceptible mice[J]. PLoS One, 2015, 10(12): e0144196. DOI:10.1371/journal.pone.0144196 |
| [19] |
Oliveira L, Madureira P, Andrade EB, et al. Group B streptococcus GAPDH is released upon cell lysis, associates with bacterial surface, and induces apoptosis in murine macrophages[J]. PLoS One, 2012, 7(1): e29963. DOI:10.1371/journal.pone.0029963 |
| [20] |
Gómez-Arreaza A, Acosta H, Quiñones W, et al. Extracellular functions of glycolytic enzymes of parasites: unpredicted use of ancient proteins[J]. Molecular and Biochemical Parasitology, 2014, 193(2): 75-81. |
| [21] |
Tunio SA, Oldfield NJ, Berry A, et al. The moonlighting protein fructose-1, 6-bisphosphate aldolase of Neisseria meningitidis: surface localization and role in host cell adhesion[J]. Molecular Microbiology, 2010, 76(3): 605-615. DOI:10.1111/mmi.2010.76.issue-3 |
| [22] |
Yamaguchi M, Ikeda R, Nishimura M, et al. Localization by scanning immunoelectron microscopy of triosephosphate isomerase, the molecules responsible for contact-mediated killing of Cryptococcus, on the surface of Staphylococcus[J]. Microbiology and Immunology, 2010, 54(6): 368-370. DOI:10.1111/j.1348-0421.2010.00225.x |
| [23] |
Sha J, Erova TE, Alyea RA, et al. Surface-expressed enolase contributes to the pathogenesis of clinical isolate SSU of Aeromonas hydrophila[J]. Journal of Bacteriology, 2009, 191(9): 3095-3107. DOI:10.1128/JB.00005-09 |
| [24] |
Antúnez K, Anido M, Arredondo D, et al. Paenibacillus larvae enolase as a virulence factor in honeybee larvae infection[J]. Veterinary Microbiology, 2011, 147(1/2): 83-89. |
| [25] |
Deng J, Wu HZ. Regulation of GAPDH secretion in Edwardsiella tarda[J]. Microbiology China, 2017, 44(10): 2398-2406. (in Chinese) 邓佳, 吴海珍. 迟缓爱德华氏菌中甘油醛-3-磷酸脱氢酶的胞外分泌调控[J]. 微生物学通报, 2017, 44(10): 2398-2406. |
 2019, Vol. 46
2019, Vol. 46




