扩展功能
文章信息
- 岳陈陈, 余旭亚, 赵永腾, 李涛
- YUE Chen-Chen, YU Xu-Ya, ZHAO Yong-Teng, LI Tao
- 外源2, 6-二叔丁基对甲酚对非生物胁迫条件下雨生红球藻虾青素积累的影响
- The effects of exogenous butylated hydroxytoluene on astaxanthin accumulation in Haematococcus pluvialis under abiotic stress
- 微生物学通报, 2019, 46(6): 1265-1271
- Microbiology China, 2019, 46(6): 1265-1271
- DOI: 10.13344/j.microbiol.china.180597
-
文章历史
- 收稿日期: 2018-07-30
- 接受日期: 2018-09-14
- 网络首发日期: 2018-11-02
虾青素(3, 3′-二羟基-β, β-胡萝卜素-4, 4′-二酮)是一种具有强抗氧化性的红色酮类胡萝卜素,其抗氧化能力强于维生素E和其它类胡萝卜素[1],具有消炎、改善视力、预防癌症等作用[2-3],广泛应用于水产、医药、化妆品和保健品行业[4]。虾青素在绿藻、酵母和植物中均有发现[5-6]。雨生红球藻是一种单细胞淡水绿藻,是天然虾青素的最佳来源[7-8]。尽管雨生红球藻常用于虾青素的生产,却存在着高投入、低产出问题,探寻有效的培养方法提高微藻虾青素的积累量显得尤为重要。
非生物胁迫条件,诸如氮缺陷、强光照等,能引发微藻产生氧化应激反应,即产生活性氧(Reactive oxygen species,ROS)作为一种信号分子参与到生物信号通路中[9-10]。NO是一种重要的信号分子,参与植物防御系统应对胁迫条件[11]。研究表明外源添加一些抗氧化剂能促进胁迫条件下雨生红球藻中虾青素的积累[12-13],2, 6-二叔丁基对甲酚(Butylated hydroxytoluene,BHT)是一种人工合成的酚类抗氧化剂,在食品、化妆品、医药和石化产品中应用广泛[14]。有研究表明,BHT能抑制氧化应激条件下小鼠细胞的脂质过氧化[15]。BHT影响雨生红球藻虾青素积累的研究还未见报道。
以雨生红球藻为材料,采用适宜浓度的外源BHT处理雨生红球藻细胞,研究BHT对其生长、虾青素积累、信号分子、抗氧化体系和虾青素合成关键酶基因的影响,以探究BHT诱导雨生红球藻虾青素合成的机制。
1 材料与方法 1.1 材料 1.1.1 藻种 雨生红球藻(Haematococcus pluvialis) LUGU由本实验室筛选、保存。 1.1.2 主要试剂和仪器 BHT,生工生物工程(上海)股份有限公司;一氧化氮检测试剂盒、活性氧检测试剂盒、SOD、CAT、GSH和GSSG检测试剂盒,上海碧云天生物技术有限公司;Trizol、逆转录试剂盒、chy和lcy引物以及荧光定量试剂盒,生工生物工程(上海)股份有限公司;过氧化物酶检测试剂盒,南京建成生物工程研究所;乙腈,Thermo Fisher Scientific公司。紫外可见分光光度计,安玛西亚(中国)有限公司;超声波微波组合体系,上海生析超声仪器有限公司;荧光定量PCR仪,Bio-Rad公司;高速冷冻离心机,LaboGene ScanSpeed公司;高效液相仪,Waters公司。
1.2 方法 1.2.1 雨生红球藻的培养 以Bold’s Basal Medium (BBM)[16]为基础培养基,将雨生红球藻培养于容积为3 L的鼓泡式光生物反应器中,培养温度为25±1 ℃,光照2 800±100 lx,连续通入0.1 vvm的无菌空气,培养10 d。 1.2.2 BHT处理 将上述的培养液3 500×g离心5 min,弃上清,无菌水洗去培养基再离心,用缺氮的BBM培养基重悬沉淀(使接种量为2.5×105个/mL,培养基总体积为350 mL),培养于容积为500 mL的鼓泡式光生物反应器中。将BHT溶于乙醇配成浓度为3.5 g/L的母液,加入培养基中使得BHT质量浓度分别为0 (对照组)、1.0、2.0、2.5和3.0 mg/L (保持各组加入相同体积的乙醇),每个浓度设置3个平行样。温度27±1 ℃,光照12 000±100 lx,持续通入0.04 vvm的无菌空气培养15 d,隔天定期取样,测定藻细胞生物量、虾青素积累量、ROS、NO、POD、CAT、SOD、谷胱甘肽,实时荧光定量检测chy和lcy。 1.2.3 微藻生物量的测定 收集雨生红球藻细胞,冻干,称重。生物量计算公式为:细胞生物量/(g/L)=藻粉干重(g)/藻液体积(L)。
1.2.4 测定虾青素积累量 采用高效液相法测定雨生红球藻中虾青素的含量。隔天定期取5 mL处于诱导阶段的藻液,3 000 r/min离心5 min,弃上清,水洗3次,加入2 mL甲醇-二氯甲烷(3:1,体积比),冰水浴2 500 ×g匀浆20 s,4 ℃、10 000 r/min离心15 min,上清转移至一试管中,重复上述步骤至沉淀物基本呈现无色为止。收集提取液使用滤膜过滤,用高效液相色谱仪测定其浓度,色谱柱为C18柱(Waters,25 cm×4.6 mm,5 mm),流动相A (二氯甲烷:甲醇:乙腈:水=5.0:85.0:5.5:4.5,体积比)和流动相B (二氯甲烷:甲醇:乙腈:水=25.0:28.0:42.5:4.5,体积比)遵循:8 min B 0%,6 min B 0−100%,51 min B 100%。流速为1 mL/min;检测器为Waters 996光电二极管阵列检测器,进样量20 μL,检测波长为480 nm,积分得到虾青素质量浓度c (mg/L)。虾青素含量计算公式为:虾青素含量(mg/g)=虾青素质量浓度(mg/L)/细胞生物量(g/L)。
1.2.5 ROS和NO含量测定 细胞内ROS的含量按照活性氧检测试剂盒说明书进行测定。内源NO的检测按照DAF-FM DA (NO荧光探针)的说明书进行。 1.2.6 内源抗氧化物的测定 3种抗氧化酶过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD),分别使用过氧化物酶测试盒、过氧化氢酶检测试剂盒和总SOD活性检测试剂盒进行检测。使用GSH和GSSG检测试剂盒测定藻细胞内谷胱甘肽(GSH)的含量。 1.2.7 雨生红球藻chy和lcy基因表达分析 使用Primer 5.0设计的chy和lcy酶基因扩增引物(表 1)进行PCR扩增后测序,以此为模板设计荧光定量引物(表 2)。| Primer | Primer sequence (5′→3′) | Annealing temperature (℃) |
| chyF | CTACACCACAGCGGCAAGTA | 55 |
| chyR | GCCTCACCTGATCCTACCAA | |
| lcyF | CTTCTTCTCCGCCTTCTTCA | 60 |
| lcyR | GCATCCTACCGCTCAAAGAA |
| Primer | Primer sequence (5′→3′) | Annealing temperature (℃) |
| chyF | CCAATCACTAACCCTCGCTAA | 54 |
| chyR | TGGTCCAAGCGGTAGGGTGC | |
| lcyF | GACTGGAGTGGGAAGAAC | 54 |
| lcyR | CCTACCGCTCAAAGAAATA |
离心收集诱导期藻细胞,保存于−80 ℃备用。将藻细胞在液氮中磨成粉末状,使用Trizol法提取总RNA,使用逆转录试剂盒合成cDNA,以此为模板按照Shang等[12]的方法进行RT-PCR扩增,得到chy和lcy基因的相对表达量,以18S rRNA (引物为5′-CGG TCTGCCTCTGGTATG-3′与5′-GCTTGCTTTGAAC ACGCT-3′)基因作为内标来调节RNA的用量和循环数,使内标基因在不同浓度诱导下的表达丰度一致。
1.3 数据处理每次均设置3个平行样,所有图表中数据为平均值±标准偏差,使用ANOVA (SPSS 19.0)一步法分析实验数据。最小显著性差异进行多重比较检验调查不同试验的组间差异,图中“*”表示同一时间与其他组差异显著(P < 0.05);“**”表示同一时间与其他组差异极显著(P < 0.01)。
2 结果与分析 2.1 不同浓度BHT对微藻细胞生物量的影响对照组生物量达到0.62 g/L,2.5、2.0和1.0 mg/L BHT处理组的生物量峰值分别为0.45、0.56和0.58 g/L,3.0 mg/L处理组的细胞生长受到明显的抑制(图 1),表明低浓度的BHT (1.0 mg/L和2.0 mg/L)处理雨生红球藻时,藻细胞生物量较对照组无显著性变化;高浓度的BHT (2.5 mg/L和3.0 mg/L)会对细胞生长产生显著抑制。
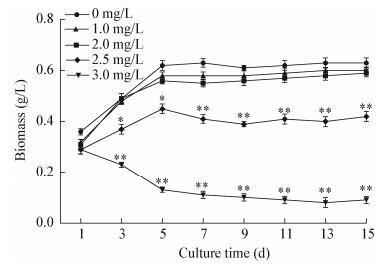
|
| 图 1 不同浓度BHT对微藻细胞生物量的影响 Figure 1 Effect of different concentrations of BHT on the biomass of H. pluvialis during induction |
|
|

|
| 图 2 不同浓度BHT对雨生红球藻虾青素含量的影响 Figure 2 Effect of BHT on astaxanthin content of H. pluvialis during induction |
|
|
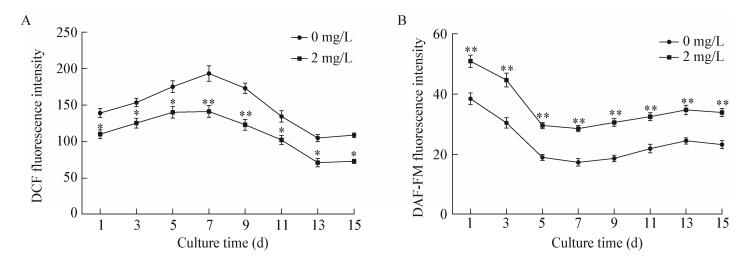
|
| 图 3 BHT对雨生红球藻内ROS和NO水平的影响 Figure 3 Effect of BHT on ROS and NO levels of H. pluvialis during induction 注:A:BHT对藻细胞内ROS水平的影响;B:BHT对藻细胞内NO水平的影响. *:P < 0.05,差异显著;**:P < 0.01,差异极显著. Note: A: Effect of BHT on ROS levels of H. pluvialis; B: Effect of BHT on NO levels of H. pluvialis. *: P < 0.05, significant difference; **: P < 0.01, extremely significant difference. |
|
|
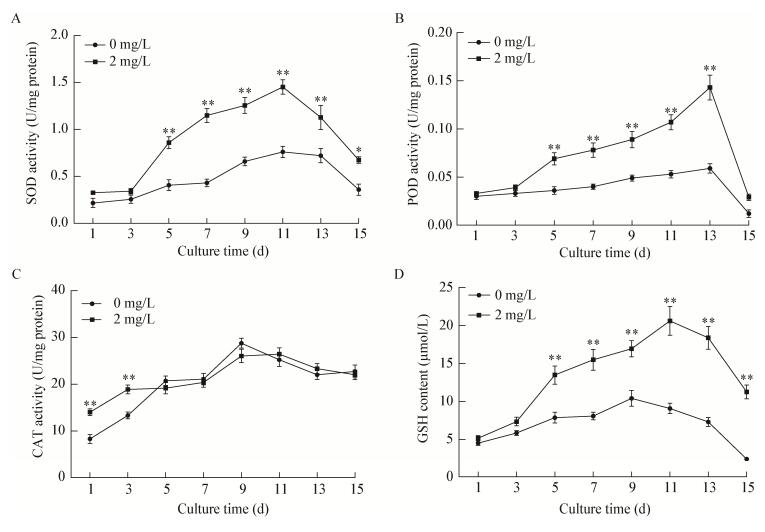
|
| 图 4 BHT处理对雨生红球藻细胞内抗氧化物质的影响 Figure 4 Effects of BHT on antioxidants levels of H. pluvialis during induction 注:A:BHT对藻细胞内SOD活性的影响;B:BHT对藻细胞内POD活性的影响;C:BHT对藻细胞内CAT活性的影响;D:BHT对藻细胞内GSH含量的影响. *:P < 0.05,差异显著;**:P < 0.01,差异极显著. Note: A: Effect of BHT on SOD activity of H. pluvialis; B: Effect of BHT on POD activity of H. pluvialis; C: Effect of BHT on CAT activity of H. pluvialis; D: Effect of BHT on GSH content of H. pluvialis. *: P < 0.05, significant difference; **: P < 0.01, extremely significant difference. |
|
|
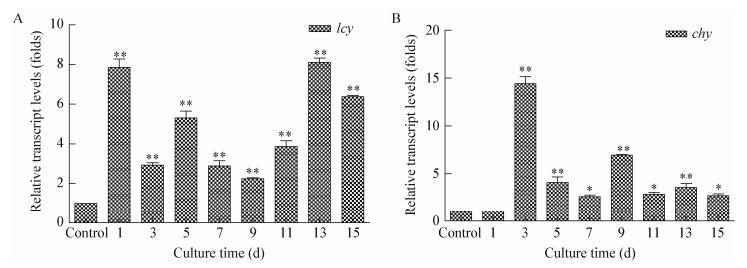
|
| 图 5 BHT对lcy和chy基因转录水平的影响 Figure 5 Effect of BHT on relative transcript levels of lcy and chy during induction 注:A:BHT对lcy基因转录水平的影响;B:BHT对chy基因转录水平的影响. *:P < 0.05,差异显著;**:P < 0.01,差异极显著. Note: A: Effect of BHT on the relative transcript level of lcy during induction; B: Effect of BHT on the relative transcript level of chy during induction. *: P < 0.05, significant difference; **: P < 0.01, extremely significant difference. |
|
|
Ding等[17]利用不同浓度的褪黑素诱导雨生红球藻积累虾青素,结果表明,褪黑素可有效促进藻细胞中虾青素的积累,10 μmol/L褪黑素处理高于5和15 μmol/L褪黑素处理的虾青素含量,与BHT一样,过高或过低剂量的外源褪黑素均不利于虾青素的合成。Wen等[18]研究证明强光照条件下,添加3% (体积比)乙醇诱导雨生红球藻,其生物量较对照组提高了25.3%,同时促进了虾青素的积累,较对照提高了2.03倍,但当乙醇含量达到5% (体积比)时抑制了藻细胞的生长。本实验中BHT添加量对强光缺氮胁迫下雨生红球藻虾青素积累的影响较大,当添加2 mg/L BHT时诱导效果最佳,其虾青素浓度可达31.66 mg/g,比对照组提高了1.87倍,对生物量无明显的促进作用;而当添加3 mg/L BHT时,同样抑制了藻细胞的生长,说明高浓度的诱导剂可能对藻细胞产生了一定的毒害作用。此外,乙醇既可作为碳源促进雨生红球藻的生长,又可作为诱导子促进虾青素的积累;而BHT可能只起到了诱导的作用,通过调控藻细胞内信号分子水平和虾青素合成酶基因表达水平,进而促进了虾青素的积累。
雨生红球藻中虾青素的合成涉及诸多机制调控。已有研究表明,强光照和氮胁迫等条件能促进虾青素的积累,与细胞内ROS的迸发有关,ROS的过量积累又会破坏藻细胞的蛋白和核酸等大分子,对细胞产生毒害作用[19-20]。NO是一种重要的信号分子,能响应生物和非生物胁迫。外源添加褪黑素时提高了病原体侵染拟南芥中的NO水平,增加了抗性基因表达,从而提高了机体抗性[21-22]。机体响应胁迫会启动自身的抗氧化系统,体内抗氧化物质的含量或活性提高,用于淬灭过高的ROS,降低胁迫条件对机体的损伤[23]。此外,胁迫条件下虾青素的大量积累经常会伴随着雨生红球藻生物量和细胞存活率的降低[24-25]。本试验中,强光缺氮条件下,外源添加2 mg/L BHT下,虾青素含量较对照组提高了1.87倍,而生物量较对照组无显著性变化。这可能是由于外源BHT提高了逆境下藻细胞内抗氧化物质(虾青素、谷胱甘肽和相关抗氧化酶)的含量或活性,清除了胞内过量的ROS,维持了氧代谢平衡的作用,从而提高了藻细胞在强光照缺氮下的抗性,进而促进虾青素积累,并维持微藻正常的生物量。Nanou等[26]利用BHT诱导真菌Blakeslea trispora,使胡萝卜素和细胞内抗氧化物质的含量得以提高,而胡萝卜素是虾青素合成途径中重要的中间代谢产物。Ding等[27]研究表明,外源添加适宜浓度的抗氧化剂褪黑素可提高雨生红球藻细胞内的虾青素含量,同时雨生红球藻的生物量无显著变化。Franz等[28]发现抗氧化剂茴香醚可以刺激微藻产生光保护,降低光氧化胁迫,提高藻细胞抗性。褪黑素和BHT均是抗氧化剂。因此,抗氧化剂可能通过调控非生物胁迫下雨生红球藻中ROS、NO和相关抗氧化酶的水平,从而提高藻细胞内虾青素的积累。
lcy和chy为藻细胞虾青素合成途径上的重要调控基因,先前的研究表明,外源添加水杨酸和氨基环丙烷,可上调雨生红球藻中lcy和chy的表达水平,从而促进了虾青素的积累[29-30],这与本文研究结果一致。综上,适量BHT可有效促进强光缺氮胁迫下雨生红球藻中虾青素的积累,这可能与BHT调控细胞内信号分子水平、抗氧化系统及虾青素合成相关基因的表达有关。
| [1] |
Igielska-Kalwat J, Gościańska J, Nowak I. Karotenoidy jako naturalne antyoksydanty[J]. Advances in Hygiene & Experimental Medicine/Postepy Higieny i Medycyny Doswiadczalnej, 2015, 69: 418-428. |
| [2] |
Kidd P. Astaxanthin, cell membrane nutrient with diverse clinical benefits and anti-aging potential[J]. Alternative Medicine Review, 2011, 16(4): 355-364. |
| [3] |
Tanaka T, Shnimizu M, Moriwaki H. Cancer chemoprevention by carotenoids[J]. Molecules, 2012, 17(3): 3202-3242. DOI:10.3390/molecules17033202 |
| [4] |
Lin YJ, Chang JJ, Lin HY, et al. Metabolic engineering a yeast to produce astaxanthin[J]. Bioresource Technology, 2017, 245: 899-905. DOI:10.1016/j.biortech.2017.07.116 |
| [5] |
Higuera-Ciapara I, Félix-Valenzuela L, Goycoolea FM. Astaxanthin: a review of its chemistry and applications[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(2): 185-196. DOI:10.1080/10408690590957188 |
| [6] |
Ambati RR, Phang SM, Ravi S, et al. Astaxanthin: sources, extraction, stability, biological activities and its commercial applications — a review[J]. Marine Drugs, 2014, 12(1): 128-152. DOI:10.3390/md12010128 |
| [7] |
Lorenz RT. A technical review of Haematococcus algae[J]. NatuRoseTM Technical Bulletin, 1999, 60: 1-12. |
| [8] |
Rao AR, Reddy AH, Aradhya SM. Antibacterial properties of Spirulina platensis, Haematococcus pluvialis, Botryococcus braunii micro algal extracts[J]. Current Trends in Biotechnology and Pharmacy, 2010, 4(3): 809-819. |
| [9] |
Lesser MP. Oxidative stress in marine environments: biochemistry and physiological ecology[J]. Annual Review of Physiology, 2006, 68: 253-278. DOI:10.1146/annurev.physiol.68.040104.110001 |
| [10] |
Ye ZW, Jiang JG, Wu GH. Biosynthesis and regulation of carotenoids in Dunaliella: progresses and prospects[J]. Biotechnology Advances, 2008, 26(4): 352-360. DOI:10.1016/j.biotechadv.2008.03.004 |
| [11] |
Wendehenne D, Durner J, Klessig DF. Nitric oxide: a new player in plant signalling and defence responses[J]. Current Opinion in Plant Biology, 2004, 7(4): 449-455. DOI:10.1016/j.pbi.2004.04.002 |
| [12] |
Shang MM, Ding W, Zhao YT, et al. Enhanced astaxanthin production from Haematococcus pluvialis using butylated hydroxyanisole[J]. Journal of Biotechnology, 2016, 236: 199-207. DOI:10.1016/j.jbiotec.2016.08.019 |
| [13] |
Zhao YT, Shang MM, Xu JW, et al. Enhanced astaxanthin production from a novel strain of Haematococcus pluvialis using fulvic acid[J]. Process Biochemistry, 2015, 50(12): 2072-2077. DOI:10.1016/j.procbio.2015.09.004 |
| [14] |
Chen C, Shaw YS. Cyclic metabolic pathway of a butylated hydroxytoluene by rat liver microsomal fractions[J]. Biochemical Journal, 1974, 144(3): 497-501. DOI:10.1042/bj1440497 |
| [15] |
Horáková L, Ondrejicková O, Bachratá K, et al. Preventive effect of several antioxidants after oxidative stress on rat brain homogenates[J]. General Physiology and Biophysics, 2000, 19(2): 195-205. |
| [16] |
Ebrahimian A, Kariminia HR, Vosoughi M. Lipid production in mixotrophic cultivation of Chlorella vulgris in a mixture of primary and secondary municipal wastewater[J]. Renewable Energy, 2014, 71: 502-508. DOI:10.1016/j.renene.2014.05.031 |
| [17] |
Ding W, Zhao P, Peng J, et al. Melatonin enhances astaxanthin accumulation in the green microalga Haematococcus pluvialis by mechanisms possibly related to abiotic stress tolerance[J]. Algal Research, 2018, 33: 256-265. DOI:10.1016/j.algal.2018.05.021 |
| [18] |
Wen ZW, Liu ZY, Hou YY, et al. Ethanol induced astaxanthin accumulation and transcriptional expression of carotenogenic genes in Haematococcus pluvialis[J]. Enzyme and Microbial Technology, 2015, 78: 10-17. DOI:10.1016/j.enzmictec.2015.06.010 |
| [19] |
Wang B, Zarka A, Trebst A, et al. Astaxanthin accumulation in Haematococcus pluvialis (Chlorophyceae) as an active photoprotective process under high irradiance[J]. Journal of Phycology, 2003, 39(6): 1116-1124. DOI:10.1111/j.0022-3646.2003.03-043.x |
| [20] |
Kobayashi M, Kakizono T, Nagai S. Enhanced carotenoid biosynthesis by oxidative stress in acetate-induced cyst cells of a green unicellular alga, Haematococcus pluvialis[J]. Applied and Environmental Microbiology, 1993, 59(3): 867-873. |
| [21] |
Domingos P, Prado AM, Wong A, et al. Nitric oxide: a multitasked signaling gas in plants[J]. Molecular Plant, 2015, 8(4): 506-520. DOI:10.1016/j.molp.2014.12.010 |
| [22] |
Shi HT, Chen YH, Tan DX, et al. Melatonin induces nitric oxide and the potential mechanisms relate to innate immunity against bacterial pathogen infection in Arabidopsis[J]. Journal of Pineal Research, 2015, 59(1): 102-108. DOI:10.1111/jpi.12244 |
| [23] |
Shi HT, Wang X, Tan DX, et al. Comparative physiological and proteomic analyses reveal the actions of melatonin in the reduction of oxidative stress in Bermuda grass (Cynodon dactylon (L). Pers.)[J]. Journal of Pineal Research, 2015, 59(1): 120-131. DOI:10.1111/jpi.12246 |
| [24] |
Li YT, Sommerfeld M, Chen F, et al. Consumption of oxygen by astaxanthin biosynthesis: a protective mechanism against oxidative stress in Haematococcus pluvialis (Chlorophyceae)[J]. Journal of Plant Physiology, 2008, 165(17): 1783-1797. DOI:10.1016/j.jplph.2007.12.007 |
| [25] |
Hong ME, Choi HI, Kwak HS, et al. Rapid selection of astaxanthin-hyperproducing Haematococcus mutant via azide-based colorimetric assay combined with oil-based astaxanthin extraction[J]. Bioresource Technology, 2018, 267: 175-181. DOI:10.1016/j.biortech.2018.07.033 |
| [26] |
Nanou K, Roukas T. Oxidative stress response and morphological changes of Blakeslea trispora induced by butylated hydroxytoluene during carotene production[J]. Applied Biochemistry and Biotechnology, 2010, 160(8): 2415-2423. DOI:10.1007/s12010-009-8712-y |
| [27] |
Ding W, Zhao YT, Xu JW, et al. Melatonin: a multifunctional molecule that triggers defense responses against high light and nitrogen starvation stress in Haematococcus pluvialis[J]. Journal of Agricultural and Food Chemistry, 2018, 66(29): 7701-7711. DOI:10.1021/acs.jafc.8b02178 |
| [28] |
Franz AK, Danielewicz MA, Wong DM, et al. Phenotypic screening with oleaginous microalgae reveals modulators of lipid productivity[J]. ACS Chemical Biology, 2013, 8(5): 1053-1062. DOI:10.1021/cb300573r |
| [29] |
Gao ZQ, Meng CX, Zhang XW, et al. Induction of salicylic acid (SA) on transcriptional expression of eight carotenoid genes and astaxanthin accumulation in Haematococcus pluvialis[J]. Enzyme and Microbial Technology, 2012, 51(4): 225-230. DOI:10.1016/j.enzmictec.2012.07.001 |
| [30] |
Lee C, Choi YE, Yun YS. A strategy for promoting astaxanthin accumulation in Haematococcus pluvialis by 1-aminocyclopropane-1-carboxylic acid application[J]. Journal of Biotechnology, 2016, 236: 120-127. DOI:10.1016/j.jbiotec.2016.08.012 |
 2019, Vol. 46
2019, Vol. 46




