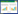扩展功能
文章信息
- 杨焕玲, 查磊, 赵旭, 赵妍, 王倩, 余昌霞, 陈明杰
- YANG Huan-Ling, ZHA Lei, ZHAO Xu, ZHAO Yan, WANG Qian, YU Chang-Xia, CHEN Ming-Jie
- 培养基中添加海藻糖对大球盖菇、斑玉蕈菌丝生长的影响
- Effect of adding trehalose to culture medium on the growth of Stropharia rugosoannulata and Hypsizigus marmoreus
- 微生物学通报, 2019, 46(5): 1108-1114
- Microbiology China, 2019, 46(5): 1108-1114
- DOI: 10.13344/j.microbiol.china.180663
-
文章历史
- 收稿日期: 2018-08-24
- 接受日期: 2018-11-26
- 网络首发日期: 2019-01-10
2. 上海市农业科学院食用菌研究所 上海 201403;
3. 甘肃省农业工程技术研究院 甘肃 武威 733006
2. Institute of Edible Fungi, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China;
3. Gansu Academy of Agricultural Engineering & Technology, Wuwei, Gansu 733006, China
食用菌是我国继粮食、油料、果品和蔬菜之后的第五大种植产业,市场前景广阔[1]。大球盖菇(Stropharia rugosoannulata)、斑玉蕈(Hypsizigus marmoreus)味道鲜美、风味独特,高蛋白、低脂肪、低热量,营养丰富[2],具有增强免疫力、防癌抗衰老、预防冠心病等功效[3],是极具开发潜力的食药兼用珍稀食用菌种类[4]。随着人们生活水平的提高,对大球盖菇及斑玉蕈的需求量也逐年增加,提高其产量及质量对产业发展具有重要意义。
食用菌的培养基是菌种保藏的关键,同时也是生产上的重要依据[5]。目前,食用菌常规培养一般主要使用马铃薯葡萄糖培养基(PDA培养基),培养基类型非常单一,但在科研及生产过程中发现PDA培养基并不是所有食用菌的最佳培养基,虽然可以使许多菌株生长,但存在生长速度慢、生物量低等问题,直接影响食用菌的生产。近年来对大球盖菇及斑玉蕈培养基的优化主要包括碳源、氮源、无机盐、维生素及植物生长调节剂等[6-7]。海藻糖是一种非还原性二糖,是广泛存在于各种生物体内的抗逆境剂,能够增强生物体对高温、脱水、干旱、冷冻、高渗透性、重金属及有毒试剂等逆境的抵抗能力[8-9]。通过外源添加的方式,海藻糖也能对细胞起到较好的非特异性保护作用。大球盖菇是一种草腐菌,采用稻草、麦秸等农林废弃物为原料,可以生料栽培,具有很强的木质纤维素分解能力[10]。纤维素酶通过其酶系组分的协同作用,将大分子高结晶化的纤维素分解为葡萄糖,可以被菌丝吸收利用。纤维素酶活性的高低与食用菌子实体的产量密切相关。斑玉蕈为一种木腐菌,栽培过程中主要以木屑为原料[11],因此对木质素的降解尤为重要。漆酶具有降解木质素、氧化降解酚类物质、抑制杂菌、改善出菇品质等重要作用,漆酶活性的高低可能与菌体的生长速度、生产周期有密切的关系,漆酶活性较高的菌种生长速度较快,生产周期相对较短[12]。
为了满足生产及科研的需要,并为进一步探索非渗透性保护剂对菌丝体生长的影响提供基础[13],本研究使用了添加海藻糖的培养基对大球盖菇、斑玉蕈菌株进行培养,以基础PDA培养基作为对照,对其菌丝生长状况、生长速度和生物量进行了比较,同时测定了大球盖菇的羧甲基纤维素酶活性和斑玉蕈的漆酶活性,筛选出各自适用的最佳培养基。
1 材料与方法 1.1 供试菌株大球盖菇菌株CY-12、斑玉蕈菌株HM-54由上海市农业科学院食用菌研究所菌种保藏中心提供。
1.2 培养基PDA培养基(g/L):马铃薯200,葡萄糖20,加蒸馏水至1 L。固体培养基加琼脂15 g/L。
PDTA培养基(g/L):马铃薯200,葡萄糖10,海藻糖10,加蒸馏水至1 L。固体培养基加琼脂15 g/L。
PTA-2培养基(g/L):马铃薯200,海藻糖20,加蒸馏水至1 L。固体培养基加琼脂15 g/L。
PTA-5培养基(g/L):马铃薯200,海藻糖50,加蒸馏水至1 L。固体培养基加琼脂15 g/L。
所有培养基均在1×105 Pa下灭菌20 min。
1.3 主要试剂和仪器海藻糖,国药集团化学试剂有限公司;羧甲基纤维素酶试剂盒、漆酶试剂盒,苏州科铭生物技术有限公司。酶标仪,Bio-Rad公司。
1.4 菌丝形态及生理指标的测定 1.4.1 生长状态及菌丝生长速度的测定每组选用同一生长状况的菌丝进行接种,在长满菌丝的PDA固体培养基上,分别用直径为5 mm的打孔器沿菌落边缘打孔,将菌块接种于不同类型的固体培养基上,25 ℃暗条件下培养,每天定时观察菌株的生长形态。接种后培养4、6、8 d用十字交叉法测量菌落半径,菌落半径差值(mm)与生长天数(d)的比值即为菌丝生长速度(mm/d)。每组重复3次,计算菌丝平均生长速度并且在培养10 d时对菌丝菌落进行拍照。
1.4.2 菌丝生物量的测定接种后的液体培养基在25 ℃、150 r/min、黑暗条件下培养到10 d时,菌丝基本长满摇瓶,处于生长旺盛阶段,第10天时收集菌丝。用烘干至恒重(M1)的滤纸过滤,取菌丝团同滤纸共同烘干至恒重(M2),计算菌丝团干重M=M2−M1,每个处理设置3次重复。
1.4.3 SDS-PAGE电泳分析收集在液体培养基中培养10 d的菌丝,用TCA/丙酮法提取蛋白质,并用浓度为12.5%的凝胶进行SDS-PAGE电泳分析。
1.4.4 羧甲基纤维素酶活力的测定大球盖菇羧甲基纤维素酶活的测定参照Mandels等[14]的方法,使用羧甲基纤维素酶试剂盒进行测定。取处理好的大球盖菇菌丝,加液氮后充分研磨,分别精确称取0.1 g,加入1 mL的提取液,充分混匀,然后于4 ℃、10 000 r/min条件下离心10 min。收集上清液置于冰上,按照试剂盒说明书测定羧甲基纤维素酶的活力。
1.4.5 漆酶活力的测定斑玉蕈漆酶活力的测定参照张雪玲等[15]的方法,使用漆酶试剂盒进行测定。取处理好的斑玉蕈菌丝加液氮后充分研磨,分别精确称取0.1 g,加入1 mL的提取液充分混匀,然后于4 ℃、10 000 r/min条件下离心10 min。收集上清液置于冰上,按照试剂盒说明书测定漆酶的活力。
2 结果与分析 2.1 大球盖菇、斑玉蕈在不同培养基上的生长情况将接种后的培养皿置于25 ℃培养箱中黑暗条件下培养,分别在接种后第4、6、8、10天比较观察菌丝生长状态,记录菌丝色泽、边缘整齐度以及菌落长势,菌丝洁白粗壮,菌落浓密,菌丝分枝多且密,长势好,边缘整齐则标记为“+++”;菌丝中等粗壮与浓密,微黄,菌丝分枝中等,边缘较整齐记为“++”;菌丝纤细绒毛状,微黄至黄褐色,稀疏,边缘不整齐则记为“+”。
大球盖菇CY-12及斑玉蕈HM-54菌株在4种培养基上第10天的生长情况见图 1,菌丝生长情况评价见表 1。两种食用菌在不同的培养基中菌落边缘均整齐,大球盖菇CY-12菌株在不同的培养基中生长,菌丝均表现为洁白粗壮,菌落浓密,菌丝分枝多且密,长势好,添加海藻糖的培养基在长势上略优于PDA培养基。斑玉蕈HM-54菌株在不同培养基上的生长情况均表现为菌丝洁白粗壮,菌落浓密,菌丝分枝多且密,长势好。
|
| 图 1 不同培养基上大球盖菇和斑玉蕈的菌落生长形态 Figure 1 Colony morphology of Stropharia rugosoannulata and Hypsizigus marmoreus on different culture media 注:A:大球盖菇;B:斑玉蕈. Note: A: Stropharia rugosoannulata; B: Hypsizigus marmoreus |
|
|
| 菌株 Strains |
培养基 Medium |
色泽 Color |
边缘整齐度 Uniformity |
菌丝分枝 Branching |
疏密程度 Density |
长势 Growth vigor |
| 大球盖菇 Stropharia rugosoannulata |
PDA | 洁白White | 整齐Tidiness | 多Much | 密集Dense | +++ |
| PDTA | 洁白White | 整齐Tidiness | 多Much | 密集Dense | +++ | |
| PTA-2 | 洁白White | 整齐Tidiness | 较多More | 密集Dense | +++ | |
| PTA-5 | 洁白White | 整齐Tidiness | 较多More | 密集Dense | +++ | |
| 斑玉蕈 Hypsizigus marmoreus |
PDA | 洁白White | 整齐Tidiness | 多Much | 较密集Denser | ++ |
| PDTA | 洁白White | 整齐Tidiness | 很多Most | 密集Dense | +++ | |
| PTA-2 | 洁白White | 整齐Tidiness | 多Much | 密集Dense | +++ | |
| PTA-5 | 洁白White | 整齐Tidiness | 较多More | 密集Dense | +++ |
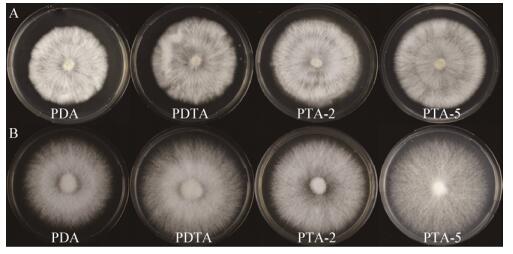
菌丝在不同培养基上的生长速度结果(图 2)表明,添加海藻糖的培养基对菌丝的生长速度具有不同程度的提高。与基础培养基PDA相比,大球盖菇CY-12菌丝在PTA-5培养基上生长速度最快,具有极显著差异;斑玉蕈HM-54在添加海藻糖的培养基上菌丝速度也有一定程度的提高,相较于基础培养基PDA,PDTA、PTA-5上的菌丝生长速度显著加快。
|
| 图 2 不同培养基上大球盖菇、斑玉蕈的菌丝生长速度 Figure 2 Mycelial growth rate of Stropharia rugosoannulata and Hypsizigus marmoreus on different culture media Note: *: P < 0.05; **: P < 0.01; ***: P < 0.001; N.S.: P > 0.05. |
|
|
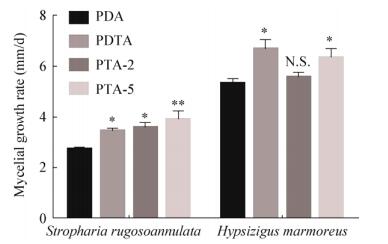
在不同液体培养基上培养的两种食用菌的菌丝生物量测定结果(图 3)表明,海藻糖的添加能不同程度地提高菌丝生物量。大球盖菇CY-12的菌丝生物量在PTA-5培养基中显著增加;斑玉蕈HM-54在添加海藻糖的培养基中生物量也增加显著,而且在PDTA及PTA-5培养基中菌丝生物量的增加达到极显著差异。
|
| 图 3 不同培养基上大球盖菇、斑玉蕈的菌丝生物量 Figure 3 Mycelial biomass of Stropharia rugosoannulata and Hypsizigus marmoreus on different culture media Note: *: P < 0.05; **: P < 0.01; ***: P < 0.001; N.S.: P > 0.05. |
|
|
收集不同培养基培养的菌丝提取蛋白质进行SDS-PAGE电泳,结果(图 4)表明,来自不同培养基的大球盖菇CY-12、斑玉蕈HM-54蛋白质在SDS-PAGE电泳图上的条带组成基本一致,说明添加海藻糖的培养基可能并未改变菌丝的蛋白质结构与组成,但蛋白条带的颜色深浅存在明显的差异,初步说明来自不同培养基菌丝体的部分蛋白表达量存在差异性。
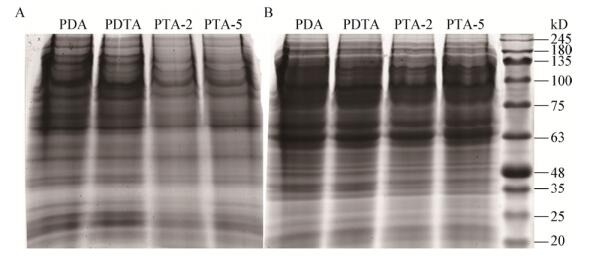
|
| 图 4 来自不同培养基的大球盖菇(A)和斑玉蕈(B)蛋白质的SDS-PAGE电泳图 Figure 4 SDS-PAGE electrophoresis of Stropharia rugosoannulata (A) and Hypsizigus marmoreus (B) protein on different culture media |
|
|
在不同液体培养基中大球盖菇菌丝的羧甲基纤维素酶(CMC酶)活力(图 5)具有显著性差异。以大球盖菇CY-12在PDA培养基中CMC酶的活力作为对照组,PDTA和PTA-2培养的菌丝CMC酶的活力显著低于PDA,而PTA-5培养的菌丝CMC酶的活力显著高于PDA,说明大球盖菇在PTA-5培养基中CMC酶活力最高,菌丝对纤维素的分解能力可能会显著增加。

|
| 图 5 不同培养基中大球盖菇的羧甲基纤维素酶活力 Figure 5 CMCase activities of Stropharia rugosoannulata on different culture media Note: *: P < 0.05. |
|
|
斑玉蕈菌丝在不同液体培养基中漆酶的活力(图 6)具有显著性差异。以在PDA培养基中斑玉蕈HM-54菌丝的漆酶活力作为对照组,PTA-2和PTA-5显著低于PDA培养基中漆酶的活力,而PDTA极显著高于PDA培养基中漆酶的活力,说明斑玉蕈在PDTA培养基中漆酶活力最高,菌丝对木质素的分解能力可能会显著增加。

|
| 图 6 不同培养基中斑玉蕈的漆酶活力 Figure 6 Laccase activities of Hypsizigus marmoreu on different culture media Note: *: P < 0.05; ***: P < 0.001. |
|
|
食用菌的菌种培养基对于科学研究及保藏菌种具有重要意义,也是栽培生产上高产稳产的关键。海藻糖作为一种稳定的非还原性二糖,具有防止蛋白质变性的作用[16],而且海藻糖积累到一定水平会响应于高温、碳氮饥饿、氧自由基、脱水、冷胁迫、冷冻、甲苯及乙醇等引发的胁迫性应激[17-19]。海藻糖的外源添加可能将有助于增强大球盖菇及斑玉蕈在培养过程中应对不良环境的能力。大球盖菇属于草腐菌,以木质纤维素为主要的营养来源,人工栽培主要的原材料是稻草、麦秆、玉米秸秆等[10]。大球盖菇具有完整的纤维素酶系,能够降解培养基基质,吸收营养和能量,在菌丝体内合成蛋白质、脂质和其他成分,保证能够正常生长发育。羧甲基纤维素酶是纤维素酶系中的重要一员,与大球盖菇的产量密切相关。通过测定羧甲基纤维素酶活力的表达,可从生理水平上衡量不同培养基对其菌丝生物量的影响。斑玉蕈是一种木腐菌,栽培过程中以木屑作为主要原材料[11]。研究表明漆酶的活性与斑玉蕈的菌丝生长及子实体发育密切相关,而且漆酶活力和生物量成正比关系[20]。因此,我们选择通过测定漆酶活力来考察不同培养基对斑玉蕈菌丝生物量的影响。
本研究以普通PDA培养基作为对照,通过对菌丝生长情况评价、菌丝生长速度、菌丝生物量、羧甲基纤维素酶及漆酶活力进行分析,发现添加海藻糖的培养基对大球盖菇、斑玉蕈菌丝的生长能产生一定的积极作用,促进了两种食用菌的菌丝生长速度及其生物量的增加,添加不同比例的海藻糖对羧甲基纤维素酶和漆酶的影响较大。添加不同比例海藻糖的培养基对大球盖菇、斑玉蕈的菌丝形态影响不大,均表现为菌丝洁白粗壮,菌落浓密,菌丝分枝多且密,长势好。使用PTA-5培养基时大球盖菇的菌丝生长速度极显著高于普通PDA培养基,菌丝生物量和羧甲基纤维素酶的活力也显著高于普通PDA培养基。因此,大球盖菇的最适培养基是PTA-5。使用PDTA和PTA-5培养的斑玉蕈,其菌丝生长速度显著高于PDA培养基,菌丝生物量极显著高于PDA培养基。漆酶活力测定结果显示,PDTA培养的斑玉蕈菌丝漆酶活力极显著高于PDA培养基,因此斑玉蕈的最佳培养基为PDTA培养基。
综上研究结果表明,添加海藻糖的培养基不仅能为大球盖菇、斑玉蕈菌丝生长提供良好的营养和环境[21],显著加快两种食用菌菌丝的生长速度,提高菌丝生物量,还可能增强大球盖菇、斑玉蕈在培养过程中应对环境胁迫的能力[22],而且制作方法简单,具有间接增加经济效益的潜力。
| [1] |
Zhang JX. An introduction of the project "Molecular Mechanisms and Regulations of Yield and Quality of Edible Mushrooms"—Scientific basis of the industrial development and technological innovation of the edible mushroom production[J]. Mycosystema, 2015, 34(4): 511-523. (in Chinese) 张金霞. "食用菌产量和品质形成的分子机理及调控"项目简介——食用菌产业发展与技术创新的科学基础[J]. 菌物学报, 2015, 34(4): 511-523. |
| [2] |
Zhang J, Zhang GQ, Zou L, et al. Isolation, purification and ITS sequence identification of Stropharia Rugosoannulata[J]. Jiangsu Agricultural Sciences, 2017, 45(1): 120-123. (in Chinese) 张健, 张国权, 邹莉, 等. 大球盖菇的分离纯化及ITS序列鉴定[J]. 江苏农业科学, 2017, 45(1): 120-123. |
| [3] |
Chen H, Feng C, Chen MJ, et al. Effects of exogenous saponin on the growth and development of Hypsizygus marmoreus[J]. Acta Agriculturae Shanghai, 2017, 33(3): 31-36. (in Chinese) 陈辉, 冯川, 陈明杰, 等. 外源添加皂苷对斑玉蕈生长发育的影响[J]. 上海农业学报, 2017, 33(3): 31-36. |
| [4] |
Hu KH, Liu JZ, Sun SJ, et al. Laccase transtormation system established in Hypsizigus marmoreus breeding[J]. Mycosystema, 2010, 29(4): 528-535. (in Chinese) 胡开辉, 刘建忠, 孙淑静, 等. 斑玉蕈育种中漆酶转化体系建立的初步研究[J]. 菌物学报, 2010, 29(4): 528-535. |
| [5] |
Zhang D, Yan MQ, Liu JY, et al. Influence factors on short- and medium-term spawn preservation of Flammulina velutipes using orthogonal experimental design[J]. Microbiology China, 2018, 45(6): 1375-1383. (in Chinese) 张丹, 颜梦秋, 刘建雨, 等. 金针菇菌种中短期保藏因素的正交分析[J]. 微生物学通报, 2018, 45(6): 1375-1383. |
| [6] |
Wu XZ, Wang QL, Du ST, et al. Effect of several different inorganic salts, vitamins and plant hormones on the mycelial growth of Hypsizigus mermoreus (Peck) bigelow[J]. Journal of Northwest A & F University (Natural Science Edition), 2012, 40(3): 158-162. (in Chinese) 吴秀珍, 王秋玲, 杜双田, 等. 无机盐、维生素及生长调节剂对斑玉蕈菌丝生长的影响[J]. 西北农林科技大学学报:自然科学版, 2012, 40(3): 158-162. |
| [7] |
Guo YY, Ruan LY, Feng HC, et al. Characteristics of mycelial growth and enzyme production of Hypsizygus marmoreus under different nutritional conditions[J]. Mycosystema, 2014, 33(3): 697-705. (in Chinese) 郭艳艳, 阮玲云, 冯宏昌, 等. 不同营养条件下斑玉蕈菌丝生长及产酶特性[J]. 菌物学报, 2014, 33(3): 697-705. |
| [8] |
Rangel DEN, Braga GUL, Fernandes ÉKK, et al. Stress tolerance and virulence of insect-pathogenic fungi are determined by environmental conditions during conidial formation[J]. Current Genetics, 2015, 61(3): 383-404. DOI:10.1007/s00294-015-0477-y |
| [9] |
Paul MJ, Gonzalez-Uriarte A, Griffiths CA, et al. The role of trehalose 6-phosphate in crop yield and resilience[J]. Plant Physiology, 2018, 177(1): 12-23. |
| [10] |
Sun M. Mycelium culture and the variation regularity of extracellular enzyme activity of Stropharia rugosoannulata Farlow[D]. Yanji: Master's Thesis of Yanbian University, 2013 (in Chinese) 孙萌.大球盖菇菌丝培养及胞外酶活性变化规律研究[D].延吉: 延边大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10184-1013321219.htm |
| [11] |
Zhang JJ. The functions of laccase on the mycelial growth and fruiting body development of basibiomycete Hypsizigus marmoreus[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2014 (in Chinese) 张津京.漆酶在斑玉蕈菌丝生长和子实体发育中的功能研究[D].南京: 南京农业大学博士学位论文, 2014 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3184529 |
| [12] |
Zhu HX. The comparison for the capacity of laccase production in various types of edible fungi and the characterization of laccase[D]. Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2008 (in Chinese) 朱海潇.食用菌产漆酶能力的比较及漆酶性能的研究[D].福州: 福建农林大学硕士学位论文, 2008 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1322821 |
| [13] |
Zhang RY, Hu DD, Zuo XM, et al. Advances in the preservation of edible mushroom cultures[J]. Acta Edulis Fungi, 2010, 17(4): 84-88. (in Chinese) 张瑞颖, 胡丹丹, 左雪梅, 等. 食用菌菌种保藏技术研究进展[J]. 食用菌学报, 2010, 17(4): 84-88. DOI:10.3969/j.issn.1005-9873.2010.04.023 |
| [14] |
Mandels M, Hontz L, Nystrom J, et al. Enzymatic hydrolysis of waste cellulose[J]. Biotechnology and Bioengineering, 2010, 105(1): 1-25. DOI:10.1002/bit.v105:1 |
| [15] |
Zhang XL, Chen XL, Li H. Determination of enzymatic properties of a laccase Lac1338, and effects of directed mutants on the degradations of different dyes[J]. Biotechnology Bulletin, 2016, 32(7): 170-177. (in Chinese) 张雪玲, 陈小利, 李荷. 漆酶Lac1338的酶学特性测定及定向突变对其酶解染料影响[J]. 生物技术通报, 2016, 32(7): 170-177. |
| [16] |
Olsson C, Jansson H, Swenson J. The role of trehalose for the stabilization of proteins[J]. The Journal of Physical Chemistry B, 2016, 120(20): 4723-4731. DOI:10.1021/acs.jpcb.6b02517 |
| [17] |
Hottiger T, de Virgilio C, Hall MN, et al. The role of trehalose synthesis for the acquisition of thermotolerance in yeast. Ⅱ. Physiological concentrations of trehalose increase the thermal stability of proteins in vitro[J]. The FEBS Journal, 1994, 219(1/2): 187-193. |
| [18] |
Bhaganna P, Volkers RJM, Bell ANW, et al. Hydrophobic substances induce water stress in microbial cells[J]. Microbial Biotechnology, 2010, 3(6): 701-716. DOI:10.1111/mbt.2010.3.issue-6 |
| [19] |
Kar JR, Hallsworth JE, Singhal RS. Fermentative production of glycine betaine and trehalose from acid whey using Actinopolyspora halophila (MTCC 263)[J]. Environmental Technology & Innovation, 2015, 3: 68-76. |
| [20] |
Zhang JJ, Chen MJ, Feng ZY, et al. Effects of aromatic compounds on biomass, laccase activities and transcript levels of Hypsizygus marmoreus[J]. Mycosystema, 2016, 35(9): 1130-1138. (in Chinese) 张津京, 陈明杰, 冯志勇, 等. 芳香族化合物对斑玉蕈菌丝生物量、漆酶活性及其转录水平的影响[J]. 菌物学报, 2016, 35(9): 1130-1138. |
| [21] |
Rubio-Texeira M, van Zeebroeck G, Thevelein JM. Trehalose metabolism: enzymatic pathways and physiological functions[A]//Hoffmeister D. Biochemistry and Molecular Biology[M]. Cham: Springer, 2016: 191-277
|
| [22] |
Zhao X, Song XX, Li YP, et al. Gene expression related to trehalose metabolism and its effect on Volvariella volvacea under low temperature stress[J]. Scientific Reports, 2018, 8(1): 11011. DOI:10.1038/s41598-018-29116-z |
 2019, Vol. 46
2019, Vol. 46