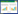扩展功能
文章信息
- 麦婉莹, 洪葵
- MAI Wan-Ying, HONG Kui
- 真菌细胞色素P450在大肠杆菌中的表达
- Heterologous expression of a fungal cytochrome P450 in Escherichia coli
- 微生物学通报, 2019, 46(5): 1092-1099
- Microbiology China, 2019, 46(5): 1092-1099
- DOI: 10.13344/j.microbiol.china.180487
-
文章历史
- 收稿日期: 2018-06-19
- 接受日期: 2018-08-01
- 网络首发日期: 2018-08-15
细胞色素P450 (Cytochrome P450 monooxygenases,CYP450)是一类具有半胱氨酸-亚铁血红素(亚铁原卟啉)结构的单加氧酶[1-4],广泛存在于动植物及细菌中,能够催化饱和C−H键的羟基化、C=C键的环氧化等氧化反应[5-6]。在多种真菌来源药物分子的生物合成后修饰过程中,细胞色素P450酶参与了多步氧化反应,如蛇孢菌素的四步氧化[7]、蕈青霉素的五步氧化(PaxP)[8]、赤霉素的四步氧化(P450-1)[9]、单端孢霉烯的四步氧化(Tri4)[10]、烟曲霉素的四步氧化(Fma-P450)[11]等。
研究表明,真核CYP450蛋白在其氨基酸序列的氨基端(N端)具有一段包含20−30个氨基酸残基的疏水性螺旋区域和一段富含脯氨酸的区域[12],这段脯氨酸富集区在真核CYP450中具有高度保守性。以脯氨酸富集区为界限,其下游氨基酸序列为该CYP450的催化功能域;而其上游N端区域具有较强的疏水性,能够使蛋白锚定在内质网膜等细胞(器)膜上[12]。这种特征增加了该类蛋白在大肠杆菌系统内的表达难度,使其表达水平偏低甚至不表达。
为了能使真核CYP450基因在大肠杆菌系统中得到可溶性表达并获得较高产量,目前已发展出多种技术方法,其中对于CYP450氨基酸序列的N端序列修饰已被大量实验验证,能够有效优化真核CYP450在原核表达系统中的表达,提高其蛋白表达水平,甚至能使原本无法在原核系统内表达的真核CYP450获得有效表达[12-14]。对真核CYP450的N端序列修饰技术主要包括替换和沉默,替换是指将目的P450酶的N端氨基酸序列替换成已知能在大肠杆菌系统中获得有效甚至是高效表达的某个P450酶的N端;而沉默是指对目的P450酶N端氨基酸序列中的若干个氨基酸进行敲除[13]。
焦曲霉094102 (Aspergillus ustus 094102)菌株可以合成Ophiobolin类化合物,与该类化合物生物合成相关的基因簇为POC8003,该基因簇中Au8003基因编码Ophiobolin F合成酶[15],其上游基因Au8002编码的蛋白经BLAST软件进行分析,与已报道的二倍半萜类氧化酶的一致性达79%[7],表明基因Au8002可能编码催化Ophiobolin F后修饰氧化过程的细胞色素P450酶。本研究通过对Au8002进行N端氨基酸序列沉默和替换,于大肠杆菌系统中进行异源表达,同时通过添加CYP450蛋白生物合成前体5-ALA,提高目的蛋白的表达量,为后续鉴定该目的蛋白功能奠定基础。
1 材料与方法 1.1 材料 1.1.1 目的基因扩增模板、菌株及质粒以焦曲霉094102菌株的cDNA为目的基因扩增模板;已知细胞色素P450蛋白CYP5144C1的基因序列从NCBI数据库中获得,GenBank登录号为AB597883;大肠杆菌TOP10、BL21(DE3)均为本实验室保存;pMD19-T(simple)载体购于武汉友名生物技术有限公司;pET-28a(+)载体由本实验室保存。
1.1.2 培养基LB培养基(g/L):蛋白胨10.0,酵母提取物5.0,NaCl 10.0。氨苄青霉素工作浓度为100 mg/μL,卡那霉素工作浓度为50 mg/μL。
1.1.3 主要试剂和仪器Pfu高保真酶、PCR试剂,天根生化科技(北京)有限公司;EcoR I内切酶、Nde I内切酶、Not I内切酶、T4 DNA连接酶,New England Biolabs公司;2×EsTaq Mix,康为世纪生物科技有限公司;组氨酸标签鼠单克隆抗体(His-Tag Mouse Monoclonal Antibody),Abbkine公司;羊抗鼠抗体(HRP,Goat Anti-Mouse IgG),Affbiotech公司;1 kb Ladder Plus DNA Marker,东盛生物科技有限公司;PageRule Prestained Protein Ladder,赛默飞世尔科技有限公司。裂解缓冲液、20 mmol/L 4-羟乙基哌嗪乙磺酸(HEPES),实验室自行配置;电化学发光(Electro- Chemi-Luminescence,ECL)显影液A和B液、PCR仪、电泳仪,Bio-Rad公司;多用途水平电泳槽,北京百晶生物技术公司;分光光度计,PerkinElmer公司。
1.2 实验方法 1.2.1 目的蛋白Au8002疏水性N端的预测利用下列在线分析软件对Au8002蛋白进行跨膜区的预测:TMHMM 2.0 Server (http://www.cbs.dtu.dk/services/TMHMM/)、InterPro 60.0 Server (http://www.ebi.ac.uk/interpro/scan.html#)及SMART (http://smart.embl-heidelberg.de/)。
1.2.2 不同N端修饰下相应目的基因的克隆及表达用于扩增5144C1NTD-Au8002蛋白相应基因的上游引物序列为F:5′-GAATTCATGTCTCTGCT GCTCGCCGCCACGCTGTTCCTTCACTCCAGG CAGAAGCGTTATCCGCTGCCCGGTCCCAGAATCGCC-3′ (粗体部分为编码CYP5144C1蛋白疏水性N端的基因序列,下划线部分为EcoR I酶切位点);∆41−63NTD-Au8002蛋白相应基因的扩增通过Overlap PCR获得,其上游引物序列为5′-CATATGATGGAG GCCTACCTGCCC-3′ (下划线部分为Nde I酶切位点),Overlap PCR的中间引物序列为F:5′-CGAGA TGTTGCTGTACGTTCTCCCCTGGCCAAGTTT-3′,R:5′-AAACTTGGCCAGGGGAGAACGTACAGCA ACATCTCG-3′;扩增∆2−69NTD-Au8002蛋白相应基因的上游引物序列为5′-GAATTCATGCCCGGTC CCAGAATCGCC-3′ (下划线部分为EcoR I酶切位点);用于扩增上述N端修饰蛋白基因序列的下游引物序列均为5′-GCGGCCGCTCAATGGTACACA ACGCGAA-3′ (下划线部分为Not I酶切位点)。利用焦曲霉094102菌株的cDNA为模板,采用Pfu高保真DNA聚合酶对上述不同N端修饰目的基因5144C1NTD-Au8002、∆41−63NTD-Au8002、∆2−69NTD- Au8002进行PCR扩增。PCR反应体系(25 μL):模板cDNA 1 μL,引物F和R (10 μmol/L)各1 μL,Pfu高保真DNA聚合酶(2.5 U/μL) 0.2 μL,5×Pfu高保真DNA聚合酶Buffer (含Mg2+) 5 μL,dNTPs (10 mmol/L) 0.5 μL,无菌水16.3 μL。PCR反应条件:94 ℃ 5 min;95 ℃ 30 s,62 ℃ 30 s,72 ℃ 1.5 min,30个循环;72 ℃ 5 min。
利用Gel Extraction Kit (200)试剂盒对PCR扩增产物进行切胶回收和纯化。将获得的纯化产物和pET-28a(+)表达载体同时进行相应的限制性内切酶Nde I或EcoR I和Not I双酶切,酶切条件为37 ℃、3 h。酶切产物经过纯化后,利用T4连接酶将基因片段与表达载体于16 ℃连接5 h。连接产物经热激转化,导入E. coli BL21(DE3)感受态细胞中,孵育后涂布于含Kan抗性的LB平板。随机挑取转化子培养,提取质粒后进行酶切验证,阳性克隆进一步进行测序验证以确定无突变产生。正确构建的基因工程菌命名如表 1所示。
| Au8002蛋白的不同N端序列修饰 N-terminal modifications of Au8002 protein |
基因工程菌名称 Names of the engineering strains |
目的蛋白理论分子量 Theoretical molecular weight of chimeric proteins (kD) |
| Au8002 (wt) | E. coli Au8002 | 61.78 |
| 5144C1NTD-Au8002 | E. coli 5144C1NTD-Au8002 | 56.50 |
| ∆41−63NTD-Au8002 | E. coli ∆41−63NTD-Au8002 | 59.20 |
| ∆2−69NTD-Au8002 | E. coli ∆2−69NTD-Au8002 | 54.30 |
将构建好的表达菌株单菌落接种于含卡那霉素的LB培养液中,37 ℃、200 r/min培养过夜作为下一步的种子液,按1%的接种量扩大培养于含卡那霉素的500 mL LB培养基中,37 ℃、200 r/min培养至OD600值为0.6−0.8,取出2 mL菌液作为诱导前对照样品,其余菌液加入终浓度为0.5 mmol/L的IPTG进行诱导表达。16 ℃培养20 h后,取2 mL菌液作为诱导后样品。同时设置诱导条件优化组,向培养基中加入终浓度为0.5 mmol/L的5-ALA,为具有P450功能的目的蛋白在大肠杆菌系统内的蛋白合成提供亚铁血红素的生物合成中间体。利用紫外分光光度计检测诱导前后样品菌液的OD600,并收集诱导前后获得的菌体样品,加入6×蛋白上样缓冲液后95 ℃干浴处理10 min,经10% SDS-PAGE电泳检测,应用Bio-Rad软件分析目的蛋白表达量与基因工程菌总蛋白表达量的占比。
1.2.4 目的蛋白诱导表达后的Western blot检测(1) 将滤纸和硝酸纤维素膜分别切成与SDS-PAGE凝胶同样大小,其中滤纸用适量转膜缓冲液平衡,硝酸纤维素膜则需甲醇浸泡激活后再用适量转膜缓冲液平衡;(2)取未经染色的SDS-PAGE蛋白凝胶与平衡过的滤纸及硝酸纤维素膜按次序叠放在一起,室温72 V电压转膜1 h;(3)取出硝酸纤维素膜,丽春红染色检测转膜效果,再用ddH2O漂洗至膜发白;(4)称取脱脂奶粉于1×TBS溶液中制得脱脂奶粉终浓度为5%脱脂奶粉封闭液,将硝酸纤维素膜浸在4 mL封闭液中,室温下于脱色摇床上60 r/min摇动封闭2 h;(5)取1 mL 5%封闭液与3 mL 1×TBS溶液混合,并加入终浓度为1:5 000的组氨酸标签鼠单克隆抗体,将封闭后的硝酸纤维素膜浸在一抗稀释液中,4 ℃孵育过夜;(6)吸弃一抗稀释液,用1×TBS溶液漂洗硝酸纤维素膜3次,每次10 min;(7)用1×TBS溶液配制终浓度为1:5 000的HRP二抗溶液,将经一抗孵育的硝酸纤维素膜浸于二抗稀释液中,室温下于脱色摇床上60 r/min摇动孵育1 h;(8)吸弃二抗稀释液,用1×TBS溶液漂洗3次,每次10 min;(9)将硝酸纤维素膜置于干净保鲜膜上,各取0.5 mL ECL显影液A、B液,混合后均匀滴在硝酸纤维素膜上进行显影处理1 min;(10)弃去多余显影液,将硝酸纤维素膜置于照胶机中进行曝光处理,检测目标蛋白条带。
1.2.5 目的蛋白CO活性检测收集诱导后菌体,重悬于裂解缓冲液(20 mmol/L HEPES,pH 7.4)中,置于冰上超声破碎(超声破碎程序:30 min,2 s,5 s,30%)。破碎后的细胞裂解液经4 ℃、4 500 r/min离心45 min,收集上清液为目的蛋白样品。用反应缓冲液母液1:1稀释含有目的蛋白的破碎后上清液至4 mL [反应缓冲液母液:200 mmol/L HEPES、2.0 mmol/L EDTA、40%甘油(体积比)和1.0%胆酸钠(质量体积比),pH 7.4],缓慢混合均匀后分装至2个1 mL比色皿中,分别标记为a、b,利用分光光度计记录两个比色皿此时在400−500 nm间的基线。取出比色皿b,于通风橱内向其中缓慢通入一氧化碳(CO)气体,以大约每秒1个气泡的速率一共通入60个气泡;取出比色皿a,同时向比色皿a、b中加入约1 mg Na2S2O4粉末后,用封口膜密封住比色皿,轻柔上下颠倒数次混匀;将各比色皿分别放置在分光光度计中,并于上述步骤中的位置保持一致,多次记录两个比色皿中的样品在400−500 nm的紫外吸收,直至样品在450 nm附近的吸光值不再增加,停止检测。
2 结果与分析 2.1 目的蛋白Au8002疏水性N端的判定TMHMM 2.0 Server预测Au8002蛋白只有一个跨膜区域,位于多肽链第41位的丙氨酸Ala与第63位的苯丙氨酸Phe之间;SMART及InterPro 60.0 Server的预测结果均与TMHMM 2.0 Server一致,表明目的蛋白Au8002的疏水性跨膜区位于多肽链第41−63位氨基酸间。对目的蛋白Au8002跨膜区下游的氨基酸序列进行分析,发现多肽链第70−72位氨基酸序列为脯氨酸-甘氨酸-脯氨酸(PGP),综合对该蛋白的跨膜区域的预测结果可以大致确定此处为Au8002蛋白的脯氨酸富集区(对应图 1蓝色区域所示),并以此为界限划分出该蛋白的N端疏水性区域及C端催化功能域(图 1)。

|
| 图 1 Au8002蛋白氨基酸序列分析结果及其N端序列修饰 Figure 1 Identifications of the amino acid sequence of Au8002 protein and the NTD modifications for Au8002 Note: Amino acid sequences of the N-terminal domain (gray), proposed proline-rich region (blue), and the following catalytic domain (green) of wild-type Au8002 protein and three NTD-modified Au8002 protein. The catalytic domain (blue and green) of protein Au8002 was fused to the N-terminal domain (gray) from CYP5144C1 to construct NTD-modified protein 5144C1NTD-Au8002. The amino acids 41−63 and 2−69 in the NTD (gray) of wild-type Au8002 were deleted to construct NTD-modified protein ∆41−63NTD-Au8002 and ∆2−69NTD-Au8002, respectively. |
|
|
Ichinose等对多种真菌CYP450进行疏水性N端序列修饰后发现,CYP5144C1蛋白的N端氨基酸序列能有效提高这类蛋白在大肠杆菌体内的表达水平[12],本研究选取这段N端序列替换Au8002蛋白的N端序列,构建N端替换蛋白5144C1NTD-Au8002;由于真菌Au8002蛋白序列中包含的疏水性跨膜区能使该蛋白在表达过程中锚定在细胞生物膜上,使其无法可溶表达,因此本研究敲除Au8002蛋白氨基酸序列中的跨膜区域构建N端沉默蛋白∆41−63NTD-Au8002;同时,由于真菌CYP450疏水性N端中的氨基酸大部分均呈疏水性,可能影响目的蛋白在大肠杆菌系统中的可溶性,因此敲除Au8002蛋白疏水性N端全长构建N端沉默蛋白∆2−69NTD-Au8002 (图 1)。
2.3 不同序列修饰蛋白基因序列的克隆及其诱导表达以焦曲霉094102菌株的cDNA片段为模板分别PCR扩增获得大小约1 500 bp的5144C1NTD- Au8002、1 550 bp的∆41−63NTD-Au8002以及1 450 bp的∆2−69NTD-Au8002的基因片段,如图 2所示。将上述片段分别与载体pET-28a(+)连接并转化到菌株E. coli BL21(DE3)中,经酶切和基因测序等验证插入目的片段无突变,分别得到能够表达3种序列修饰蛋白的基因工程菌E. coli 5144C1NTD- Au8002、E. coli ∆41−63NTD-Au8002和E. coli ∆2−69NTD-Au8002。

|
| 图 2 不同修饰蛋白的基因序列的PCR扩增 Figure 2 PCR products encoding the modified Au8002 proteins Note: M: DNA marker; 1: Amplification products of 5144C1NTD-Au8002; 2: Amplification products of ∆41−63NTD-Au8002; 3: Amplification products of ∆2−69NTD-Au8002. |
|
|
各重组工程菌株经IPTG诱导表达目的蛋白后,对各工程菌通过SDS-PAGE及Western blot进行菌体内总蛋白表达量的检测,结果分别如图 3A、B所示。与诱导前相比,诱导后各重组工程菌株均在50−60 kD处有特异表达条带(图 3A中箭头所指处),其分子量大小分别与N端序列修饰蛋白5144C1NTD- Au8002、∆41−63NTD-Au8002和∆2−69NTD-Au8002预测大小基本一致,而野生型Au8002蛋白(条带1)在同样的诱导表达条件下无法获得蛋白表达(图 3B),证明原本无法在大肠杆菌内进行蛋白表达的野生型Au8002蛋白在经过上述3种疏水性N端序列修饰后成功获得了蛋白表达。其中,∆2−69NTD- Au8002的蛋白条带最浓(图 3A,条带5),其蛋白表达量占工程菌总蛋白表达量的14.8%,比5144C1NTD- Au8002 (14.1%)、∆41−63NTD-Au8002 (11.6%)高,说明在本研究采用的3种N端修饰中,疏水性N端全长的沉默对Au8002蛋白在大肠杆菌系统中的表达具有最佳优化效果。选取重组工程菌E. coli ∆2−69NTD-Au8002进行诱导表达条件优化的研究,在诱导目的蛋白表达的过程中添加CYP450蛋白生物合成前体5-ALA后,目的蛋白的表达量从工程菌总蛋白表达量的14.8%提高至41.7%,说明5-ALA的添加能提高目的蛋白的表达水平。

|
| 图 3 各工程菌体内的总蛋白表达检测 Figure 3 Expression of total protein in engineered strains Note: A: SDS-PAGE. M: Protein marker; a: Uninduced; b: Induced; 1: E. coli Au8002; 2: E. coli 5144C1NTD-Au8002; 3: E. coli ∆41−63NTD-Au8002; 4: E. coli ∆2−69NTD-Au8002; 5: E. coli ∆2−69NTD-Au8002 with 5-ALA. B: Western blot. 1: E. coli Au8002; 2: E. coli 5144C1NTD-Au8002; 3: E. coli ∆41−63NTD-Au8002; 4: E. coli ∆2−69NTD-Au8002; 5: E. coli ∆2−69NTD-Au8002 with 5-ALA. |
|
|
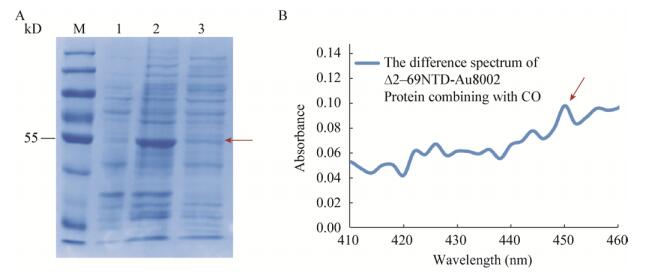
收集诱导表达后的上述各工程菌菌体,破碎细胞后分别通过SDS-PAGE对菌体和破碎后上清液样品进行检测,仅在工程菌E. coli ∆2−69NTD-Au8002的菌体破碎上清液中检测到目的蛋白条带(图 4A),但该条带浓度与全菌样品中的目的蛋白条带相比较淡,表明∆2−69NTD-Au8002仅部分可溶。E. coli ∆2−69NTD-Au8002菌体破碎后的上清液呈现橙红色,与P450酶特征相符,初步说明目的蛋白为P450酶。同时,取该上清液作CO活性检测,其差示光谱如图 3B所示,显示蛋白∆2−69NTD-Au8002在450 nm处有一个特征吸收峰(图 4B箭头所指),与P450酶的蛋白质生化特征相符[17],从而进一步验证了∆2−69NTD-Au8002蛋白是一个具有能与CO结合的亚铁血红素的可溶性P450蛋白。但由于∆2−69NTD-Au8002蛋白溶解度较低,因此其与CO结合后在450 nm处产生的吸收峰值较小。
|
| 图 4 ∆2−69NTD-Au8002蛋白在大肠杆菌系统中的表达及其可溶性蛋白的CO结合检测 Figure 4 SDS-PAGE analysis of ∆2−69NTD-Au8002 expression and the CO-combining test of the soluble protein 注:A:M:蛋白Marker;1:未诱导的工程菌E. coli ∆2−69NTD-Au8002;2:诱导后的工程菌E. coli ∆2−69NTD-Au8002;3:诱导后工程菌E. coli ∆2−69NTD-Au8002的破壁上清. B: ∆2−69NTD-Au8002蛋白与CO结合的差示光谱. Note: A: M: Protein marker; 1: E. coli ∆2−69NTD-Au8002 without IPTG induction; 2: E. coli ∆2−69NTD-Au8002 with IPTG induction; 3: Supernatant of induced E. coli ∆2−69NTD-Au8002 crude enzyme mixture. B: The difference spectrum of ∆2−69NTD-Au8002 protein combining with CO. |
|
|
由于大肠杆菌原核表达系统具有系统可控、产量高的优点,目前研究常采用大肠杆菌表达系统进行蛋白异源表达并验证功能。但大肠杆菌Escherichia coli的基因组中尚未发现P450基因[5],且真核CYP450蛋白序列中未经修饰的N端序列会增加该蛋白在原核大肠杆菌表达系统中蛋白表达的难度。近年来,通过揭示真核CYP450氨基酸的序列特征,发现对真核CYP450疏水性N端进行氨基酸序列替换或者沉默,改变该酶的拓扑结构,能够优化该类蛋白在原核表达系统中的可溶性表达水平[12-14]。
前期研究中发现,焦曲霉094102菌株中有一个可能与二倍半萜类化合物Ophiobolins生物合成后修饰氧化相关的P450基因Au8002,与已报道的二倍半萜类氧化酶的一致性达79%[7],表明Au8002可能是一个同样能催化Ophiobolin F氧化的P450酶。由于真菌来源的Au8002蛋白序列中包含的疏水性跨膜区能够使该蛋白在表达过程中锚定在细胞的生物膜上从而无法在大肠杆菌中获得蛋白表达(图 3),本研究通过对Au8002蛋白疏水性N端氨基酸序列的替换及沉默,构建了3种不同的序列修饰蛋白,实现了Au8002蛋白在大肠杆菌系统中的蛋白表达。由于CYP5144C1的疏水性N端序列已被证实能有效提高多个真菌来源的P450蛋白在大肠杆菌体内的表达水平[14],具有显著的高效性和一定的广泛适用性,因此在对目的蛋白N端序列进行替换修饰时,选取了CYP5144C1的N端序列进行替换,构建了5144C1NTD-Au8002蛋白;此外,通过敲除疏水性跨膜区序列构建了∆41−63NTD- Au8002蛋白、敲除疏水区序列全长构建了∆2−69NTD- Au8002蛋白。在上述3种不同的Au8002蛋白疏水性N端序列修饰中,∆2−69NTD-Au8002蛋白在大肠杆菌表达系统中的表达水平最高,且只有在该序列修饰下才能使目的蛋白具有一定的水溶性,以上结果说明对同一个真菌P450蛋白疏水性N端氨基酸序列的不同修饰将会在不同程度上改善目的蛋白在大肠杆菌中的蛋白表达水平和可溶性水平,实验结果与现有报道相符[13-14],也验证了真菌P450疏水性N端的序列修饰优化策略的可行性。同时,对培养基的优化实验结果显示,亚铁血红素生物合成前体5-ALA的加入也能在一定程度上提高目的蛋白在大肠杆菌中的表达水平。然而,∆2−69NTD-Au8002蛋白的可溶性仍偏低,且即使其在氨基酸序列上、下游均带有组氨酸标签也无法经镍柱亲和层析获得纯化蛋白,该现象可能是目的蛋白在大肠杆菌体内形成时多肽链折叠过于紧密、无法暴露融合标签导致。上述结果说明真菌蛋白Au8002在大肠杆菌系统中的表达仍具有挑战性,本研究采用的N端序列修饰策略虽有效实现了其在大肠杆菌中的表达,但其可溶性仍有待提高。
由于经过修饰的序列位于保守的脯氨酸富集区上游的非催化域,因此理论上经过N端序列修饰的嵌合型蛋白将保留原有蛋白功能。对于该序列修饰蛋白的功能验证需要进行进一步研究。
| [1] |
Hayaishi O. Molecular Mechanisms of Oxygen Activation[M]. New York: Academic Press, 1974.
|
| [2] |
Gunsalus IC, Pederson TC, Sligar SG. Oxygenase-catalyzed biological hydroxylations[J]. Annual Review of Biochemistry, 1975, 44: 377-407. DOI:10.1146/annurev.bi.44.070175.002113 |
| [3] |
Omura T, Ishimura Y, Fujii-Kuriyama Y. Cytochrome P450[M]. Kodansha: Tokyo, 1993.
|
| [4] |
Ortiz de Montellano PR, de Voss JJ. Oxidizing species in the mechanism of cytochrome P450[J]. Natural Product Reports, 2002, 19(4): 477-493. DOI:10.1039/b101297p |
| [5] |
Meunier B, de Visser SP, Shaik S. Mechanism of oxidation reactions catalyzed by cytochrome P450 enzymes[J]. Chemical Reviews, 2004, 104(9): 3947-3980. DOI:10.1021/cr020443g |
| [6] |
Luo Q, He Y, Hou DY, et al. Construction and characterization of engineered diesel-degrading bacterium[J]. Microbiology China, 2017, 44(6): 1271-1279. (in Chinese) 罗群, 何颖, 侯登勇, 等. 柴油降解基因工程菌的构建及降解特性[J]. 微生物学通报, 2017, 44(6): 1271-1279. |
| [7] |
Narita K, Chiba R, Minami A, et al. Multiple oxidative modifications in the ophiobolin biosynthesis: P450 oxidations found in genome mining[J]. Organic Letters, 2016, 18(9): 1980-1983. DOI:10.1021/acs.orglett.6b00552 |
| [8] |
Saikia S, Parker EJ, Koulman A, et al. Defining paxilline biosynthesis in Penicillium paxilli: functional characterization of two cytochrome P450 monooxygenases[J]. The Journal of Biological Chemistry, 2007, 282(23): 16829-16837. DOI:10.1074/jbc.M701626200 |
| [9] |
Malonek S, Rojas MC, Hedden P, et al. Functional characterization of two cytochrome P450 monooxygenase genes, P450-1 and P450-4, of the gibberellic acid gene cluster in Fusarium proliferatum (Gibberella fujikuroi MP-D)[J]. Applied and Environmental Microbiology, 2005, 71(3): 1462-1472. DOI:10.1128/AEM.71.3.1462-1472.2005 |
| [10] |
Tokai T, Koshino H, Takahashi-Ando N, et al. Fusarium Tri4 encodes a key multifunctional cytochrome P450 monooxygenase for four consecutive oxygenation steps in trichothecene biosynthesis[J]. Biochemical and Biophysical Research Communications, 2007, 353(2): 412-417. DOI:10.1016/j.bbrc.2006.12.033 |
| [11] |
Lin HC, Tsunematsu Y, Dhingra S, et al. Generation of complexity in fungal terpene biosynthesis: discovery of a multifunctional cytochrome P450 in the fumagillin pathway[J]. Journal of the American Chemical Society, 2014, 136(11): 4426-4436. DOI:10.1021/ja500881e |
| [12] |
Ichinose H, Wariishi H. High-level heterologous expression of fungal cytochrome P450s in Escherichia coli[J]. Biochemical and Biophysical Research Communications, 2013, 438(2): 289-294. DOI:10.1016/j.bbrc.2013.07.057 |
| [13] |
Zelasko S, Palaria A, Das A. Optimizations to achieve high-level expression of cytochrome P450 proteins using Escherichia coli expression systems[J]. Protein Expression and Purification, 2013, 92(1): 77-87. DOI:10.1016/j.pep.2013.07.017 |
| [14] |
Ichinose H, Hatakeyama M, Yamauchi Y. Sequence modifications and heterologous expression of eukaryotic cytochromes P450 in Escherichia coli[J]. Journal of Bioscience and Bioengineering, 2015, 120(3): 268-274. DOI:10.1016/j.jbiosc.2015.01.019 |
| [15] |
Chai HZ, Yin R, Liu YF, et al. Sesterterpene ophiobolin biosynthesis involving multiple gene clusters in Aspergillus ustus[J]. Scientific Reports, 2016, 6: 27181. DOI:10.1038/srep27181 |
| [16] |
Guengerich FP, Martin MV, Sohl CD, Cheng Q. Measurement of cytochrome P450 and NADPH-cytochrome P450 reductase[J]. Nature Protocols, 2009, 4(9): 1245-1251. DOI:10.1038/nprot.2009.121 |
| [17] |
Omura T, Sato R. The carbon monoxide-binding pigment of liver microsomes[J]. The Journal of Biological Chemistry, 1964, 239: 2370-2378. |
 2019, Vol. 46
2019, Vol. 46