扩展功能
文章信息
- 王艳玲, 尚敏敏, 张紊玮, 郭小洁, 王永刚
- WANG Yan-Ling, SHANG Min-Min, ZHANG Wen-Wei, GUO Xiao-Jie, WANG Yong-Gang
- 假单胞菌YL11对扩展青霉的抑制作用及其机理初探
- Initial study on inhibition of Penicillium expansum by Pseudomonas sp. YL11 and mechanism
- 微生物学通报, 2019, 46(5): 1081-1091
- Microbiology China, 2019, 46(5): 1081-1091
- DOI: 10.13344/j.microbiol.china.180470
-
文章历史
- 收稿日期: 2018-06-11
- 接受日期: 2018-09-25
- 网络首发日期: 2018-10-19
2. 甘肃农业大学食品科学与工程学院 甘肃 兰州 730070
2. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou, Gansu 730070, China
苹果是最重要的温带水果,其果实在采后会受到多种病原真菌的侵染而腐烂变质。其中由扩展青霉(Penicillium expansum)引起的苹果采后青霉病是导致苹果腐烂变质、造成经济损失最主要的原因之一[1-2]。目前控制扩展青霉的方式主要以使用化学杀菌剂和冷藏等物理手段为主,但是化学杀菌剂的长期和大量使用,会导致病原菌产生耐药性,并且增加水果体内的药物残留,对人类健康和环境安全存在着潜在危害,化学杀菌剂的使用备受争议。采用冷藏等物理方法虽然一定程度上阻止了病原菌的生长但容易影响水果的风味和营养价值,并且会增加冷害发生的风险。因此,寻找新的方法用于果蔬采后病害的防治显得尤为重要。近年来,生物防治已逐渐成为一种可替代化学杀菌剂的防治方法,其中拮抗微生物的应用成为一个研究热点[3-6]。
目前,已有不少关于苹果青霉病生物防治的研究报道,比如付瑞敏等[7]研究发现解淀粉芽孢杆菌所产丰原素对扩展青霉的磷脂酶A有抑制作用;Li等[8]研究了粘质红酵母通过诱导苹果中过氧化酶和多酚氧化酶的活性来抑制苹果脂质过氧化从而诱导苹果中防御机制依赖性酶的活化来防治苹果青霉病;蔡孟轩等[9]研究了橄榄假丝酵母能诱导果实抗病性以及与病原菌的营养和空间竞争来控制苹果青霉病。然而,这些研究并不能满足我国农业生产的需求,筛选出更多具有较好防治效果的生防菌仍然是当务之急。本研究以前期分离筛选的假单胞菌YL11为研究对象[10],研究了假单胞菌YL11无菌发酵液对扩展青霉菌落直径、孢子萌发率、菌丝体含量、苹果损伤接种病斑直径扩展的影响,并对细胞膜通透性(电导率、核酸及蛋白释放量、AKP含量)和能量代谢(SDH活性、ATP酶活性和ATP含量)的相关指标进行了测定。以期评价假单胞菌YL11对扩展青霉的抑制作用和苹果采后青霉病的防治效果,并对其抑菌机理进行初步探讨,旨在为进一步将其应用于苹果采后青霉病的生物防治奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 菌株、供试苹果及培养基假单胞菌YL11 (Pseudomonas sp. YL11)分离自甘肃定西地区马铃薯根际土壤并保存;致病菌扩展青霉(Penicillium expansum)由甘肃农业大学食品科学与工程学院采后生物学与技术实验室惠赠;供试苹果为甘肃静宁县红富士(Red Fuji)。
PDA培养基(g/L):马铃薯200.0,葡萄糖20.0,琼脂20.0,pH自然,1×105 Pa灭菌20 min;PDB培养基:PDA培养基中不加琼脂;LB培养基(g/L):蛋白胨10.0,酵母提取物5.0,氯化钠10.0,琼脂15.0,pH 7.0,1×105 Pa灭菌20 min。
1.1.2 主要试剂和仪器牛肉膏、蛋白胨、酵母浸膏,北京奥博星生物技术有限责任公司;琼脂,北京索莱宝科技有限公司;葡萄糖、氯化钠,国药集团化学试剂有限公司;琥珀酸脱氢酶(SDH)测试盒、碱性磷酸酶(AKP)测试盒、ATP含量测试盒和超微量总ATP酶测试盒,南京建成生物工程研究所。
恒温培养摇床、电热恒温培养箱、电热鼓风干燥箱,上海一恒科学仪器有限公司;洁净工作台,苏州安泰空气技术有限公司;立式高压灭菌器,上海申安医疗器械厂;生物显微镜,宁波舜宇仪器有限公司;快速组织细胞破碎仪,天津欧诺仪器股份有限公司;酶标仪,美谷分子仪器有限公司。
1.2 Pseudomonas sp. YL11发酵液抑菌活性研究 1.2.1 Pseudomonas sp. YL11无菌发酵液的制备菌株Pseudomonas sp. YL11接种于LB液体培养基中,37 ℃、120 r/min振荡培养3 d,4 ℃、10 000 r/min离心15 min,收集上清液用0.22 μm无菌滤膜过滤,滤液即为无菌发酵液。
1.2.2 无菌发酵液对P. expansum的抑菌作用将100 μL P. expansum孢子悬浮液(106 CFU/mL)均匀涂布在PDA培养基,在培养基中央放置牛津杯,分别加入200 μL体积分数为80%、90%、100%的无菌发酵液,无菌水为空白对照。每个处理重复3次,28 ℃恒温培养3 d,用十字交叉法测量抑菌圈直径,计算抑菌效价[6]。

|
式中:X为抑菌圈直径(mm);Y为牛津杯直径(mm);V为发酵液体积(μL)。
1.2.3 无菌发酵液对P. expansum孢子萌发的影响参照牛黎莉等[11]方法并稍加修改,将5 mm琼脂饼放置到灭菌载玻片上(每个载玻片上放置3个),每个琼脂饼上滴加10 μL不同体积分数的无菌发酵液,以无菌水为对照,放置20 min后,每个琼脂饼加入10 μL P. expansum孢子悬浮液(106 CFU/mL),28 ℃培养9 h。显微镜检观察,孢子萌发形成的芽管长度大于孢子一半时视为萌发,计算孢子萌发率。
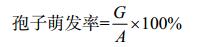
|
式中:G表示萌发孢子数(个);A表示总的孢子数(个)。

|
式中:S表示空白对照萌发孢子率;S′表示处理的孢子萌发率。
1.2.4 无菌发酵液对P. expansum生物量的影响参照刘琼等[12]方法并稍加修改,不同体积分数的无菌发酵液加入到PDB培养基,接种150 μL P. expansum孢子悬浮液(106 CFU/mL),28 ℃、180 r/min振荡培养3 d后,室温8 000 r/min离心20 min,收集菌丝体,75 ℃恒温干燥1 d后称重,即为菌丝体干重,每一处理重复3次,以无菌水处理为对照组。
1.2.5 无菌发酵液处理对苹果损伤接种后病斑直径的影响参照白小东等[13]方法并稍加修改。选择外观整齐、大小均一、无损伤及病虫害的苹果,0.2%次氯酸钠浸泡2 min,无菌水冲洗干净后室温晾干,用70%的酒精进行表面消毒,再用直径3 mm的无菌打孔器在果实赤道部位均匀刺4个伤口,注入20 μL无菌发酵液静置2 h,接入20 μL P. expansum孢子悬浮液(106 CFU/mL),用聚乙烯薄膜包装,在室温[(23±1℃),RH 50%−60%]条件下贮藏3、5、7、9 d后用十字交叉法测量病斑直径。每个处理用苹果20个,3次重复,以无菌水处理为对照组。
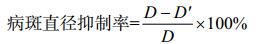
|
式中:D表示空白对照病斑直径(mm);D′表示处理的病斑直径(mm)。
1.3 Pseudomonas sp. YL11对P. expansum膜通透性的影响无菌发酵液对P. expansum电导率的影响,测定方法参照高向阳[14]方法;无菌发酵液对P. expansum核酸及蛋白质释放量的影响,测定方法参照陈婵娟等[15]方法;无菌发酵液对P. expansum AKP含量影响的测定,将1 mL孢子悬浮液(106 CFU/mL)接种于50 mL PDB培养基中,加入不同体积分数的无菌发酵液,28 ℃、180 r/min下振荡培养42 h,以无菌水处理为空白对照。每间隔6 h取样1.5 mL,4 ℃、12 000 r/min离心10 min,弃沉淀取上清液,用碱性磷酸酶(AKP)试剂盒测定AKP的含量。
1.4 Pseudomonas sp. YL11对P. expansum能量代谢的影响 1.4.1 无菌发酵液对P. expansum SDH活性的影响测定方法参照黄婉玉等[16]方法,用琥珀酸脱氢酶试剂盒测定SDH活性。
1.4.2 无菌发酵液对P. expansum总ATP酶活性和ATP含量的影响将1 mL孢子悬浮液(106 CFU/mL)接种于50 mL PDB培养基中,加入不同体积分数无菌发酵液,28 ℃、180 r/min振荡培养42 h,以无菌水为空白对照。每间隔6 h取样1.5 mL,4 ℃、12 000 r/min离心10 min,弃沉淀取上清液,收集菌丝体,用快速组织细胞破碎仪破碎细胞,取上清弃沉淀,用ATP含量试剂盒测定ATP的含量,用超微量ATP酶试剂盒测定总ATP酶活性。
1.5 数据处理采用SPSS 17.0软件进行数据分析,结果以平均值±标准差表示。
2 结果与分析 2.1 Pseudomonas sp. YL11对P. expansum的抑菌作用 2.1.1 Pseudomonas sp. YL11无菌发酵液对P. expansum的抑菌作用80%、90%、100%不同体积分数的Pseudomonas sp. YL11无菌发酵液对P. expansum均有抑制作用。随着体积分数的增加,抑菌圈直径逐渐增大,当无菌发酵液体积分数为100%时,抑菌圈直径为22.33±0.27 mm,抑菌效价为71.67 mm/mL (表 1,图 1)。挑取抑菌圈周围的P. expansum菌丝制片,显微观察到菌丝生长异常,形态畸形,出现溶解、断裂和膨大的现象。随着发酵液浓度的增加,现象越明显。
| 无菌发酵液体积分数 Volume fraction of cell-free fermentation filtrate (%) |
抑菌圈直径 The diameter of inhibition zone (mm) |
抑菌效价 Inhibition titer (mm/mL) |
| CK | - | - |
| 80 | 15.33±0.32c | 36.65 |
| 90 | 18.67±0.15b | 53.35 |
| 100 | 22.33±0.27a | 71.67 |
| 注:同列数据后的不同小写字母表示差异显著(P < 0.05). Note: The different letter means significant difference (P < 0.05). |
||

|
| 图 1 Pseudomonas sp. YL11无菌发酵液对P. expansum的抑菌作用 Figure 1 Inhibitory activity of strain YL11's cell-free fermentation filtrate on P. expansum 注:A:100%体积分数无菌发酵液;B:90%体积分数无菌发酵液;C:80%体积分数无菌发酵液;D:空白对照. Note: A: 100% cell-free fermentation filtrate; B: 90% cell-free fermentation filtrate; C: 80% cell-free fermentation filtrate; D: CK. |
|
|
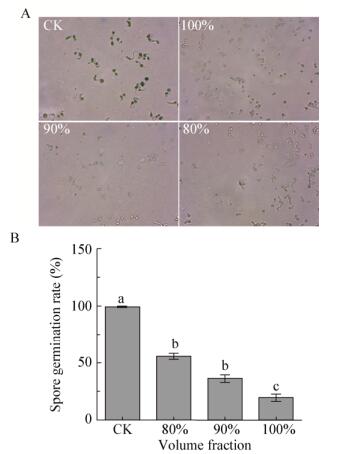
无菌水处理的P. expansum孢子几乎全部萌发,Pseudomonas sp. YL11无菌发酵液处理对孢子萌发具有显著抑制作用(图 2A)。无菌水处理的P. expansum孢子在9 h萌发率为99.5%,与对照相比,体积分数为80%无菌发酵液处理时,孢子萌发率为55.7%,孢子萌发抑制率为44.0%;体积分数为90%无菌发酵液处理时,孢子萌发率为36.2%,孢子萌发抑制率为63.6%;体积分数为100%无菌发酵液处理时,孢子萌发率为19.7%,孢子萌发抑制率为80.2%。高浓度的Pseudomonas sp. YL11无菌发酵液对孢子萌发具有显著的抑制作用,随着发酵液浓度的增加,P. expansum孢子的萌发率显著降低(图 2B)。
|
| 图 2 Pseudomonas sp. YL11无菌发酵液对P. expansum孢子萌发的影响 Figure 2 Effects of Pseudomonas sp. YL11's cell-free fermentation filtrate on spore germination of P. expansum 注:A:无菌水和无菌发酵液处理后光学显微镜下P. expansum孢子萌发形态(400×);B:无菌水和无菌发酵液处理后P. expansum孢子萌发率,柱形图上不同的小写字母表示差异显著(P < 0.05). Note: A: Spore germination morphology of P. expansum under optical microscope (400×); B: The rate of spore germination of P. expansum, the different letter means significant difference (P < 0.05). |
|
|
Pseudomonas sp. YL11无菌发酵液对P. expansum菌体生物量的积累有一定的抑制作用(图 3),其中无菌水处理的菌丝体干重为7.8 mg/mL,体积分数为80%和90%无菌发酵液处理时,菌丝干重分别为7.7 mg/mL和6.5 mg/mL,与对照组相比无显著性差异,而体积分数为100%无菌发酵液处理时,菌丝体干重为4.7 mg/mL,抑制率达到39.74%,与对照组相比差异显著(P < 0.05)。

|
| 图 3 Pseudomonas sp. YL11无菌发酵液对P. expansum生物量的影响 Figure 3 Effects of Pseudomonas sp. YL11's cell-free fermentation filtrate on mycelial dry weight of P. expansum 注:柱形图上不同的小写字母表示差异显著(P < 0.05). Note: The different letter means significant difference (P < 0.05). |
|
|
80%、90%、100%不同体积分数的Pseudomonas sp. YL11无菌发酵液对苹果损伤接种病斑直径的扩展均有抑制作用,且随着浓度的增加,抑制作用越明显(图 4A)。在损伤接种3 d后,100%体积分数的无菌发酵液抑制苹果病斑扩展的效果最显著,与对照(1.04 cm)相比,病斑直径仅为0.55 cm,抑制率达到47.1%;5 d和7 d后,不同浓度的发酵液均表现出良好的抑制效果,其中100%体积分数发酵液处理后病斑直径为1.52 cm和2.57 cm,病斑直径扩展的抑制率分别为38.2%和38.1%;9 d后,空白对照苹果出现大面积腐烂,病斑直径扩展已达到5.15 cm,而100%体积分数发酵液处理的苹果病斑直径为3.78 cm,抑制率为26.6%,表现出较好的抑制效果(图 4B)。表明主要是Pseudomonas sp. YL11无菌发酵液能有效抑制P. expansum的生长,进而更好地抑制了病斑扩展。

|
| 图 4 Pseudomonas sp. YL11无菌发酵液处理对苹果病斑直径的影响 Figure 4 Effects of Pseudomonas sp. YL11 's cell-free fermentation filtrate on the diameters of disease spots 注:A:不同处理在2 h后接种23 ℃贮存3、5、7、9 d后病斑的变化;B:不同处理在2 h后接种23 ℃贮存3、5、7、9 d后病斑直径的变化,柱形图上不同的小写字母表示差异显著(P < 0.05). Note: A: Decay lesion of apples after 3, 5, 7, 9 d at 23 ℃ and 2 h inoculation; B: The diameter of decay lesion of apples after 3, 5, 7, 9 d at 23 ℃ and 2 h inoculation, the different letter means significant difference (P < 0.05). |
|
|
细胞膜是P. expansum的保护屏障,当遇到抑菌剂发生作用时,P. expansum细胞膜会遭到破坏,保护屏障被打破,使其内部电解质外泄至培养液中,导致培养液的电导率升高,因此菌液电导率的变化反映了P. expansum细胞膜通透性的变化情况。由图 5可知,对照组电导率值基本保持不变,而不同浓度的无菌发酵液处理的菌悬液的电导率值均高于对照,随着作用时间的延长而逐渐增大,其中100%发酵液处理菌悬液的电导率增大趋势更为明显。电导率在12 h后呈下降趋势,有可能是受细胞自身活动的影响,发酵液中活性成分与细胞膜表面发生了静电结合,导致带电离子减少,使菌悬液的电导率降低。因此推断Pseudomonas sp. YL11发酵液破坏了细胞膜的完整性,使细胞膜离子通透性增加,胞内电解质外泄,导致电导率升高。

|
| 图 5 Pseudomonas sp. YL11无菌发酵液对P. expansum电导率的影响 Figure 5 Effects of Pseudomonas sp. YL11's cell-free fermentation filtrate on conductivity of P. expansum |
|
|
核酸和蛋白质是菌体自身维持生命活动所必需的基本物质,当细胞膜结构遭到破坏时,细胞内容物包括核酸、蛋白质会发生外泄,通过测定菌体培养液中核酸和蛋白质浓度的变化,可以反映菌体细胞膜结构的完整性。由图 6可知,与空白对照相比,处理组OD260和OD280值均增大。发酵液处理后P. expansum胞内核酸和蛋白质大量渗透到细胞外部,说明Pseudomonas sp. YL11发酵液破坏了细胞膜的完整性,使得胞内物质外渗。80%和90%的发酵液比100%发酵液处理P. expansum后菌体培养液的OD260和OD280值偏低,表明释放到胞外的核酸和蛋白质量相对较少,80%和90%的发酵液对细胞膜的破坏程度比100%发酵液的破坏程度要低。其中3 h时胞外核酸浓度和蛋白质浓度均达到最大,表明此时对细胞膜的完整性破坏达到最大。

|
| 图 6 Pseudomonas sp. YL11发酵液对P. expansum核酸和蛋白释放量的影响 Figure 6 Effects of Pseudomonas sp. YL11's cell-free fermentation filtrate on nucleic acid and protein release of P. expansum 注:A:无菌发酵液对P. expansum核酸释放量的影响;B:无菌发酵液对P. expansum蛋白释放量的影响. Note: A: Effects of cell-free fermentation filtrate on nucleic acid release of P. expansum; B: Effects of cell-free fermentation filtrate on protein release of P. expansum. |
|
|
碱性磷酸酶(AKP)是存在于细胞壁与细胞膜之间的一种酶,正常情况下该酶不能透过细胞壁或细胞膜渗透到细胞外。但当细胞壁或细胞膜遭到一定程度的破坏后,透性增加,AKP会大量渗透到胞外,因此通过检测细胞外AKP含量的变化可以反映菌体细胞受破坏的情况。由图 7可知,Pseudomonas sp.YL11发酵液处理菌悬液中的AKP含量明显高于对照,随着发酵液浓度增大,处理后细胞外AKP含量也相应增加,而对照组AKP含量基本没有变化,表明Pseudomonas sp. YL11发酵液对P. expansum细胞壁有一定破坏作用,造成细胞壁结构通透性增大,胞外AKP含量增加,且高浓度的发酵液对细胞壁的破坏性更强。

|
| 图 7 Pseudomonas sp. YL11无菌发酵液处理对P. expansum AKP含量的变化 Figure 7 Effects of Pseudomonas sp. YL11's cell-free fermentation filtrate on the AKP content of P. expansum |
|
|
琥珀酸脱氢酶(SDH)是TCA循环中唯一一个整合于膜上的多亚基酶,在真核生物中结合于线粒体内膜,在原核生物中整合于细胞膜上,其是连接氧化磷酸化与电子传递的枢纽之一,可为真核细胞线粒体和多种原核细胞需氧和产能的呼吸链提供电子,为线粒体的一种标志酶。由图 8可知,Pseudomonas sp. YL11发酵液作用于P. expansum后,其SDH活性均会逐渐下降,明显低于对照组,6 h下降到最低点,随后呈上升趋势,12 h活性达到最大,有可能与细胞自身修复作用有关。12 h后活性持续降低,表明活性物质影响了SDH活性,且随着发酵液浓度升高作用越强,SDH酶活性降低,从而导致TCA循环受阻,影响菌体正常的能量代谢,最终导致菌体细胞生长受阻。

|
| 图 8 Pseudomonas sp. YL11无菌发酵液处理对P. expansum SDH活性的影响 Figure 8 Effects of Pseudomonas sp. YL11's cell-free fermentation filtrate on the activity of SDH of P. expansum |
|
|
ATPase是一类能将三磷酸腺苷(ATP)催化水解为二磷酸腺苷(ADP)和磷酸根离子的酶,ATP酶的活性与P. expansum的能量代谢关系密切,因此本试验测定了不同浓度的Pseudomonas sp. YL11发酵液对P. expansum的ATP酶活性的影响。由图 9可知,在42 h内,处理组ATPase总体大致呈现先下降再上升再下降的趋势,推测微生物菌体在外加不利的环境下积极做出反应,通过信号传输导致自身保护酶系统的改变来抵御外界不利环境的影响,进而维持细胞活动。与对照组相比,3种处理后菌体中ATP酶活性显著降低,且在6 h时,100%无菌发酵液处理对ATPase影响最大,酶活约为对照组的48.6%。12 h后各处理组菌体ATPase活性有一定恢复,其中80%和90%无菌发酵液处理组最为明显,在24 h达到最大值。24 h后由于受到活性成分的作用ATPase活性持续下降。总体来说100%发酵液处理时P. expansum中的ATP酶活性最低,从而说明100%的发酵液对P. expansum内的ATP酶活性有较好的抑制效果。

|
| 图 9 Pseudomonas sp. YL11无菌发酵液对P. expansum总ATP酶活性的影响 Figure 9 Effects of Pseudomonas sp. YL11's cell-free fermentation filtrate on the activity of ATPase of P. expansum |
|
|
ATP与物质和能量代谢、能量的释放、贮存和利用都有关。用不同浓度Pseudomonas sp. YL11发酵液处理P. expansum,检测菌体中ATP含量,从而可以分析Pseudomonas sp. YL11发酵液对P. expansum能量代谢的直接影响。由图 10可知,在起始的6 h内3种处理均使菌体中ATP的含量剧烈下降。分析原因,有可能是P. expansum菌液进入新培养基中后迅速生长繁殖,导致ATP被大量消耗。然而在6−12 h,菌体中ATP含量呈现增长趋势,其中以CK的增长幅度最大;同时图 10中数据还表明,随着Pseudomonas sp. YL11发酵液浓度的增加,ATP含量恢复依次放缓,说明在该阶段Pseudomonas sp. YL11发酵液影响ATP的合成,且体积分数为100%发酵液处理影响最显著。24 h以后,各处理的菌体ATP含量变化相对平缓且呈逐渐下降趋势。表明不同浓度的发酵液通过降低ATP含量来影响P. expansum的能量代谢。
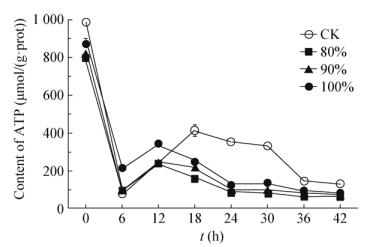
|
| 图 10 Pseudomonas sp. YL11无菌发酵液处理对P. expansum ATP含量的影响 Figure 10 Effects of Pseudomonas sp. YL11's cell-free fermentation filtrate on the content of ATP in P. expansum |
|
|
扩展青霉可导致多种水果腐败变质,苹果青霉病是苹果的一种重要果实病害,给苹果的生产和贮存带来很大的经济损失。以拮抗微生物为基础的生物防治,已经成为人们赖以减小化学农药残留危害的重要手段。近年来用于防治植物病害的生防菌主要有假单胞菌、芽胞杆菌、肠杆菌、链霉菌、微球菌等,其中假单胞菌是最具有利用价值的菌种之一[17]。假单胞菌是植物根际最普遍的微生物类群,具有分布广、种类多、竞争定殖能力强、抗菌谱广等特点[18]。目前,已报道假单胞菌对纹枯病菌、稻瘟病、鞘腐病、棉花枯萎病等多种植物病原菌具有抑制作用[19],而假单胞菌用于防治扩展青霉引起的苹果青霉病的研究鲜有报道。本文以前期分离获得的一株有拮抗作用的Pseudomonas sp. YL11为研究对象[10],系统研究拮抗菌Pseudomonas sp. YL11发酵液对苹果青霉病病原菌扩展青霉的抑制作用。结果表明:Pseudomonas sp. YL11无菌发酵液对扩展青霉菌丝和孢子萌发均有强烈的抑制作用,造成菌丝生长畸形、产孢能力降低。且随着发酵液浓度的增大,抑菌作用逐渐增强。经Pseudomonas sp. YL11无菌发酵液处理后,对苹果损伤接种扩展青霉病斑直径的扩展有了显著的抑制作用,在3 d时,抑制作用最强,抑制率达到47.1%,在9 d时,空白对照苹果已经腐烂,无菌发酵液处理的抑制率仍然为26.6%,表明其对苹果青霉病的生物防治具有潜在的应用价值。
大量研究表明,假单胞菌的生防作用机制包括抗生作用、嗜铁素对铁的营养竞争、生态位竞争、诱导植物抗性和分泌胞外水解酶、产生HCN等抑菌代谢产物等[18-19]。其中荧光性假单胞菌的抗病机理主要是分泌一种或几种抗生素来抑制植物病原菌的生长,如:吩嗪-1-羧酸、2, 4-二乙酰藤黄酚、藤黄绿脓菌素、硝吡咯菌素等[19]。本实验中无菌发酵液具有抑菌效果,既可以抑制扩展青霉菌丝生长,又能抑制孢子萌发,由此推断Pseudomonas sp. YL11是通过分泌某种抑菌活性物质来抑制扩展青霉。另外不同体积分数无菌发酵液对病原菌丝孢子的抑制实验表明,无菌发酵液浓度越大,抑制效果越明显,进一步说明了拮抗菌对扩展青霉的抑制活性与其产生的抑菌活性物质的量成正相关。张紊玮等研究发现Pseudomonas sp. YL11无菌发酵液对马铃薯干腐病致病菌硫色镰刀菌菌丝生长和孢子萌发均有抑制作用,抑制作用随发酵液浓度增加而增大,Pseudomonas sp. YL11对F. solani、T. roseum和A. niger也具有一定拮抗作用[10]。结合本文拮抗性实验,表明Pseudomonas sp. YL11的次级代谢产物可能产生其中的某几种抗生素而抑制植物病原菌的生长,从而起到拮抗多种植物病害的作用。
细胞膜的完整性是菌体正常生长代谢的一个主要影响因素。核酸、蛋白质等大分子物质贯穿于整个细胞膜和细胞质中,是维持生命活动最重要的物质。本实验中扩展青霉经Pseudomonas sp. YL11无菌发酵液处理后,导致细胞外电导率、核酸和蛋白质含量、AKP含量均增大,表明扩展青霉细胞壁和细胞膜的完整性遭到破坏,渗透性增大,引起胞内核酸、蛋白质外泄,从而影响菌体正常生长。上述结果与马利平等研究报道的枯草芽孢杆菌B96-Ⅱ会增加细胞膜的通透性,造成蛋白质、糖类等内容物的渗漏,导致膜受损结果一致,使细胞膜正常有序的代谢发生紊乱,最终致使菌体生长受阻[20]。此外,琥珀酸脱氢酶(SDH)在真核生物中结合于线粒体内膜,是连接氧化磷酸化与电子传递的枢纽之一,为呼吸链提供电子,是线粒体的一种标志酶。ATP酶是生物膜上的一种蛋白酶,在物质运输、能量转换及信息传递方面发挥重要作用。经Pseudomonas sp. YL11无菌发酵液处理后,SDH、ATP酶和ATP含量进一步降低,表明进而影响到能量代谢,最终导致菌体死亡。这与黄现青等[21]研究报道的枯草芽孢杆菌fmbJ代谢产物会降低点青霉SDH活性,以及李冲伟等[22]发现木霉发酵产物严重影响ATPase酶活结果相一致,都是通过影响能量代谢及生物合成从而抑制了菌体的生长。课题组在后期还将研究Pseudomonas sp. YL11抗菌活性物质的分离纯化与鉴定及安全性评价,同时还将研究Pseudomonas sp. YL11对梨等其他水果青霉病的防控效果,进而实行田间应用,以期开发一种高效杀菌、环境友好型的微生物菌剂。
| [1] |
Zhang YN, Wang YX, Luo YB, et al. The occurrence rule and control measures of apple fruit blue mould rot[J]. Food Science and Technology, 2015, 40(10): 246-251. (in Chinese) 张亚楠, 王云香, 罗云波, 等. 苹果青霉病发病规律与防治措施[J]. 食品科技, 2015, 40(10): 246-251. |
| [2] |
Zhang YL, Zhang B, Tian SH, et al. Distribution detection of Penicillium sp. in apple tissues[J]. Shandong Agricultural Sciences, 2015, 47(4): 103-105. (in Chinese) 张悦丽, 张博, 田淑慧, 等. 苹果青霉病菌在苹果组织中的分布检测[J]. 山东农业科学, 2015, 47(4): 103-105. |
| [3] |
Fu RM, Xing WH, Gu YN, et al. Isolation and identification of antagonistic bacteria against postharvest blue mold decay of apple and its mutation by low energy N+ implantation[J]. Northern Horticulture, 2015(21): 116-120. (in Chinese) 付瑞敏, 邢文会, 谷亚楠, 等. 苹果采后青霉病拮抗菌株的分离、鉴定和低能N+注入诱变[J]. 北方园艺, 2015(21): 116-120. |
| [4] |
Liu ZY, Zhang HY, Chen KP. Review on improving the biological control efficacity of postharvest fruits with antagonistic yeast cultivated with culture added elicitors[J]. Science and Technology of Food Industry, 2012, 33(4): 450-453, 457. (in Chinese) 刘周阳, 张红印, 陈克平. 激发子诱导培养提高拮抗酵母对水果采后病害生防效力的研究进展[J]. 食品工业科技, 2012, 33(4): 450-453, 457. |
| [5] |
Zhao WY. Control effect of yeast antagonist on post-harvest blue mold of apple[J]. Journal of Anhui Agricultural Sciences, 2011, 39(5): 2676-2677. (in Chinese) 赵文亚. 拮抗酵母菌对苹果采后青霉病的防治效果[J]. 安徽农业科学, 2011, 39(5): 2676-2677. DOI:10.3969/j.issn.0517-6611.2011.05.061 |
| [6] |
Chen F, Yun JM, Ai DY, et al. Screening of bacterial strain against Penicillium expansum and isolating of its antibacterial compounds[J]. Science and Technology of Food Industry, 2014, 35(9): 160-164. (in Chinese) 陈芳, 贠建民, 艾对元, 等. 拮抗扩展青霉菌株的筛选及其抗菌活性物质分离[J]. 食品工业科技, 2014, 35(9): 160-164. |
| [7] |
Fu RM, Xing WH, Zhang H, et al. Breeding of antagonistic bacteria against Penicillium expansum and study on its inhibition mechanism[J]. Science and Technology of Food Industry, 2016, 37(5): 154-158. (in Chinese) 付瑞敏, 邢文会, 张红, 等. 扩展青霉拮抗菌的选育及抑菌机制初探[J]. 食品工业科技, 2016, 37(5): 154-158. |
| [8] |
Li RP, Zhang HY, Liu WM, et al. Biocontrol of postharvest gray and blue mold decay of apples with Rhodotorula mucilaginosa and possible mechanisms of action[J]. International Journal of Food Microbiology, 2011, 146(2): 151-156. DOI:10.1016/j.ijfoodmicro.2011.02.015 |
| [9] |
Cai MX, Zhou YH, Zhang HY, et al. Effect and possible modes of action of Candida oleophila on controlling Penicillium expansum in apples[J]. Food Science, 2018, 39(5): 265-271. (in Chinese) 蔡孟轩, 周雅涵, 张鸿雁, 等. 橄榄假丝酵母控制苹果果实青霉病的效果及机制[J]. 食品科学, 2018, 39(5): 265-271. |
| [10] |
Zhang WW, Wang YL, Bi Y, et al. Screening and identification of an antagonistic strain against potato dry rot[J]. Microbiology China, 2018, 45(8): 1726-1736. (in Chinese) 张紊玮, 王艳玲, 毕阳, 等. 一株马铃薯干腐病拮抗菌的筛选、鉴定及其生物防效[J]. 微生物学通报, 2018, 45(8): 1726-1736. |
| [11] |
Niu LL, Bi Y, Zhang SG, et al. Comparison of inhibitory effect of sodium silicate at different concentrations and corresponding pH on Trichothecium roseum in vitro and in vivo[J]. Science and Technology of Food Industry, 2015, 36(13): 157-161. (in Chinese) 牛黎莉, 毕阳, 张盛贵, 等. 体内和体外条件下不同浓度硅酸钠和对应pH抑制粉红单端孢(Trichothecium roseum)效果比较[J]. 食品工业科技, 2015, 36(13): 157-161. |
| [12] |
Liu Q, Zhang XL, Fan SY. Preliminary research on antifungal effect of extracts from garland chrysanthemum on watermelon blight[J]. Northern Horticulture, 2016(14): 114-118. (in Chinese) 刘琼, 张新龙, 范淑英. 茼蒿提取物对西瓜枯萎病病菌抑制效果的初步研究[J]. 北方园艺, 2016(14): 114-118. |
| [13] |
Bai XD, Niu LL, Bi Y, et al. 18 kinds of salt on apple of core rot control and part of the mechanism[J]. Science and Technology of Food Industry, 2015, 36(10): 335-338. (in Chinese) 白小东, 牛黎莉, 毕阳, 等. 18种盐对苹果霉心病的控制及部分机理[J]. 食品工业科技, 2015, 36(10): 335-338. |
| [14] |
Gao XY. Studies on the mechanism of a new antibiotic Wanlongmycin against Phytophthora melonis[D]. Guangzhou: Doctoral Dissertation of South China University of Technology, 2005 (in Chinese) 高向阳.新抗生素万隆霉素对黄瓜疫病菌的作用机理研究[D].广州: 华南理工大学博士学位论文, 2005 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y787081 |
| [15] |
Chen CJ, Ning XB. Characteristics of the sublethal injured and resuscitative Vibrio parahaemolyticus[J]. Science and Technology of Food Industry, 2013, 34(14): 160-165. (in Chinese) 陈婵娟, 宁喜斌. 亚致死热损伤和复苏状态的副溶血性弧菌特性[J]. 食品工业科技, 2013, 34(14): 160-165. |
| [16] |
Huang WY, Cao W, Li J, et al. Determination of protein content in juice by coomassie brilliant blue[J]. Food and Fermentation Industries, 2009, 35(5): 160-162. (in Chinese) 黄婉玉, 曹炜, 李菁, 等. 考马斯亮蓝法测定果汁中蛋白质的含量[J]. 食品与发酵工业, 2009, 35(5): 160-162. |
| [17] |
Yang GF, Wei YL. The research status and application prospect of Pseudomonas[J]. Biotechnology Bulletin, 2011(1): 37-39, 49. (in Chinese) 杨光富, 魏云林. 假单胞菌研究现状及应用前景[J]. 生物技术通报, 2011(1): 37-39, 49. |
| [18] |
Zuo J, Liao XL. Study progress on plant fungal diseases prevention by Pseudomonas spp.[J]. Modern Agricultural Science and Technology, 2011(22): 164-165, 167. (in Chinese) 左静, 廖晓兰. 应用假单胞菌防治植物真菌性病害研究进展[J]. 现代农业科技, 2011(22): 164-165, 167. DOI:10.3969/j.issn.1007-5739.2011.22.102 |
| [19] |
Zhang Y, Su P, Liu SQ, et al. Inhibition of antifungal Pseudomonas SU8 against several phytopathogenic fungi[J]. Agrochemicals, 2013, 52(12): 917-920. (in Chinese) 张亚, 苏品, 刘双清, 等. 拮抗假单胞菌SU8对几种植物病原真菌的抑制作用[J]. 农药, 2013, 52(12): 917-920. |
| [20] |
Ma LP, Hao BQ, Wang J, et al. Inhabitation of antagonistic bacterium B96-Ⅱ to Fusarium oxysporum f. sp. asparagi[J]. Chinese Journal of Applied & Environmental Biology, 2009, 15(6): 861-865. (in Chinese) 马利平, 郝变青, 王静, 等. 拮抗菌B96-Ⅱ对芦笋枯萎菌的抑菌作用[J]. 应用与环境生物学报, 2009, 15(6): 861-865. |
| [21] |
Huang XQ, Bie XM, Lü FX, et al. Inhibitory effect of lipopeptides from Bacillus subtilis fmbJ on Penicillium notatum and its antisepsis to peach[J]. Transactions of the CSAE, 2008, 24(1): 263-267. (in Chinese) 黄现青, 别小妹, 吕凤霞, 等. 枯草芽孢杆菌fmbJ产脂肽抑制点青霉效果及其桃防腐试验[J]. 农业工程学报, 2008, 24(1): 263-267. DOI:10.3321/j.issn:1002-6819.2008.01.052 |
| [22] |
Li CW, Yang LB, Deng X, et al. Inhibiting effects and mechanism of Trichoderma strains to Cytospora chrysosperma[J]. Scientia Silvae Sinicae, 2012, 48(9): 88-94. (in Chinese) 李冲伟, 杨立斌, 邓勋, 等. 木霉菌株对金黄壳囊孢菌的抑菌效应及机制[J]. 林业科学, 2012, 48(9): 88-94. |
 2019, Vol. 46
2019, Vol. 46