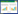扩展功能
文章信息
- 李雪艳, 张涛, 杨红梅, 楚敏, 高雁, 曾军, 霍向东, 张涛, 林青, 欧提库尔, 李玉国, 娄恺, 史应武
- LI Xue-Yan, ZHANG Tao, YANG Hong-Mei, CHU Min, GAO Yan, ZENG Jun, HUO Xiang-Dong, ZHANG Tao, LIN Qing, MAHEMUTI Outikuer, LI Yu-Guo, LOU Kai, SHI Ying-Wu
- 棉花黄萎病拮抗细菌产铁载体测定及其对抑菌活性的影响
- Determination of the siderophore produced by antagonistic cotton Verticillium wilt bacteria and its effect on antibacterial activity
- 微生物学通报, 2019, 46(5): 1074-1080
- Microbiology China, 2019, 46(5): 1074-1080
- DOI: 10.13344/j.microbiol.china.180448
-
文章历史
- 收稿日期: 2018-06-06
- 接受日期: 2018-09-10
- 网络首发日期: 2018-10-11
2. 新疆农业科学院微生物应用研究所 新疆 乌鲁木齐 830091
2. Institute of Microbiology, Xinjiang Academy of Agricultural Sciences, Urumqi, Xinjiang 830091, China
铁元素虽然在地壳中的含量占第4位,但土壤中的铁可溶性低,在新疆高盐碱地生理pH和有氧的条件下,Fe2+很容易被氧化为Fe3+,中性或碱性条件下形成稳定的不溶性的Fe(OH)3,导致环境中可利用的铁远远不能满足生物体的正常需求[1],缺铁与缺氮和缺磷并列,发生最为广泛,严重限制了植物的生长[2]。缺铁胁迫时,部分植物微生物分泌一种或者几种铁载体(Siderophore)从环境中获取铁离子[3],并且铁载体可作为铁源被微生物直接利用,有效促进植物生长。铁载体不仅供给植物铁营养,而且可通过与植物病原菌竞争铁营养达到生物防治的作用,大部分病原菌无分泌铁载体的能力或能力较低,与其他产铁载体微生物竞争铁营养的能力弱,产铁载体菌株表现出明显抑制植物病原微生物的效果[4-10]。探究棉花黄萎病拮抗细菌产铁载体测定及其对抑菌活性的影响,为拮抗细菌防治棉花黄萎病机制提供理论指导。因此对4株拮抗细菌研究其产铁能力有重要意义。目前国内外研究产铁载体的微生物有细菌、真菌、放线菌等,应用范围主要有修复重金属污染[11-12]、植物促生、农业生物防治、结合其他物质耐药抗菌[13]等。产铁载体的细菌以假单胞属居多[14],芽孢杆菌产铁载体的研究较少。本研究的4株拮抗菌均属于芽孢杆菌,其中Bacillus velezensis BHZ-29、Bacillus vanillea SMT-24菌株产铁载体能力及铁载体对棉花黄萎病的作用未见报道。本课题组已研究Bacillus velezensis BHZ-29、Bacillus atrophaeus SHZ-24、Bacillus subtilis SHT-15、Bacillus vanillea SMT-24 4株拮抗菌均能提高棉花生物量,降低棉花黄萎病致病指数,但防治机理尚不明确。通过检测、定量4株拮抗菌株产铁载体能力以及测量不同铁离子浓度处理的发酵无菌滤液的抑菌圈大小,确定铁载体是对大丽轮枝菌抑菌活性的影响。
1 材料与方法 1.1 菌株供试菌株来源:BHZ-29、SHZ-24菌株由本实验室分别从博乐、石河子棉株体内筛选;SHT-15、SMT-24均从石河子棉株种植根际土壤中分离所得。
大丽轮枝菌来源:由新疆农业科学院植物保护研究所刘海洋提供。
1.2 培养基PDA培养基、NA培养基、NB液体培养基、MKB液体培养基参考文献[15],MKB-CAS双层平板培养基[16]:上层为MKB固体培养基,下层为CAS检测培养基,CAS染液[17]加琼脂。
1.3 主要试剂和仪器刃天青,上海士锋科技有限公司;十六烷基三甲基溴化铵,天津市光复精细化工研究所;高氯酸亚铁水合物,阿法埃莎(中国)化学有限公司。紫外分光光度计,岛津自动化设备有限公司;高速冷冻离心机,Eppendorf公司;高压灭菌锅,北京市永光明医疗仪器厂。
1.4 菌株BHZ-29、SHZ-24、SHT-15、SMT-24产铁载体的检测方法 1.4.1 MKB发酵液的制备挑取NA培养基上划分的菌株BHZ-29、SHZ-24、SHT-15、SMT-24单菌落分别接种于MKB液体培养基,每500 mL瓶装液量为50 mL,30 ℃、200 r/min发酵培养2 d,按照5%的量转接入新的MKB液体培养基,分别培养1−6 d。
1.4.2 MKB-CAS固体平板定性检测挑取NA培养基上划分的单菌落接种于NB液体培养基,每500 mL瓶装液量50 mL,30 ℃、200 r/min发酵培养48 h,各取1 mL发酵液于1.5 mL的EP管中10 000 r/min离心10 min,保留菌体部分,灭菌蒸馏水洗涤菌体2次后重悬。竹签蘸取重悬菌液在MKB-CAS固体平板上划线,30 ℃恒温培养箱培养24 h,拍照记录结果。
1.4.3 铁载体类型鉴定取BHZ-29、SHZ-24、SHT-15、SMT-24菌株发酵4 d的MKB发酵液4 mL,10 000 r/min离心10 min保留上清液备用。参考文献[18-19],Arnow实验检验儿茶酚型铁载体:取4株拮抗细菌备用上清液各1 mL,依次加入1 mL 0.5 mol/L的HCl,1 mL钼酸盐溶液(NaNO2 10 g,Na2MoO4 10 g,蒸馏水定容至100 mL)后溶液变黄,加入1 mL 0.5 mol/L的NaOH,溶液由黄变红并保持15 min不变色,证明有儿茶酚型铁载体,对照组将蒸馏水代替拮抗细菌上清液,其余操作相同(CK1)。高氯酸铁试验检验异羟肟酸型铁载体:取4株拮抗菌备用上清液各0.5 mL,加入2.5 mL 5 mmol/L的高氯酸铁溶液,颜色变红则有异羟肟酸型铁载体,变黄则无,对照组将蒸馏水代替拮抗细菌上清液,其余操作相同(CK2)。
1.4.4 铁载体分泌曲线测定取10 000 r/min离心10 min的1 mL MKB发酵液上清液与1 mL CAS检测液混合,稀释定容至15 mL,反应1 h后在紫外可见分光光度计630 nm处测量吸光度值(As),以无菌的MKB发酵液作为参比值(Ar),分别定量菌株BHZ-29、SHZ-24、SHT-15、SMT-24发酵1−6 d的产铁量,铁载体活性单位[20-21]:Su (Siderophore unit)=[(Ar−As)/Ar]×100。
1.4.5 产铁载体能力判定拮抗菌株连续1−6 d发酵的吸光度值及参比值同1.4.4,依据文献[22],吸光度比值As/Ar每减少一个0.2增加一个“+”,对菌株产铁载体的能力进行划分,一般产铁载体能力较高(+++)的细菌其吸光度比值As/Ar低于0.5,分别对拮抗菌株BHZ-29、SHZ-24、SHT-15、SMT-24产铁能力进行划分。
1.5 低浓度铁离子处理的铁载体对大丽轮枝菌的作用将25 ℃、150 r/min发酵7 d的大丽轮枝菌(105 CFU/mL) 10−2倍稀释液涂布于PDA固体培养基,用6 mm的打孔器打5孔备用。通过铁离子浓度改变铁载体量,分别取培养4 d,含铁离子浓度为0、10、20 μmol/L的MKB发酵液,10 000 r/min离心10 min,0.22 μm滤膜过滤,各取无菌发酵液100 μL加入PDA孔中,25 ℃恒温培养箱培养4 d,统计3组处理的抑菌圈大小。以未离心的发酵液为阳性对照,未接菌的发酵MKB培养基为空白对照。
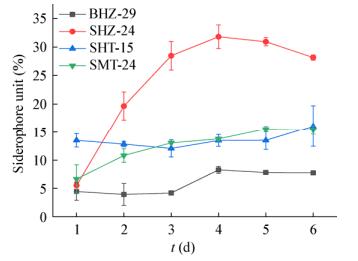
2 结果与分析 2.1 MKB-CAS双层平板检测产铁载体结果图 1A、B显示,菌株BHZ-29、SHZ-24、SHT-15、SMT-24在MKB-CAS培养基上生长良好,菌体周围出现明显的橙紫色显色反应,表明BHZ-29、SHZ-24、SHT-15、SMT-24均可产铁载体。

|
| 图 1 BHZ-29、SHZ-24、SHT-15、SMT-24菌株产铁载体MKB-CAS双层平板检测结果 Figure 1 Siderophore-producing assay results of BHZ-29, SHZ-24, SHT-15 and SMT-24 strains by MKB-CAS double-plate 注:字母a−d分别代表菌株BHZ-29、SHZ-24、SHT-15、SMT-24. Note: The letters a to d represent strain BHZ-29, SHZ-24, SHT-15 and SMT-24, respectively. |
|
|
图 2A Arnow实验结果显示,菌株BHZ-29、SHZ-24、SHT-15、SMT-24均出现一定程度变红现象且15 min内颜色无变化,表明4株拮抗菌均含有儿茶酚型铁载体。SHZ-24红色最深,儿茶酚型铁载体含量最高。图 2B高氯酸铁实验结果表明,4株拮抗菌反应颜色为黄色未变红,4株拮抗菌含异羟肟酸型铁载体为阴性。

|
| 图 2 儿茶酚型、异羟肟酸型铁载体检测结果 Figure 2 Test results of catechol and hydroxamic acid siderophores 注:1、8:SMT-24;2、5:SHZ-24;3、7:BHZ-29;4、6:SHT-15;CK1、CK2空白为对照. Note: 1, 8: Strain SMT-24; 2, 5: Strain SHZ-24; 3, 7: Strain BHZ-29; 4, 6: Strain SHT-15; CK1, CK2 are the blank control. |
|
|
由图 3可知,SHZ-24菌株产铁载体量明显高于BHZ-29、SHT-15、SMT-24菌株(第1天除外),菌株BHZ-29产铁载体量最少。从铁载体增长曲线看,不同菌株达到稳定铁载体量时间不同。菌株SHT-24铁载体量1−4 d期间逐渐增加,第4天铁载体量最高,第4−6天略有下降。菌株SHT-15 1−5 d铁载体量无明显变化,5−6 d呈现上升趋势。菌株SMT-24铁载体量1−5 d缓慢增长,5−6 d达到稳定量。BHZ-29菌株1−3 d铁载体量无明显变化,3−4 d略增长后达到稳定量。
|
| 图 3 BHZ-29、SHZ-24、SHT-15、SMT-24菌株发酵1−6 d产铁载体曲线 Figure 3 Siderophore-producing curve of BHZ-29, SHZ-24, SHT-15 and SMT-24 strains by fermentation 1−6 d |
|
|
由表 1可知,菌株BHZ-29吸光度值As/Ar比值最小为0.917±0.092,产铁能力弱,低于“+”等级。SHZ-24菌株As/Ar比值最小为0.682±0.021,产铁能力最高为“++”。菌株SHT-15与SMT-24 As/Ar比值最低分别为0.845±0.005、0.846±0.008,产铁能力均为“+”。
| Time (d) | As/Ar | 产铁载体能力Siderophore-producing capability | |||||||
| BHZ-29 | SHZ-24 | SHT-15 | SMT-24 | BHZ-29 | SHZ-24 | SHT-15 | SMT-24 | ||
| 1 | 0.956±0.015a | 0.945±0.006a | 0.865±0.012b | 0.933±0.025a | + | ||||
| 2 | 0.961±0.032a | 0.803±0.025c | 0.872±0.005b | 0.892±0.012b | + | + | + | ||
| 3 | 0.957±0.024a | 0.715±0.025c | 0.879±0.015b | 0.870±0.014b | + | + | + | ||
| 4 | 0.917±0.092a | 0.682±0.021c | 0.865±0.011b | 0.857±0.009b | ++ | + | + | ||
| 5 | 0.922±0.003a | 0.691±0.007d | 0.845±0.005c | 0.898±0.007b | ++ | + | + | ||
| 6 | 0.923±0.002a | 0.719±0.005d | 0.862±0.005b | 0.846±0.008c | ++ | + | + | ||
| 注:小写字母表示同天,不同菌株之间的差异性(P < 0.05). Note: Small letters indicate the differences between different strains on the same day (P < 0.05). |
|||||||||
图 4、图 5表明,具有拮抗大丽轮枝菌能力的4株菌株中,菌株SHZ-24、SMT-24、BHZ-29含铁量为0、10、20 μmol/L的滤液均无抑制大丽轮枝菌效果,菌株SHT-15 0、10、20 μmol/L含铁量的处理发酵滤液均出现明显的的抑菌圈现象;表明产铁能力As/Ar比值高于0.682时,菌株BHZ-29、SHZ-24、SMT-24含铁离子浓度0、10、20 μmol/L 3组处理发酵无菌滤液对抑菌活性无影响,菌株SHT-15 3组处理对抑菌活性有影响,各处理间抑菌活性差异不显著。
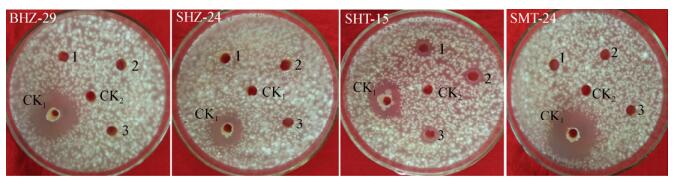
|
| 图 4 低浓度铁离子处理的铁载体滤液对大丽轮枝菌的抑菌作用结果 Figure 4 Inhibitory effect of siderophore treated with low concentration iron ions on Verticillium dahliae 注:CK1为阳性对照,CK2菌株空白对照,1、2、3分别表示含铁离子浓度为0、10、20 μmol/L. Note: CK1 is positive control and CK2 strain is blank control. 1, 2, and 3 indicate iron ion concentrations of 0, 10 and 20 μmol/L, respectively. |
|
|

|
| 图 5 各处理抑菌圈大小统计图 Figure 5 Statistics of the inhibition zone diameter of each treatmente 注:小写字母代表同种菌株不同处理之间差异显著(P < 0.05). Note: Small letters represent significant differences between different treatments of the same strain (P < 0.05). |
|
|
铁载体检测方法有Arnow法、通用CAS检测法、630 nm处的相对吸光度法、薄层色谱、高压液相色谱法等[23],其中通用CAS法使用最为广泛,该方法操作简单、方便、可检测多类铁载体、适用于铁载体的初步检测,但CAS培养基中十六烷基三甲基溴化铵(HDTMA)与菌体直接接触,抑制菌体生长,显色时间长。而改良的CAS双层平板法能够避免十六烷基三甲基溴化铵与菌体直接接触,本研究采用MKB-CAS双层平板检测,菌株生长良好,24 h即可显色。
众多研究表明铁载体对多种病原菌起到抑制作用,林天兴等选用产铁载体能力As/Ar为0.017的SS05菌株,其上清液对棉花枯萎病病原真菌有抑制作用[7],陈伟等报道中HMGY6B菌株产铁载体能力As/Ar为0.23,且随着铁离子浓度的增加,对灰霉病抑菌作用逐渐减弱[24],韩松等报道产铁载体能力As/Ar约为0.2,铁载体上清液抑制尖孢镰刀菌生长[25],前人研究产铁载体能力As/Ar均低于0.5,铁载体对多种病原菌起到抑制作用,产铁载体能力达多少时无抑菌效果未明确提出,本研究产铁载体能力As/Ar高于0.682,对棉花黄萎病致病菌大丽轮枝菌抑制效果不明显,为前人研究做了补充。铁载体应用范围广泛,除抑制致病菌外,在植物促生、植物修复污染环境等方面起到关键作用,4株拮抗菌仍具有应用价值潜力,可为铁载体的研究与应用提供菌株来源。
铁载体与植物病原微生物争夺有限的铁营养抑制病原微生物生长是拮抗菌防治棉花黄萎病的机理之一,在生物防治中具有重要的意义,本研究菌株SHT-15 3组处理抑菌效果无差异性,说明SHT-15产生的抑制现象可能是受铁离子影响不显著或者是不受铁离子影响的抑菌物质产生的,具体是什么物质有待进一步研究。
| [1] |
Jia K, Guo CH. Progress on the iron transport within higher plants[J]. Genomics and Applied Biology, 2010, 29(6): 1152-1158. (in Chinese) 贾凯, 郭长虹. 高等植物体内铁运输机制研究进展[J]. 基因组学与应用生物学, 2010, 29(6): 1152-1158. DOI:10.3969/gab.029.001152 |
| [2] |
Deng LW, Zhang LY, Ma JT, et al. Research progress on the iron uptake of strategy Ⅰ plant and iron sensors to iron deficiency[J]. Heilongjiang Agricultural Sciences, 2015(9): 140-146. (in Chinese) 邓凌韦, 张丽艳, 马军韬, 等. 机理Ⅰ植物根系铁吸收及缺铁感应信号研究进展[J]. 黑龙江农业科学, 2015(9): 140-146. |
| [3] |
Saha M, Sarkar S, Sarkar B, et al. Microbial siderophores and their potential applications: a review[J]. Environmental Science and Pollution Research, 2016, 23(5): 3984-3999. DOI:10.1007/s11356-015-4294-0 |
| [4] |
Sasirekha B, Srividya S. Siderophore production by Pseudomonas aeruginosa FP6, a biocontrol strain for Rhizoctonia solani and Colletotrichum gloeosporioides causing diseases in chilli[J]. Agriculture and Natural Resources, 2016, 50(4): 250-256. DOI:10.1016/j.anres.2016.02.003 |
| [5] |
Farina R, Beneduzi A, Ambrosini A, et al. Diversity of plant growth-promoting rhizobacteria communities associated with the stages of canola growth[J]. Applied Soil Ecology, 2012, 55: 44-52. DOI:10.1016/j.apsoil.2011.12.011 |
| [6] |
Rana A, Joshi M, Prasanna R, et al. Biofortification of wheat through inoculation of plant growth promoting rhizobacteria and cyanobacteria[J]. European Journal of Soil Biology, 2012, 50: 118-126. DOI:10.1016/j.ejsobi.2012.01.005 |
| [7] |
Lin TX, Tang M, Huang MY, et al. Screening and identification of a high yield sideropho-res-producing bacteria SS05 isolated from cotton soil[J]. Microbiology China, 2012, 39(5): 668-676. (in Chinese) 林天兴, 唐梅, 黄明远, 等. 高产铁载体棉田土壤细菌SS05的筛选与鉴定[J]. 微生物学通报, 2012, 39(5): 668-676. |
| [8] |
Couillerot O, Prigent-Combaret C, Caballero-Mellado J, et al. Pseudomonas fluorescens and closely-related fluorescent pseudomonads as biocontrol agents of soil-borne phytopathogens[J]. Letters in Applied Microbiology, 2009, 48(5): 505-512. DOI:10.1111/lam.2009.48.issue-5 |
| [9] |
Chaiharn M, Chunhaleuchanon S, Lumyong S. Screening siderophore producing bacteria as potential biological control agent for fungal rice pathogens in thailand[J]. World Journal of Microbiology and Biotechnology, 2009, 25(11): 1919-1928. DOI:10.1007/s11274-009-0090-7 |
| [10] |
Sayyed RZ, Chincholkar SB. Siderophore-producing Alcaligenes feacalis exhibited more biocontrol potential Vis-à-Vis chemical fungicide[J]. Current Microbiology, 2009, 58(1): 47-51. DOI:10.1007/s00284-008-9264-z |
| [11] |
Zeng JH, Li YY, Ruan DS, et al. Phytoremediation of heavy metal contaminated soils by plant growth-promoting rhizobacteria and arbuscular mycorrhizal fungi[J]. Microbiology China, 2017, 44(5): 1214-1221. (in Chinese) 曾加会, 李元媛, 阮迪申, 等. 植物根际促生菌及丛枝菌根真菌协助植物修复重金属污染土壤的机制[J]. 微生物学通报, 2017, 44(5): 1214-1221. |
| [12] |
Liu X, Fu JW, Da Silva E, et al. Microbial siderophores and root exudates enhanced goethite dissolution and Fe/As uptake by As-hyperaccumulator Pteris vittata[J]. Environmental Pollution, 2017, 223: 230-237. DOI:10.1016/j.envpol.2017.01.016 |
| [13] |
Lamb AL. Breaking a pathogen's iron will: inhibiting siderophore production as an antimicrobial strategy[J]. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, 2015, 1854(8): 1054-1070. DOI:10.1016/j.bbapap.2015.05.001 |
| [14] |
Pan XX, Peng JH, Liu XB, et al. Isolation and identification of a strain of endogenous antagonist bacteria from banana[J]. Tropical Agricultural Engineering, 2009, 33(4): 4-8. (in Chinese) 潘羡心, 彭建华, 刘先宝, 等. 一株产铁载体香蕉拮抗内生细菌的分离及鉴定[J]. 热带农业工程, 2009, 33(4): 4-8. |
| [15] |
Long YC, Chen X, Zhou SQ. Isolation, identification and assessment on selenium biofortification of siderophore-producing rhizobacteria[J]. Current Biotechnology, 2017, 7(5): 402-408. (in Chinese) 龙云川, 陈轩, 周少奇. 高产铁载体根际菌的筛选鉴定及硒活化特性评价[J]. 生物技术进展, 2017, 7(5): 402-408. |
| [16] |
Yang CE, Lu YL, Ni HC, et al. Screening of siderophore- producing vibrio vulnificus and optimization of induction conditions using response surface methodology[J]. Science and Technology of Food Industry, 2017, 38(3): 159-165. (in Chinese) 杨常娥, 鲁艳莉, 倪捍成, 等. 创伤弧菌产铁载体菌株的筛选及其诱导条件的响应面优化[J]. 食品工业科技, 2017, 38(3): 159-165. |
| [17] |
Rong LY, Yao T, Zhao GQ, et al. Screening of siderophore- producing PGPR bacteria and their antagonism against the pathogens[J]. Plant Protection, 2011, 37(1): 59-64. (in Chinese) 荣良燕, 姚拓, 赵桂琴, 等. 产铁载体PGPR菌筛选及其对病原菌的拮抗作用[J]. 植物保护, 2011, 37(1): 59-64. DOI:10.3969/j.issn.0529-1542.2011.01.012 |
| [18] |
Sun M. ARTP selection of high siderophore productions trains and preliminary analysis on mechanism of the siderophore improving[D]. Wuxi: Master's Thesis of Jiangnan University, 2017 (in Chinese) 孙萌.铁载体高产菌株的ARTP选育及其铁载体产量提高机理的初步分析[D].无锡: 江南大学硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10295-1017272857.htm |
| [19] |
Shenker M, Oliver I, Helmann M, et al. Utilization by tomatoes of iron mediated by a siderophore produced by Rhizopus arrhizus[J]. Journal of Plant Nutrition, 1992, 15(10): 2173-2182. DOI:10.1080/01904169209364466 |
| [20] |
Schwyn B, Neilands JB. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56. |
| [21] |
Yoshida T, Hayashi KI, Ohmoto H. Dissolution of iron hydroxides by marine bacterial siderophore[J]. Chemical Geology, 2002, 184(1/2): 1-9. |
| [22] |
Payne SM. Detection, isolation, and characterization of siderophores[J]. Methods in Enzymology, 1994, 235: 329-344. DOI:10.1016/0076-6879(94)35151-1 |
| [23] |
Chen SX. Detection methods on siderophores from bacteria[J]. Journal of Honghe University, 2005, 3(6): 16-18. (in Chinese) 陈绍兴. 细菌铁载体检测方法[J]. 红河学院学报, 2005, 3(6): 16-18. DOI:10.3969/j.issn.1008-9128.2005.06.006 |
| [24] |
Chen W, Wang XL, Fu W, et al. Screening, identification and antagonistic against the pathogens of a siderophore-producing bacteria HMGY6B from rhizosphere of ryegrass[J]. Microbiology China, 2016, 43(10): 2207-2215. (in Chinese) 陈伟, 王小利, 付薇, 等. 黑麦草根际产铁载体细菌HMGY6B的筛选鉴定及对病原菌的拮抗作用[J]. 微生物学通报, 2016, 43(10): 2207-2215. |
| [25] |
Han S, Zhang SC, Huang XY, et al. Antagonism of a siderophore-producing entophytic Bacteria on Fusarium oxysporum[J]. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(5): 1039-1044. (in Chinese) 韩松, 张守村, 黄晓艳, 等. 一株产铁载体内生细菌对尖孢镰刀菌的拮抗作用[J]. 西北植物学报, 2011, 31(5): 1039-1044. |
 2019, Vol. 46
2019, Vol. 46