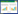扩展功能
文章信息
- 王彦, 牛世全, 郑豆豆, 周璇, 朱学泰, 孔维宝, 韩建山, 张爱梅
- WANG Yan, NIU Shi-Quan, ZHENG Dou-Dou, ZHOU Xuan, ZHU Xue-Tai, KONG Wei-Bao, HAN Jian-Shan, ZHANG Ai-Mei
- 黄瓜枯萎病拮抗放线菌的筛选、鉴定及发酵条件优化
- Screening, identification and optimization of fermentation conditions of an antagonistic actinomycetes to cucumber Fusarium wilt
- 微生物学通报, 2019, 46(5): 1062-1073
- Microbiology China, 2019, 46(5): 1062-1073
- DOI: 10.13344/j.microbiol.china.180428
-
文章历史
- 收稿日期: 2018-05-30
- 接受日期: 2018-08-10
- 网络首发日期: 2018-09-29
黄瓜是一种世界性的蔬菜,仅我国每年黄瓜的种植面积就达125.3万hm2[1]。近年来,由于黄瓜的大面积种植加之管理不当等因素,致使枯萎病大肆蔓延,严重限制了黄瓜的产量,造成巨大的经济损失,成为黄瓜种植业持续发展的主要制约因素。因此,探寻一种有效防治黄瓜枯萎病的方法对农业生产具有重要的意义。
黄瓜枯萎病是由黄瓜专化型尖孢镰刀菌(Fusarium oxysporum f. sp. cucumerinum)引起的土传真菌性病害[2],可存在于黄瓜生长的整个周期中,对世界各地的黄瓜生产造成严重的威胁[3]。目前,该病主要是化学防治,再配合轮作、倒茬等简单的农业防治。长期使用化学农药不仅使病原菌产生抗性,而且对环境造成污染,降低黄瓜品质,影响人体健康[4]。生物防治具有无污染,不致病原菌产生抗药性的特点,同时还可保证黄瓜的品质等诸多优点,已逐渐成为植物病害防治的研究热点[5]。放线菌广泛分布于自然界中,具有丰富的代谢产物,其产生的活性物质对细菌和真菌性病害具有较好的防治效果,被广泛的应用于医药、农业等各个领域[6]。
河西走廊位于甘肃省西北部,降水量少,气温变化大,水分蒸发量大,土壤盐渍化程度比较严重,属于典型的盐碱环境。本课题组已对河西走廊盐碱土壤中的放线菌资源进行了大量研究,该研究在前期研究的基础上,以敦煌地区土壤为试样材料,分离筛选得到一株对黄瓜枯萎病菌有较好拮抗效果的放线菌菌株,测定菌株促生特性,探究分类地位,优化发酵配方和条件,以期为黄瓜枯萎病的防治提供一条新途径。
1 材料与方法 1.1 材料 1.1.1 供试土样采自河西走廊敦煌地区盐碱土壤,利用五点采样法,去除地表土壤,取深度约为5 cm−20 cm的土壤装入无菌自封袋,带回实验室于4 ℃冷藏备用。土样基本信息见表 1。
| 土壤类型 Soil type |
编号 Plot No. |
采样点 Site |
海拔 Altitude (m) |
经度 Longitude (°) |
纬度 Latitude (°) |
pH |
| Oasis | 17 | Mengjiaqiao village | 1 115 | 40 | 94 | 9.1 |
| Gobi | 4 | Westlake Wetland | 1 316 | 40 | 94 | 9.1 |
| Gobi | 16 | Qili town | 1 154 | 40 | 94 | 9.3 |
| Transition zone | 5 | Yangguan town | 1 297 | 39 | 94 | 9.1 |
| Desert | 9 | Danghe reservoir | 1 439 | 39 | 94 | 9.7 |
| Desert | 18 | Mengjiaqiao village | 1 110 | 40 | 94 | 9.8 |
高氏Ⅰ号培养基(加0.05 g/L的重铬酸钾抑制细菌和真菌的生长[7]),PDA培养基,小米浸液培养基[8],酵母膏麦芽膏琼脂培养基[9],察氏琼脂培养基[9],葡萄糖天门冬素琼脂培养基[9],燕麦粉琼脂培养基[9],伊莫松琼脂培养基[9],克氏Ⅰ号琼脂培养基[9],CAS检测平板[10],SA培养基[10],King培养基[11],孟金娜无机解磷培养基[12]。
1.1.3 主要试剂和仪器Taq酶,TaKaRa公司;A19和S20,华大基因;色氨酸,天津光复精细化工研究所;铬天青,Solarbio公司;L-抗坏血酸,天津致远化学试剂有限公司;其他试剂均为分析纯试剂。
电热恒温培养箱,上海博迅实业有限公司医疗设备厂;离心机,驭锘实业(上海)有限公司;大容量恒温振荡器,江苏太仓市实验设备厂;可见分光光度计,上海元析仪器有限公司。
1.1.4 供试菌株黄瓜枯萎病菌(Fusarium oxysporum f. sp. cucumerinum),由甘肃省农业科学院提供;油菜立枯丝核菌(Rhizoctonia solani)、马铃薯茄链格孢菌(Alternaria solani)、茄腐镰刀菌(Fusarium solani)、尖孢镰刀菌(Fusarium oxysporum)和黑腐皮壳菌(Valsa mali),均由本实验室保存。
1.2 土壤放线菌的分离纯化土壤放线菌的分离纯化采用稀释涂布法[13]。无菌操作,称取5 g土样置于45 mL的无菌水中振荡20 min,利用十倍稀释法分别制成10−2、10−3和10−4梯度的悬液,然后取200 μL悬液涂布于无菌平板。28 ℃培养7 d后,挑取单菌落并进行划线纯化培养,数次纯化后得到的纯菌株保藏于斜面培养基中,置于4 ℃冷柜中备用。
1.3 拮抗放线菌的筛选 1.3.1 拮抗放线菌的初筛初筛采用平板对峙法[14]。无菌操作,在PDA平板的“十”字两端等距离(2.5 cm)处以及中心点处作好标记,中心点处放置倒置的黄瓜枯萎病菌菌饼(d=8 mm),另外任意3处则放置倒置的放线菌菌饼(d=8 mm),其中以不放置放线菌菌饼作为对照试验(每组试验3个重复)。28 ℃恒温培养箱中培养,待对照组的黄瓜枯萎病病原菌的菌丝体铺满整个平板时,测量试验组抑菌带,计算抑菌率。计算公式为:

|
对初筛试验中效果较好(抑菌率 > 60%)的拮抗菌进行复筛。将菌悬液1 mL (1×105 CFU/mL)接种于高氏Ⅰ号液体培养基中制备种子液,28 ℃、160 r/min振荡培养24 h后将种子液按10%的接种量接入小米浸液培养基,在上述条件下培养4 d,10 000 r/min离心10 min用0.22 μm的微孔滤膜过滤其上清液,得无菌发酵滤液。
用抑制菌丝生长速率法[15]测定拮抗放线菌的抑菌率。取45 mL冷却至45 ℃左右的PDA培养基与5 mL的无菌发酵滤液混匀制成带药平板,中间接种病原菌菌饼(d=8 mm),以不加发酵滤液的PDA平板为对照。28 ℃培养6 d,用十字交叉法测其生长直径,计算其抑菌率。计算公式为:

|
菌株分泌铁载体的定性测定[10],取其菌饼(d=8 mm)接种于CAS检测平板中央,28 ℃培养7−14 d,观察有无橙黄色晕圈。定量测定[10],取菌悬液1 mL (1×105 CFU/mL)接种于50/250 mL SA液体培养基中,28 ℃、160 r/min振荡培养5 d,10 000 r/min离心10 min,取上清液2 mL与2 mL的CAS检测液混匀静置1 h后,测定OD630 (As)。取双蒸水进行对照调零,以未接种的SA液体培养基的吸光值作为参比值(Ar),计算铁载体活性单位=[(Ar−As)/Ar]×100。
1.4.2 菌株分泌吲哚乙酸(Indole-3-acetic acid,IAA)能力的测定菌株分泌IAA的定性测定[11],将菌株接种于King培养基中,28 ℃、160 r/min振荡培养5 d。10 000 r/min离心10 min,取上清液1 mL与2 mL的Salkowski试剂混匀,黑暗培养20 min后呈现粉红色即有IAA的产生。定量测定[11],取105的菌悬液1 mL接种于50/250 mL King培养基中,28 ℃、160 r/min振荡培养5 d,10 000 r/min离心10 min,取上清液1 mL与2 mL的Salkowski试剂混匀,黑暗培养20 min后测定OD530,计算IAA含量。
1.4.3 菌株溶磷能力的测定菌株溶磷能力的定性测定[12],取其菌饼(d=8 mm)接种于孟金娜无机解磷培养基平板中央,28 ℃培养7−14 d,观察有无溶磷圈。定量测定[12],取菌悬液1 mL (1×105 CFU/mL)接种于50/250 mL孟金娜无机解磷液体培养基中,28 ℃、160 r/min振荡培养5 d,10 000 r/min离心10 min,取上清液2 mL,采用钼锑抗比色法测定OD700,计算溶磷量。
1.5 拮抗放线菌的鉴定 1.5.1 形态特征与培养特征高氏Ⅰ号培养基上划线培养,观察其气生菌丝、基内菌丝颜色及有无可溶性色素。插片法观察其孢子的有无及菌丝的形态特征。采用Shirling等[16]的方法,选取8种不同的鉴别培养基,28 ℃培养7−14 d后观察气生菌丝、基内菌丝颜色、可溶性色素的有无及生长状况。
1.5.2 生理生化试验参照《链霉菌属鉴定手册》和《放线菌系统学》等的方法[9, 17]。
1.5.3 分子生物学鉴定将拮抗放线菌接种于高氏Ⅰ号液体培养基中振荡培养4 d后收集菌丝体,利用微波法[18]进行放线菌菌株基因组DNA提取。以Stach等[19]设计的放线菌特异性引物A19和S20进行PCR扩增。PCR反应体系为25 μL:约100 μg/L模板DNA 5 μL,10 μmol/L引物A19和S20各1 μL,2.5 U/μL的Taq聚合酶15 μL,ddH2O 3 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃ 10 min。PCR产物经0.1%的琼脂糖凝胶电泳检测后送至华大基因有限公司测序。将测序结果提交至NCBI中的GenBank数据库进行BLAST分析比对,利用MEGA 6.0构建系统发育树。
1.6 菌株16-3-10耐盐碱试验以高氏Ⅰ号培养基为基础培养基,分别观察菌株在不同NaCl浓度和pH条件下的生长情况。NaCl浓度分别为0.5、2.5、5.0、7.5、10.0、12.0、15.0、18.0、20.0、25.0、30.0、35.0、40.0、45.0、50.0、55.0、60.0、65.0 g/L;pH分别为7.0、8.0、9.0、10.0、11.0、12.0、13.0。
1.7 菌株16-3-10抗菌谱测定测定菌株16-3-10对5种病原菌的抑菌活性,方法同1.3.1。5株供试菌株分别为油菜立枯丝核菌、马铃薯茄链格孢菌、茄腐镰刀菌、尖孢镰刀菌和黑腐皮壳菌。
1.8 营养条件的优化 1.8.1 不同碳氮源对菌株16-3-10发酵滤液抑菌活性的影响以小米浸液培养基为基础培养基,分别以等量的淀粉、蔗糖、果糖、乳糖、麦芽糖、甘油、玉米粉替换葡萄糖;分别以等量的酵母膏、牛肉膏、硫酸铵、硝酸钾、硝酸铵、尿素和黄豆粉替换蛋白胨。以黄瓜枯萎病菌为指示菌,测定方法同1.3.2,确定最佳碳氮源。
1.8.2 正交试验选择最佳碳氮源并参照发酵基础培养基配方,利用正交设计助手设计4因素5水平的正交试验。
1.9 发酵条件的优化在优化后培养基配方的基础上,用抑制菌丝生长速率法测定不同发酵条件对菌株发酵滤液抑菌活性的影响。发酵温度:将摇床培养温度分别调至24、28、32 ℃,其他条件保持不变。装瓶量:装瓶量分别为25/250、50/250、75/250、100/250、125/250、150/250 mL,其他培养条件保持不变。发酵时间:分别摇床培养2、3、4、5、6、7 d,其他培养条件保持不变。起始pH:将培养基起始pH调至5.0、6.0、7.2、8.5、9.0、10.0和11.0,其他培养条件保持不变。以黄瓜枯萎病菌为指示菌,测定方法同1.3.2。
1.10 数据处理采用Excel 2010进行数据基本处理,SPSS 17.0进行显著性分析,正交设计助手设计正交试验,MEGA 6.0构建系统发育树。
2 结果与分析 2.1 土壤放线菌的分离纯化利用稀释涂布平板法分离纯化得到168株放线菌,保藏于4 ℃冷柜中。
2.2 拮抗放线菌的筛选 2.2.1 拮抗放线菌的初筛利用平板对峙法对分离所得的168株放线菌进行初筛,其中有14株菌株的抑制率超过60% (表 2),占分离总数的8.33%。
| 菌株编号 Strains |
抑菌带 Inhibition diameter (mm) |
抑菌率 Inhibition rate (%) |
| 4-2-1 | 28.3±0.4BC | 69.10±0.01C |
| 4-2-3 | 24.7±0.3A | 60.17±0.01A |
| 4-2-5 | 29.5±0.8DE | 71.87±0.02CD |
| 4-3-5 | 28.8±0.8CD | 70.49±0.02C |
| 4-3-6 | 28.7±0.9CD | 70.00±0.02C |
| 4-3-8 | 30.9±0.2E | 75.29±0.01D |
| 4-4-4 | 29.3±0.6DE | 71.38±0.01CD |
| 5-4-2 | 25.1±0.1A | 61.14±0.00A |
| 5-4-8 | 24.7±0.6A | 60.32±0.02A |
| 16-2-15 | 25.8±0.4AB | 64.47±0.02AB |
| 16-3-10 | 27.3±0.3BC | 69.92±0.01C |
| 17-2-5 | 28.1±0.5CD | 68.54±0.01BC |
| 17-2-13 | 25.7±0.3AB | 62.60±0.01A |
| 17-2-14 | 25.3±0.8A | 61.79±0.02A |
| 注:同列数据后不同大写字母表示差异显著(P < 0.05). Note: Different capital letters after the same column represent significant differences (P < 0.05). |
||
对初筛试验结果中效果较好的14株菌株进行复筛,结果显示,14株放线菌菌株抑菌率在4.14%−53.77%之间(表 3),其中菌株16-3-10对黄瓜枯萎病病菌抑制效果最好,达到53.77%,显著高于其他菌株(P < 0.01) (图 1)。结合初筛试验结果,将菌株16-3-10作为后续研究的目标菌株。
| 菌株编号 Strains |
平均菌落直径 Mean colony diameter (mm) |
抑菌率 Inhibition rate (%) |
| 4-2-1 | 56.0±0.2DE | 35.74±0.02C |
| 4-2-3 | 77.2±0.1H | 7.49±0.01A |
| 4-2-5 | 51.2±0.2C | 42.25±0.02D |
| 4-3-5 | 46.2±0.1B | 48.94±0.01F |
| 4-3-6 | 59.6±0.1E | 31.02±0.01CD |
| 4-3-8 | 58.1±0.1DE | 26.22±0.01C |
| 4-4-4 | 55.1±0.3D | 30.74±0.03CD |
| 5-4-2 | 71.2±0.2FG | 7.79±0.01A |
| 5-4-8 | 73.7±0.1GH | 4.14±0.01A |
| 16-2-15 | 71.8±0.0FG | 6.81±0.00A |
| 16-3-10 | 39.7±0.1A | 53.77±0.01F |
| 17-2-5 | 76.3±0.1H | 8.70±0.01A |
| 17-2-13 | 68.3±0.1F | 19.29±0.01B |
| 17-2-14 | 71.0±0.1FG | 8.03±0.01A |
| 注:同列数据后不同大写字母表示差异显著(P < 0.01). Note: Different capital letters after the same column represent significant differences (P < 0.01). |
||
|
| 图 1 菌株16-3-10对黄瓜枯萎病病菌的抑制效果图 Figure 1 Inhibitory effect of strain 16-3-10 against Fusarium oxysporum f. sp. cucumerinum Note: A: Control; B: Strain 16-3-10. |
|
|
试验结果表明,菌株16-3-10具有产铁载体,分泌IAA和溶磷能力。定量测定铁载体(Ar−As)/Ar的比值为−1.510±0.026,IAA含量为4.85±0.38 mg/L,磷含量为27.04±2.17 mg/L。
2.4 菌株16-3-10的鉴定 2.4.1 形态特征与培养特征观察菌株16-3-10在高氏Ⅰ号培养基气生菌丝较发达,呈白色,基内菌丝为麦秆黄色,有可溶性色素产生,孢子呈椭圆形。在8种鉴别培养基的培养特征见表 4,除在克氏Ⅰ号培养基上不能生长外,其他7种供试培养基均可生长。气生菌丝和基内菌丝在7种不同的培养基上呈现不同的颜色。仅在高氏Ⅰ号和PDA培养基上产生可溶性色素。
| 培养基 Meduim |
气生菌丝 Aerial mycelium |
基内菌丝 Vegetative mycelium |
可溶性色素 Soluble pigment |
生长状况 Growth status |
| Gause No.1 agar | White | Wheat straw yellow | Wheat straw yellow | +++ |
| Yeast extract-malt extract agar | White | Cinnamon brown | None | +++ |
| Czapek dox agar | White | Wheat straw yellow | None | +++ |
| Glucose asparagine agar | Litchi white | Litchi white | None | + |
| Oatmeal agar | White | Cream | None | ++ |
| Potato dextrose agar | White | Ya pear yellow | Wheat straw yellow | +++ |
| Imosone agar | White | Antler brown | None | +++ |
| Kline No.1 agar | None | None | None | None |
| 注:+++、++、+:长势的强弱. Note: +++, ++, +: Intensity of growth status. |
||||
菌株16-3-10生理生化试验结果,牛奶凝固与胨化试验、硝酸盐还原试验、明胶液化试验和淀粉水解试验均为阳性,硫化氢试验和纤维素水解试验为阴性。菌株16-3-10均可利用9种碳源(葡萄糖、甘油、乳糖、蔗糖、海藻糖、麦芽糖、果糖、甘露醇和肌醇),其中对葡萄糖、甘油、乳糖、蔗糖和海藻糖利用能力最好,对麦芽糖和甘露醇的利用能力较好,对果糖和肌醇的利用能力最差。
2.4.3 系统发育学分析利用放线菌特异性引物A19和S20对菌株16-3-10的16S rRNA基因序列进行扩增,测序得一条长度为619 bp的DNA序列,将测序结果提交至NCBI中的GenBank数据库,获得登录号MH234000,进行BLAST比对,选取高相似序列,利用MEGA 6.0邻接法构建基于16S rRNA基因序列的系统发育树(图 2)。结果显示,菌株16-3-10与Streptomyces azureus的亲缘关系最近,支持率达99%。结合形态特征及生理生化试验,菌株初步鉴定为链霉菌属(Streptomyces sp.)放线菌,与Streptomyces azureus具有较近的亲缘关系。

|
| 图 2 基于16S rRNA基因序列构建的菌株16-3-10系统发育树 Figure 2 Phylogenetic tree of strain 16-3-10 based on 16S rRNA gene sequences 注:Bootstrap次数设置为1 000,邻接法构建系统发育树;括号中的序号代表序列GenBank登录号;分支位置中的数字表示Bootstrap支持率;标尺表示每个核苷酸位点上的0.005替换值. Note: The number at branch nodes are the percentage bootstrap support based on Neighbor-Joining analysis of 1 000 resample data sets; Numbers in parentheses represent the sequences, accession number in GenBank; The numbers in each branch points denote the percentages supported by bootstrap; The scale bar corresponds to 0.005 substitutions per nucleotide position. |
|
|
耐盐试验结果表明,当培养基NaCl浓度在0.5−35.0 g/L时,菌株生长状况良好且受NaCl浓度影响较小;当培养基NaCl浓度在35.0−60.0 g/L时,菌株生长状况随NaCl浓度的增加而急剧下降,NaCl浓度变化对菌株的生长影响显著;当培养基NaCl浓度大于65.0 g/L时,菌株完全不能生长。耐碱试验结果表明,当培养基pH在7.0−9.0时,菌株生长状况良好,受pH影响较小;当培养基pH在10.0−11.0时,菌株生长状况随pH增加而下降,pH的变化对菌株影响显著;当培养基pH大于12.0时菌株完全不能生长(表 5)。
| Item | 生长状况 Growth status |
| 盐浓度Salt concentration (g/L) 0.5 | +++ |
| 2.5 | +++ |
| 5.0 | +++ |
| 7.5 | +++ |
| 10.0 | +++ |
| 12.0 | +++ |
| 15.0 | +++ |
| 18.0 | +++ |
| 20.0 | +++ |
| 25.0 | +++ |
| 30.0 | +++ |
| 35.0 | ++ |
| 40.0 | ++ |
| 45.0 | + |
| 50.0 | + |
| 55.0 | + |
| 60.0 | + |
| 65.0 | – |
| pH | |
| 7.0 | +++ |
| 8.0 | +++ |
| 9.0 | +++ |
| 10.0 | ++ |
| 11.0 | + |
| 12.0 | – |
| 注:+++、++、+:长势的强弱;–:未生长. Note: +, ++ and +++: Intensity of growth status; –: No growth. |
|
试验结果表明,菌株16-3-10对5种病原菌均表现出较好的抑制效果(图 3),其中该菌株对茄链格孢菌抑制效果最好,抑菌率高达82.12%,对茄腐镰刀菌抑制效果较差,抑菌率为69.11%。

|
| 图 3 菌株16-3-10抗菌谱测定结果 Figure 3 Inhibition spectrum of strain 16-3-10 注:L:油菜立枯丝核;A:马铃薯茄链格孢菌;Q:茄腐镰刀菌;G:尖孢镰刀菌;P:黑腐皮壳菌. Note: L: Rhizoctonia solani; A: Alternaria dauci; Q: Fusarium solani; G: Fusarium oxysporum; P: Valsa mali. |
|
|
以8种不同碳源培养基所得发酵滤液对病原菌均有一定的抑菌活性,其中以乳糖为碳源时发酵滤液对黄瓜枯萎病菌的抑菌效果最好,抑菌率达到67.89%;以玉米粉为碳源时发酵滤液抑菌效果最差,抑菌率仅为27.49% (图 4)。因此,确定乳糖为该菌株抑菌发酵培养的最佳碳源。以8种不同氮源培养基所得发酵滤液对病原菌均有一定抑菌活性。以蛋白胨为氮源时发酵滤液抑菌效果最好,抑菌率达到58.22%;以硝酸钾为氮源时发酵滤液抑菌效果最差,抑菌率仅为15.54% (图 4)。因此,确定蛋白胨为该菌株发酵培养的最佳氮源。

|
| 图 4 不同碳氮源对菌株16-3-10发酵滤液抑菌活性的影响 Figure 4 Effect of different carbon sources and nitrogen on inhibition activity of submerged cultured 16-3-10 注:a:可溶性淀粉;b:蔗糖;c:果糖;d:乳糖;e:麦芽糖;f:甘油;g:玉米粉;h:葡萄糖;i:酵母膏;g:牛肉膏;k:硫酸铵;l:硝酸钾;m:尿素;n:黄豆粉;o:蛋白胨. Note: a: Soluble starch; b: Sucrose; c: Fructose; d: Lactose; e: Maltose; f: Glycerol; g: Corn flour; h: Glucose; i: Yeast extract; g: Beef extract; k: (NH4)2SO4; l: KNO3; m: Urea; n: Soybean meal; o: Peptone. |
|
|
以碳源(乳糖)、氮源(蛋白胨)、NaCl和CaCO3为因素的正交试验表明,4因素对菌株16-3-10抑菌活性影响的主次顺序为乳糖 > 蛋白胨 > CaCO3 > NaCl (表 6);确定该菌株抑菌发酵的最优培养基配方为(g/L):小米10.0,乳糖20.0,蛋白胨1.0,NaCl 5.0,CaCO3 6.0。
| 序号 Number |
1乳糖 Lactose (g/L) |
2蛋白胨 Peptone (g/L) |
3氯化钠 NaCl (g/L) |
4碳酸钙 CaCO3 (g/L) |
抑菌率 Inhibition rate (%) |
| 1 | 2.5 | 1 | 1.0 | 1 | 34.83 |
| 2 | 2.5 | 3 | 2.0 | 2 | 32.89 |
| 3 | 2.5 | 5 | 2.5 | 3 | 25.37 |
| 4 | 2.5 | 10 | 5.0 | 6 | 31.10 |
| 5 | 2.5 | 20 | 10.0 | 8 | 21.95 |
| 6 | 5.0 | 1 | 2.0 | 3 | 49.59 |
| 7 | 5.0 | 3 | 2.5 | 6 | 52.31 |
| 8 | 5.0 | 5 | 5.0 | 8 | 37.04 |
| 9 | 5.0 | 10 | 10.0 | 1 | 18.52 |
| 10 | 5.0 | 20 | 1.0 | 2 | 18.76 |
| 11 | 10.0 | 1 | 2.5 | 8 | 68.75 |
| 12 | 10.0 | 3 | 5.0 | 1 | 49.58 |
| 13 | 10.0 | 5 | 10.0 | 2 | 42.40 |
| 14 | 10.0 | 10 | 1.0 | 3 | 25.00 |
| 15 | 10.0 | 20 | 2.0 | 6 | 38.48 |
| 16 | 20.0 | 1 | 5.0 | 2 | 76.23 |
| 17 | 20.0 | 3 | 10.0 | 3 | 71.32 |
| 18 | 20.0 | 5 | 1.0 | 6 | 62.67 |
| 19 | 20.0 | 10 | 2.0 | 8 | 48.46 |
| 20 | 20.0 | 20 | 2.5 | 1 | 30.77 |
| 21 | 30.0 | 1 | 10.0 | 6 | 63.33 |
| 22 | 30.0 | 3 | 1.0 | 8 | 64.36 |
| 23 | 30.0 | 5 | 2.0 | 1 | 46.92 |
| 24 | 30.0 | 10 | 2.5 | 2 | 41.03 |
| 25 | 30.0 | 20 | 5.0 | 3 | 43.85 |
| K1 | 146.13% | 292.73% | 205.61% | 180.62% | |
| K2 | 176.22% | 270.47% | 216.34% | 211.30% | |
| K3 | 224.22% | 214.39% | 218.23% | 215.13% | |
| K4 | 289.45% | 164.10% | 247.79% | 247.89% | |
| K5 | 259.49% | 153.81% | 217.53% | 240.56% | |
| R | 143.32% | 138.92% | 42.18% | 67.27% | |
| 最优水平 Optimal level |
4 | 1 | 4 | 4 | |
| 主次顺序 The important order |
1 > 2 > 4 > 3 | ||||
在此培养基配方条件下,验证试验结果表明菌株16-3-10发酵滤液对黄瓜枯萎病菌的抑菌率达到78.47%。
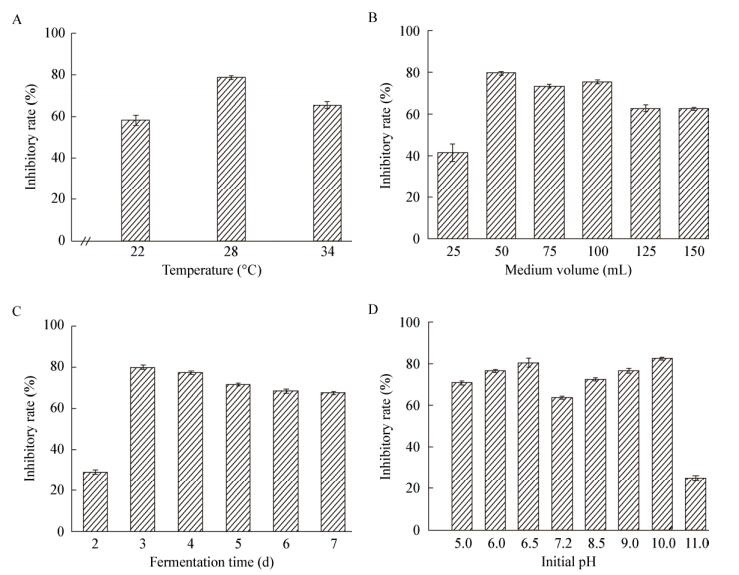
2.8 菌株16-3-10发酵条件的优化 2.8.1 发酵温度菌株16-3-10在24−32 ℃时发酵滤液均具有抑菌活性,在28 ℃时抑菌活性达到最高值78.70%。
2.8.2 装瓶量菌株16-3-10装瓶量在25/250−150/250 mL之间抑菌活性基本呈现出先上升后下降的趋势,装瓶量为50/250 mL时菌株的抑菌活性最好,抑菌率达到79.63%。
2.8.3 发酵时间菌株在发酵培养2−7 d时抑菌活性基本呈现出先上升后下降的趋势,发酵培养3 d时抑菌活性最好,抑菌率为79.95%。
2.8.4 起始pH起始pH在5.0−11.0时菌株均有抑菌效果,抑菌活性随着pH的增长呈现出先上升后降低再上升再降低的变化趋势,菌株在起始pH 6.5和10.0时菌株的抑菌活性最高,分别为80.56%、82.50% (图 5)。
|
| 图 5 发酵温度(A)、装瓶量(B)、培养时间(C)、起始pH (D)对菌株16-3-10发酵滤液抑菌活性的影响 Figure 5 Effect of fermentation temperature (A), medium volume (B), fermentation time (C), initial pH (D) on inhibition activity of submerged cultured 16-3-10 |
|
|
综合上述实验结果,基本可以确定菌株16-3-10的最优发酵条件:培养温度为28 ℃,装瓶量为50/250 mL,培养时间为3 d,起始pH为10.0时,菌株16-3-10发酵滤液的抑菌活性最好抑菌率达到82.50%。
3 结论与讨论黄瓜枯萎病是一种严重制约黄瓜产业发展的主要病害之一。近年来,由于种植区连作频繁,致使黄瓜枯萎病大肆蔓延。放线菌因其丰富的代谢产物而备受科研工作者的青睐[20]。有研究表明,约45%的微生物活性物质是由放线菌产生[21],其中90%以上是由链霉菌属菌株所产生。
极端环境中的微生物具有特殊基因类型,能产生特殊的代谢产物,具有很高的研究价值[22]。盐碱环境中存在大量特殊的微生物类群,蕴含丰富的微生物资源。本研究从河西走廊敦煌盐碱土壤中分离筛选出一株对黄瓜枯萎病病菌具有良好拮抗效果且具有产铁载体、分泌IAA和溶磷能力的放线菌菌株16-3-10。经形态特征、培养特征、生理生化特性及16S rRNA基因序列分析其为链霉菌属菌株,与Streptomyces azureus具有较近的亲缘关系。
与普通环境相比,盐碱环境的微生物适应盐浓度和pH的范围更广。菌株16-3-10在盐浓度为6.0%或起始pH 11.0时均可生长,这与关统伟等[23]从盐碱环境分离的放线菌菌株最适生长盐浓度在6%−8%的研究结果一致。究其原因可能与菌株长期生长在盐碱环境,为适应其高盐高碱的极端环境产生特殊的生理途径和代谢产物有关。菌株16-3-10对5株供试病原菌的抑菌率均高于69%,具有较广的抗菌谱,且对盐碱环境有一定的耐受性,具有进一步深入研究的潜力。
研究表明,不同培养基配方对菌株抑菌活性有较大影响[24],程沁园等[25]的放线菌菌株WB-F以葡萄糖为碳源,黄豆粉为氮源时,单体积发酵液抑菌活性提高了30%。朱宏建等[26]的放线菌菌株ND045分别在碳源为蔗糖、氮源为大豆粉时,菌株发酵滤液对辣椒尖孢炭疽病菌(Colletotrichum acutata)的抑菌率为65.21%、40.58%。菌株16-3-10在不同培养组分下抑菌活性存在显著差异,当碳源为乳糖时菌株的抑菌活性达到67.97%;当氮源为蛋白胨时菌株的抑菌活性达到53.05%。培养基中各组分量的不同对菌株抑菌活性也有较大影响[27],正交试验表明,与优化前相比,菌株16-3-10抑菌活性增加了153.43%,各因素对菌株16-3-10抑菌活性影响主次顺序为:乳糖 > 蛋白胨 > CaCO3 > NaCl,这与李威等[28]对抗茄子青枯病菌(Ralstonia solanacearum)的放线菌菌株XL-6各因素主次顺序(玉米粉 > MgCl2 > 酵母粉 > NaCl > K2HPO4)的研究结果基本一致。不同发酵条件对菌株发酵液抑菌活性有一定影响[29],本研究中菌株16-3-10的最优发酵条件为:温度28 ℃,装瓶量50/250 mL,发酵时间3 d、起始pH 10.0,与杨晓楠等[30]从黄瓜根际土壤中分离的生防放线菌菌株T111的最优发酵条件存在一定差异,这是不同菌株对于发酵过程中各理化因素需求不同的表现,也是生理代谢途径因菌种差异的体现。
发酵是获得微生物活性物质的基本途径,探寻生防菌株最佳发酵条件具有重要意义。本研究首次从河西走廊盐碱土壤中分离筛选出具有促生效果的抗黄瓜枯萎病菌生防菌株,通过发酵配方和条件的优化,显著提高了其抑菌活性。但本研究结果是在实验室条件下得到,能否将其应用于农业生产还需进一步探究。目前研究室正在进行抑菌机制的研究,以期为黄瓜枯萎病的防治提供理论依据。
| [1] |
Jiang H, Cao S, Wang LJ, et al. Research progress on cucumber Fusarium wilt and its integrated control[J]. China Plant Protection, 2012, 32(11): 13-17. (in Chinese) 蒋荷, 曹莎, 王丽君, 等. 黄瓜枯萎病研究进展及其综合防治[J]. 中国植保导刊, 2012, 32(11): 13-17. DOI:10.3969/j.issn.1672-6820.2012.11.003 |
| [2] |
Liang Y, Zhang GY, Wang C, et al. Identification and biocontrol effect of a strain of actinomycete antagonistic to wilt disease of cucumber[J]. Acta Pedologica Sinica, 2013, 50(4): 810-817. (in Chinese) 梁银, 张谷月, 王辰, 等. 一株拮抗放线菌的鉴定及其对黄瓜枯萎病的生防效应研究[J]. 土壤学报, 2013, 50(4): 810-817. |
| [3] |
Chen F, Wang M, Zheng Y, et al. Quantitative changes of plant defense enzymes and phytohormone in biocontrol of cucumber Fusarium wilt by Bacillus subtilis B579[J]. World Journal of Microbiology and Biotechnology, 2010, 26(4): 675-684. DOI:10.1007/s11274-009-0222-0 |
| [4] |
Lan JL, Su MX, Ge CB, et al. Relativity between the distribution of Fusarium oxysporum and the course of disease of wilt disease of Watermelon[J]. Chinese Agricultural Science Bulletin, 2007, 23(12): 302-305. (in Chinese) 蓝江林, 苏明星, 葛慈斌, 等. 尖孢镰刀菌的分布与西瓜枯萎病病程的相关性[J]. 中国农学通报, 2007, 23(12): 302-305. DOI:10.3969/j.issn.1000-6850.2007.12.066 |
| [5] |
An DD, Chen YM, Li J, et al. Anti-microbial activity of endophytic actinomycetes isolated from Ammodendron bifolium and their antagonism to endophytic bacteria[J]. Chinese Journal of Applied Ecology, 2010, 21(4): 1021-1025. (in Chinese) 安登第, 陈玉梅, 李进, 等. 银沙槐内生放线菌抗菌活性及其与内生细菌的拮抗关系[J]. 应用生态学报, 2010, 21(4): 1021-1025. |
| [6] |
Li R, Shen ZZ, Sun L, et al. Novel soil fumigation method for suppressing cucumber Fusarium wilt disease associated with soil microflora alterations[J]. Applied Soil Ecology, 2016, 101: 28-36. DOI:10.1016/j.apsoil.2016.01.004 |
| [7] |
Jiang Y, Duan SR, Tang SK, et al. Rare actinomycete isolation method[J]. Microbiology China, 2006, 33(1): 181-183. (in Chinese) 姜怡, 段淑蓉, 唐蜀昆, 等. 稀有放线菌分离方法[J]. 微生物学通报, 2006, 33(1): 181-183. DOI:10.3969/j.issn.0253-2654.2006.01.038 |
| [8] |
Niu SQ, Geng H, Yan WR, et al. Screening and identification of actinomycetes on Astragalus membranaceus root rot and optimization of fermentation conditions[J]. Acta Phytophylacica Sinica, 2016, 43(6): 943-950. (in Chinese) 牛世全, 耿晖, 阎薇茹, 等. 黄芪根腐病生防放线菌筛选鉴定及其优化培养[J]. 植物保护学报, 2016, 43(6): 943-950. |
| [9] |
Actinomycetes Classification Group, Institute of Microbiology, Chinese Academy of Sciences. Streptomyces Identification Manual[M]. Beijing: Science Press, 1975: 162-185. (in Chinese) 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975: 162-185. |
| [10] |
Rong LY, Yao T, Zhao GQ, et al. Screening of siderophore-producing PGPR bacteria and their antagonism against the pathogens[J]. Plant Protection, 2011, 37(1): 59-64. (in Chinese) 荣良燕, 姚拓, 赵桂琴, 等. 产铁载体PGPR菌筛选及其对病原菌的拮抗作用[J]. 植物保护, 2011, 37(1): 59-64. DOI:10.3969/j.issn.0529-1542.2011.01.012 |
| [11] |
Wang H, Wang JJ, Xu S, et al. Screening and growth promoting characteristics of efficient organophosphate-degradation bacteria[J]. Acta Microbiologica Sinica, 2017, 57(5): 667-680. (in Chinese) 王欢, 王敬敬, 徐松, 等. 有机磷降解菌的筛选及其促生特性[J]. 微生物学报, 2017, 57(5): 667-680. |
| [12] |
Li ZG, Luo YM, Teng Y. The Research Method of Soil and Environmental Microorganism[M]. Beijing: Science Press, 2008: 52-61. (in Chinese) 李振高, 骆永明, 腾应. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008: 52-61. |
| [13] |
Zhao SL, Ren FE, Liu JL, et al. Screening, identification and optimization of fermentation conditions of an antagonistic actinomycetes strain to Setosphaeria turcica[J]. Acta Microbiologica Sinica, 2012, 52(10): 1228-1236. (in Chinese) 赵淑莉, 任飞娥, 刘金亮, 等. 玉米大斑病生防放线菌的筛选鉴定及发酵条件优化[J]. 微生物学报, 2012, 52(10): 1228-1236. |
| [14] |
Xue YY, Fan WZ, Zhang SW, et al. Screening, identification and biocontrol effect of antagonistic actinomycetes against the pathogen of Cytospora sp. for apple tree[J]. Chinese Journal of Applied Ecology, 2016, 27(10): 3379-3386. (in Chinese) 薛应钰, 范万泽, 张树武, 等. 苹果树腐烂病菌拮抗放线菌的筛选、鉴定及防效[J]. 应用生态学报, 2016, 27(10): 3379-3386. |
| [15] |
Niu SQ, Li WJ, Li HY, et al. Screening of actinomyces on antagonism to Fusariun spp. isolated from saline-alkali soils in Hexi corridor[J]. Journal of Northwest Normal University (Natural Science), 2017, 53(2): 94-98. (in Chinese) 牛世全, 李渭娟, 李海云, 等. 河西走廊盐碱土壤中抗马铃薯干腐病放线菌的筛选鉴定[J]. 西北师范大学学报:自然科学版, 2017, 53(2): 94-98. |
| [16] |
Shirling EB, Gottlieb D. Methods for characterization of Streptomyces species[J]. International Journal of Systematic and Evolutionary Microbiology, 1966, 16(3): 313-340. |
| [17] |
Xu LH, Li WJ, Liu ZH, et al. Actinomycete Systematic— Principle, Methods and Practice[M]. Beijing: Science Press, 2007: 40-46. (in Chinese) 徐丽华, 李文均, 刘志恒, 等. 放线菌系统学—原理、方法及实践[M]. 北京: 科学出版社, 2007: 40-46. |
| [18] |
Xu P, Li WJ, Xu LH, et al. A microwave-based method for genomic DNA extraction from actinomycetes[J]. Microbiology China, 2003, 30(4): 82-84. (in Chinese) 徐平, 李文均, 徐丽华, 等. 微波法快速提取放线菌基因组DNA[J]. 微生物学通报, 2003, 30(4): 82-84. DOI:10.3969/j.issn.0253-2654.2003.04.020 |
| [19] |
Stach JEM, Maldonado LA, Ward AC, et al. New primers for the class Actinobacteria: application to marine and terrestrial environments[J]. Environmental Microbiology, 2003, 5(10): 828-841. DOI:10.1046/j.1462-2920.2003.00483.x |
| [20] |
Himaman W, Thamchaipenet A, Pathom-Aree W, et al. Actinomycetes from Eucalyptus and their biological activities for controlling Eucalyptus leaf and shoot blight[J]. Microbiological Research, 2016, 188-189: 42-52. DOI:10.1016/j.micres.2016.04.011 |
| [21] |
Demain AL, Sanchez S. Microbial drug discovery: 80 years of progress[J]. The Journal of Antibiotics, 2009, 62(1): 5-16. DOI:10.1038/ja.2008.16 |
| [22] |
Li WJ, Xu P, Xu LH, et al. Actinomycete resources in extreme environments[J]. Microbiology China, 2003, 30(4): 125-127. (in Chinese) 李文均, 徐平, 徐丽华, 等. 极端环境中的放线菌资源[J]. 微生物学通报, 2003, 30(4): 125-127. DOI:10.3969/j.issn.0253-2654.2003.04.032 |
| [23] |
Guan TW, Zhang LL, Zhao ZY, et al. Soil actinomycetes in Tarim Basin desert saline-alkali habitat[J]. Journal of Microbiology, 2007, 27(1): 80-84. (in Chinese) 关统伟, 张利莉, 赵震宇, 等. 塔里木盆地荒漠盐碱生境土壤放线菌的初步研究[J]. 微生物学杂志, 2007, 27(1): 80-84. DOI:10.3969/j.issn.1005-7021.2007.01.019 |
| [24] |
Gurovic MSV, Olivera NL. Antibacterial producing actinomycetes from Extra Andean Patagonia[J]. Journal of Arid Environments, 2017, 144: 216-219. |
| [25] |
Cheng QY, Ye L, Xing YY, et al. Fermentation conditions and characteristics of anti-bacteria active substance by marine actinomycete WB-F5[J]. Chinese Journal of Natural Medicines, 2007, 5(2): 142-145. (in Chinese) 程沁园, 叶亮, 邢莹莹, 等. 海洋放线菌WB-F5发酵条件的优化及抑菌活性产物[J]. 中国天然药物, 2007, 5(2): 142-145. |
| [26] |
Zhu HJ, Ouyang XY, Zhou Q, et al. Isolation, identification and optimizing fermentation conditions of an antagonistic strain against Colletotrichum acutata[J]. Acta Phytopathologica Sinica, 2012, 42(4): 418-424. (in Chinese) 朱宏建, 欧阳小燕, 周倩, 等. 一株辣椒尖孢炭疽病菌拮抗菌株的分离鉴定与发酵条件优化[J]. 植物病理学报, 2012, 42(4): 418-424. DOI:10.3969/j.issn.0412-0914.2012.04.011 |
| [27] |
Zhang ZJ, Han JX, Liu XZ, et al. Optimization of B16 endophytic strain culture for its control of ginseng Cylindrocarpon destructans[J]. Microbiology China, 2017, 44(11): 2698-2707. (in Chinese) 张正杰, 韩金秀, 刘学周, 等. 内生菌株B16发酵条件优化及其对人参锈腐病的防效[J]. 微生物学通报, 2017, 44(11): 2698-2707. |
| [28] |
Li W, Xiao XO, Li K, et al. Screening, identification and fermentation optimization of an antagonistic actinomycete strain XL-6 against Ralstonia solanacearum[J]. Microbiology China, 2018, 45(2): 357-367. (in Chinese) 李威, 肖熙鸥, 李可, 等. 茄子青枯病拮抗放线菌XL-6的筛选、鉴定及发酵条件优化[J]. 微生物学通报, 2018, 45(2): 357-367. |
| [29] |
Zhang FG, Gao YH, Ren HS, et al. Screening, identification and optimization of fermentation conditions of an antagonistic endophyte to mulberry bacterial blight[J]. Acta Microbiologica Sinica, 2013, 53(12): 1285-1294. (in Chinese) 张飞官, 高雅慧, 任慧爽, 等. 桑疫病病原拮抗菌的分离、鉴定及发酵条件优化[J]. 微生物学报, 2013, 53(12): 1285-1294. |
| [30] |
Yang XN, Li Y, Miao JQ, et al. Identification, physical and chemical property determination, and fermentation condition optimization of antagonistic strain T111[J]. Chinese Journal of Applied & Environmental Biology, 2011, 17(4): 541-547. (in Chinese) 杨晓楠, 李杨, 苗建强, 等. 拮抗放线菌T111菌株鉴定、发酵液理化性质测定及发酵条件优化[J]. 应用与环境生物学报, 2011, 17(4): 541-547. |
 2019, Vol. 46
2019, Vol. 46