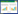扩展功能
文章信息
- 张爱梅, 吴菊艳, 韩雪英, 孔维宝
- ZHANG Ai-Mei, WU Ju-Yan, HAN Xue-Ying, KONG Wei-Bao
- 沙棘根瘤内生细菌中抑菌促生菌株的筛选和鉴定
- Screening and identification of antagonistic and plant-growth promoting endophytic bacteria from Seabuckthorn nodules
- 微生物学通报, 2019, 46(5): 1041-1051
- Microbiology China, 2019, 46(5): 1041-1051
- DOI: 10.13344/j.microbiol.china.180563
-
文章历史
- 收稿日期: 2018-07-19
- 接受日期: 2018-10-29
- 网络首发日期: 2018-11-09
植物内生细菌是指生活在健康植物的组织或器官内,对宿主没有明显病害症状的细菌[1]。已有研究报道,几乎所有的植物都存在内生菌,且不同植物的不同组织部位中(如根、茎、叶、花、种子和根瘤)均有内生菌的存在[2]。根瘤是豆科或非豆科植物根部的瘤状凸起,由根瘤菌或弗兰克氏菌引起,根瘤中也定居着大量内生细菌[3]。
植物内生细菌具有丰富的生物学功能,主要包括生物防治、促生、固氮和生物修复作用等[4]。植物内生细菌通过产生抗生素、细菌素、溶菌酶、超氧化物歧化酶、挥发性有机物等代谢产物来抑制或者杀死病原物,或通过与病原物营养竞争和生态排斥作用抑制病原物生长,起到生物防治的作用[2]。植物内生细菌可以产生吲哚乙酸(Indole-3-acetic acid,IAA)、细胞激动素、赤霉素等植物激素,直接促进宿主植物的生长[5];还可通过产生铁载体将Fe3+还原成植物能够吸收的Fe2+,向宿主提供可以利用的铁元素来满足植物的生长需要;能溶解土壤中的难溶性磷酸盐来改善植物对矿物质的利用率[6]。
沙棘是一种非豆科植物,沙棘根瘤是弗兰克氏菌侵染沙棘根部后形成的共生体。徐瑞瑞[7]研究发现,沙棘根瘤中除弗兰克氏菌外还存在大量的非弗兰克氏菌。作者前期研究也发现,沙棘根瘤中存在种类繁多的内生细菌,并从中分离出大量的内生细菌资源[8]。相对于植物其他组织部位的内生细菌而言,根瘤内生细菌不仅将植物作为其栖息场所,而且对宿主植物有促生、防病及联合固氮等广泛的生物学作用,其对土壤的适应性更强,用于土传性病害的生物防治更具优势[2]。因此,本研究对来源于沙棘根瘤的内生细菌进行筛选,筛选出具有较高抑菌和促生活性的菌株,并对其生物学特性及对作物的防病促生效果进行初步探索,还通过形态学观察、生理生化试验,16S rRNA基因序列分析对菌株进行鉴定,为开发新型农用微生物资源提供理论基础。
1 材料与方法 1.1 供试菌株所用的供试内生细菌共131株,均由本实验室分离保存。供试细菌为3种标准菌株,即以革兰氏阴性菌为代表的大肠杆菌(Escherichia coli)、以革兰氏阳性菌为代表的枯草芽孢杆菌(Bacillus subtilis)和金黄色葡萄球菌(Staphyloccocus aureus);两种植物病原真菌,即黄瓜枯萎病病原真菌(Fusarium oxysporum f. sp. cucumebrium Owen)和黄芪根腐病病原真菌(Fusarium oxysporum Schlecht)。5种供试病原菌均由本实验室保存。
1.2 主要试剂和仪器及培养基蛋白胨、牛肉膏、氯化钠、葡萄糖、磷酸三钙、铬天青S、天冬酰胺,上海泰坦科技股份有限公司;PCR反应试剂,北京康为世纪生物科技有限公司;引物由北京诺禾致源生物信息科技有限公司合成。PCR仪,上海一恒科学仪器有限公司。牛肉膏蛋白胨培养基(菌株活化培养基)、PDA培养基(拮抗菌筛选培养基)、无机磷培养基、CAS固体培养基、蔗糖-天冬酰胺培养基(促生活性测定培养基)等,参照张雨[9]的方法配制。
1.3 沙棘根瘤拮抗性内生细菌的筛选沙棘根瘤抑菌性内生细菌的筛选采用双层琼脂法和琼脂扩散法,初筛采用双层平板对峙法,参照Nieto-Lozano等[10]的方法;复筛采用牛津杯法,参照唐梅等[6]的方法,采用十字交叉法测定抑菌圈的直径。
1.4 拮抗性内生细菌促生活性测定 1.4.1 促生活性测定菌株促生活性的测定分别采用定性和定量检测方法。产吲哚乙酸能力测定参照Salkowski比色法[9]进行;溶磷能力的定性测定参考Ji等[11]的方法,定量测定采用钼锑抗比色法[12];产铁载体能力的定性测定采用CAS平板对峙法[11],定量测定参考张雨[9]的相对定量检测法。
1.4.2 促生盆栽试验黄瓜品种:旱黄瓜,种子购于北京派得伟业科技发展有限公司。
土壤采用进口丹麦品氏泥炭营养土。盆栽试验方法参照江绪文等[13]的方法并加以改进。将已消毒的旱黄瓜种子种于装有灭菌营养土壤的花盆(d=16 cm)中,每个处理10盆,每盆1粒种子。待黄瓜长到株高平均为35 cm时,将沙棘根瘤内生促生菌液(总菌量1.2×108 CFU/mL)以每盆100 mL浇灌于盆栽土壤中,以无菌水作对照。待黄瓜长至开花期后,分别测定黄瓜植株的生长指标及其叶绿素的含量,测定方法参照田琴[14]的方法。
1.5 内生细菌的鉴定 1.5.1 形态学鉴定参考《常见细菌系统鉴定手册》[15],依据菌落和显微形态特征分别进行鉴定。
1.5.2 生理生化鉴定对筛选的具抑菌促生活性的内生细菌菌株进行运动性、接触酶等生理生化试验,参考《常见细菌系统鉴定手册》[15]进行鉴定。
1.5.3 内生细菌的16S rRNA基因序列分析沙棘根瘤内生细菌DNA的提取采用微波法[16]。
16S rRNA基因扩增采用细菌通用引物:27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-TACGGCTACCTTGTTACGACTT-3′)。PCR反应体系(25 μL):上、下游引物(10 μmol/L)各1 μL,模板DNA (约50.0 mg/mL) 4 μL,2×Es Taq MasterMix (Dye) 15 μL,加ddH2O至25 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 1 min,56 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 10 min[17]。PCR产物经1%琼脂糖凝胶电泳检测后进行双向测序,测序由北京诺禾致源生物信息科技有限公司完成。将所得到的序列用NCBI的BLAST进行比对,用MEGA 7.0软件采用临近法(Neighbor-Joining method)构建系统发育树。
1.6 数据处理采用SPSS 17.0软件进行数据统计分析,用Origin 7.5软件绘图。
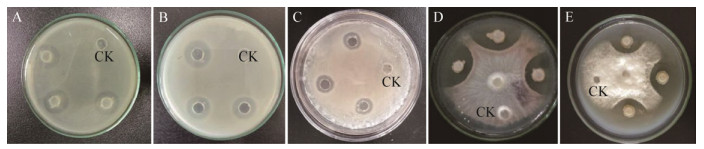
2 结果与分析 2.1 拮抗内生细菌的筛选 2.1.1 初筛对131株沙棘根瘤内生细菌进行抑菌活性初筛后发现,25株内生细菌对供试细菌或病原真菌表现出不同程度的抑菌效果(表 1)。其中有5株内生细菌能同时抑制大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、黄芪根腐病和黄瓜枯萎病病原真菌(图 1),有6株内生细菌能同时抑制除大肠杆菌外的其他4种病原供试菌,有1株内生细菌能同时抑制除黄芪根腐病菌外的其他4种病原供试菌,其他13株内生细菌对部分病原供试菌也具有较好的抑菌效果。有2株内生细菌TT207和GR201能同时抑制两种病原真菌,且抑菌带直径均超过25.9 mm,抑菌效果明显。
| 菌株编号 Strain number |
枯草芽孢杆菌 B. subtilis |
黄瓜枯萎病菌 Fusarium oxysporum f. sp. cucumebrium Owen |
金黄色葡萄球菌 S. aureus |
黄芪根腐病菌 Fusarium oxysporum Schlecht |
大肠杆菌 E. coli |
| TT201 | 18.8±0.32 | 23.3±0.41 | 23.9±0.05 | 23.2±0.04 | 20.3±0.32 |
| SB107 | 17.9±0.94 | 24.1±0.58 | 18.7±0.23 | 18.1±0.24 | 17.0±0.04 |
| TT207 | 13.2±0.24 | 25.9±0.03 | 21.5±0.46 | 27.3±0.58 | 11.4±0.06 |
| SY101 | 12.4±0.33 | 25.2±0.22 | 21.7±0.05 | 21.9±0.09 | 10.3±0.09 |
| NR204 | 14.3±0.09 | 31.2±0.80 | 13.3±0.16 | 20.5±0.08 | 9.9±0.43 |
| NR107 | 10.4±0.05 | 27.7±0.34 | 18.0±0.07 | 18.8±0.06 | / |
| TT06 | 12.3±0.21 | 25.6±0.06 | 15.8±0.39 | 18.7±0.05 | / |
| GR201 | 14.3±0.13 | 27.0±0.22 | 13.0±0.44 | 27.1±0.06 | / |
| SR308 | 11.8±0.34 | 25.4±0.21 | 11.1±0.33 | 18.7±0.07 | / |
| SR204 | 11.1±0.25 | 21.5±0.06 | 11.3±0.05 | 19.2±0.23 | / |
| SY117 | 11.7±0.02 | 23.0±0.11 | 13.5±0.21 | 20.7±0.08 | / |
| NR102 | 9.7±0.07 | 20.0±0.04 | 9.9±0.19 | / | 10.7±0.08 |
| SY122 | 12.0±0.26 | 19.5±0.19 | 24.3±0.36 | / | / |
| TT15 | 10.0±0.05 | 25.7±0.35 | / | / | / |
| SY126 | 10.0±0.30 | 24.3±0.27 | / | 24.1±0.42 | / |
| SR301 | 11.0±0.20 | / | / | 23.4±0.16 | / |
| TT308 | 12.5±0.14 | / | 11.9±0.33 | / | / |
| NR103 | 14.0±0.30 | / | 10.3±0.16 | / | / |
| GR203 | 13.0±0.16 | / | / | / | / |
| SY108 | 10.2±0.29 | / | / | / | / |
| TT20 | 10.3±0.35 | / | / | / | 9.8±0.03 |
| TT114 | / | 22.7±0.08 | / | 19.9±0.23 | / |
| TT115 | / | 30.4±0.22 | 18.5±0.23 | / | / |
| GB305 | / | 24.3±0.16 | 11.6±0.04 | / | / |
| SB301 | / | / | 10.3±0.05 | / | / |
| 菌饼直径 Diaphragm diameter |
8 mm | ||||
| 注:/:无抑菌效果. Note: /: No inhibitory effect. |
|||||
|
| 图 1 内生细菌对5种供试病原菌的抑菌效果图 Figure 1 Antibacterial effect of endophytic bacteria to five indicating pathogens 注:CK:对照. A:大肠杆菌;B:金黄色葡萄球菌;C:枯草芽孢杆菌;D:黄瓜枯萎病原真菌;E:黄芪根腐病原真菌. Note: CK: Control. A: E. coli; B: S. aureus; C: B. subtilis; D: Fusarium oxysporum f. sp. cucumebrium Owen; E: Fusarium oxysporum Schlecht. |
|
|
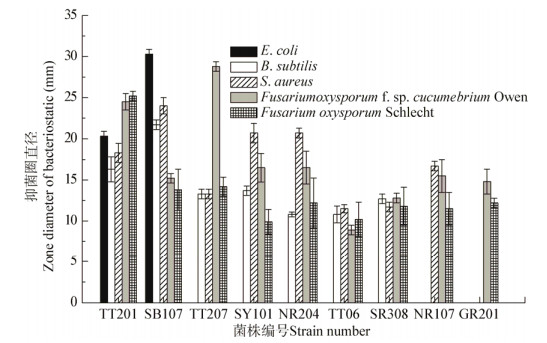
对初筛得到的9株抑菌性能较好的内生细菌,根据其发酵液对供试病原菌的抑菌性进行复筛(图 2)。结果表明,9株内生细菌对2株供试病原真菌均有抑菌效果,除菌株TT201和TT06外,其余7株内生细菌对黄瓜枯萎病菌的抑菌性均强于黄芪根腐病菌。其中,菌株TT201对黄瓜枯萎病菌和黄芪根腐病菌的抑制性相对较高,其抑菌带直径分别为24.5 mm和25.2 mm;菌株TT207对黄瓜枯萎病菌的抑制性最强,其抑菌带直径达到28.8 mm;菌株TT06对病原真菌抑菌性最弱。
|
| 图 2 9株内生细菌对5种供试病原菌的抑菌活性 Figure 2 Antibacterial activity of nine endophytic bacteria to five indicating pathogens |
|
|
9株内生细菌对供试病原细菌的抑菌性结果表明,有2株内生细菌能同时抑制3种病原细菌,有5株内生细菌能抑制除大肠杆菌外的2种病原细菌。菌株SB107对大肠杆菌的抑菌性最强,其抑菌带直径达到30.3 mm。
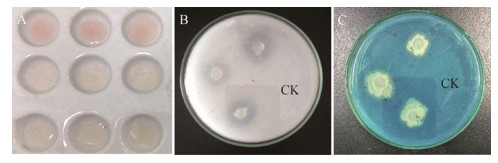
2.2 内生细菌的促生活性检测 2.2.1 促生活性的测定结果对复筛得到的9株具有抑菌活性的内生细菌进行促生活性的测定,分别检测了菌株的产IAA、溶磷和产铁载体能力,结果如表 2所示。其中,8株内生细菌具有促生活性,1株无促生活性。只产IAA的有5株,能产铁载体的有4株,具有溶磷能力的有5株;既能产生IAA又具有溶磷能力的有2株,既能产生IAA也能产铁载体的有2株,既具有溶磷能力又能产铁载体的有3株。菌株SR308的促生活性较好,能同时具有产IAA (含量:23.17±0.17 μg/mL)、溶磷(溶磷量:1.36±0.01 μg/mL)和产铁载体(含量:4.9±0.37%)的能力,且其产IAA能力最强。菌株SY101的溶磷能力最强,可溶性磷的含量为2.0±0.02 μg/mL。菌株TT207的产铁载体能力最强,产铁载体的含量达68.2±0.06%。图 3为部分菌株促生活性测定的效果图。
| 菌株 Strains |
吲哚乙酸 IAA (μg/mL) |
铁载体 Siderophore (%) |
溶磷活性 Dissolving inorangic phosphorus (μg/mL) |
| SR308 | 23.17±0.17 | 4.9±0.37 | 1.36±0.01 |
| TT201 | 0.55±0.03 | 7.7±1.50 | / |
| SB107 | 8.24±0.61 | / | / |
| NR204 | 1.90±0.27 | / | / |
| SY101 | 3.78±0.31 | / | 2.00±0.02 |
| GR201 | / | 27.5±0.52 | 0.67±0.01 |
| TT207 | / | 68.2±0.06 | 1.13±0.01 |
| TT06 | / | / | 1.15±0.01 |
| NR107 | / | / | / |
| 注:/:无促生活性. Note: /: No plant-growth promoting activity. |
|||
|
| 图 3 内生细菌促生活性的效果图 Figure 3 Plant-growth promoting effect of endophytic bacteria 注:A:产吲哚乙酸;B:溶磷活性;C:产铁载体. CK:对照. Note: A: IAA; B: Dissolving inorganic phosphorus; C: Siderophore. CK: Control. |
|
|
通过对沙棘根瘤内生细菌促生活性的测定结果发现,菌株SR308能同时产生3种促生活性物质,因此选取菌株SR308对旱黄瓜的促生作用进行盆栽试验,分别对旱黄瓜植株的生长指标及其叶绿素含量进行了测定。
研究发现SR308菌株发酵液对旱黄瓜的生长具有明显的促进作用(表 3),与对照相比,用SR308菌株发酵液处理后的黄瓜的各项生长指标均高于对照处理,特别是用菌株SR308发酵液浇灌过的黄瓜地上部分湿重和干重分别是对照组的1.99倍和1.63倍,且黄瓜苗株高比对照组增加了70%,差异比较显著;茎粗、主根干重和主根湿重均高于对照组,但差异均不显著。
| 处理 Treatments |
苗高 Height of seedling (cm) |
茎粗 Stem diameter (cm) |
地上部分湿重 Wet weight of aboveground parts (g) |
地上部分干重 Dry weight of aboveground parts (g) |
主根湿重 Main root wet weight (g) |
主根干重 Main root dry weight (g) |
| SR308 | 64.80±1.66a | 0.51±0.04a | 20.91±1.63a | 1.16±0.07a | 1.20±0.19a | 0.045±0.006a |
| Control | 45.40±1.81b | 0.42±0.02ab | 10.51±0.50b | 0.71±0.03b | 1.00±0.14a | 0.041±0.004a |
| 注:数据后小写字母分别表示处理间存在P < 0.05水平显著性差异. Note: Lowercase letters are significantly at 0.05 probability level of the different treatments. |
||||||
研究也发现,SR308菌株发酵液浇灌过的黄瓜叶绿素含量高于用无菌水浇灌的(表 4)。其叶绿素a、b和总含量分别为对照组的1.83、2.14和2.01倍,具有显著差异性,类胡萝卜素的含量比对照组高0.07 mg/g,其差异性不显著。可见,沙棘根瘤内生细菌SR308对旱黄瓜植株具有明显的促生效果(图 4)。
| 处理 Treatments |
叶绿素a Chlorophyll a (mg/g) |
叶绿素b Chlorophyll b (mg/g) |
类胡萝卜素 Carotenoid (mg/g) |
叶绿素总量 Total chlorophyll content (mg/g) |
| SR308 | 1.70±0.068a | 0.45±0.054a | 0.33±0.009a | 2.61±0.014a |
| Control | 0.93±0.104b | 0.21±0.024b | 0.26±0.028a | 1.30±0.134b |
| 注:数据后小写字母分别表示处理间存在P < 0.05水平显著性差异. Note: Lowercase letters are significantly at 0.05 probability level of the different treatments. |
||||

|
| 图 4 菌株SR308处理30 d后对黄瓜生长的影响 Figure 4 Effect of strain SR308 to cucumber growth after 30 d treatment |
|
|
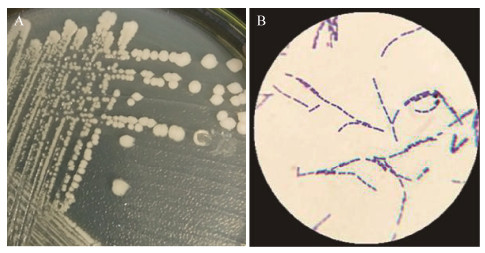
选取具有较强抑菌性的内生菌株TT201,以及产生3种促生活性物质能力较强的菌株SR308分别进行了鉴定。图 5和图 6为两株内生细菌的菌落和显微形态特征。菌株TT201的菌落呈圆形、扁平,白色不透明,边缘啮蚀状,中央褶皱状隆起,表面干燥,菌落直径为1 mm−4 mm (图 5A),经革兰氏染色后镜检观察到其为G−菌,细胞呈短杆状,有芽孢生成(图 5B);菌株SR308的菌落呈圆形、扁平光滑,乳白色不透明,边缘啮蚀状,表面较湿润,菌落直径为1 mm–3 mm (图 6 A),经革兰氏染色后镜检观察到其为G+菌,细胞呈直杆状,也有芽孢生成(图 6B)。

|
| 图 5 菌株TT201的菌落形态和显微形态 Figure 5 Colony and microscopy morphology photos of TT201 注:A:菌落形态;B:显微形态. Note: A: Colony morphology photo; B: Microscopy morphology photo. |
|
|
|
| 图 6 菌株SR308的菌落形态和显微形态 Figure 6 Colony and microscopy morphology photos of SR308 注:A:菌落形态;B:显微形态. Note: A: Colony morphology photo; B: Microscopy morphology photo. |
|
|
两株内生细菌的部分生理生化鉴定结果见表 5,生理生化反应结果的测定以实验室保存的模式菌株大肠杆菌和枯草芽孢杆菌为依据。菌株TT201的运动性、接触酶、甲基红、硫化氢反应均呈阳性,V-P、柠檬酸盐反应为阴性,能够产生吲哚,不能水解淀粉,能利用葡萄糖、硝酸盐,水解明胶和纤维素,与短芽孢杆菌属(Brevibacillus)菌种特征基本相符。菌株SR308的运动性、接触酶、甲基红、硫化氢、V-P反应均呈阳性,柠檬酸盐反应为阴性,能水解淀粉,能利用葡萄糖、硝酸盐,水解明胶和纤维素,与芽孢杆菌属(Bacillus)菌种特征基本相符。初步鉴定这两株菌株分别为短芽孢杆菌属(Brevibacillus)和芽孢杆菌属(Bacillus)。
| 测定指标Items | TT201 | SR308 |
| 葡萄糖产酸Glucose produces acid | + | + |
| 葡萄糖产气Glucose produces gas | − | + |
| 运动性Motility | + | + |
| 接触酶Catalase | + | + |
| 甲基红Methyl red | + | + |
| 淀粉水解Starch hydrolysis | − | + |
| V-P | − | + |
| 吲哚产生Benzpyrole | + | − |
| 柠檬酸盐利用Citrate utilization | − | − |
| 硝酸盐还原Nitrate reduction | + | + |
| 明胶液化Gelatin liquefaction | + | + |
| 纤维素水解Lignocellulose hydrolyzed | + | + |
| 硫化氢H2S | + | + |
| 注:+:阳性反应;–:阴性反应. Note: +: Positive; –: Negative. |
||
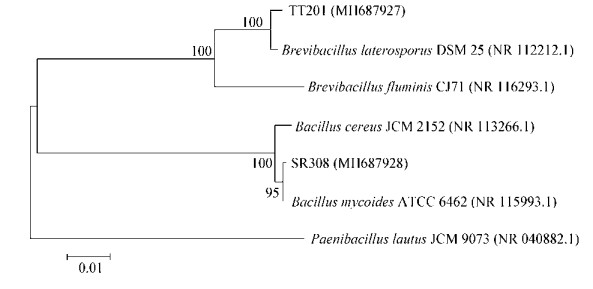
从测序结果可知,菌株TT201的16S rRNA基因片段长度为1 400 bp左右,菌株SR308的16S rRNA基因片段长度为1 420 bp左右。构建系统发育树结果显示(图 7),TT201与Brevibacillus laterosporus DSM 25 (NR 112212.1)位于同一分支,其聚类支持强度为100%;SR308与Bacillus mycoides ATCC 6462 (NR 115993.1)位于同一分支,其聚类支持强度为95%。结合形态和生理生化特征将菌株TT201鉴定为侧孢短芽孢杆菌(Brevibacillus laterosporus),菌株SR308鉴定为蕈状芽孢杆菌(Bacillus mycoides)。
|
| 图 7 基于16S rRNA基因序列应用临近法构建TT201和SR308的系统发育树 Figure 7 Phylogenetic tree based on 16S rRNA gene sequences of TT201 and SR308 with the Neighbor-Joining method 注:参与比对序列的GenBank登录号列于括号中,分支处标注有自展值,标尺所示长度为0.01核苷酸置换率. Note: The GenBank accession numbers of aligned sequences are shown in the brackets. The bootstrap values are shown at the node. Bar 0.01 means the nucleotide substitution rate of 0.01. |
|
|
植物内生细菌与宿主植物在长期协同进化的过程中形成了互惠互利的共生关系,一方面植物为内生细菌提供生长必需的能量和营养物质,另一方面内生细菌可产生生物活性物质或借助于信号传导作用对植物体产生影响。植物内生细菌具有固氮、生防、促植物生长、增强宿主植物抗逆性、抗病虫害等多种生物学作用[18]。已有研究表明,植物内生细菌可产生抗菌类物质抑制病原菌对宿主的侵害,减少植物的发病率,还可通过竞争生态位和营养抑制植物病原菌的侵染和生长,从而达到生物防治的作用[19];内生细菌也能产生生长调节类物质促进宿主植物的生长,同时还可促进宿主植物对氮、磷、钾、铁等营养物质的吸收[20-21]。
本研究从沙棘根瘤内生细菌中筛选出一株具有广谱抑菌作用的内生细菌TT201,经鉴定为侧孢短芽孢杆菌。抑菌初筛发现菌株TT201对E. coli、B. subtilis和S. aureus的抑制带宽分别为20.3、18.8和23.9 mm,对黄瓜枯萎病菌和黄芪根腐病菌的抑制带宽为23.3 mm和23.2 mm。复筛的结果发现其对E. coli、B. subtilis和S. aureus的抑制带宽分别为20.3、16.3和18.3 mm,对黄瓜枯萎病菌和黄芪根腐病菌的抑制带达24.5 mm和25.2 mm。与初筛相比,复筛结果中菌株TT201对枯草芽孢杆菌和金黄色葡萄球菌的抑菌性较弱,说明此菌株对革兰氏阳性菌的抑制性低于革兰氏阴性菌。总体而言,菌株TT201对5种供试病原菌均表现出相对较强的抑制能力。复筛结果也发现,部分沙棘根瘤内生细菌对黄瓜枯萎病菌的抑制性强于黄芪根腐病菌,其原因可能是由于两种枯萎病菌属不同生理专化型而引起的。沈文渊[22]研究发现,不同枯萎病专化型镰刀菌对植物有不同程度的致病性,同种药剂对不同枯萎病专化型镰刀菌的抑制效果也存在差异。当然,在筛选抑菌高效、稳定的生防内生细菌时只使用一种或少数几种病原菌作为筛选条件是远远不够的,这会导致所筛选的内生细菌生防能力单一、综合防治效果差、应用范围窄[4]。因此,在筛选生防内生菌时应选取多种病原菌作为筛选目标,也可将多种菌剂配合使用,开发新型农用微生物菌肥,同时进行盆栽和大田试验进行验证,提高植物内生细菌的综合防治效果。
本研究从131株沙棘根瘤内生细菌中筛选出一株具有较好促生活性的内生细菌SR308,它也具有较好的抑菌作用,经鉴定为蕈状芽孢杆菌。研究发现,菌株SR308能够产生植物生长激素IAA,其含量达到23.17±0.17 μg/mL;同时能溶解难溶性磷酸盐,产生嗜铁素,有较高的促生活性。王秀呈等[23]研究发现,水稻内生固氮菌除有固氮作用外,还同时具有溶磷、产铁和分泌生长激素的能力。本研究结果发现,沙棘根瘤内生细菌SR308具有产IAA、铁载体和溶磷的能力,但对其是否具有固氮作用还需进一步的研究。
郑文波等[24]研究发现高产吲哚乙酸并具解磷作用的芽孢杆菌具有促生作用。本研究也发现,蕈状芽孢杆菌SR308的发酵液对黄瓜的生长具有明显的促进作用,用菌株SR308发酵液处理过的黄瓜苗株高达64.8 cm,比对照组高19.4 cm;其叶绿素总含量达到2.61 mg/g,比对照组高1.31 mg/g。袁玉娟[25]发现芽孢杆菌能降低黄瓜枯萎病发病率并促进黄瓜生长,这与本研究结果较相似,但本试验的菌株SR308对黄瓜具有促生长作用,其是否对黄瓜枯萎病具有防治作用还需进一步验证。对于菌株SR308促进黄瓜的生长是否因为菌株所产生的IAA、铁载体或解磷作用,还需研究探讨。因此,进一步研究沙棘根瘤内生细菌的促生性能及其促生机理,可为提高内生细菌对植物生长促生效果的研究提供丰富的理论依据。
| [1] |
Zhang XJ, Liu RJ. Broad and narrow definition of endophytes and related advances in the study[J]. Microbiology China, 2014, 41(3): 560-571. (in Chinese) 张晓婧, 刘润进. 广义与狭义植物内生生物的定义及其研究进展[J]. 微生物学通报, 2014, 41(3): 560-571. |
| [2] |
Cao K, Wang XN, Sun YF, et al. Research progress on endophytic bacterial diversity and biocontrol of plant roots[J]. Agriculture & Technology, 2017, 37(17): 1-3. (in Chinese) 曹焜, 王晓楠, 孙宇峰, 等. 植物根部内生细菌多样性及其生防作用研究进展[J]. 农业与技术, 2017, 37(17): 1-3. |
| [3] |
Qiu BS. Nodule endophytic bacteria[J]. Microbiology China, 2013, 40(3): 544. (in Chinese) 邱并生. 根瘤内生细菌[J]. 微生物学通报, 2013, 40(3): 544. |
| [4] |
He LM, Ye JR. Endophytic bacteria: research advances and biocontrol applications[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2014, 38(6): 153-159. (in Chinese) 何玲敏, 叶建仁. 植物内生细菌及其生防作用研究进展[J]. 南京林业大学学报:自然科学版, 2014, 38(6): 153-159. |
| [5] |
Li W, Liu M, Zhang BX, et al. Research progress and application status of plant growth promoting Rhizobacteria[J]. Chinese Agricultural Science Bulletin, 2014, 30(24): 1-5. (in Chinese) 李琬, 刘淼, 张必弦, 等. 植物根际促生菌的研究进展及其应用现状[J]. 中国农学通报, 2014, 30(24): 1-5. DOI:10.11924/j.issn.1000-6850.2013-3360 |
| [6] |
Tang M, Gong MF, Guan QL, et al. Screening of endophytic bacteria resistant to MRSA of Arisaema heterophyllum Bl. in Emei mountain[J]. Jiangsu Agricultural Sciences, 2015, 43(7): 388-389. (in Chinese) 唐梅, 龚明福, 管芩澜, 等. 峨眉山异叶天南星抗MRSA内生细菌的筛选[J]. 江苏农业科学, 2015, 43(7): 388-389. |
| [7] |
Xu RR. The isolation, cuture and molecular identification of frankia and non-frankia actinomycetes from Hippophae rhamnoidoes root nodules[D]. Beijing: Master's Thesis of Chinese Academy of Forestry, 2011 (in Chinese) 徐瑞瑞.沙棘弗兰克氏和非弗兰克氏放线菌的分离、培养及分子鉴定[D].北京: 中国林业科学研究院硕士学位论文, 2011 http://cdmd.cnki.com.cn/Article/CDMD-82201-1011247132.htm |
| [8] |
Zhang AM, Han XY, Sun K, et al. Root nodules endophytic and rhizosphere soil bacteria diversity of Hippophae rhamnoidoes subsp. sinensis based on high-throughput sequencing[J]. Grassland and Turf, 2018, 38(2): 49-55. (in Chinese) 张爱梅, 韩雪英, 孙坤, 等. 高通量测序分析中国沙棘根瘤与根际土壤细菌多样性[J]. 草原与草坪, 2018, 38(2): 49-55. DOI:10.3969/j.issn.1009-5500.2018.02.009 |
| [9] |
Zhang Y. Isolation and identification of endophytic bacteria from Ginger and their plant growth promotion potential[D]. Sichuan: Master's Thesis of Sichuan Agricultural University, 2015 (in Chinese) 张雨.生姜内生细菌分离鉴定及促生效果研究[D].四川: 四川农业大学硕士学位论文, 2015 |
| [10] |
Nieto-Lozano JC, Reguera-Useros JI, Peláez-Martínez MC, et al. Effect of bacteriocin produced by Pediococcus acidolactici against Listeria monocytogenes and Clostridium perfringens on Spanish raw meat[J]. Meat Science, 2006, 72(1): 57-61. DOI:10.1016/j.meatsci.2005.06.004 |
| [11] |
Ji SH, Gururani MA, Chun SC. Isolation and characterization of plant growth promoting endophytic diazotrophic bacteria from Korean rice cultivars[J]. Microbiological Research, 2014, 169(1): 83-98. DOI:10.1016/j.micres.2013.06.003 |
| [12] |
Yang S, Yang T, Lin B, et al. Isolation and evaluation of two phosphate-dissolving fungi[J]. Acta Microbiologica Sinica, 2018, 58(2): 264-273. (in Chinese) 杨顺, 杨婷, 林斌, 等. 两株溶磷真菌的筛选、鉴定及溶磷效果的评价[J]. 微生物学报, 2018, 58(2): 264-273. |
| [13] |
Jiang XW, Li HQ, Tan Y. Identification, tolerance to abiotic stress and host plant effects of endophytic bacteria HX-2 from Agastache rugose[J]. Acta Prataculturae Sinica, 2018, 27(1): 161-168. (in Chinese) 江绪文, 李贺勤, 谭勇. 藿香内生细菌HX-2的鉴定、耐性及对宿主植物的促生作用[J]. 草业学报, 2018, 27(1): 161-168. |
| [14] |
Tian Q. Isolation and identification of endophytic diazotrophic bacteria from wheat and their effect on wheat seedling growth[D]. Yangling: Masterʼs Thesis of Northwest A & F University, 2012 (in Chinese) 田琴.小麦内生放线菌的分离鉴定及防病促生作用研究[D].杨凌: 西北农林科技大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10712-1012437024.htm |
| [15] |
Dong XZ, Cai MY. Handbook of Systematic Identification of Common Bacteria[M]. Beijing: Science Press, 2001: 43-386. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 43-386. |
| [16] |
Wang Q, Tang JN, Tang C, et al. Rapid method with microwave oven heating for bacterial DNA extraction applied to PCR amplification[J]. Journal of Southwest University for Nationalities (Natural Science Edition), 2015, 41(2): 150-155. (in Chinese) 王琼, 唐俊妮, 汤承, 等. 一种采用微波炉加热快速提取细菌DNA用于PCR扩增的方法[J]. 西南民族大学学报:自然科学版, 2015, 41(2): 150-155. |
| [17] |
Feng GD, Chen MB, Yang SZ, et al. A comparative study on bacteria DNA extraction methods used for PCR amplification[J]. Journal of South China Agricultural University, 2013, 34(3): 439-442. (in Chinese) 冯广达, 陈美标, 羊宋贞, 等. 用于PCR扩增的细菌DNA提取方法比较[J]. 华南农业大学学报, 2013, 34(3): 439-442. |
| [18] |
Wen CY, Wu YH, Tian XL. Recent advances and issues on the endophyte[J]. Chinese Journal of Ecology, 2004, 23(2): 86-91. (in Chinese) 文才艺, 吴元华, 田秀玲. 植物内生菌研究进展及其存在的问题[J]. 生态学杂志, 2004, 23(2): 86-91. DOI:10.3321/j.issn:1000-4890.2004.02.019 |
| [19] |
Zhang QL, Yang YH, Tan ZJ, et al. The progress of researches on endophytic functions in vegetations[J]. Biotechnology Bulletin, 2010(7): 28-34. (in Chinese) 张祺玲, 杨宇红, 谭周进, 等. 植物内生菌的功能研究进展[J]. 生物技术通报, 2010(7): 28-34. |
| [20] |
Zhou JP, Yang BS, Dai J. Biological effect and prospect of endophytes[J]. Journal of Qujing Normal University, 2016, 35(3): 35-40. (in Chinese) 周俊萍, 杨本寿, 代娇. 植物内生菌的生物学作用及应用前景[J]. 曲靖师范学院学报, 2016, 35(3): 35-40. DOI:10.3969/j.issn.1009-8879.2016.03.008 |
| [21] |
Yang Z, Cao J. Research progress of endophytic fungi and their secondary metabolites[J]. Journal of Microbiology, 2016, 36(4): 1-6. (in Chinese) 杨镇, 曹君. 植物内生菌及其次级代谢产物的研究进展[J]. 微生物学杂志, 2016, 36(4): 1-6. DOI:10.3969/j.issn.1005-7021.2016.04.001 |
| [22] |
Shen WY. Biological characteristics and biological control research on four kinds of gourd Fusarium wilt[D]. Ya'an: Master's Thesis of Sichuan Agricultural University, 2012 (in Chinese) 沈文渊.瓜类枯萎病菌四种专化型的生物学特性及瓜类枯萎病生物防治研究[D].雅安: 四川农业大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10626-1013157501.htm |
| [23] |
Wang XC, Cao YH, Tang X, et al. Rice endogenous nitrogen fixing and growth promoting bacterium Herbaspirillum seropedicae DX35[J]. Acta Microbiologica Sinica, 2014, 54(3): 292-298. (in Chinese) 王秀呈, 曹艳花, 唐雪, 等. 水稻内生固氮菌Herbaspirillum seropedicae DX35的筛选及其促生特性[J]. 微生物学报, 2014, 54(3): 292-298. |
| [24] |
Zheng WB, Shen F, Yan XM, et al. Isolation and identification of the IAA-producing and phosphate-dissolving bacteria and its promoting effects on red soil[J]. Soil, 2015, 47(2): 361-368. (in Chinese) 郑文波, 申飞, 闫小梅, 等. 红壤中产吲哚乙酸并具解磷作用的促生菌筛选鉴定及促生效果研究[J]. 土壤, 2015, 47(2): 361-368. |
| [25] |
Yuan YJ. Cucumber growth promotion and wilt disease suppression of Bacillus subtilis SQR9 and their mechanisms[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2011 (in Chinese) 袁玉娟. Bacillus subtilis SQR9的黄瓜促生和枯萎病生防效果及其作用机制研究[D].南京: 南京农业大学硕士学位论文, 2011 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2038165 |
 2019, Vol. 46
2019, Vol. 46