扩展功能
文章信息
- 程晓宇, 刘伟伟, 许楹, 周宁一
- CHENG Xiao-Yu, LIU Wei-Wei, XU Ying, ZHOU Ning-Yi
- 中国东海和南海海域可培养烃类降解细菌的筛选及功能
- Screening and characterization of culturable hydrocarbon-degrading strains from the South and East China Seas
- 微生物学通报, 2019, 46(5): 975-985
- Microbiology China, 2019, 46(5): 975-985
- DOI: 10.13344/j.microbiol.china.180685
-
文章历史
- 收稿日期: 2018-09-04
- 接受日期: 2018-12-12
- 网络首发日期: 2019-01-28
烃类化合物是由碳元素和氢元素构成的化合物,主要包含烷烃、环烷烃、烯烃、炔烃、芳香烃等[1]。烃类化合物均难溶于水,短链烃类化合物易挥发,长链烷烃、环烷烃和芳烃化合物等不易挥发、有毒且难降解。研究表明,烃类化合物污染土壤会损害植物的根系,阻碍植物根系的吸收作用及呼吸作用,最终导致植物的死亡。烃类化合物污染水体并被水中的鱼类经皮肤吸附、摄食作用积累在体内,并进一步通过食物链的传递作用富集在人体内,进而危害人体健康[2]。
陆地与海洋沉积物中的烃类化合物的来源和组成十分复杂,其来源方式主要包括矿物油的直接输入,农业生产中农药的滥用,大气颗粒物的沉降,工业废弃物、城市生活垃圾等的排放,以及天然有机化合物的自然降解等[3-4]。其中矿物油的直接输入和农药的滥用为主要烃类化合物来源。据报道目前每年有800万t的石油进入环境,其中我国每年就有60多万t石油释放到土壤、海洋中,严重污染了土壤、地下水、河流和海洋,给生态带来了严重的危害[5-7];另一方面,我国是农药生产和消耗大国,在农业生产过程中农药投入量高达每年60万t左右,其中又有80%不能被完全利用而被释放到土壤、河流和海洋中[8-9]。针对修复烃类化合物造成的环境污染,目前常用的修复手段主要为物理修复、化学修复和生物修复技术等[10-13]。其中生物修复技术尤其是微生物原位修复技术因其成本低、修复效率高、可原位修复、不会造成二次污染等优势已经引起学者们的关注[14-16]。
我国是一个海洋大国,毗邻中国大陆的东部和南部海域包括渤海、黄海、东海和南海,海岸线长1.8万km,岛屿海岸线长1.4万km,总面积为473万km2。我国海域横跨温带、亚热带和热带3种气候带,拥有4大类型海洋生态系统,包括滨海湿地生态系统、珊瑚礁生态系统、上升流生态系统和深海生态系统。广阔海洋下火山、海盆等多种多样理化性质迥异的地质结构,为微生物及其他生物的繁衍创造了特殊生境,也为海洋烃类化合物降解菌株的筛选以及原位修复海洋烃类化合物污染创造了条件[17-19]。
现有文献对海洋烃类化合物降解菌株的研究仅停留在对烷烃降解菌的筛选上[20-21],很少有研究关注简单及复杂芳烃化合物降解菌的筛选。本研究将从我国东海和南海近海沉积物中筛选和分离能够降解烃类化合物的菌株,并对这些降解菌株进行鉴定,然后进一步分析烃类化合物降解菌株的多样性,丰富我国海洋菌种资源库,并为我国海洋保护法的制定与完善提供参考,也为原位修复烃类污染的海洋环境储备菌种资源。
1 材料与方法 1.1 材料 1.1.1 样品采集采样站点如图 1所示,样品分两批次分别从南海及东海海域采集:2016年6月于南海采集第一批海底沉积物样;2017年6月于东海海域A2和B2两站点采集第二批海底沉积物样品。样品采集后置于4 ℃保存,运抵实验室后立即进行烃类降解细菌的筛选、分离、纯化、鉴定。

|
| 图 1 我国东海和南海样品采集点分布示意图 Figure 1 Sampling sites of the South and East China Seas |
|
|
十一烷、十二烷基苯、十六烷、二十烷、碱木素购自Sigma公司;肉桂酸、香豆酸、香草醛、对羟基苯甲酸、苯甲酸、苯丙酸、间羟基肉桂酸购自Aladdin公司。
摇床,上海知楚仪器有限公司;恒温培养箱,上海精宏实验设备有限公司;PCR扩增仪,Bio-Rad公司;高速离心机,Eppendorf公司。
1.1.3 培养基人工海水培养基(MMC,g/L):NaCl 24.0,NH4Cl 1.0,KCl 0.7,Na2HPO4·12H2O 3.0,KH2PO4 2.0,调节pH 7.2−7.4,1×105 Pa灭菌30 min后补加2%微量元素溶液。
微量元素溶液(g/L):MgSO4·7H2O 10.0,CuSO4·5H2O 1.0,FeSO4·7H2O 1.0,CaCl2 1.0,MnSO4 1.0,经0.22 μm滤膜过滤除菌。
LB培养基(g/L):NaCl 10.0,胰蛋白胨10.0,酵母提取物5.0,调节pH 7.0,1×105 Pa灭菌30 min。固体培养基在液体培养基的基础上添加1.0%−1.5%的琼脂。
1.2 方法 1.2.1 烃类化合物降解菌的富集在超净工作台内,用无菌药匙取约1 g沉积物于补加相应烃类化合物为唯一碳源的MMC培养基,20 ℃、150 r/min培养。培养1周后,对富集物以1%的接种量进行转接,共重复2次。
1.2.2 菌株分离纯化将最后一次不同碳源富集培养的菌液根据OD600值分别以1×10−1、1×10−2、1×10−3、1×10−4、1×10−5等梯度稀释后均匀涂布于LB固体培养基平板上并标记碳源和菌株编号,置于20 ℃恒温培养。培养3 d左右平板上可见菌落生长。根据菌落形态、大小等特征分别挑取不同单菌落进行划线,获得纯培养。
1.2.3 菌株降解验证前处理挑取单菌落于LB液体培养基中,标记碳源和菌株编号,20 ℃条件下培养,获得菌液;然后吸取1 mL菌液于无菌离心管中,6 000 r/min离心3 min,弃上清,再用等体积MMC培养基重悬后6 000 r/min离心3 min,弃上清,清洗菌体,重复2次。之后用等体积MMC培养基将菌体重悬,用于生长验证。
1.2.4 降解验证在含有2%微量元素的MMC培养基补加终浓度2 mmol/L的烃类化合物碳源,并接入1%相应降解菌株菌液,对照组MMC培养基设置为两组:第一组设置为只添加碳源,而不接入降解菌;第二组设置为只接入降解菌而不添加碳源。实验组和对照组均置于20 ℃、150 r/min培养,观察并记录具有降解作用的菌株。
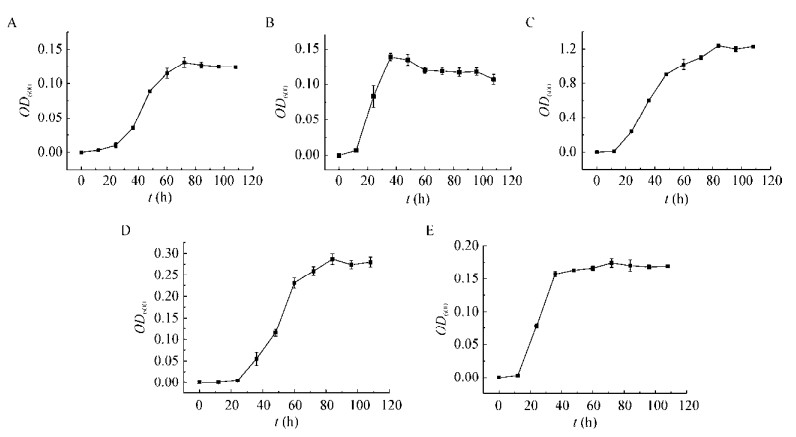
1.2.5 部分烃类化合物降解菌株生长情况研究分别挑取间羟基肉桂酸降解菌NyZ302、肉桂酸降解菌NyZ306、十六烷降解菌NyZ309、十二烷基苯降解菌NyZ313和苯甲酸降解菌NyZ321于LB液体培养基,30 ℃、150 r/min培养至OD600值为0.5左右;然后分别取1 mL菌液6 000 r/min离心5 min收集菌体,并用100 mmol/L pH 7.4的磷酸缓冲液清洗菌体3次后重悬于1 mL MMC培养基中;最后以1%的接种量分别接种于含有2%微量元素溶液、终浓度2 mmol/L间羟基肉桂酸、肉桂酸、十六烷、十二烷基苯或苯甲酸的MMC培养基中,于30 ℃、150 r/min培养,期间每隔12 h取样一次,利用紫外分光光度计测定OD600值。以培养时间为横坐标,菌液OD600值为纵坐标绘制生长曲线。
1.2.6 降解菌株鉴定通过煮沸法提取细菌DNA[22]:取降解菌株的LB培养液100 μL于离心管中,6 000 r/min离心5 min后弃上清,用无菌水洗2次后再加入200 μL无菌水重悬,沸水煮10 min后冰浴5 min,然后12 000 r/min离心5 min,取上清液于新的离心管中,制成菌裂解液,4 ℃保存。
细菌16S rRNA基因通用引物为27F (5ʹ-AGAGTTTGATCATGGCTCAG-3ʹ)和1492R (5ʹ-TACG GCTACCTTGTTACGACTT-3ʹ)。PCR反应体系(50 μL):2×Mix 25 μL,双蒸水20 μL,DNA模板2.5 μL,16S rRNA基因上游引物27F及下游引物1492R (10 μmol/L)各1.25 μL。PCR反应条件为:95 ℃ 5 min;95 ℃ 1 min,55 ℃ 30 s,72 ℃ 30 s,29次循环;72 ℃ 4 min。PCR产物用0.8%的琼脂糖凝胶电泳分离,Goldview染色,凝胶成像分析仪观察PCR扩增结果。PCR产物送上海擎熙生物技术有限公司测序。在NCBI (http://www.ncbi.nlm.nih.gov/BLAST)进行BLASTn比对分析以确定与其相似性较高的模式菌株,并对所有降解菌株进行甘油保种。
2 结果与分析 2.1 3个站点烃类化合物降解菌的分离培养通过对3组沉积物样品分别以12种烃类化合物为唯一碳源进行3次富集培养,获得各自的富集培养菌液。之后对每种富集菌液稀释涂布,获得可能的降解菌株,纯培养后进行降解验证。以十六烷(n-Hexadecane,HD)降解菌株利用底物十六烷为唯一碳源生长实验为例来描述降解菌的分离培养。如图 2所示,添加十六烷为碳源的实验组培养液变浑浊,而不接降解菌株和不添加十六烷为碳源的无机盐培养基的两组对照组培养液未变浑浊,从而证明筛选菌株具有降解该底物的能力。在3组沉积物样品中共获得63株具有烃类化合物降解功能的菌。其中,在南海沉积物中共筛选出25株;在东海A2站点沉积物中共筛选出19株;在东海B2站点沉积物中共筛选出19株。

|
| 图 2 十六烷降解菌株对十六烷的降解功能验证 Figure 2 Degradation of n-hexadecane by n-hexadecane-degrading strains |
|
|
选择其中的5株不同烃类降解菌株NyZ302、NyZ306、NyZ309、NyZ313、NyZ321,检测这5株菌分别在以含有2 mmol/L间羟基肉桂酸、肉桂酸、十六烷、十二烷基苯和苯甲酸的MMC培养基中生长情况。
如图 3所示,菌株NyZ302在以2 mmol/L间羟基肉桂酸为唯一碳源的MMC培养基上培养约60 h后其生长达到平台期,OD600值约为0.125;菌株NyZ306在以2 mmol/L肉桂酸为唯一碳源的MMC培养基上培养约40 h后其生长达到平台期,OD600值约为0.14;菌株NyZ309在以2 mmol/L十六烷为唯一碳源的MMC培养基上培养约80 h后其生长达到平台期,OD600值约为1.25;菌株NyZ313在以2 mmol/L正十二烷基苯为唯一碳源的MMC培养基上培养约80 h后其生长达到平台期,OD600值约为0.30;菌株NyZ321在以2 mmol/L苯甲酸为唯一碳源的MMC培养基上培养约40 h后其生长达到平台期,OD600值约为0.15。总体来看,以上5株降解菌培养时间在60 h左右生长逐渐达到平台期,其中十六烷降解菌株NyZ309生长最佳,OD600值最高,本研究中其他的十六烷降解菌利用该烃类碳源的生长状况与菌株NyZ309类似。
|
| 图 3 部分烃类化合物降解菌生长曲线 Figure 3 Growth curves of hydrocarbon-degradaing strains 注:A:NyZ302利用间羟基肉桂酸的生长曲线;B:NyZ306利用肉桂酸的生长曲线;C:NyZ309利用十六烷的生长曲线;D:NyZ313利用十二烷基苯的生长曲线;E:NyZ321利用苯甲酸的生长曲线. Note: A: NyZ302 on m-hydroxy cinnamic acid; B: NyZ306 on cinnamic acid; C: NyZ309 on n-hexadecane; D: NyZ313 on 1-phenyldodecane; E: NyZ321 on benzoate. |
|
|
通过16S rRNA基因序列分析鉴定,3个站点筛选出的63株降解菌分属于10个属,这10个属分别为红球菌属(Rhodococcus)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、盐单胞菌属(Halomonas)、弧菌属(Vibrio)、交替单胞菌属(Alteromonas)、志贺氏菌属(Shigella)、肠杆菌属(Escherichia)、硝酸盐还原菌属(Nitratireductor)和芽孢杆菌属(Bacillus)。如图 4所示,63株降解菌中,红球菌属(Rhodococcus)有15株、不动杆菌属(Acinetobacter)有14株,假单胞菌属(Pseudomonas)有12株、盐单胞菌属(Halomonas)有12株,均占有20%左右的比例,其他种属的菌株则仅占有很小的比例。

|
| 图 4 降解菌菌群组成结构 Figure 4 Community composition of degrading bacteria |
|
|
16S rRNA基因序列分析鉴定结果表明,从南海沉积物中分离筛选出的25株烃类化合物降解菌,主要为红球菌属(Rhodococcus)、弧菌属(Vibrio)、盐单胞菌属(Halomonas)、假单胞菌属(Pseudomonas)和芽孢杆菌属(Bacillus)。菌株编号和其可降解烃类化合物如表 1所示,在25株降解菌株中有15株红球菌属(Rhodococcus)占有较大比例;其次为弧菌属(Vibrio)和盐单胞菌属(Halomonas)各4株;而假单胞菌属(Pseudomonas)和芽孢杆菌属(Bacillus)仅各1株。
| 烃类化合物 Hydrocarbon compounds |
菌种 Species |
数目 Amount |
编号 Number |
| m-Hydroxycinnamic acid | Halomonas sp. | 2 | NyZ301, NyZ302 |
| Cinnamic acid | Rhodococcus sp. | 4 | NyZ303, NyZ304, NyZ305, NyZ306 |
| n-Hexadecane | Rhodococcus sp. | 4 | NyZ340, NyZ341, NyZ342, NyZ343 |
| 1-Phenyldodecane | Rhodococcus sp. | 2 | NyZ344, NyZ345 |
| Undecane | Rhodococcus sp. | 3 | NyZ346, NyZ347, NyZ348 |
| Rhodococcus sp. | 2 | NyZ349, NyZ350 | |
| Eicosane | Bacillus sp. | 1 | NyZ351 |
| Vibrio sp. | 4 | NyZ352, NyZ354, NyZ355, NyZ356 | |
| Lignin (Alkali lignin) | Pseudomonas sp. | 1 | NyZ353 |
| Halomonas sp. | 2 | NyZ357, NyZ362 |
从东海A2站点共分离筛选出19株烃类化合物降解菌,16S rRNA基因序列分析鉴定结果表明,19株烃类化合物降解菌主要为不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、盐单胞菌属(Halomonas)、志贺氏菌属(Shigella)和肠杆菌属(Escherichia)。菌株编号和其可降解烃类化合物如表 2所示,在19株降解菌株中不动杆菌属(Acinetobacter)占有较大比例,为7株;其次为假单胞菌属(Pseudomonas),为6株;此外盐单胞菌属(Halomonas)有4株;而志贺氏菌属(Shigella)和肠杆菌属(Escherichia)仅各1株。
| 烃类化合物 Hydrocarbon compounds |
菌种 Species |
数目 Amount |
编号 Number |
| p-Hydroxybenzoic acid | Pseudomonas sp. | 2 | NyZ315, NyZ316 |
| Benzoic acid | Pseudomonas sp. | 1 | NyZ322 |
| Acinetobacter sp. | 1 | NyZ321 | |
| n-Hexadecane | Acinetobacter sp. | 2 | NyZ307, NyZ308 |
| Eicosane | Acinetobacter sp. | 2 | NyZ333, NyZ334 |
| 1-Phenyldodecane | Acinetobacter sp. | 2 | NyZ311, NyZ312 |
| Coumalic acid | Pseudomonas sp. | 1 | NyZ363 |
| Vanillin | Pseudomonas sp. | 2 | NyZ318, NyZ326 |
| 3-Phenylpropanoic acid | Shigella sp. | 1 | NyZ319 |
| Escherichia sp. | 1 | NyZ320 | |
| Lignin (Alkali lignin) | Halomonas sp. | 4 | NyZ358, NyZ359, NyZ360, NyZ361 |
从东海B2站点共分离筛选出19株烃类化合物降解菌,16S rRNA基因序列分析鉴定结果表明,19株烃类化合物降解菌主要为不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、盐单胞菌属(Halomonas)、交替单胞菌属(Alteromonas)和硝酸盐还原菌属(Nitratireductor)。菌株编号和其可降解烃类化合物如表 3所示,在19株降解菌株中不动杆菌属(Acinetobacter)占有较大比例,为8株;其次为盐单胞菌属(Halomonas)和假单胞菌属(Pseudomonas),各4株;而交替单胞菌属(Alteromonas)和硝酸盐还原菌属(Nitratireductor)分别仅为2株和1株,占有较小比例。
| 烃类化合物 Hydrocarbon compounds |
菌种 Species |
数目 Amount |
编号 Number |
| p-Hydroxybenzoic acid | Pseudomonas sp. | 2 | NyZ317, NyZ323 |
| Eicosane | Acinetobacter sp. | 4 | NyZ332, NyZ335, NyZ336, NyZ338 |
| Pseudomonas sp. | 2 | NyZ337, NyZ339 | |
| n-Hexadecane | Acinetobacter sp. | 2 | NyZ309, NyZ310 |
| 1-Phenyldodecane | Acinetobacter sp. | 1 | NyZ313 |
| Vanillin | Alteromonas sp. | 2 | NyZ324, NyZ325 |
| Lignin (Alkali lignin) | Halomonas sp. | 4 | NyZ327, NyZ328, NyZ329, NyZ331 |
| Nitratireductor sp. | 1 | NyZ330 | |
| Benzoic acid | Acinetobacter sp. | 1 | NyZ314 |
如表 4所示,在3个站点筛选到的可培养烃类化合物降解菌株种属类别与海域有关。其中东海A2与B2站点同一种烃类化合物的降解菌株基本属于同一种属,东海站点与南海站点同一种烃类化合物的降解菌株种属类型则有较大差别;东海A2和B2站点中降解菌株主要为不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和盐单胞菌属(Halomonas),而南海站点降解菌株主要为红球菌属(Rhodococcus)、弧菌属(Vibrio)和盐单胞菌属(Halomonas),两海域优势降解菌属差别很大,例如东海沉积物中正十六烷和十二烷基苯降解菌主要为不动杆菌属(Acinetobacter),而南海沉积物中主要为红球菌属(Rhodococcus);东海沉积物中正二十烷降解菌主要为不动杆菌属(Acinetobacter)和假单胞菌属(Pseudomonas),南海沉积物中主要为红球菌属(Rhodococcus)和芽孢杆菌属(Bacillus);东海沉积物中木质素降解菌主要为盐单胞菌属(Halomonas),而南海沉积物中木质素降解菌主要为弧菌属(Vibrio)和盐单胞菌属(Halomonas)。
| 烃类化合物 Hydrocarbon compounds |
站点 Sites |
菌种 Species |
| p-Hydroxybenzoic acid | The East China Sea A2 | Pseudomonas sp. |
| The East China Sea B2 | Pseudomonas sp. | |
| The South China Sea | − | |
| m-Hydroxycinnamic acid | The East China Sea A2 | − |
| The East China Sea B2 | − | |
| The South China Sea | Halomonas sp. | |
| Cinnamic acid | The East China Sea A2 | − |
| The East China Sea B2 | − | |
| The South China Sea | Rhodococcus sp. | |
| Benzoic acid | The East China Sea A2 | Acinetobacter sp., Pseudomonas sp. |
| The East China Sea B2 | Acinetobacter sp. | |
| The South China Sea | − | |
| 3-Phenylpropanoic acid | The East China Sea A2 | Shigella sp., Escherichia sp. |
| The East China Sea B2 | − | |
| The South China Sea | − | |
| Vanillin | The East China Sea A2 | Pseudomonas sp. |
| The East China Sea B2 | Alteromonas sp. | |
| The South China Sea | − | |
| n-Hexadecane | The East China Sea A2 | Acinetobacter sp. |
| The East China Sea B2 | Acinetobacter sp. | |
| The South China Sea | Rhodococcus sp. | |
| 1-Phenyldodecane | The East China Sea A2 | Acinetobacter sp. |
| The East China Sea B2 | Acinetobacter sp. | |
| The South China Sea | Rhodococcus sp. | |
| Lignin (Alkali lignin) | The East China Sea A2 | Halomonas sp. |
| The East China Sea B2 | Halomonas sp., Nitratireductor sp. | |
| The South China Sea | Vibrio sp., Halomonas sp., Pseudomonas sp. | |
| Eicosane | The East China Sea A2 | Acinetobacter sp. |
| The East China Sea B2 | Acinetobacter sp., Pseudomonas sp. | |
| The South China Sea | Rhodococcus sp., Bacillus sp. | |
| Undecane | The East China Sea A2 | − |
| The East China Sea B2 | − | |
| The South China Sea | Rhodococcus sp. | |
| Coumalic acid | The East China Sea A2 | Pseudomonas sp. |
| The East China Sea B2 | − | |
| The South China Sea | − | |
| 注:−:在本站点未筛选到该烃类化合物降解菌. Note: −: The hydrocarbon-degrading bacteria were not screened at this site. |
||
为了认识海洋环境中烃类化合物降解菌及其多样性,本研究中分别以肉桂酸、碱木素、十六烷等12种烃类化合物为唯一碳源,对我国南海站点、东海A2和B2站点的沉积物样品进行降解菌株的富集培养;然后将富集菌液梯度稀释涂布于固体LB培养基进行降解菌的分离纯化,以及鉴定降解能力;随后通过对各个降解菌的16S rRNA基因进行测序和对比分析。结果表明筛选出的63株降解菌分别属于10个属,并且南海站点菌株类型与东海A2和B2站点差别很大,南海的烃类化合物降解菌株主要为红球菌属(Rhodococcus)、弧菌属(Vibrio)和盐单胞菌属(Halomonas),东海的烃类化合物降解菌株主要为不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和盐单胞菌属(Halomonas)。
石油烃类化合物、木质素降解菌在东海和南海中均有分布,东海沉积物中占优势的石油烃类化合物降解菌、木质素降解菌为不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和盐单胞菌属(Halomonas),南海沉积物中占优势的石油烃类化合物降解菌、木质素降解菌为红球菌属(Rhodococcus)、弧菌属(Vibrio)和盐单胞菌属(Halomonas);对于单环芳烃化合物降解菌则可能在东南海沉积物中并非广泛存在。造成实验中筛选得到的东海和南海烃类化合物降解菌种类有较大差异的原因可能与采样点距离大陆的距离、受人类活动的影响大小,以及海底的环境有关。目前对海洋中的烃类化合物降解菌株的筛选大部分集中在以石油为唯一碳源的石油烃降解菌株的筛选,其降解菌株主要为盐单胞菌属(Halomonas)、食烷菌属(Alcanivorax)、海杆菌属(Marinobacter)、微杆菌属(Microbacterium)等[23],并且研究表明γ-变形菌纲中的食烷菌属(Alcanivorax)[24]、海源菌属(Idiomarina)等是海洋中广泛存在的优势石油烃降解菌。然而在本实验中,以十六烷、正十二烷基苯、十一烷等单一石油组分为唯一碳源筛选石油烃降解菌时,并未筛选到食烷菌属(Alcanivorax)、海杆菌属(Marinobacter)、海源菌属(Idiomarina)、微杆菌属(Microbacterium)等这类优势菌属,而降解菌集中在盐单胞菌属(Halomonas)、红球菌属(Rhodococcus)、不动杆菌属(Acinetobacter)和假单胞菌属(Pseudomonas)中,推测这些差异的出现可能与不同研究中碳源的选择和研究中菌株筛选条件的选择有关。在以单环芳烃化合物为唯一碳源筛选降解菌株时,我们在研究中也获得了一些未被报道过的降解菌株,例如目前文献报道的间羟基肉桂酸降解菌主要为Escherichia coli K-12、Salmonella typhimurium、Streptomyces coelicolor等[25],而我们在南海海底沉积物中筛选到了2株未被报道过的具有间羟基肉桂酸降解功能的盐单胞菌(Halomonas);现阶段很少有文献报道肉桂酸降解菌的筛选,我们在南海沉积物中也筛选到了4株具有肉桂酸降解功能的红球菌(Rhodococcus);现阶段关于香草醛的降解菌的报道主要为Bacillus coagulans[26]、Rhodococcus jostii RHA1[27]等,然而我们在东海A2站点沉积物中也筛选到了2株未被报道过的具有香草醛降解功能的交替单胞菌(Alteromonas)。现阶段研究人员对木质素降解菌的研究主要集中在真菌上,对细菌的木质素降解研究关注很少,已知的木质素降解菌主要为链霉菌(Streptomyces)、微杆菌(Microbacterium)、红球菌(Rhodococcus)、假单胞菌(Pseudomonas)、伯克霍尔德氏(Burkholderia)、肠杆菌(Enterobacter)[28]等,我们分别在南海沉积物、东海A2和B2站点沉积物中筛选到了木质素的降解菌,包括弧菌(Vibrio)、盐单胞菌(Halomonas)和硝酸盐还原菌(Nitratireductor),这些未被报道的降解菌株被筛选得到也表明了在我国东海和南海沉积物中蕴藏着丰富的具有烃类化合物降解功能的微生物资源。
对东海A2、B2和南海这3个站点降解菌的16S rRNA基因鉴定结果分析发现,与筛选得到的降解菌一致性比较高的菌株在海洋环境的分布很广泛。例如:美丽盐单胞菌(Halomonas venusta)在我国南海中广泛分布,在来源于南海的石油降解菌群中分离得到,该菌株与来自东海A2站点的木质素降解菌株NyZ360、NyZ361等一致性比较高;麦氏交替单胞菌(Alteromonas macleodii)同样在海洋中分布广泛,在来源于大西洋、印度洋和西南太平洋等海域的石油降解菌群以及多环芳烃降解菌群中分离得到,该菌与来自东海B2站点的香草醛降解菌株NyZ324、NyZ325等一致性比较高;解藻酸弧菌(Vibrio alginolyticus)、魔鬼弧菌(Vibrio diabolicus)、副溶血弧菌(Vibrio parahaemolyticus)等作为水生生物的致病菌,在海洋中分布更为广泛[29],它们与来自南海站点的木质素降解菌株NyZ354、NyZ355、NyZ356等一致性比较高。由此初步推测这些种属细菌在海洋环境中广泛分布,并且绝大部分具有潜在的烃类化合物降解能力。
目前对海洋中香草醛、肉桂酸等单环芳烃化合物和木质素等芳香性高聚物的降解菌的筛选研究工作报道很少,然而这些简单芳烃化合物和复杂芳香性高聚物[30-31]在海洋中分布广泛,并且也会对海洋环境造成一定的破坏。我们在研究中也获得了这些单环芳烃化合物和芳香性高聚物的降解菌,并且这些降解菌大部分属于红球菌属(Rhodococcus)、假单胞菌属(Pseudomonas)、盐单胞菌属(Halomonas)、弧菌属(Vibrio)等,这部分的工作也可以进一步丰富芳烃化合物海洋降解菌库。诚然,相应的肉桂酸等部分单环芳烃化合物、木质素等芳香性高聚物的降解机制还需要进一步的研究。本研究在一定程度上能够反映我国东南海中烃类化合物降解菌的多样性以及它们在海洋有机碳循环中的可能作用,并可为原位高效修复海洋烃类化合物的污染提供一定的菌种储备。
致谢: 衷心感谢上海交通大学生命科学技术学院王风平教授提供沉积物样品。| [1] |
Zhang HS. Hydrocarbon and Hydrocarbon Derivatives[M]. 2nd ed. Ji'nan: Shandong Education Publishing House, 2001. (in Chinese) 张洪生. 烃及烃的衍生物[M]. 2版. 济南: 山东教育出版社, 2001. |
| [2] |
Bælum J, Borglin S, Chakraborty R, et al. Deep-sea bacteria enriched by oil and dispersant from the Deepwater Horizon spill[J]. Environmental Microbiology, 2012, 14(9): 2405-2416. DOI:10.1111/emi.2012.14.issue-9 |
| [3] |
Pu JB. Research progress on hydrocarbon sources in marine environment[J]. Marine Environmental Science, 1991, 10(2): 69-73. (in Chinese) 蒲家彬. 海洋环境中烃类来源的研究进展[J]. 海洋环境科学, 1991, 10(2): 69-73. |
| [4] |
Wang YQ. Hydrocarbons in the ocean[J]. Marine Environmental Science, 1983, 2(4): 72-80. (in Chinese) 王有清. 海洋中的烃类[J]. 海洋环境科学, 1983, 2(4): 72-80. |
| [5] |
Wei XF, Zhang ZZ, Luo YJ, et al. Bioremediation of heavy oil contaminated soil[J]. Chemistry & Bioengineering, 2005, 22(7): 7-9. (in Chinese) 魏小芳, 张忠智, 罗一菁, 等. 重质石油污染土壤的生物修复[J]. 化学与生物工程, 2005, 22(7): 7-9. DOI:10.3969/j.issn.1672-5425.2005.07.003 |
| [6] |
Li B. Total petroleum hydrocarbons pollution and its detection methods[J]. Guangdong Chemical Industry, 2010, 37(4): 269-271. (in Chinese) 李波. 石油烃的污染及其检测方法综述[J]. 广东化工, 2010, 37(4): 269-271. DOI:10.3969/j.issn.1007-1865.2010.04.131 |
| [7] |
Song YF, Zhou QX, Song XY, et al. Pollutants residue in soil and the eco-toxicity after irrigation with petroleum wastewater[J]. Chinese Journal of Ecology, 2004, 23(5): 61-66. (in Chinese) 宋玉芳, 周启星, 宋雪英, 等. 石油污灌土壤污染物的残留与生态毒理[J]. 生态学杂志, 2004, 23(5): 61-66. DOI:10.3321/j.issn:1000-4890.2004.05.012 |
| [8] |
Cui ZL, Cui LX, Huang Y, et al. Advances and application of microbial degradation in pesticides pollution remediation[J]. Journal of Nanjing Agricultural University, 2012, 35(5): 93-102. (in Chinese) 崔中利, 崔利霞, 黄彦, 等. 农药污染微生物降解研究及应用进展[J]. 南京农业大学学报, 2012, 35(5): 93-102. |
| [9] |
Du H. Effects to eco-environment of pesticide pollution and its sustainable mangement strategies[J]. Gansu Agricultural Science and Technology, 2010(11): 24-28. (in Chinese) 杜蕙. 农药污染对生态环境的影响及可持续治理对策[J]. 甘肃农业科技, 2010(11): 24-28. DOI:10.3969/j.issn.1001-1463.2010.11.010 |
| [10] |
Kosaric N. Biosurfactants and their application for soil bioremediation[J]. Food Technology & Biotechnology, 2001, 39(4): 295-304. |
| [11] |
Ke W. Microorganism treatment of organic pollutants[J]. Bioengineering, 2005, 21(1): 106. (in Chinese) 柯为. 微生物治理有机污染物[J]. 生物工程学报, 2005, 21(1): 106. DOI:10.3321/j.issn:1000-3061.2005.01.038 |
| [12] |
Li MY. Breeding of petroleum hydrocarbon degradation strains and study on degradation of hydrocarbons in petroleum[D]. Xi'an: Master's Thesis of Northwest University, 2011 (in Chinese) 李茂毅.石油烃降解菌株的选育以及对石油中烃类物质降解的研究[D].西安: 西北大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10697-1011087140.htm |
| [13] |
Zhou ZG, Ma CJ, Yang YY. Research progress of oil spill disposal technology[J]. Safety Health & Environment, 2013, 13(4): 34-37. (in Chinese) 周志国, 马传军, 杨洋洋. 海上溢油处置技术研究进展[J]. 安全、健康和环境, 2013, 13(4): 34-37. DOI:10.3969/j.issn.1672-7932.2013.04.013 |
| [14] |
Swannell RP, Lee K, McDonagh M. Field evaluations of marine oil spill bioremediation[J]. Microbiological Reviews, 1996, 60(2): 342-365. |
| [15] |
Varjani SJ, Upasani VN. Biodegradation of petroleum hydrocarbons by oleophilic strain of Pseudomonas aeruginosa NCIM 5514[J]. Bioresource Technology, 2016, 222: 195-201. DOI:10.1016/j.biortech.2016.10.006 |
| [16] |
Wilkes H, Buckel W, Golding BT, et al. Metabolism of hydrocarbons in n-alkane-utilizing anaerobic bacteria[J]. Journal of Molecular Microbiology and Biotechnology, 2015, 26(1/3): 138-151. |
| [17] |
Zhang XH. Marine Microbiology[M]. Qingdao: China Ocean University Press, 2007. (in Chinese) 张晓华. 海洋微生物学[M]. 青岛: 中国海洋大学出版社, 2007. |
| [18] |
Zhang S. Diversities of marine microbes in China[M]. Beijing: Science Press, 2013. (in Chinese) 张偲. 中国海洋微生物多样性[M]. 北京: 科学出版社, 2013. |
| [19] |
Wang FP, Zhou YH, Zhang XX, et al. Biodiversity of deep-sea microorganisms[J]. Biodiversity Science, 2013, 21(4): 445-455. (in Chinese) 王风平, 周悦恒, 张新旭, 等. 深海微生物多样性[J]. 生物多样性, 2013, 21(4): 445-455. |
| [20] |
Allan SE, Smith BW, Anderson KA. Impact of the Deepwater Horizon oil spill on bioavailable polycyclic aromatic hydrocarbons in Gulf of Mexico coastal waters[J]. Environmental Science & Technology, 2012, 46(4): 2033-2039. |
| [21] |
Kasai Y, Kishira H, Sasaki T, et al. Predominant growth of Alcanivorax strains in oil-contaminated and nutrient- supplemented sea water[J]. Environmental Microbiology, 2010, 4(3): 141-147. |
| [22] |
Li CZ, Mao LQ, Yan T, et al. Screening and identification of a cyclohexylamine-degrading strain and studies on its physiological and biochemical characteristics[J]. Environmental Science & Technology, 2016, 39(8): 1-5. (in Chinese) 李存治, 毛灵琪, 晏婷, 等. 环己胺降解菌的筛选及其生理生化特性研究[J]. 环境科学与技术, 2016, 39(8): 1-5. |
| [23] |
Yang Y, Shao ZZ. Isolation, characterization and diversity of hydrocarbon-degrading bacteria in deep-sea sediments of Indian Ocean[J]. Biotic Resources, 2017, 39(6): 423-433. (in Chinese) 杨洋, 邵宗泽. 印度洋深海沉积物石油烃降解菌分离、鉴定与多样性分析[J]. 生物资源, 2017, 39(6): 423-433. |
| [24] |
Hazen TC, Dubinsky EA, Desantis TZ, et al. Deep-sea oil plume enriches indigenous oil-degrading bacteria[J]. Science, 2010, 330(6001): 204-208. DOI:10.1126/science.1195979 |
| [25] |
Barnes MR, Duetz WA, Williams PA. A 3-(3-hydroxyphenyl) propionic acid catabolic pathway in Rhodococcus globerulus PWD1: cloning and characterization of the hpp operon[J]. Journal of Bacteriology, 1997, 179(19): 6145-6153. DOI:10.1128/jb.179.19.6145-6153.1997 |
| [26] |
Karmakar B, Vohra RM, Nandanwar H, et al. Rapid degradation of ferulic acid via 4-vinylguaiacol and vanillin by a newly isolated strain of Bacillus coagulans[J]. Journal of Biotechnology, 2000, 80(3): 195-202. |
| [27] |
Chen HP, Chow M, Liu CC, et al. Vanillin catabolism in Rhodococcus jostii RHA1[J]. Applied and Environmental Microbiology, 2012, 78(2): 586-588. DOI:10.1128/AEM.06876-11 |
| [28] |
Xie CX, Sun JZ, Li CL, et al. Exploring the lignin degradation by bacteria[J]. Microbiology China, 2015, 42(6): 1122-1132. (in Chinese) 谢长校, 孙建中, 李成林, 等. 细菌降解木质素的研究进展[J]. 微生物学通报, 2015, 42(6): 1122-1132. |
| [29] |
Shao ZZ. Catalogue of China Marine Microbial Collections[M]. Beijing: Chemical Industry Press, 2010. (in Chinese) 邵宗泽. 中国海洋微生物菌种目录[M]. 北京: 化学工业出版社, 2010. |
| [30] |
Liang Z, Zhang DH, Wang M, et al. Distribution of lignin in the surface sediments of the mud area in East China Sea and its implication for tracing terrigenous organic matter[J]. Marine Environmental Science, 2014, 33(4): 509-513, 530. (in Chinese) 梁贞, 张大海, 王敏, 等. 东海泥质区中木质素的分布特征及其指示意义[J]. 海洋环境科学, 2014, 33(4): 509-513, 530. |
| [31] |
Zhang T. Sedimentary records of lignin in Yellow Sea and East China Sea and the application to the study of fate of terrestrial organic carbon and environmental changes[D]. Qingdao: Doctoral Dissertation of Ocean University of China, 2012 (in Chinese) 张婷.黄、东海木质素沉积记录及其在陆源有机物示踪和环境演变研究中的应用[D].青岛: 中国海洋大学博士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10423-1012505892.htm |
 2019, Vol. 46
2019, Vol. 46