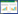扩展功能
文章信息
- 梁华, 王少辉, 吴晓君, 许漩, 田明星, 丁铲, 张焕容, 于圣青
- LIANG Hua, WANG Shao-Hui, WU Xiao-Jun, XU Xuan, TIAN Ming-Xing, DING Chan, ZHANG Huan-Rong, YU Sheng-Qing
- 禽大肠杆菌、肠炎、鼠伤寒、鸡白痢及鸡伤寒沙门菌多重PCR方法的建立及应用
- Multiplex PCR assay for detection of Avian pathogenic E. coli, Salmonella enteritidis, Salmonella typhimurium, Salmonella gallinarum and Salmonella pullorum
- 微生物学通报, 2019, 46(4): 960-966
- Microbiology China, 2019, 46(4): 960-966
- DOI: 10.13344/j.microbiol.china.180269
-
文章历史
- 收稿日期: 2018-04-04
- 接受日期: 2018-06-11
- 网络首发日期: 2018-06-21
2. 中国农业科学院上海兽医研究所 上海 200241
2. Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Shanghai 200241, China
随着集约化养禽业的快速发展,长期、不合理地使用抗生素引起广泛的耐药性,由此导致疾病的发生和流行不断增多,给养禽业造成重要经济损失。目前,严重危害家禽的细菌性传染病主要是禽大肠杆菌病和沙门菌病,表现为心包炎、肝周炎、脑膜炎、败血症、肠炎、白痢、伤寒等症状[1-2],其主要由禽致病性大肠杆菌(Avian pathogenic E. coli,APEC)、肠炎沙门菌(S. enteritidis)、鼠伤寒沙门菌(S. typhimurium)、鸡白痢沙门菌(S. pullorum)和鸡伤寒沙门菌(S. gallinarum)引起。另外,APEC和沙门菌是人畜共患病原,且家禽是APEC和沙门菌的储库,可通过禽类及其产品传播给人类,对人类健康及公共卫生造成潜在威胁[3-5]。
目前,对细菌性疾病的诊断主要通过细菌分类鉴定、血清型鉴定、生化试验、分子生物学技术、免疫学技术等方法。传统方法主要通过血清凝集鉴定沙门菌,但该方法费时费力,且有些血清型难以区分。PCR技术因其特异性强、敏感性高、操作简单、检测快速等优点而被广泛应用[6]。多重PCR具有省时省力、高效经济、简便等优点,可实现并常用于对多种不同病原或多个基因的同步检测。因此,本研究通过序列比对分析确定了禽致病性大肠杆菌、肠炎沙门菌、鼠伤寒沙门菌、鸡白痢沙门菌和鸡伤寒沙门菌的特异性检测靶基因,然后设计引物并建立了一种能够准确快速检测禽大肠杆菌、肠炎沙门菌、鼠伤寒沙门菌、鸡白痢沙门菌和鸡伤寒沙门菌的快速检测PCR方法,为禽大肠杆菌病和沙门菌病的鉴别诊断及流行病学调查提供了技术手段。
1 材料与方法 1.1 菌株禽致病性大肠杆菌DE719、鼠伤寒沙门菌(S. typhimurium) ATCC14028、鼠伤寒沙门菌(S. typhimurium) SL1344、鼠伤寒沙门菌(S. typhimurium) CVCC3384、肠炎沙门菌(S. enteritidis) CVCC3374、肠炎沙门菌(S. enteritidis) CVCC1805、鸡白痢沙门菌(S. pullorum) CVCC519、鸡伤寒沙门菌(S. gallinarum) ATCC9184、禽波氏菌ATCCIPDH591-77、铜绿假单胞菌PA14、鸡毒支原体CVCC1651、猪链球菌、血清1型鸭疫里默氏杆菌CH3、血清2型鸭疫里默氏杆菌Yb2、血清10型鸭疫里默氏杆菌HXb2、单增李斯特菌10403s、禽巴氏杆菌CVCC493、金黄色葡萄球菌CVCC543、禽致病性大肠杆菌临床分离株和沙门菌临床分离株由上海兽医研究所保存。
1.2 主要试剂和仪器DNA marker、2×Taq PCR Master Mix,北京康为世纪生物科技有限公司;GeneJET Gel Extraction Kit,Thermo公司;细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司。PCR仪,ABI公司;核酸电泳仪、全自动凝胶成像系统,上海天能科技有限公司。
1.3 引物设计通过比较分析不同血清型沙门菌的全基因组序列及禽致病性大肠杆菌基因序列,筛选特异性诊断靶标基因,设计特异性检测引物(表 1),引物由华津生物科技有限公司合成。
| Primers name | Primers sequences (5ʹ→3ʹ) | Concentration of primers (μmol/L) | Size (bp) |
| phoA-F | GGCAATACACTCACTATGCGCTG | 0.5 | 761 |
| phoA-R | AGGATTCGCAGCATGATCCTG | 0.5 | |
| glgC- F | CGTCGCTATAAAGCGGAATATGT | 0.2 | 83 |
| glgC-R | CCTTTTCAAAACATACGCGAGTAG | 0.2 | |
| SGP-F | GTTGCCGTACCGGTCGTAACG | 0.3 | 249 |
| SGP-R | TTCCTGACGGGCATCGACGGC | 0.3 | |
| sdfI-F | GATGTGGTTGGTTCGTCACTG | 0.4 | 409 |
| sdfI-R | GCGAGACCTCAAACTTACTCAG | 0.4 | |
| STM4495- F | CAGCGGTATGATGCGGTAGT | 0.5 | 569 |
| STM4495- R | TCACCGGTGGACATGCCTGC | 0.5 |
根据细菌基因组DNA提取试剂盒说明书进行基因组DNA的提取。
1.5 多重PCR反应体系的建立及优化首先以阳性菌株为模板进行单基因PCR扩增,建立单基因PCR反应体系。然后,采用方阵法优化引物浓度、退火温度,确定最佳PCR反应体系及反应条件,建立多重PCR方法。多重PCR反应体系:2×Taq PCR Master Mix 10 μL,模板1 μL,各引物对最佳浓度见表 1,超纯水补至20 μL。PCR反应条件:94 ℃ 2 min;94 ℃ 50 s,57 ℃ 30 s,72 ℃ 50 s,35个循环;72 ℃ 10 min。
1.6 PCR产物的鉴定取10 μL PCR扩增产物上样于1.5%琼脂糖凝胶,120 V恒压电泳30 min,在紫外灯下观察并记录结果。将阳性条带切胶,采用GeneJET Gel Extraction Kit回收目的片段,送上海华津生物科技有限公司测序。
1.7 多重PCR的特异性试验分别以禽致病性大肠杆菌、沙门菌、禽波氏菌、鸡毒支原体、鸭疫里默氏杆菌、禽巴氏杆菌、铜绿假单胞菌、单增李斯特菌、金黄色葡萄球菌等细菌基因组DNA为模板进行多重PCR扩增,以检测建立多重PCR方法的特异性。
1.8 多重PCR的敏感性试验 1.8.1 菌液敏感性试验分别培养禽致病性大肠杆菌DE719、鼠伤寒沙门菌、鸡白痢沙门菌、鸡伤寒沙门菌、肠炎沙门菌标准株,并依次稀释,取1 μL作为模板进行多重PCR反应,检测多重PCR方法的菌液敏感性。
1.8.2 基因组DNA敏感性试验分别提取禽致病性大肠杆菌DE719、鼠伤寒沙门菌、肠炎沙门菌、鸡白痢沙门菌、鸡伤寒沙门菌标准株的基因组DNA,并依次稀释,取1 μL作为模板进行多重PCR,检测多重PCR方法的DNA敏感性。
1.9 多重PCR的应用应用建立的多重PCR方法对本实验室保存的52株APEC及沙门菌菌株进行检测,比较与血清学和生化鉴定的结果,验证多重PCR方法的可行性。
2 结果与分析 2.1 多重PCR方法的建立分别以禽致病性大肠杆菌DE719和沙门菌标准菌株基因组DNA为模板,用设计的引物建立单基因PCR,然后经过条件优化建立多重PCR检测体系。结果显示,建立的PCR可特异性扩增出目的条带,且与预期扩增基因片段大小一致(图 1)。禽致病性大肠杆菌可扩增出761 bp特异性条带;鼠伤寒沙门菌可扩增出569 bp特异性条带;肠炎沙门菌可扩增出409 bp特异性条带;鸡白痢沙门菌可扩增出249 bp特异性条带;鸡伤寒沙门菌可扩增出249 bp和83 bp特异性条带。将阳性特异性条带切胶回收后测序,结果表明扩增条带序列与目的基因序列一致。经过试验条件优化最终确定各引物对的最佳浓度(表 1)及PCR反应程序,具体反应参数见1.5。
|
| 图 1 多重PCR方法的建立 Figure 1 Development of multiplex PCR 注:1:多重PCR产物;2:鸡伤寒沙门菌ATCC9184;3:鸡白痢沙门菌CVCC519;4:肠炎沙门菌CVCC3374;5:鼠伤寒沙门菌ATCC14028;6:禽致病性大肠杆菌DE719;7:阴性对照;M:DL2000 DNA marker. Note: 1: Products of multiplex PCR; 2: S. gallinarum ATCC9184; 3: S. pullorum CVCC519; 4: S. enteritidis CVCC3374; 5: S. typhimurium ATCC14028; 6: APEC DE719; 7: Negative control; M: DL2000 DNA marker. |
|
|
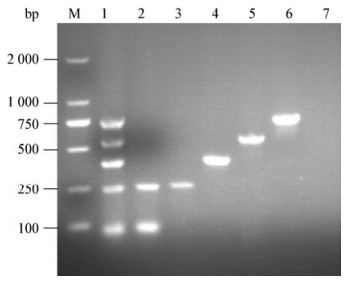
分别以禽致病性大肠杆菌DE719、鼠伤寒沙门菌ATCC14028、肠炎沙门菌CVCC3374、肠炎沙门菌CVCC1805、鸡白痢沙门菌CVCC519、鸡伤寒沙门菌ATCC9184、禽波氏菌ATCCIPDH591-77、铜绿假单胞菌PA14、鸡毒支原体CVCC1651、猪链球菌、鸭疫里默氏杆菌、单增李斯特菌10403s、禽巴氏杆菌CVCC493、金黄色葡萄球菌CVCC543等细菌基因组DNA为模板进行PCR扩增,结果显示阳性菌株均扩增出目的条带,而阴性菌株均未扩增出目的片段(图 2),表明多重PCR方法具有较好的特异性。
|
| 图 2 多重PCR的特异性 Figure 2 The specificity of multiplex PCR 注:1:多重PCR产物;2:血清1型鸭疫里默氏杆菌CH3;3:金黄色葡萄球菌CVCC543;4:铜绿假单胞菌PA14;5:猪链球菌;6:血清2型鸭疫里默氏杆菌Yb2;7:鼠伤寒沙门菌分离株SAT52;8:血清10型鸭疫里默氏杆菌HXb2;9:鸡伤寒沙门菌ATCC9184;10:单增李斯特菌10403s;11:禽巴氏杆菌CVCC493;12:禽致病性大肠杆菌DE719;13:血清15型鸭疫里默氏杆菌wg4;14:鸡白痢沙门菌CVCC519;15:禽支原体CVCC274;16:鼠伤寒沙门菌SL1344;17:禽波氏菌IPDH591-77;18:金黄色葡萄球菌CVCC543;19:肠炎沙门菌CVCC1805;20:鸡毒支原体CVCC1651;21:阴性对照;M:DL2000 DNA marker. Note: 1: Products of multiplex PCR; 2: Riemerella anatipestifer CH3; 3: Staphylococcus aureus CVCC543; 4: Pseudomonas aeruginosa PA14; 5: Streptococcus suis; 6: Riemerella anatipestifer Yb2; 7: S. typhimurium SAT52; 8: Riemerella anatipestifer HXb2; 9: S. gallinarum; 10: Listeria monocytogenes 10403s; 11: Pasteurella CVCC493; 12: APEC strain DE719; 13: Riemerella anatipestifer wg4; 14: S. pullorum CVCC519; 15: Mycoplasma avium CVCC274; 16: S. typhimurium SL1344; 17: Bordetella IPDH591-77; 18: Staphylococcus aureus CVCC543; 19: S. enteritidis CVCC1805; 20: Mycoplasma gallisepticum CVCC1651; 21: Negative control; M: DL2000 DNA marker. |
|
|
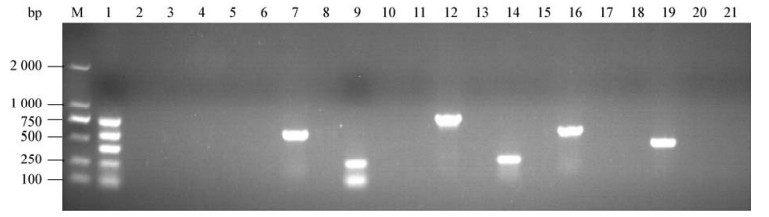
分别以稀释的阳性菌株菌液为模板进行多重PCR扩增,结果显示,禽致病性大肠杆菌、鼠伤寒沙门菌、肠炎沙门菌、鸡白痢沙门菌和鸡伤寒沙门菌的最低检出量均为103 CFUs/反应(图 3A)。
|
| 图 3 多重PCR敏感性试验 Figure 3 Sensitivity test of multiplex PCR 注:A:多重PCR菌液敏感性. 1:108 CFUs;2:107 CFUs;3:106 CFUs;4:105 CFUs;5:104 CFUs;6:103 CFUs;7:102 CFUs;8:阴性对照. B:多重PCR的DNA敏感性. 1:200 ng;2:100 ng;3:50 ng;4:10 ng;5:1 ng;6:500 pg;7:100 pg;8:阴性对照. M:DL2000 DNA marker. Note: A: Sensitivity test of multiplex PCR using bacteria. 1: 108 CFUs; 2: 107 CFUs; 3: 106 CFUs; 4: 105 CFUs; 5: 104 CFUs; 6: 103 CFUs; 7: 102 CFUs; 8: Negative control. B: Sensitivity test of multiplex PCR using DNA. 1: 200 ng; 2: 100 ng; 3: 50 ng; 4: 10 ng; 5: 1 ng; 6: 500 pg; 7: 100 pg; 8: Negative control. M: DL2000 DNA marker. |
|
|
以不同稀释度的阳性菌株基因组DNA为模板进行多重PCR扩增,结果显示,多重PCR反应体系检测禽致病性大肠杆菌、鼠伤寒沙门菌、肠炎沙门菌、鸡白痢沙门菌和鸡伤寒沙门菌的最低检出DNA量均为100 pg/反应(图 3B),具有较高的灵敏度。
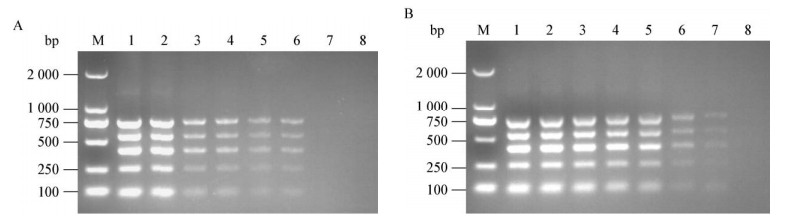
2.4 临床分离菌株的检测采用本研究所建立的多重PCR方法对本实验室保存的52株临床分离菌株进行检测,结果显示,多重PCR检测结果(图 4)与单重PCR检测、玻板凝集试验及生化鉴定结果一致,表明多重PCR方法可用于临床菌株检测。
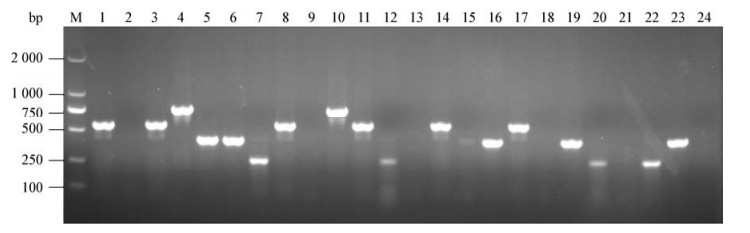
|
| 图 4 细菌临床分离株的检测 Figure 4 Detection of bacterial isolates 注:M:DL2000 DNA marker;1:鼠伤寒沙门菌SM5;2:猪霍乱沙门菌SM1;3:鼠伤寒沙门菌SM10;4:禽致病性大肠杆菌APCE94;5:肠炎沙门菌SM2;6:肠炎沙门菌SM12;7:鸡白痢沙门菌SP001;8:鼠伤寒沙门菌SM11;9:都柏林沙门菌SM3;10:禽致病性大肠杆菌FJ1-B;11:鼠伤寒沙门菌SM47;12:鸡白痢沙门菌SP017;13:都柏林沙门菌SM4;14:鼠伤寒沙门菌SM50;15:肠炎沙门菌SM8;16:肠炎沙门菌SM13;17:鼠伤寒沙门菌SM51;18:猪霍乱沙门菌SM9;19:肠炎沙门菌SM14;20:鸡白痢沙门菌SP035;21:阿贡那沙门菌SA1;22:鸡白痢沙门菌CVCC519;23:鼠伤寒沙门菌SM15;24:阴性对照. Note: M: DL2000 DNA marker; 1: S. typhimurium SM5; 2: S. choleraesuis SM1; 3: S. typhimurium SM10; 4: APEC APCE94; 5: S. enteritidis SM2; 6: S. enteritidis SM12; 7: S. pullorum SP001; 8: S. typhimurium SM11; 9: S. dublin SM11; 10: APEC FJ1-B; 11: S. typhimurium SM47; 12: S. pullorum SP017; 13: S. dublin SM4; 14: S. typhimurium SM50; 15: S. enteritidis SM8; 16: S. enteritidis SM13; 17: S. typhimurium SM51; 18: S. choleraesuis SM9; 19: S. enteritidis SM14; 20: S. pullorum SP035; 21: S. agona SA1; 22: S. pullorum CVCC519; 23: S. typhimurium SM15; 24: Negative control. |
|
|
目前对细菌性传染病的防治主要采用抗生素等药物进行防治,但由于抗生素的不合理使用,导致耐药性的出现及禽类产品的药物残留,不仅影响养禽业的健康发展,而且危害食品安全和人类生存环境。禽大肠杆菌病和沙门菌病是危害养禽业的重要细菌病,给养禽业造成重大经济损失[1-2],且具有重要的公共卫生学意义。因此,建立禽大肠杆菌病和沙门菌病的快速准确的检测及鉴别诊断方法,对养禽业及公共卫生具有重要作用。
传统的细菌性疾病诊断方法仍是通过细菌分离培养、生化鉴定及血清凝集反应,但该方法费时费力,且平板凝集易出现假阳性等,不能满足临床快速诊断及疾病防控的需求。鸡白痢沙门菌、鸡伤寒沙门菌和肠炎沙门菌的抗原结构相似,需要通过生化鉴定才可鉴别血清型,过程繁琐、耗时耗力[7]。免疫学技术虽然比传统方法操作简单,但灵敏度不如PCR方法。PCR方法具有快速、灵敏、特异等优点,因此广泛应用于病原菌检测。多重PCR是在单基因PCR基础上发展起来的检测方法,可同时检测多种病原及不同基因,因此具有高效快速、经济简便等优点,已广泛应用于多种病原菌的检测。前期研究分别建立了常见家禽病原菌,如禽大肠杆菌、沙门菌、禽多杀性巴氏杆菌、副鸡嗜血杆菌、鸭疫里默氏杆菌的多重PCR检测方法[8-9]。然而这些方法仅特异性检测沙门菌属基因,无法进一步区分不同血清型。另外,也有研究针对沙门菌种属特异性基因建立了肠炎沙门菌、鼠伤寒沙门菌、伤寒沙门菌、鸡白痢沙门菌及不同血清组的PCR检测方法[10-16]。因此,本研究通过序列分析筛选并参考前期研究,建立了可以同时检测禽大肠杆菌并区分常见禽源沙门菌血清型的多重PCR方法。
特异性诊断靶标基因的筛选对PCR检测方法的建立及可靠性至关重要。由于鸡白痢沙门菌和鸡伤寒沙门菌的抗原表型及基因组结构非常相似,难以鉴别。本研究通过比对分析沙门菌全基因组序列,筛选出鸡伤寒沙门菌和鸡白痢沙门菌的特异性基因片段SGP作为靶标基因。另外,与其他血清型沙门菌相比,鸡伤寒沙门菌的glgC基因存在11 bp核苷酸的缺失,常作为靶标基因鉴定鸡伤寒沙门菌[17],因此本研究选其作为鸡伤寒沙门菌的检测基因。参考前期研究,本文分别选择了大肠杆菌看家基因phoA、肠炎沙门菌特异性基因sdfⅠ、鼠伤寒沙门菌特异性基因stm4495作为靶标基因[8, 18]。引物序列直接决定了PCR的特异性及反应条件,本研究根据筛选的靶标基因分别设计了5对特异性引物,保证其退火温度尽量接近且不产生发卡结构。通过条件优化,建立了检测禽大肠杆菌和区分不同血清型沙门菌的多重PCR方法。特异性试验、敏感性试验检测结果表明建立的多重PCR方法能够特异、灵敏地检测禽大肠杆菌并区分不同血清型沙门菌。利用建立的多重PCR方法检测52株APEC和沙门菌临床分离株,结果显示多重PCR和传统细菌分离鉴定、血清凝集结果一致,结果可靠。因此,本研究建立的多重PCR方法可检测禽大肠杆菌并区分常见的禽源沙门菌的血清型,具有快速简便、特异性强、敏感性高等优点,可用于禽源样品中APEC和沙门菌的特异性快速检测及分子流行病学调查。
| [1] |
Dziva F, Stevens MP. Colibacillosis in poultry: unravelling the molecular basis of virulence of avian pathogenic Escherichia coli in their natural hosts[J]. Avian Pathology, 2008, 37(4): 355-366. DOI:10.1080/03079450802216652 |
| [2] |
Pang T, Bhutta ZA, Finlay BB, et al. Typhoid fever and other salmonellosis: a continuing challenge[J]. Trends in Microbiology, 1995, 3(7): 253-255. DOI:10.1016/S0966-842X(00)88937-4 |
| [3] |
Mora A, Viso S, López C, et al. Poultry as reservoir for extraintestinal pathogenic Escherichia coli O45:K1:H7-B2-ST95 in humans[J]. Veterinary Microbiology, 2013, 167(3/4): 506-512. |
| [4] |
Mellata M. Human and avian extraintestinal pathogenic Escherichia coli: infections, zoonotic risks, and antibiotic resistance trends[J]. Foodborne Pathogens and Disease, 2013, 10(11): 916-932. DOI:10.1089/fpd.2013.1533 |
| [5] |
Foley SL, Nayak R, Hanning IB, et al. Population dynamics of Salmonella enterica serotypes in commercial egg and poultry production[J]. Applied and Environmental Microbiology, 2011, 77(13): 4273-4279. DOI:10.1128/AEM.00598-11 |
| [6] |
Martinez-Ballesteros I, Paglietti B, Rementeria A, et al. Intra- and inter-laboratory evaluation of an improved multiplex-PCR method for detection and typing of Salmonella[J]. The Journal of Infection in Developing Countries, 2012, 6(5): 443-451. |
| [7] |
Shah DH, Park JH, Cho MR, et al. Allele-specific PCR method based on rfbS sequence for distinguishing Salmonella gallinarum from Salmonella pullorum: serotype-specific rfbS sequence polymorphism[J]. Journal of Microbiological Methods, 2005, 60(2): 169-177. DOI:10.1016/j.mimet.2004.09.005 |
| [8] |
Hu QH, Tu J, Han XG, et al. Development of multiplex PCR assay for rapid detection of Riemerella anatipestifer, Escherichia coli, and Salmonella enterica simultaneously from ducks[J]. Journal of Microbiological Methods, 2011, 87(1): 64-69. DOI:10.1016/j.mimet.2011.07.007 |
| [9] |
Zhang M, Han F, Shen WZ, et al. Establishment and application of multiplex PCR assay for detecting Pasteurella multocida, Haemophilus paragallinarum and Escherichia coli[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2018, 27(2): 163-168. (in Chinese) 张曼, 韩飞, 沈文正, 等. 禽多杀性巴氏杆菌、副鸡嗜血杆菌和大肠杆菌多重PCR检测方法的建立及应用[J]. 西北农业学报, 2018, 27(2): 163-168. |
| [10] |
Paião FG, Arisitides LGA, Murate LS, et al. Detection of Salmonella spp., Salmonella enteritidis and Typhimurium in naturally infected broiler chickens by a multiplex PCR-based assay[J]. Brazilian Journal of Microbiology, 2013, 44(1): 37-42. DOI:10.1590/S1517-83822013005000002 |
| [11] |
Pui CF, Wong WC, Chai LC, et al. Multiplex PCR for the concurrent detection and differentiation of Salmonella spp., Salmonella Typhi and Salmonella Typhimurium[J]. Tropical Medicine and Health, 2011, 39(1): 9-15. DOI:10.2149/tmh.2010-20 |
| [12] |
de Freitas CG, Santana P, Da Silva PHC, et al. PCR multiplex for detection of Salmonella Enteritidis, Typhi and Typhimurium and occurrence in poultry meat[J]. International Journal of Food Microbiology, 2010, 139(1/2): 15-22. |
| [13] |
Lee SH, Jung BY, Rayamahji N, et al. A multiplex real-time PCR for differential detection and quantification of Salmonella spp., Salmonella enterica serovar Typhimurium and Enteritidis in meats[J]. Journal of Veterinary Science, 2009, 10(1): 43-51. DOI:10.4142/jvs.2009.10.1.43 |
| [14] |
Yang L, Lou YK, Su CH, et al. Development of a multiplex PCR for rapid identification of Salmonella enteritidis, Salmonella typhimurium, Salmonella pollorum and Salmonella gallinarum[J]. Acta Veterianria et Zootechnica Sinica, 2014, 45(2): 268-273. (in Chinese) 杨林, 娄亚坤, 宿春虎, 等. 多重PCR方法快速鉴别肠炎、鼠伤寒、鸡白痢及鸡伤寒沙门菌[J]. 畜牧兽医学报, 2014, 45(2): 268-273. |
| [15] |
Gong JS, Zhuang LL, Lu GW, et al. Development and application of a multiplex PCR for detection of avian Salmonella[J]. China Poultry, 2016, 38(4): 14-18. (in Chinese) 龚建森, 庄林林, 陆光武, 等. 禽源沙门菌多重PCR检测方法的建立与应用[J]. 中国家禽, 2016, 38(4): 14-18. |
| [16] |
Geng SZ, Pan ZM, Jiang CH, et al. Development of allele-specific PCR assay for detecting Salmonella pullorum[J]. Veterinary Science in China, 2007, 37(2): 113-116. (in Chinese) 耿士忠, 潘志明, 蒋春红, 等. 鸡白痢沙门菌等位基因特异性PCR检测方法的建立[J]. 中国兽医科学, 2007, 37(2): 113-116. |
| [17] |
Kang MS, Kwon YK, Jung BY, et al. Differential identification of Salmonella enterica subsp. enterica serovar Gallinarum biovars Gallinarum and Pullorum based on polymorphic regions of glgC and speC genes[J]. Veterinary Microbiology, 2011, 147(1/2): 181-185. |
| [18] |
Boyd EF, Porwollik S, Blackmer F, et al. Differences in gene content among Salmonella enterica serovar typhi isolates[J]. Journal of Clinical Microbiology, 2003, 41(8): 3823-3828. DOI:10.1128/JCM.41.8.3823-3828.2003 |
 2019, Vol. 46
2019, Vol. 46