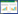扩展功能
文章信息
- 刘青, 李升, 梁才康, 张红辉, 吴静, 王嘉福, 冉雪琴
- LIU Qing, LI Sheng, LIANG Cai-Kang, ZHANG Hong-Hui, WU Jing, WANG Jia-Fu, RAN Xue-Qin
- 贵州地区木霉菌分离鉴定及对辣椒疫霉的拮抗作用
- Isolation and identification of Trichoderma spp. against Phytophthora capsici
- 微生物学通报, 2019, 46(4): 741-751
- Microbiology China, 2019, 46(4): 741-751
- DOI: 10.13344/j.microbiol.china.180703
-
文章历史
- 收稿日期: 2018-09-08
- 接受日期: 2018-12-11
- 网络首发日期: 2018-12-29
2. 2贵州大学动物科学学院 贵州 贵阳 550025;
3. 铜仁学院 贵州 铜仁 554300
2. Institute of Animal Science, Guizhou University, Guiyang, Guizhou 550025, China;
3. Tongren University, Tongren, Guizhou 554300, China
辣椒疫病是由辣椒疫霉(Phytophthora capsici)引起的一种真菌性病害,其潜伏期短,可多次侵染,传播与蔓延速度快,通过雨水、土壤、空气等多种途径传播,主要危害辣椒,番茄、茄子、黄瓜等蔬菜,造成作物叶片枯萎、果实腐烂、茎杆坏死以及植株萎蔫死亡等多种症状[1-2]。在辣椒重病区,枯死率可达80%以上,每年因辣椒疫病造成的减产达20%-30%,严重时全田绝收[3]。辣椒疫病的防治措施主要采取轮作倒茬、嫁接、合理套种、浅灌控水、抗病品种选育及化学合成杀菌剂施用等,未能从根本上解决辣椒疫病的防治难题[4-5],生物防控是目前公认安全有效的防治措施,但受限于高效的生防菌株[6]。
木霉菌(Trichoderma pers)属于半知菌亚门从梗孢目从梗孢科,是一类分布广泛的真菌,主要生长在森林、坡沟、平原、草地等潮湿生境的土壤、枯枝落叶、木桩、腐木以及真菌的子实体上[7-9]。木霉菌已用于防治作物灰霉病(Botrytis)、马铃薯干腐病(Fusarium solani)、烟草根腐(Fusarium oxysporum)、瓜类枯萎病(Cucurbits fusarium wilt)、番茄灰霉病(Botrytis cinerea)、棉花黄萎病(Verticillium dahliae Kleb)、葡萄霜霉(Plasmopara viticola)等病害[10-13]。其抑菌机制包括竞争、寄生、抗生、溶菌、诱导抗性和协同拮抗作用,木霉菌对不同病原菌的作用机制不同,拮抗效果也不同[14-15]。研究表明,棘孢木霉(Trichoderma asperellum)发酵液能降低番茄早疫病菌抗氧化防御酶的活力,破坏病原菌保护酶系统原有的平衡状态,致使活性氧自由基清除系统障碍[16]。长枝木霉(Trichoderma longibrachiatum)能够覆盖或深入病原菌的内部生长,与病原菌菌丝相互缠绕和交错,且缠绕部位出现明显缢缩,最终使部分病原菌菌丝细胞原生质浓缩和菌丝断裂[17]。木霉菌丝可寄生吸附于其它真菌的菌丝上,分泌胞外酶如几丁质酶、木聚糖酶和葡聚糖酶等,溶解其它真菌的细胞壁[18]。木霉还可以产生多种次生代谢产物,如木霉菌素、胶霉菌素和抗菌肽等,杀死其它真菌[19]。本研究拟从贵州地区分离木霉菌株,筛选出高效的生防菌株,探究分离木霉拮抗作用的生理生化机制。
1 材料与方法 1.1 试验材料 1.1.1 样品辣椒疫霉菌Phytophthora capsici (ACCC 36278)购于中国农业微生物菌种保藏管理中心。
1.1.2 培养基马铃薯葡萄糖液体培养基(PDB):新鲜马铃薯去皮,切成碎块,称取200.0 g加入适量水煮沸(约30 min),充分溶解碎块后使用8层纱布过滤,取滤液,加入葡萄糖20.0 g,蒸馏水补至1 L,1×105 Pa灭菌30 min。PDB加入琼脂20.0 g,冷却至50-55 ℃时加入1%链霉素液3 mL,即配成马铃薯葡萄糖固体培养基(PDA)。
查氏培养基(g/L):NaNO3 2.0,K2HPO4 1.0,KCl 0.5,MgSO4 0.5,FeSO4 0.01,蔗糖30.0,琼脂20.0。1×105 Pa灭菌30 min。
1.1.3 主要试剂和仪器多聚半乳糖醛酸酶活性试剂盒、丙二醛含量检测试剂盒、β-葡萄糖苷酶活性检测试剂盒、几丁质酶活性检测试剂盒,北京索莱宝(Solarbio)科技有限司;DNA提取试剂盒、2×Taq PCR MasterMix、DL2000 DNA marker、琼脂糖凝胶DNA回收试剂盒,天根生化科技(北京)有限公司。紫外分光光度计,尤尼柯(上海)仪器有限公司;PCR仪,Bio-Rad公司。
1.2 霉菌的分离 1.2.1 腐木霉菌分离将贵州省贵州大学林下采集的8个腐木样品清理表层附土,切成小木块,放入1:50的次氯酸钠溶液中浸泡5 s,无菌水漂洗3次,放入PDA培养基表面,每个平皿约放3-4块在28 ℃培养。待菌落长出,接种至新的PDA培养基上,重复5-6次,得到纯化霉菌,4 ℃保存备用。
1.2.2 土壤根系霉菌分离将贵州省贵州大学树木根系土壤、贵州省赫章县辣椒种植地成熟辣椒根系土壤、贵州省赫章县平菇基地废弃菌孢土壤、贵州大学农学院蔬菜种植基地成熟辣椒根系土壤共12个样品,采用平板稀释法,取10 g土样加入90 mL无菌水中,涡旋仪充分振荡,吸取1 mL悬浮液于9 mL无菌水中,制成10%的土壤悬浮液,用灭菌水稀释成10-3、10-4、10-5、10-6梯度溶液,涂布于PDA培养基上,于28 ℃倒置培养,2 d后挑取菌落边缘的菌丝,同1.3.1得到纯化的霉菌,4 ℃保存备用。
1.3 分离霉菌形态学鉴定待菌丝长成菌落,用解剖针挑取少量菌丝置于载玻片上,加入几滴无菌水,盖上盖玻片制成临时装片,于显微镜下观察菌丝的形态、分生孢子梗的分枝结构、分枝所呈现的形态,产孢瓶体的形状以及分生孢子的形状、颜色、分生孢子壁大小[20],根据菌丝体颜色、孢子形态、产孢结构及有无横隔等特征进行形态学鉴定[21-22]。
1.4 分离霉菌分子生物学鉴定 1.4.1 分离霉菌菌丝的液体培养分离菌株在PDA培养基上28 ℃培养,布满菌丝后,挑取菌丝体接种于装有100 mL PDB培养基的300 mL三角瓶中,28℃、180 r/min振荡培养6 d至培养液中长出球状菌丝体,滤纸抽滤得到菌丝体,置于培养皿55℃烘干备用。
1.4.2 分离霉菌基因组DNA提取参照北京天根新型植物DNA基因组柱式提取试剂盒说明书,提取菌株DNA基因组模板,-20 ℃保存备用。
1.4.3 分离霉菌ITS区域序列PCR扩增采用真菌鉴定通用引物ITS1 (5′-TCCGTAGG TGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATT GATATGC-3′)[23],扩增片段约为600 bp。PCR反应体系(20 μL):DNA模板1 μL,上、下游引物(10 μmol/L)各1 μL,2×PCR Taq MasterMix 10 μL,双蒸水补足到20 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 5 min,PCR产物经1.2%琼脂糖凝胶电泳,胶回收后由上海英潍捷基贸易有限公司完成测序,应用NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi)和ISTH (http://www.isth.info/tools/molkey/index.php)进行在线比对分析。应用MEGA 7.0软件,采用Neighbor-Joining法构建系统发育树。
1.5 分离霉菌对辣椒疫霉菌的抑制率测定参照El-Tarabily等[24]方法。取活化后直径约为0.5 cm的辣椒疫霉菌饼接种至PDA培养基上,菌饼距培养基中心1 cm-2 cm,28 ℃培养36 h,在距辣椒疫霉菌饼3.5 cm处放置木霉新鲜菌株菌饼,且2个菌饼距培养皿边缘等距,以不接种木霉为对照,每处理设3次重复,分别计算接种新鲜木霉菌3、5、7 d时的抑制率。分离霉菌对辣椒疫霉菌的抑制率(%)=(对照菌落的半径-对峙培养辣椒疫霉菌落的半径)/对照菌落的半径×100。
1.6 分离霉菌发酵液粗提物对辣椒疫霉生长和代谢的影响 1.6.1 发酵液的制备选取抑菌率最高的4株木霉Tv-1、Tv-2、Thz-2和Tha-1活化培养48 h,接种到含100 mL PDB培养基的300 mL三角瓶中,于28℃、180 r/min摇床避光培养7 d,取发酵液12 000 r/min离心5 min,收集上清,无菌滤膜(直径0.22 μm)过滤除菌获得无菌上清液,备用。
1.6.2 发酵液粗提物抑菌效果测定参考牛津杯法检测,取直径约为0.5 cm的辣椒疫霉菌菌块放置于PDA平板中央,28 ℃培养2 d后,在距辣椒疫霉块四周约2.5 cm处放置发酵液浸泡滤纸片,每个滤纸片上加20μL无菌上清液,28℃培养5 d后记录辣椒疫霉受抑制情况。
1.6.3 辣椒疫霉菌丝处理将辣椒疫霉分生孢子悬浮液接种于100 mL PDB培养基的300 mL三角瓶中,28℃、180 r/min避光培养5 d,加入1.7.1提取的木霉菌发酵液500 μL,加入等体积的无菌水作为空白对照,28℃静置培养5 d,备用。
1.6.4 丙二醛含量和3种酶活性测定参照何璐[28]的方法,分别称取不同处理的菌丝体1 g,经液氮研磨,加入9倍体积预冷的PBS缓冲液制得菌体组织匀浆液,4℃、12 000 r/min离心15 min;取上清液为提取液,按照丙二醛(MDA)含量、纤维素酶、β-葡萄糖苷酶(β-GC)和多聚半乳糖醛酸酶(PG)试剂盒说明书进行酶活性测定,每个处理重复3次。
2 结果与分析 2.1 分离霉菌形态学鉴定分离得到11株霉菌,菌株的形态特征各不相同(表 1,图 1)。从5份土壤样品分离得到的霉菌,形态特征类似哈茨木霉种;6个腐木样品分离到的形似绿色木霉、哈茨木霉、钩状木霉、棘孢木霉4个种,腐木样的木霉种类多样性高于土壤样。
| 菌株号 Strains |
疑似种 Species |
分生孢子产色 Color of conidium |
分生孢子大小 Size of conidium (μm) |
| Thz-1 | Trichoderma harzianum | Green | 3.0-5.5 |
| Tv-1 | Trichoderma virens | Green | 3.0-5.5 |
| Thz-2 | Trichoderma harzianum | Green | 3.0-4.5 |
| Tha-1 | Trichoderma hamatum | Reseda | 4.0-4.5 |
| Tv-2 | Trichoderma virens | Transparent | 5.0-7.0 |
| Tha-3 | Trichoderma hamatum | Green | 3.0-5.5 |
| Tha-2 | Trichoderma hamatum | Green | 2.0-3.5 |
| Ta-1 | Trichoderma asperellum | Green | 3.0-4.8 |
| Thz-4 | Trichoderma harzianum | Green | 3.0-5.5 |
| Thz-3 | Trichoderma harzianum | Green | 2.0-4.5 |
| Tha-4 | Trichoderma hamatum | Green | 3.5-5.5 |
|
| 图 1 分离菌株的形态特征 Figure 1 Morphological characteristics of isolated strains 注:A、B:28 ℃培养7 d的菌落形态(A:PDA;B:查氏培养基);C:分生孢子梗和瓶梗;D:分生孢子.标尺=20 µm. Note: A, B: Cultures at 28 ℃ after 7 d (A: PDA; B: Charlesʼs medium); C: Conidiophores and phialides; D: Conidia. Bars=20 μm. |
|
|
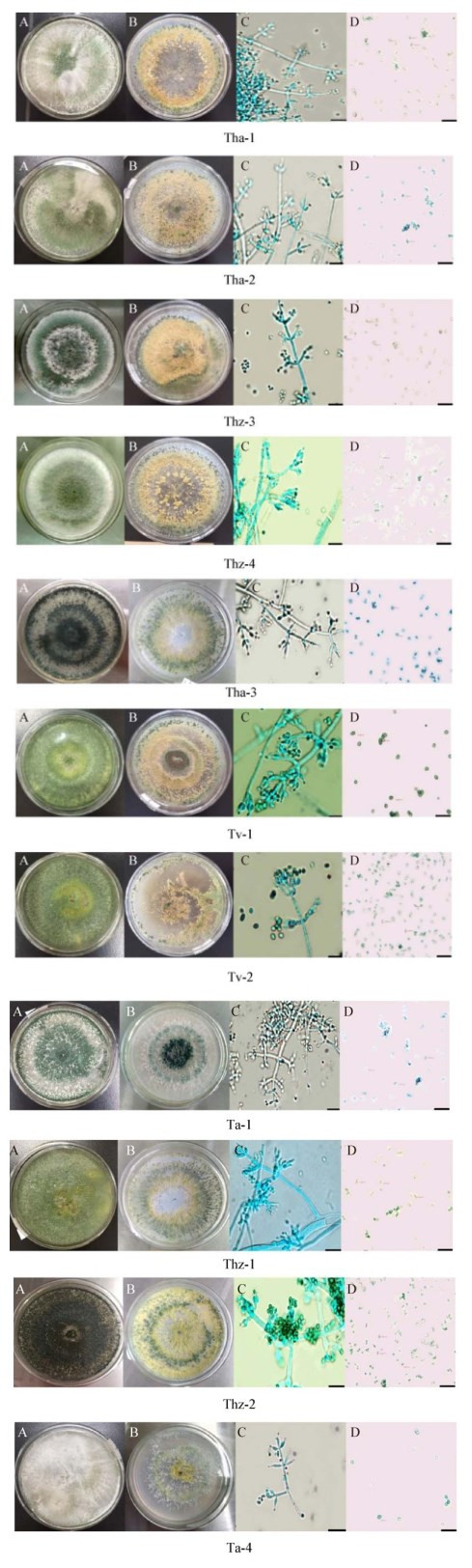
以11株霉菌的基因组DNA为模板,采用ITS1、ITS4为引物对分离霉菌ITS区段序列进行PCR扩增,得到大小约为600 bp的片段,没有非特异性扩增片段(图 2)。测序结果显示11株菌的扩增片段分别为575、588、601、603、603、603、615、623、686、695、733 bp,将11个片段的碱基序列进行比对,与木霉菌的相似性均高于94%。
|
| 图 2 木霉菌ITS区段PCR扩增 Figure 2 The PCR amplification of ITS fragments from the genome of Trichoderma 注:M:DL2000 DNA marker;1-11:11株木霉ITS序列扩增片段. Note: M: DL2000 DNA marker; 1-11: ITS amplified fragment of 11 strains of Trichoderma. |
|
|
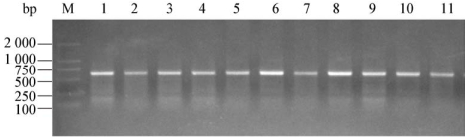
以芽孢杆菌Bacillus (KF986320.1)为外群构建系统发育进化树,形成4个分支:T. harzianum分支包括Thz1、Thz2、Thz3、Thz4;T. virens分支包括Tv1、Tv2;T. hamatum分支由Tha1、Tha2、Tha3组成;T. asperellum分支包括Ta1和Ta4,此分支与本文其它的分支进化关系较远(图 3)。
|
| 图 3 基于ITS序列构建的木霉菌系统发育进化树 Figure 3 Phylogenetic tree of ITS sequences from Trichoderma strain 注:*:模式菌株,Bacillus (KF986320.1)为外族群;节点左边的数值是基于邻接法1 000次重复取样数据集的Bootstrap支持率(> 60%);比例尺0.05表示100个核苷酸中有5个被替换;括号内的序号表示相应序列在GenBank的登录号. Note:*: The reference strains, the ITS of Bacillus (KF986320.1) was taken as outer group. The values on the left side of the node were Bootstrap support rates (> 60%) based on the neighboring method by 1 000 repeated sampling. The scale bar, 0.05, represented five out of 1 000 nucleotides were replaced, Numbers in the parentheses indicated GenBank accession number of the sequence. |
|
|
从贵州地区采集的12个土壤样品和8个腐木样品共分离到11株木霉菌,结合形态学和ITS序列的相似性将11株菌鉴定为4个种:Thz1、Thz2、Thz3、Thz4属于哈茨木霉种;Tv1与Tv2为绿色木霉种、Tha1、Tha2、Tha3属于钩状木霉种;Ta1和Ta4为棘孢木霉种。其中,哈茨木霉菌为优势菌种,分离频率为36.36%;其次为钩状木霉菌,分离频率为27.28%;绿色木霉菌和棘孢木霉,分离频率均为18.19%。
2.3 木霉菌对辣椒疫霉的拮抗作用如图 4所示,对峙实验2 d后,观察到木霉菌的生长速度明显超过辣椒疫霉;3 d后,木霉开始覆盖辣椒疫霉的菌落;5 d后,绿色木霉Tv-1、Tv-2与辣椒疫霉接触,辣椒疫霉停止向前生长,而Tv-1与Tv-2继续向外生长,于辣椒疫霉的菌落表面迅速生长,产生大量孢子,最后将辣椒疫霉完全覆盖但不形成抑菌圈。棘孢木霉Ta-1和钩状木霉Tha-3与辣椒疫霉呈对峙状态,在交界处形成0.5 cm-0.8 cm的抑菌带,产生褐黄色素,平板背面则为暗红色素。其余钩状木霉Tha-2、棘孢木霉Ta-4、哈茨木霉Thz-1、Thz-2、Thz-3、Thz-4与辣椒疫霉的交界处菌丝会出现褐变。
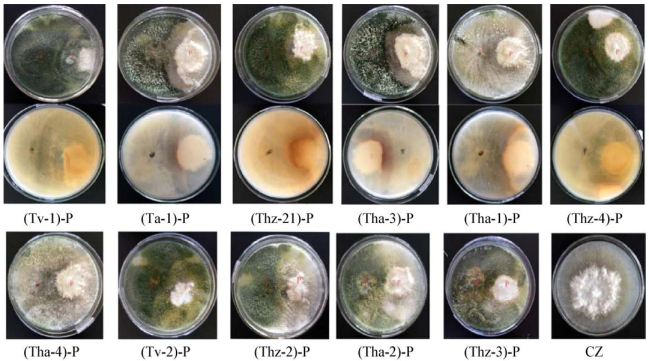
|
| 图 4 木霉菌与辣椒疫霉对峙实验 Figure 4 The morphological features of the Trichoderma antagonism to Phytophthora capsaici in dual culture 注:CZ为PDA培养基7 d的辣椒疫霉;P代表辣椒疫霉. Note: CZ was the Phytophthora capsici on PDA medium at 7 d; P represented Phytophthora capsici. |
|
|
对峙抑菌实验结果(表 2)表明,11株木霉菌均对辣椒疫霉菌的生长有抑制作用,菌株的抑制率差异很大。3 d时,抑制率最高的菌株是Tha-3 (32.14%),与其余10株木霉菌株间差异显著(P < 0.05),其余菌株之间无明显差异(P < 0.05);5 d时,抑制率最高的菌株是Tha-2和Tv-2,均为72.22%,菌株间差异不明显(P < 0.05),7 d抑制率最高的菌株是Tv-2 (95.12%),菌株间无明显差异(P < 0.05)。
| 菌株编号 Strains |
登录号 GenBank accession No. |
时间 Time (d) |
||
| 3 | 5 | 7 | ||
| Thz-1 | MH749454 | 3.57 | 44.44 | 87.80 |
| Thz-2 | MH781012 | 7.14 | 63.89 | 90.24 |
| Thz-3 | MH845564 | 25.00 | 72.22 | 89.24 |
| Thz-4 | MH845615 | 17.86 | 50.00 | 85.37 |
| Tha-1 | MH781010 | 10.71 | 55.56 | 92.68 |
| Tha-2 | MH781011 | 28.57 | 58.33 | 82.93 |
| Tha-3 | MH781007 | 32.14 | 50.00 | 68.29 |
| Ta-4 | MH781009 | 25.00 | 61.11 | 73.17 |
| Ta-1 | MH781008 | 14.29 | 63.89 | 78.05 |
| Tv-1 | MH781005 | 17.86 | 69.44 | 92.68 |
| Tv-2 | MH781006 | 21.43 | 72.22 | 95.12 |
木霉菌Tv-1和Tv-2、Thz-2、Tha-1的发酵液粗提物对辣椒疫霉均有明显的抑制效果,其中Tv-2的发酵液粗提物的抑菌效果略高(图 5)。
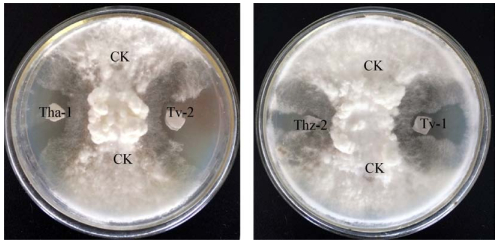
|
| 图 5 木霉菌发酵液粗提物对辣椒疫霉的拮抗作用 Figure 5 Antagonism to Phytophthora capsici by the crude extracts of Trichoderma strains 注:CK为对照;Tha-1、Tv-1、Tv-2和Thz-2分别为发酵液的粗提物处理. Note: CK indicated as control, Tha-1, Tv-1, Tv-2 and Thz-2 indicated the supernatants of fermentation from four strains against Phytophthora capsici. |
|
|
经木霉菌发酵液粗提物处理,辣椒疫霉菌中MDA含量均显著高于对照组(P < 0.05) (图 6),分别为1.48、2.69、1.20、2.16 nmol/g,对照组仅为0.77 nmol/g。
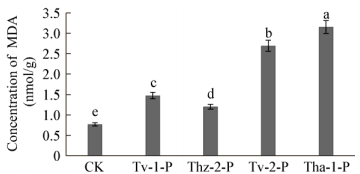
|
| 图 6 木霉菌发酵液粗提物对辣椒疫霉菌丝丙二醛含量的影响 Figure 6 Effect of crude antagonistic extract of Trichoderma on the concentration of MDA in Phytophthora capsici hyphae 注:不同小写字母代表差异在P < 0.05条件下显著.下同. Note: Different lowercase letters represent significant difference at P < 0.05. The same below. |
|
|
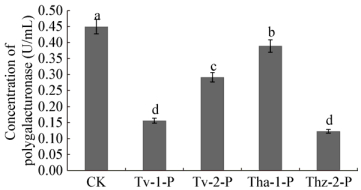
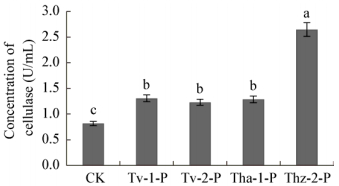
经木霉菌发酵液粗提物处理后,辣椒疫霉菌丝β-GC与PG活性显著下降(P < 0.05) (图 7、8),活性最低的是Thz-2-P (酶活为0.196 U/mL、0.122 U/mL),活性最高的是Tha-1 (0.497 U/mL、0.388 U/mL),而对照组酶活为0.567 U/mL、0.459 U/mL。纤维素酶显著高于对照组(P < 0.05) (图 9),其中木霉Thz-2的作用最强,酶活为2.647 U/mL,显著高于Tv-1、Tv-2和Thz-2处理组。
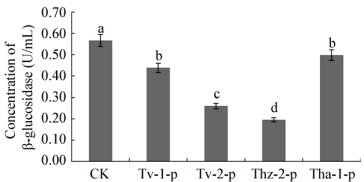
|
| 图 7 木霉菌发酵液粗提物对辣椒疫霉β-GC活性的影响 Figure 7 Effect of crude antagonistic extract of Trichoderma on the β-glucosidase activities of Phytophthora capsici |
|
|
|
| 图 8 木霉菌发酵液粗提物对辣椒疫霉多聚半乳糖醛酸酶活性的影响 Figure 8 Effect of crude antagonistic extract of Trichoderma on the polygalacturonase activities of Phytophthora capsici |
|
|
|
| 图 9 木霉菌发酵液粗提物对辣椒疫霉纤维素酶活性的影响 Figure 9 Effect of crude antagonistic extract of Trichoderma on the cellucase activities of Phytophthora capsici |
|
|
本文从腐木和土壤样品中分离得到11株木霉,经形态学和ITS分子鉴定为木霉属真菌,分属于绿色木霉、哈茨木霉、钩状木霉、棘孢木霉4个种,说明贵州地区木霉菌资源丰富。将分离得到11株木霉菌与辣椒疫霉进行对峙实验,证明11株木霉菌对辣椒疫霉均有明显的抑制作用,抑菌率为68.29%-95.12%,其中有4株木霉菌株Tv-1和Tv-2、哈茨木霉Thz-2、钩状木霉Tha-1的抑菌率最高,分别为92.68%、95.12%、92.68%、90.24%,明显高于已知木霉菌。如沈阳地区分离的木霉菌株对辣椒疫霉菌的平板抑制率为29.8%-73.0%[25],贵州地区分离的木霉菌对辣椒疫霉菌菌的抑制率最高为57.8%[26],表明本文分离得到4株对辣椒疫霉具有良好拮抗能力的木霉菌。
丙二醛(MDA)是细胞膜脂质过氧化的产物,其含量增加提示细胞膜受到损坏。真菌细胞膜对维持细胞的微环境和正常代谢起着重要作用,细胞膜脂质过氧化,膜结构遭到破坏,将引起细胞代谢紊乱,影响孢子萌发管的生长[27-29],本研究以4株木霉菌Tv-1、Tv-2、Thz-2和Tha-1发酵液粗提物处理辣椒疫霉,检测到辣椒疫霉菌丝的丙二醛含量明显增加,提示辣椒疫霉的细胞膜严重受损。此外,在分离木霉菌与辣椒疫霉的对峙实验中,观察到两菌交界处菌落颜色发生变化,形成明显的抑菌带,辣椒疫霉的生长受到抑制,推测可能是木霉菌分泌的抑制物作用的结果。已有研究表明[30-35],木霉菌可将纤维素酶、几丁质酶、葡聚糖酶、木聚糖酶等分泌到细胞外降解病原菌细胞壁中的纤维素、几丁质、葡聚糖等成分,破坏菌株的细胞壁骨架,影响菌株孢子萌发、菌丝生长、芽管伸长以及形态建成。辣椒疫霉属于卵菌纲,菌丝体的细胞壁只有纤维素而不含几丁质[30],细胞壁中纤维素以微纤丝的形式错落包埋于基质中,可以被纤维素酶催化水解[36]。本研究结果表明,木霉菌发酵液处理辣椒疫霉后纤维素酶活性显著增加,推测木霉菌发酵液中含有一定量的纤维素酶作用于辣椒疫霉细胞壁的结构组分,使细胞内代谢受阻,可能是木霉菌发酵液抑制辣椒疫霉菌体生长的重要原因。辣椒疫霉分泌的PG与β-GC能引起寄主植物细胞壁结构解体、组织软化,是导致辣椒疫病的主要致病毒力因子,若能抑制其活性,则可在一定程度上降低辣椒疫霉的致病力,起到抑菌作用[37-40]。本文测定结果表明,木霉菌发酵液对辣椒疫霉PG、β-GC的合成具有显著抑制作用,这将有助于降低辣椒疫霉的致病毒力。
综上,本文分离得到4株木霉菌,包括绿色木霉菌Tv-1和Tv-2、哈茨木霉菌Thz-2、钩状木霉Tha-1,它们具有抑制辣椒疫霉生长的作用,可作为防治辣椒疫病的生防菌株。
| [1] |
Li P, Jiang T, Gao ZM, et al. Pathogenicity differentiation of isolates of Phytophthora capsici to pepper[J]. Acta Phytopathologica Sinica, 2012, 42(4): 431-435. (in Chinese) 李萍, 江涛, 高智谋, 等. 辣椒疫霉(Phytophthora capsici)对辣椒的致病力分化研究[J]. 植物病理学报, 2012, 42(4): 431-435. DOI:10.3969/j.issn.0412-0914.2012.04.013 |
| [2] |
Yang XH, Xiao CG, Yuan J. Studies on identification of Phytophthora capsici in Guizhou Province and on its biological characteristics[J]. Journal of Southwest Agricultural University (Natural Science), 2004, 26(4): 413-416. (in Chinese) 杨学辉, 肖崇刚, 袁洁. 贵州辣椒疫病病原鉴定及生物学特性研究[J]. 西南农业大学学报:自然科学版, 2004, 26(4): 413-416. |
| [3] |
Yang WR, Xing D, Peng GH, et al. Research advances on biocontrol to Phytophthora capsici of pepper with trichoderma[J]. Modern Agricultural Science & Technology, 2015(19): 127-129. (in Chinese) 杨万荣, 邢丹, 蓬桂华, 等. 木霉菌生物防治辣椒疫病的研究进展[J]. 现代农业科技, 2015(19): 127-129. DOI:10.3969/j.issn.1007-5739.2015.19.074 |
| [4] |
Yi TY, Xie BY, Zhang BX, et al. Advances in research on prevention and control of pepper blight[J]. Chinese Vegetables, 2002(5): 52-55. (in Chinese) 易图永, 谢丙炎, 张宝玺, 等. 辣椒疫病防治研究进展[J]. 中国蔬菜, 2002(5): 52-55. DOI:10.3969/j.issn.1000-6346.2002.05.034 |
| [5] |
Wang Y, Wang S, Zhao YQ, et al. Biological characteristic and identification method of pepper resistance to Phytophthora capsici Leonian in Guizhou Province[J]. Hubei Agricultural Sciences, 2014, 53(20): 4845-4847. (in Chinese) 王莹, 王姝, 赵玉桥, 等. 贵州省辣椒疫霉菌生物学特性和辣椒抗疫病性鉴定方法初探[J]. 湖北农业科学, 2014, 53(20): 4845-4847. |
| [6] |
Zhu TH, Yang ZZ. A study on strain degeneration and its control of Bacillus subtilis[J]. Journal of Southwest Forestry College, 2000, 20(1): 31-35. (in Chinese) 朱天辉, 杨佐忠. 枯草芽孢杆菌菌种退化及其控制[J]. 西南林学院学报, 2000, 20(1): 31-35. |
| [7] |
Rogerson CT. The hypocrealean fungi (Ascomycetes, Hypocreales)[J]. Mycologia, 1970, 62(5): 865-910. DOI:10.1080/00275514.1970.12019033 |
| [8] |
Doi Y. Revision of the Hypocreales with cultural observations IV. The genus Hypocrea and its allies in Japan (2) Enumeration of the species[J]. Bulletin of the National Science Museum, 1972, 15: 649-751. |
| [9] |
Zhu ZX. Classification of Trichoderma spp. in China and its molecular systematics[D]. Beijing: Doctoral Dissertation of University of Chinese Academy of Sciences, 2014 (in Chinese) 朱兆香.中国产子囊座的木霉属分类研究及该属分子系统学[D].北京: 中国科学院大学博士学位论文, 2014 |
| [10] |
Weindling R. Trichoderma lignorum as a parasite of other soil fungi[J]. Phytopathology, 1932, 22(3): 837-845. |
| [11] |
Yang XM, Chen LH, Yong XY, et al. Formulations can affect rhizosphere colonization and biocontrol efficiency of Trichoderma harzianum SQR-T037 against Fusarium wilt of cucumbers[J]. Biology and Fertility of Soils, 2011, 47(3): 239-248. DOI:10.1007/s00374-010-0527-z |
| [12] |
Zhang R, Li JH, Chai ZX, et al. Screening of biocontrol Trichoderma from potato rhizosphere of Western Gansu against Fusarium sambucinum and their identification[J]. Acta Prataculturae Sinica, 2009, 18(2): 138-145. (in Chinese) 张茹, 李金花, 柴兆祥, 等. 甘肃河西马铃薯根际生防木霉菌对接骨木镰刀菌的拮抗筛选及鉴定[J]. 草业学报, 2009, 18(2): 138-145. DOI:10.3321/j.issn:1004-5759.2009.02.021 |
| [13] |
Kang PZ, Zhang LR, Shen RQ. Antagonism of eleven Trichoderma species against Botrytis cinerea in Grape[J]. Chinese Agricultural Science Bulletin, 2007, 23(8): 392-395. (in Chinese) 康萍芝, 张丽荣, 沈瑞清. 11种木霉菌对葡萄灰霉病菌的拮抗作用[J]. 植物保护科学, 2007, 23(8): 392-395. |
| [14] |
Gao KX, Liu XG, Guo RF, et al. Mycoparasitism of Trichoderma spp. on five plant pathogenic fungi[J]. Journal of Shandong Agricultural University (Natural Science), 2002, 33(1): 37-42. (in Chinese) 高克祥, 刘晓光, 郭润芳, 等. 木霉菌对五种植物病原真菌的重寄生作用[J]. 山东农业大学学报:自然科学版, 2002, 33(1): 37-42. |
| [15] |
Gu LJ, Xu BL, Liang QL, et al. Antagonism and mechanism of action of Trichoderma aureoviride against Pythium aphanidermatum causing turfgrass root rot[J]. Acta Prataculturae Sinica, 2011, 20(2): 46-51. (in Chinese) 古丽君, 徐秉良, 梁巧兰, 等. 生防木霉菌T2菌株对禾草腐霉病抑菌作用及机制[J]. 草业学报, 2011, 20(2): 46-51. |
| [16] |
Yang S, Sun LL, Deng SL, et al. Effects of Trichoderma asperellum fermentation broth on antioxidant system and lipid peroxidation of Alternaria solani sorauer[J]. Chinese Agricultural Science Bulletin, 2017, 33(5): 90-94. (in Chinese) 杨帅, 孙丽丽, 邓世林, 等. 棘孢木霉发酵液对番茄早疫病抗氧化系统和脂质过氧化作用的影响[J]. 中国农学通报, 2017, 33(5): 90-94. |
| [17] |
Zhang J, Zhang SW, Xu BL, et al. Determining antifungal spectrum and mechanism of Trichoderma longibrachiatum in vitro[J]. Chinese Journal of Eco-Agriculture, 2014, 22(6): 661-667. (in Chinese) 张瑾, 张树武, 徐秉良, 等. 长枝木霉菌抑菌谱测定及其抑菌作用机理研究[J]. 中国生态农业学报, 2014, 22(6): 661-667. |
| [18] |
Song XY, Sun CY, Chen XL, et al. Research advances on mechanism of Trichoderma in biological control[J]. Review of China Agricultural Science and Technology, 2006, 8(6): 20-25. (in Chinese) 宋晓妍, 孙彩云, 陈秀兰, 等. 木霉生防作用机制的研究进展[J]. 中国农业科技导报, 2006, 8(6): 20-25. DOI:10.3969/j.issn.1008-0864.2006.06.005 |
| [19] |
Saravanakumar K, Yu CJ, Dou K, et al. Synergistic effect of Trichoderma-derived antifungal metabolites and cell wall degrading enzymes on enhanced biocontrol of Fusarium oxysporum f. sp. cucumerinum[J]. Biological Control, 2016, 94: 37-46. DOI:10.1016/j.biocontrol.2015.12.001 |
| [20] |
Yang HT. Trichoderma Classification and Identification[M]. Beijing: China Land Press, 2009: 19-59. (in Chinese) 杨合同. 木霉分类与鉴定[M]. 北京: 中国大地出版社, 2009: 19-59. |
| [21] |
Liu YX, Sun HL. The role of mycorrhiza and the isolation and identification of mycorrhizal fungi[J]. China Forestry, 2011(4): 52. (in Chinese) 刘应仙, 孙会林. 菌根的作用及菌根真菌的分离和鉴定[J]. 中国林业, 2011(4): 52. |
| [22] |
Gherbawy Y, Kesselboth C, Elhariry H, et al. Molecular barcoding of microscopic fungi with emphasis on the mucoralean genera Mucor and Rhizopus[A]//Gherbawy Y, Voigt K. Molecular Identification of Fungi[M]. Berlin, Heidelberg: Springer, 2010
|
| [23] |
Meksi SG, Letscher V, Filisetti D, et al. Dermatophytic disease: Report of a Tunisian case caused by a sterile dermatophyte identified as Trichophyton Rubrum by its1 and its4 sequencing[J]. Journal de Mycologie Médicale, 2014, 24(2): e87. |
| [24] |
El-Tarabily KA, Nassar AH, Hardy GE, et al. Plant growth promotion and biological control of Pythium aphanidermatum, a pathogen of cucumber, by endophytic actinomycetes[J]. Journal of Applied Microbiology, 2010, 106(1): 13-26. |
| [25] |
Xiao SQ, Xue CS, Cao YY. Screening of antagonistic Trichoderma and inhibition mechanism to Phytophthora capsici[J]. Northern Horticulture, 2011(5): 26-28. (in Chinese) 肖淑芹, 薛春生, 曹远银. 辣椒疫霉菌拮抗木霉的筛选及抑菌机制研究[J]. 北方园艺, 2011(5): 26-28. |
| [26] |
Zhang AM, Han SY, Yang H, et al. Isolation and preliminary screening of antagonistic Trichoderma spp. strains to Phytophthora capsici[J]. Guizhou Agricultural Sciences, 2014(6): 87-90. (in Chinese) 张爱民, 韩世玉, 杨红, 等. 辣椒疫霉菌拮抗木霉菌株的分离与初步筛选[J]. 贵州农业科学, 2014(6): 87-90. DOI:10.3969/j.issn.1001-3601.2014.06.022 |
| [27] |
Gu ZM, Bi H, Zhang B, et al. Inhibition action of different Trichoderma strains on Fusarium oxysporum f. Sp. cucumerimum[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2018, 27(3): 426-431. (in Chinese) 谷祖敏, 毕卉, 张兵, 等. 不同木霉菌株对黄瓜枯萎病菌的拮抗作用[J]. 西北农业学报, 2018, 27(3): 426-431. |
| [28] |
He L. Isolation and identification of the antagonistic substance of the endophytic fungi from Sophora flavescens and its function mechanism[D]. Shenyang: Doctoral Dissertation of Shenyang Agricultural University, 2011 (in Chinese) 何璐.苦参内生真菌抑菌物质纯化鉴定及作用机制研究[D].沈阳: 沈阳农业大学博士学位论文, 2011 |
| [29] |
Wang F. Screening of endophytic bacteria from Sophora flavescens and identification of its antagonistic substances[D]. Shenyang: Doctoral Dissertation of Shenyang Agricultural University, 2009 (in Chinese) 王芳.苦参内生拮抗细菌筛选及其抗菌物质纯化鉴定[D].沈阳: 沈阳农业大学博士学位论文, 2009 |
| [30] |
Hu DW, Wang YC, Xu Y. Ultrastructural and cytochemical examination on antagonism of Trichoderma harzianum to Phytophthora capsici[J]. Mycosystema, 2003, 22(1): 95-100. (in Chinese) 胡东维, 王源超, 徐颖. 木霉对辣椒疫霉菌抑制作用的超微结构与细胞化学[J]. 菌物学报, 2003, 22(1): 95-100. |
| [31] |
Mitchell R, Alexander M. The mycolytic phenomenon and biological control of Fusarium in Soil[J]. Nature, 1961, 190(4770): 109-110. DOI:10.1038/190109a0 |
| [32] |
Stressmann M, Kitao S, Griffith M, et al. Calcium interacts with antifreeze proteins and chitinase from cold-acclimated winter rye[J]. Plant Physiology, 2004, 135(1): 364-376. DOI:10.1104/pp.103.038158 |
| [33] |
Cheng XX, Feng ZL, Feng HJ, et al. Applications of fungal chitinase in the fungal disease-resistant plants[J]. Plant Protection, 2017, 43(3): 29-35. (in Chinese) 程笑笑, 冯自力, 冯鸿杰, 等. 真菌源几丁质酶在植物抗真菌病害中的应用[J]. 植物保护, 2017, 43(3): 29-35. DOI:10.3969/j.issn.0529-1542.2017.03.005 |
| [34] |
Randall TA, Dwyer RA, Huitema E, et al. Large-scale gene discovery in the oomycete Phytophthora infestans reveals likely components of phytopathogenicity shared with true fungi[J]. Molecular Plant-Microbe Interactions: MPMI, 2005, 18(3): 229-243. DOI:10.1094/MPMI-18-0229 |
| [35] |
Zuo YH, Kang ZS, Yang CP, et al. Relationship between activities of β-1, 3 -glacanase and chitinase and resistance to phytophthora root rot in soybean[J]. Acta Phytopathologica Sinica, 2009, 39(6): 600-607. (in Chinese) 左豫虎, 康振生, 杨传平, 等. β-1, 3-葡聚糖酶和几丁质酶活性与大豆对疫霉根腐病抗性的关系[J]. 植物病理学报, 2009, 39(6): 600-607. DOI:10.3321/j.issn:0412-0914.2009.06.006 |
| [36] |
Bell AE, Charlwood BV. Encyclopedia of Plant Physiology. Volume 8. Secondary plant products[C]//Berlin: Encyclopedia of Plant Physiology New, 1980
|
| [37] |
Li P, Zhang QR, Wu Y, et al. Effect of activities of polygalacturonase on pathogenicity in Phytophthora capsici[J]. Journal of Anhui Agricultural Sciences, 2015(19): 111-113, 1167. (in Chinese) 李萍, 张茜茹, 吴亚, 等. 辣椒疫霉多聚半乳糖醛酸酶活性对其致病力的影响[J]. 安徽农业科学, 2015(19): 111-113, 1167. DOI:10.3969/j.issn.0517-6611.2015.19.042 |
| [38] |
Wang CL, Wang DM, Huang W, et al. Study on the relationship between the fusaric acid, β-glucoseidase activity and the pathogenicity of Fusarium oxysporum f. sp. niveum on watermelon[J]. Journal of Xinjiang Agricultural University, 2000, 23(1): 1-6. (in Chinese) 王纯利, 王冬梅, 黄炜, 等. 西瓜枯萎病菌致病力与镰刀菌酸和β-1, 4葡萄糖苷酶活性的关系研究[J]. 新疆农业大学学报, 2000, 23(1): 1-6. |
| [39] |
Xia Y, Yang LR, Xia LM. High-level production of a fungal β-glucosidase with application potentials in the cost-effective production of Trichoderma reesei cellulose[J]. Process Biochemistry, 2018, 70: 55-60. DOI:10.1016/j.procbio.2018.03.031 |
| [40] |
Huang JF, Zhang FB, Pang YW, et al. Inhibition of banana Fusarium wilt by two biocontrol agents[J]. Microbiology China, 2017, 44(4): 835-844. (in Chinese) 黄建凤, 张发宝, 逢玉万, 等. 两株香蕉枯萎病拮抗细菌的筛选及抑菌机理[J]. 微生物学通报, 2017, 44(4): 835-844. |
 2019, Vol. 46
2019, Vol. 46