扩展功能
文章信息
- 黄佳明, 姜宁, 张爱忠
- HUANG Jia-Ming, JIANG Ning, ZHANG Ai-Zhong
- 基因工程菌生产抗菌肽的研究进展
- Progress in engineering bacteria producing antibacterial peptides
- 微生物学通报, 2019, 46(3): 654-659
- Microbiology China, 2019, 46(3): 654-659
- DOI: 10.13344/j.microbiol.china.180687
-
文章历史
- 收稿日期: 2018-09-04
- 接受日期: 2018-11-30
- 网络首发日期: 2018-12-27
自第一个抗菌肽——天蚕素被发现以来[1],迄今为止,已发现2 400多种抗菌肽[2]。抗菌肽通常是由短氨基酸序列构成的小肽,具有广谱的杀菌活性[3],对病毒和癌症细胞[4]都有一定的杀伤能力,除此之外还具有一定的免疫学活力。由于抗生素弊端的不断显现,使得抗菌肽也越来越多地作为一种潜在的抗生素替代物而被人熟知,抗菌肽的生产也受到广泛关注。如何获得大量具有更好抗菌活性的抗菌肽一直都是抗菌肽开发生产的主要内容。越来越多的研究表明,相比于传统的分离法和化学合成法,采用基因工程技术是开发、生产抗菌肽的有效方法。一方面,经过基因工程技术得到的抗菌肽,可以作为产品进行鉴定和开发;另一方面,与其他的方法相比,基因工程法存在着可以大规模生产、成本低等潜在优势。并且近些年分子生物学和DNA重组技术的发展也为抗菌肽的基因工程化提供了良好的技术支持[2]。因此,系统了解基因工程菌生产抗菌肽技术利弊尤为重要。
1 抗菌肽的主要生产方式及困难因素目前获得抗菌肽的方式主要有以下几种:(1)从生物体内直接分离提纯有生物活性的抗菌肽,再对其结构和功能进行研究。近年来研究者在不同的动物中都取得了较好的进展,不仅从猪、牛等[5-6]常见动物中,也从大鲵、黑水虻[7-8]等生物中分离提纯出了有活性的抗菌肽。但这种方法比较繁琐,且得到的抗菌肽含量普遍很低,不适合进行规模化生产,仅适合进行技术开发。(2)人工合成抗菌肽,根据已知的抗菌肽基因序列,用化学的方法合成抗菌肽[9-10]。但这种方法成本高、价格贵,不适于广泛普及应用。(3)酶解法,主要是通过将有抗菌活性的蛋白用特定的蛋白酶切割下其有抗菌活性的部分进行纯化,继而得到抗菌肽。鱼鳞抗菌肽就是通过该法得到的[11]。Esmaeilpour等[12]也通过该法从山羊乳清蛋白中分离提纯出了有活性的抗菌肽。这种方法得到的抗菌肽活性较高,但是纯化比较麻烦,产量低,需要的成本也较高。以上3种方式都是获得抗菌肽的可行手段,但都因存在其短板而制约抗菌肽的规模化生产。而利用基因工程菌来生产抗菌肽,可以在一定程度上解决这些困难。通过这种方法得到的抗菌肽目的性强,技术上有提高产量的技术空间,特别是应用可食用工程菌,成本低、应用广,是生产抗菌肽的一条理想途径。
2 基因工程菌生产抗菌肽目前用于基因工程菌的异源表达系统在生产不同大小、折叠和复杂性的异源抗菌肽方面取得了很大的进步。不同的抗菌肽因其不同的特征,在选择用于生产的宿主系统时应该仔细挑选,例如大小、细胞内的定位或分泌、正确的折叠和糖基化的方式等。有研究表明,抗菌肽生产的主要表达系统是细菌和酵母表达系统。作为表达系统,他们的组成基本相同,都是由外源基因、表达载体及宿主菌组成。但又由于真核与原核的差异,也使得它们存在着各自的特点。具体的将在下面章节进行简单的论述。
2.1 大肠杆菌生产抗菌肽 2.1.1 大肠杆菌表达系统生产抗菌肽大肠杆菌表达系统是应用最早的表达系统,对其的研究也就更为深入,在所有基因工程菌生产抗菌肽的方法中大肠杆菌表达系统是最常见的。清晰的遗传学背景、成熟的表达技术以及菌体生长快等特点使其得到了广泛的应用。这也使各种类型的抗菌肽都实现了在大肠杆菌中的表达。研究表明一般抗菌肽在大肠杆菌中的表达量因载体种类和抗菌肽的种类不同而不同,人源抗菌肽表达产量多数是比较高的[13]。例如,复合抗菌肽AL32-P113和重组抗菌肽UBI 18-35实现了在大肠杆菌中的表达,并得到了可观的表达量12.1 mg/L[14]和6 mg/L[15]。但其他抗菌肽也有一定的开发空间,如Fowlicidin-3在大肠杆菌BL21 Rosetta中的融合表达,得到了表达量为0.84 mg/mL和0.71 mg/mL的抗菌肽Trx-Fowlicidin-3a和Trx-Fowlicidin-3b[16]。抗菌肽SMAP-29融合表达时,对表达条件进行优化后得到了最高表达量占菌体11.35%的抗菌肽SMAP-29[17]。黄粉虫抗菌肽基因在大肠杆菌中也取得了较高的抗菌肽表达量,占细菌总蛋白的40%以上[18]。目前,用大肠杆菌来生产抗菌肽的方法已经十分的成熟,并取得了广泛的应用,是抗菌肽规模化生产的一条有效途径。
2.1.2 大肠杆菌表达系统生产抗菌肽的困难因素影响大肠杆菌表达系统生产抗菌肽的因素:(1)大肠杆菌表达系统由于没有像真核生物一样后期的翻译即修饰蛋白的能力,导致了中间产物的过度累积,容易形成包涵体结构。包涵体的形成有利有弊,首先在表达抗菌肽的技术中存在有利的生物技术策略,因为这能形成丰富而又比较纯的重组蛋白,易于从宿主中分离,其次还能抵抗体内蛋白酶分解。缺点就是目标肽在包涵体构成过程一般是不可直接控制的,而有效控制的方法是在融合表达过程中有望进行包涵体的表达[19]。由于后期的翻译能力弱,也使得分泌的抗菌肽的稳定性较弱,活性弱。(2)容易产生内毒素,这会导致抗菌肽在后期表达过程中容易对宿主造成“自杀现象”,即杀灭本身的宿主菌。(3)表达载体的选择。不同类型的表达载体也会对抗菌肽的生产产生不同的影响,目前常见的功能性的表达载体有3种[20]:非融合型、融合型以及分泌型的表达载体。非融合型表达载体的主要特点是得到的抗菌肽与天然抗菌肽有着很高的相似性,如pPL-Lamda;融合型表达载体可以简化提纯步骤,如pGEX系列;分泌型表达载体的主要优点是防止分泌的抗菌肽被宿主菌体内的蛋白酶降解,如pEZZ18。(4)培养条件。培养条件也会对大肠杆菌生产抗菌肽产生影响,大肠杆菌表达系统理想的培养条件是,有适量的微量元素如:Mg2+、Ca2+、K+和NH4+,以及充足的能量等。
2.2 酵母菌生产抗菌肽 2.2.1 酵母表达系统生产抗菌肽酵母是真核生物,本身具备单细胞快速生长和易于遗传操作的优点,除此之外,对后期蛋白质的正确加工和翻译后的修饰都要强于大肠杆菌。表现在酵母的糖基化以及多聚糖结构糖蛋白的产生。由于它们众多优点使其作为表达系统的研究也不断深入。毕赤酵母是酵母表达系统中应用最为广泛的表达系统,但由于没有稳定的附加体质粒,在表达外源抗菌肽基因时,所用的表达载体几乎都是可以直接整合到酵母基因组中的整合型质粒载体,如pPICZ和pIPC3k等。表达系统中用于生产抗菌肽的宿主菌株都是通过原野生型菌株NRRL-Y11430经过改良得到的[21]。毕赤酵母是甲醇营养型酵母,可以在只有甲醇的培养基中生长,而在其他培养基中几乎不生长,因而甲醇可以用于转化后重组菌株的筛选。有研究表明,与大肠杆菌相比毕赤酵母往往能取得更好的效果。例如,抗黄曲霉毒素B1在大肠杆菌和毕赤酵母中分别表达,但后者的表达量是前者的1.3倍[22]。多种抗菌肽实现了在酵母菌中的表达,而且得到了可观的表达量。抗菌肽Moricin的基因经扩增后导入毕赤酵母,实现了高表达,经发酵在上清液中得到248.98 mg/L的重组蛋白[23],经检测有明显的抑菌活性。抗菌肽Snakin-1在毕赤酵母中成功表达,得到了表达量为40 mg/L的抗菌肽[24]。重组表达载体pPICZαA-GST-Apidaecin在毕赤酵母菌中实现表达,成功表达出有明显抗菌活性的Apidaecin型抗菌肽,表达量为1.76 g/L[25]。以上研究表明,通过毕赤酵母菌生产抗菌肽是一种有效的生产方法,而且相对于大肠杆菌,作为真核表达系统的毕赤酵母具有更多的优势。
2.2.2 毕赤酵母表达系统生产抗菌肽的困难因素外源抗菌肽基因在毕赤酵母中表达时,有很多的因素都会影响抗菌肽的生产。(1)外源抗菌肽基因自身的内在因素。选用毕赤酵母偏爱的密码子可以在一定程度上提高抗菌肽的表达效率。(2) mRNA 5′端非翻译区的组成长度与AOX1/MOX保持一致也可以提高抗菌肽产量。(3) UTR序列、A+T含量和基因的拷贝数等都会在一定程度上限制抗菌肽的生产量。研究表明,A+T含量在30 mol%-55 mol%之间为最好,A+T的含量越高越容易产生类似终止子之类的结构,影响抗菌肽的生产。(4)毕赤酵母自身分泌蛋白酶,对外源抗菌肽有一定的溶解作用,这是其面临的主要问题。目前主要的解决方式是通过降低培养基pH以及在培养基中添加蛋白质水解产物等方式来提高抗菌肽的表达量,除此之外采用蛋白酶缺陷的宿主菌如SMD1168也可以提高其生产量。
2.3 枯草芽胞杆菌生产抗菌肽 2.3.1 枯草芽胞杆菌表达系统生产抗菌肽枯草芽孢杆菌是遗传和生理水平最好的革兰氏阳性菌之一。其染色体的整个序列是已知的,这极大地加快了基因工程技术的应用进程。经过多年努力,芽孢杆菌表达系统已经克隆和表达了多种真核和原核的外源基因。徐建[26]成功构建表达载体pMK-BD-2/CP1,并实现了融合抗菌肽pBD-2/cecropin P1在枯草芽孢杆菌中的表达,表达量为45 mg/L,经验证有良好的抗菌活性。魏丹丹等[27]将2个含抗菌肽PR-FO基因的表达载体质粒,分别导入枯草芽孢杆菌中进行诱导表达,最终得到了具有抗菌活性的表达量为3 mg/L和4 mg/L的抗菌肽PR-FO。通过人工合成抗菌肽的目的基因序列,将其与表达载体pHT43进行连接,构建重组表达质粒pHT43/SS-BD[28]和pHT43/CC34[29],转入到枯草芽孢杆菌中,成功表达出有抑菌效果的抗菌肽β-defensi和CC31。除此之外,抗菌肽阴极诱导素-BF和抗菌肽Abaecin也实现了在枯草芽孢杆菌中的表达,表达量分别为0.5 mg/L和3 mg/L[30-31]。以上研究表明,枯草芽孢杆菌作为基因工程菌也为抗菌肽的生产提供了一条良好的途径。
2.3.2 枯草芽胞杆菌表达系统生产抗菌肽的困难因素枯草芽胞杆菌表达系统在抗菌肽的生产中主要有以下几点限制因素:(1)枯草芽孢杆菌本身分泌蛋白酶,会降解一部分分泌表达的抗菌肽而影响表达量。(2)不能高效的表达,抗菌肽的表达效率低,这也是其亟待解决的问题。(3)质粒的不稳定性表现在两方面,即结构的不稳定性和分离的不稳定性。前者容易引起抗菌肽基因片段的丢失和结构的改变,后者容易导致表达载体质粒的丢失。使用整合性质粒是解决质粒不稳定性的一条有效途径。
2.4 乳酸菌生产抗菌肽 2.4.1 乳酸菌表达系统生产抗菌肽乳酸菌是一种益生菌,本身就可以产生抗菌和杀菌物质,不产生内毒素,表达的抗菌肽和菌体可以一起用来饲喂动物,经过改造的乳酸菌几乎不分泌本源蛋白,也就间接降低了抗菌肽被内部分解的风险。因此它与其他表达系统相比存在一些天然优势。随着分子生物学和基因工程技术的发展也使乳酸菌表达系统有了更进一步的发展。有研究表明已有抗菌肽在乳酸菌中实现成功表达,例如李朴等[32]成功实现了抗菌肽Baetenecin7在乳酸菌中的表达,得到了具有生物活性的抗菌肽Baetenecin7。但并没有实现对其表达量的测定。谭嘉圣[33]也成功实现了人源抗菌肽LL-37在乳酸菌NZ9000中的表达。这表明了乳酸菌表达系统作为一种新型表达系统,也有着生产抗菌肽的潜能。也可以作为抗菌肽开发以及规模化生产的途径。
2.4.2 乳酸菌表达系统生产抗菌肽的困难因素乳酸菌表达系统作为生产抗菌肽的新兴系统,已慢慢被人们所熟知以及应用,但也存在一些问题与不足。首先就是乳酸菌作为表达系统在表达抗菌肽方面的研究报道较少,目前对乳酸菌表达系统的研究还处于探索阶段,对其遗传背景的认识还很薄弱,这限制了其发展。其次蛋白表达效率低以及信号肽分泌效率的不稳定都是影响抗菌肽生产的重要因素。
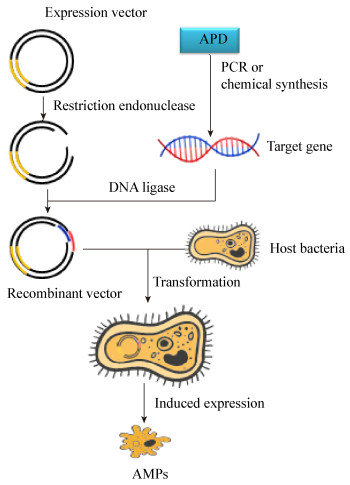
2.5 基因工程菌生产抗菌肽模式图为了能更直观地看到抗菌肽在基因工程菌的生产过程,图 1为抗菌肽在基因工程菌中生产过程的模式图。
|
| 图 1 基因工程菌生产抗菌肽模式图 Figure 1 Pattern of antimicrobial peptidesproduction by genetically engineered bacteria |
|
|
在抗生素滥用的大背景下,抗菌肽拥有着众多优点无疑是代替抗生素的最佳选择,但抗菌肽的开发一直是亟待解决的难题,虽然通过基因工程菌生产抗菌肽在一定程度上解决了抗菌肽的生产困难,但也面临着众多的问题。(1)基因工程得到的抗菌肽与天然纯化分离得到的抗菌肽存在差异。(2)表达产量低。(3)抗菌肽的毒性问题,有研究表明部分抗菌肽会导致受体细胞的自杀行为,以及分泌的抗菌肽也会杀伤受体细胞。(4)本身分泌蛋白酶,会降解抗菌肽,影响抗菌肽的表达量。面对以上问题目前采取的主要解决方式是利用生物信息学对抗菌肽分子进行改造。(1)利用生物信息技术对抗菌肽的分子构造进行改造,以期得到对宿主杀伤性小,不易被宿主分泌的蛋白酶分解的新型抗菌肽。(2)抗菌肽基因的串联技术,对抗菌肽基因进行串联,通过提高抗菌肽目的蛋白的产量来间接提高抗菌肽的表达量,这是一种提高抗菌肽表达量的方法。除此之外,对抗菌肽进行串联也可以掩蔽单体抗菌肽的活性,来达到降低抗菌肽毒性的目的。(3)融合表达,有研究表明,将抗菌肽与防止蛋白酶降解的基因进行融合表达,可以降低抗菌肽在宿主菌内被其分泌的蛋白酶分解的风险。另一种防止抗菌肽被宿主蛋白酶分解的方法就是采用包涵体的形式表达。这样不仅可以降低抗菌肽被分解的风险,也降低了抗菌肽本身对宿主菌的毒害作用。面对众多的难题,虽然研究者采取了相应的措施,但如何获得产量高、活性更好的抗菌肽还需进一步探索,近年来越来越多抗菌肽分子改造技术以及表达系统的新技术相继被报道,也为抗菌肽的开发带来了更多的选择。相信在不久的将来,在研究者的不断努力下,抗菌肽势必会有更好的未来,来造福于人类。
| [1] |
Steiner H, Hultmark D, EngströmÅ, et al. Sequence and specificity of two antibacterial proteins involved in insect immunity[J]. Nature, 1981, 292(5820): 246-248. DOI:10.1038/292246a0 |
| [2] |
Qi L, Jiang N, Zhang AZ, et al. Research present status and reform strategy of antimicrobialpeptides[J]. China Animal Husbandry & VeterinaryMedicine, 2016, 43(2): 450-456. (in Chinese) 祁丽, 姜宁, 张爱忠, 等. 抗菌肽研发现状及其改造策略[J]. 中国畜牧兽医, 2016, 43(2): 450-456. |
| [3] |
Abdelbaqi S, Deslouches B, Steckbeck J, et al. Novel engineered cationic antimicrobial peptides display broad-spectrum activity against Francisella tularensis, Yersinia pestis and Burkholderia pseudomallei[J]. Journal of Medical Microbiology, 2016, 65(2): 188-194. DOI:10.1099/jmm.0.000209 |
| [4] |
Bandyopadhyay S, Lee M, Sivaraman J, et al. Model membrane interaction and DNA-binding of antimicrobial peptide lasioglossin Ⅱ derived from bee venom[J]. Biochemical and Biophysical Research Communications, 2013, 430(1): 1-6. DOI:10.1016/j.bbrc.2012.11.015 |
| [5] |
Xia YH. Isolation, purification and activity analysis of antimicrobial peptide SSH19 from swine spleen[D]. Xinxiang: Master's Thesis of Henan University of Science and Technology, 2017 (in Chinese) 夏一赫.猪脾脏抗菌肽SSH19的分离鉴定及其生物信息学分析[D].新乡: 河南科技学院硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10467-1017154970.htm |
| [6] |
Zhang BQ. Isolation, purification and activity analysis of antimicrobial peptide BSN27 from bovine spleen[D]. Xinxiang: Master's Thesis of Henan University of Science and Technology, 2017 (in Chinese) 张冰清.牛脾脏抗菌肽BSN27的分离、纯化及活性分析[D].新乡: 河南科技学院硕士学位论文, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10467-1017154969.htm |
| [7] |
Park SI, Yoe SM. A novel cecropin-like peptide from black soldier fly, Hermetia illucens: isolation, structural and functional characterization[J]. Entomological Research, 2017, 47(2): 115-124. DOI:10.1111/1748-5967.12226 |
| [8] |
Pei JJ, Jiang L. Antimicrobial peptide from mucus of Andrias davidianus: screening and purification by magnetic cell membrane separation technique[J]. International Journal of Antimicrobial Agents, 2017, 50(1): 41-46. DOI:10.1016/j.ijantimicag.2017.02.013 |
| [9] |
Wang XQ, Gao Y, Yin ZF, et al. Solid Phase synthesis and anti-microbial activities of the antibacterial peptide IB-367[J]. Chinese Journal of Synthetic Chemistry, 2016, 24(7): 600-603. (in Chinese) 王小青, 高杨, 尹志峰, 等. 抗菌肽IB-367的固相合成与抑菌活性[J]. 合成化学, 2016, 24(7): 600-603. |
| [10] |
Isaksson J, Brandsdal BO, Engqvist M, et al. A synthetic antimicrobial peptidomimetic (LTX 109): stereochemical impact on membrane disruption[J]. Journal of Medicinal Chemistry, 2011, 54(16): 5786-5795. DOI:10.1021/jm200450h |
| [11] |
Shi YQ, Wang QQ, Wu LD, et al. Optimization of preparation of antimicrobial peptides by Two-Step enzymatic hydrolysis of fish scales using response surface methodology and antimicrobial activity of purified antimicrobial peptide[J]. Food Science, 2018, 39(6): 155-161. (in Chinese) 施永清, 王巧巧, 吴丹丽, 等. 响应面试验优化双酶酶解法制备鱼鳞抗菌肽工艺及其抑菌性能分析[J]. 食品科学, 2018, 39(6): 155-161. |
| [12] |
Esmaeilpour M, Ehsani MR, Aminlari M, et al. Antimicrobial peptides derived from goat's milk whey proteins obtained by enzymatic hydrolysis[J]. Journal of Food Biosciences and Technology, 2017, 7(1): 65-72. |
| [13] |
Parachin NS, Mulder KC, VianaAAB, et al. Expression systems for heterologous production of antimicrobial peptides[J]. Peptides, 2012, 38(2): 446-456. DOI:10.1016/j.peptides.2012.09.020 |
| [14] |
Wanmakok M, Orrapin S, Intorasoot A, et al. Expression in Escherichia coli of novel recombinant hybrid antimicrobial peptide AL32-P113 with enhanced antimicrobial activity in vitro[J]. Gene, 2018, 671: 1-9. DOI:10.1016/j.gene.2018.05.106 |
| [15] |
Ashcheulova DO, Efimova LV, Lushchyk AY, et al. Production of the recombinant antimicrobial peptide UBI18-35 in Escherichia coli[J]. Protein Expression and Purification, 2018, 143: 38-44. DOI:10.1016/j.pep.2017.10.011 |
| [16] |
He ZQ, Liu TJ, Lü YJ, et al. Biological characteristics of the antibacterial peptide Fowlicidin-3 fusion expressed in Escherichia coli[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2011, 32(4): 1-6. (in Chinese) 和祯泉, 刘天健, 吕英军, 等. 抗菌肽Folicidin-3在大肠杆菌中融合表达及抑菌活性[J]. 扬州大学学报:农业与生命科学版, 2011, 32(4): 1-6. |
| [17] |
Wu SQ, Zhao GJ, Wan J, et al. Optimization of expression conditions and purification of antibacterial peptide SMAP-29 in Escherichia coli[J]. Jiangsu Agricultural Science, 2018, 46(9): 44-47. (in Chinese) 吴三桥, 赵冠杰, 万健, 等. 抗菌肽SMAP-29在大肠杆菌中表达条件的优化及纯化研究[J]. 江苏农业科学, 2018, 46(9): 44-47. |
| [18] |
Alimu R, Mao XF, Liu ZY. Expression optimization and characterization of Tenebrio molitor antimicrobiol peptides TmAMP1m in Escherichia coli[J]. Chinese Journal of Biotechnology, 2013, 29(6): 836-847. (in Chinese) 热依汗古丽·阿里木, 毛新芳, 刘忠渊. 黄粉虫抗菌肽在大肠杆菌中表达条件优化及活性分析[J]. 生物工程学报, 2013, 29(6): 836-847. |
| [19] |
Kuddus MR, Yamano M, Rumi F, et al. Enhanced expression of cysteine-rich antimicrobial peptide snakin-1 in Escherichia coli using an aggregation-prone protein coexpression system[J]. Biotechnology Progress, 2017, 33(6): 1520-1528. DOI:10.1002/btpr.2508 |
| [20] |
Hockney RC. Recent developments in heterologous protein production in Escherichia coli[J]. Trends in Biotechnology, 1994, 12(11): 456-463. DOI:10.1016/0167-7799(94)90021-3 |
| [21] |
Luo JH, You ZL. Study on expression of heterologous gene in Pichiapastoris[J]. Biotechnology Bulletin, 2007(3): 75-79. (in Chinese) 罗竞红, 游自立. 巴斯德毕赤酵母表达系统在外源基因表达中的研究进展[J]. 生物技术通报, 2007(3): 75-79. DOI:10.3969/j.issn.1002-5464.2007.03.016 |
| [22] |
Hu L, Wang XH. Comparison of expression and activity of anti-AFBIscFv in Escherichia coli and Pichia pastoris[J]. Journal of Biology, 2018. (in Chinese) 胡莉, 王小红. 抗黄曲霉毒素B1单链抗体在大肠杆菌和毕赤酵母中的表达和活性研究[J]. 生物学杂志, 2018. |
| [23] |
Huang QG, Liang L, Chen QH, et al. High-Level expression and antibacterial properties of antimicrobial peptide moricin in Pichia pastoris[J]. Food Science, 2017, 38(16): 36-42. (in Chinese) 黄钦耿, 梁玲, 陈巧红, 等. 小菜蛾moricin在毕赤酵母中的表达及抑菌活性分析[J]. 食品科学, 2017, 38(16): 36-42. DOI:10.7506/spkx1002-6630-201716006 |
| [24] |
Kuddus MR, Rumi F, Tsutsumi M, et al. Expression, purification and characterization of the recombinant cysteine-rich antimicrobial peptide snakin-1 in Pichia pastoris[J]. Protein Expression and Purification, 2016, 122: 15-22. DOI:10.1016/j.pep.2016.02.002 |
| [25] |
Shi W, Ma R, Zhou JY, et al. Expression and identification of Apidaecin in pichiapastoris[J]. Journal of Oral Science Research, 2017, 33(5): 471-474. (in Chinese) 施文, 马瑞, 周建业, 等. Apidaecin型抗菌肽在毕赤酵母菌中的基因工程表达[J]. 口腔医学研究, 2017, 33(5): 471-474. |
| [26] |
Xu J. Construction of Bacillus subtilis strain engineered for expression of porcine β-defensin-2/cecropin P1 antimicrobial peptides and its characterization[D]. Qinhuangdao: Master's Thesis of Yanshan University, 2016 (in Chinese) 徐建.表达猪β防御素-2和cecropin P1抗菌肽枯草芽孢杆菌的构建及特性研究[D].秦皇岛: 燕山大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10216-1016764590.htm |
| [27] |
Wei DD, Li XD, Shan AS. Expression of antibacterial peptide PR-FO in Bacillus subtilis[A]//Animal Nutrition Branch of Chinese Association of Animal Science and Veterinary Medicine proceedings of the Twelfth Animal Nutrition Symposium[C]. Wuhan: Animal Nutrition Branch of Chinese Association of Animal Science and Veterinary Medicine, 2016: 697 (in Chinese) 魏丹丹, 李晓丹, 单安山.抗菌肽PR-FO在枯草芽孢杆菌中的表达[A]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集[C].武汉: 中国畜牧兽医学会动物营养学分会, 2016: 697 |
| [28] |
Wang N, Li G, Zou HQ, et al. High Expression ofporcine β-defense in Bacillus subtilis[J]. Southwest China Journal of Agricultural Sciences, 2017, 30(8): 1910-1913. (in Chinese) 王娜, 李钢, 邹辉琴, 等. 猪β-防御素cDNA在枯草芽孢杆菌中的高效表达[J]. 西南农业学报, 2017, 30(8): 1910-1913. |
| [29] |
Jiang N, Zhang AZ, Zhang CX, et al. Expressing method of antimicrobial peptide CC31 in Bacillus subtilis: China, CN105238809A[P]. 2016-01-13 (in Chinese) 姜宁, 张爱忠, 张晨雪, 等.抗菌肽CC31在枯草芽孢杆菌中的表达方法: 中国, CN105238809A[P]. 2016-01-13 |
| [30] |
He Q, Fu AY, Li TJ. Expression and one-step purification of the antimicrobial peptide cathelicidin-BF using the intein system in Bacillus subtilis[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(4): 647-653. |
| [31] |
Luan C, Zhang HW, Song DG, et al. Expressing antimicrobial peptide cathelicidin-BF in Bacillus subtilis using SUMO technology[J]. Applied Microbiology and Biotechnology, 2014, 98(8): 3651-3658. DOI:10.1007/s00253-013-5246-6 |
| [32] |
Li P, Wen YA, Liu JB, et al. Secretory-expression of antimicrobial peptide bactenecin7 gene in Lactococcus lactis and analysis the bioactivity of its expression products[J]. China Biotechnology, 2009, 29(1): 70-74. (in Chinese) 李朴, 文阳安, 刘靳波, 等. 抗菌肽Bactenecin7重组质粒构建及其在乳酸菌的分泌表达和活性鉴定[J]. 中国生物工程杂志, 2009, 29(1): 70-74. |
| [33] |
Tan JS. Synthesis and secretory expression of the origined human and hybrid antimicrobial peptides from Lactococcus lactis[D]. Guangzhou: Master's Thesis of Southern Medical University, 2015 (in Chinese) 谭嘉圣.人源及杂合抗菌肽在乳酸乳球菌中重组分泌表达[D].广州: 南方医科大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-12121-1016004119.htm |
 2019, Vol. 46
2019, Vol. 46




