扩展功能
文章信息
- 张宇洁, 王丽军, 李梦, 顾燕玲, 关波, 倪永清
- ZHANG Yu-Jie, WANG Li-Jun, LI Meng, GU Yan-Ling, GUAN Bo, NI Yong-Qing
- 一株产低温β-半乳糖苷酶微杆菌的筛选鉴定、产酶条件及其酶学特性
- Isolation and identification of a Microbacterium sp. LW106 strain producing cold-active β-galactosidase, and study on its enzyme production conditions and enzymatic properties
- 微生物学通报, 2019, 46(3): 609-617
- Microbiology China, 2019, 46(3): 609-617
- DOI: 10.13344/j.microbiol.china.180160
-
文章历史
- 收稿日期: 2018-03-27
- 接受日期: 2018-07-27
- 网络首发日期: 2018-08-14
β-D-半乳糖苷半乳糖水解酶(β-D-galactoside galactohydrase EC3.2.1.23)也称β-半乳糖苷酶(β-galactosidase),俗称乳糖酶,能够催化乳糖水解生成半乳糖和葡萄糖,部分β-半乳糖苷酶还具有一定的转糖基活性[1]。β-半乳糖苷酶来源广泛,源自微生物中的β-半乳糖苷酶产酶量高、成本低,不受季节、地理位置的限制。因此,截至目前只有来源于微生物的β-半乳糖苷酶在工业上具有应用价值[2]。通过添加β-半乳糖苷酶分解乳品中的乳糖,能显著缓解“乳糖不耐症”。浓缩乳和冷冻乳加工过程中使用β-半乳糖苷酶还可防止乳制品结晶,提高产品品质。在酸乳生产加工过程中,低乳糖牛乳发酵能够缩短牛乳凝固时间,延长货架期,提高乳制品的黏度[3]。
低温下水解乳糖不仅可以更好地保留乳品的营养成分和风味,还可以避免常温水解过程中的微生物污染[4]。然而,目前帝斯曼公司(DSM)的β-半乳糖苷酶来源于乳酸克鲁维酵母(Kluyveromyces lactis),其最适反应温度为50 ℃,在低于20 ℃的低温条件下水解乳糖的效率仅为常温下的10%左右[5]。此外,现有的商品β-半乳糖苷酶还存在活性易被Ca2+和Na+所抑制的缺陷[6],因此,筛选适合在牛乳体系中水解乳糖的新低温β-半乳糖苷酶成为研究的热点[7-9]。
新疆具有丰富的冰川资源,境内多达1.86万条冰川,面积约为全国冰川面积的42%,是新疆的天然固体水库[10]。常年低温的气候环境为发现新的具有特殊酶学性质的低温酶提供了可能。本研究对分离自天山一号冰川的一株产低温β-半乳糖苷酶菌株LW106进行了鉴定,并对其产β-半乳糖苷酶的条件及其酶学性质进行了初步分析,以期为开发新的酶学特性适合在牛乳体系中高效水解乳糖的低温β-半乳糖苷酶制剂提供理论基础。
1 材料 1.1 样品采集及预处理从距乌鲁木齐市西南约120 km的乌鲁木齐河河源区天山中国一号冰川(43°06′54.05″N,86°48′40.21″E,海拔3 833 m,年平均地温约-4.95 ℃)尾部的沉积层取样。用经过灭菌处理的工具采集冰川沉积层深度约10 cm的样品,立刻装进灭菌离心管内,车载冰箱保存并迅速转运至实验室,去除样品表层可能受到污染的部分,分装(5 g/份)后于-80 ℃保存。
在超净工作台内,取5 g沉积物样品加入50 mL浓度为0.85%的无菌生理盐水,振荡摇匀待用。
1.2 培养基(1) 1/4胰蛋白胨大豆肉汤(TSB)培养基(g/L):大豆肉汤水解物1.25,酪蛋白水解物4.25,氯化钠0.63,葡萄糖0.75,磷酸氢二钠0.63。
(2) 初筛培养基(g/L):乳糖5.0,蛋白胨0.5,酵母浸粉0.3,MgSO4·7H2O 0.07,KH2PO4 0.1,CaCl2 0.04,(NH4)2SO4 0.1,琼脂15.0,pH 7.0。
(3) 复筛培养基(g/L):乳糖10.0,酵母浸粉10.0,NaCl 4.0,胰蛋白胨5.0,pH 7.0。
(4) 发酵培养基(g/L):乳糖10.0,酵母浸粉10.0,胰蛋白胨5.0,CaCl2 0.11,KH2PO4 0.05,MnSO4 0.001,MgSO4 0.3,FeSO4 0.03,pH 7.0。
(5) 明胶基础培养基(g/L):蛋白胨5.0,牛肉膏3.0,明胶120.0,pH 7.0-7.2。
(6) 硫酸亚铁半固体培养基(g/L):蛋白胨10.0,牛肉浸粉3.0,酵母浸粉3.0,FeSO4 0.2,Na2S2O3 0.3,NaCl 5.0,琼脂粉12.0,pH 7.4。
(7) 蛋白胨-酵母膏(PY)培养基(g/L):蛋白胨10.0,酵母浸粉10.0,CaCl2 0.008,MgSO4·7H2O 0.02,K2HPO4 0.04,KH2PO4 0.04,NaHCO3 0.4,NaCl 0.08。
1.3 主要试剂和仪器蛋白胨和酵母浸粉购自北京奥博星生物技术有限责任公司;邻硝基苯酚(oNP)、邻硝基苯β-D-半乳吡喃糖苷(oNPG)、异丙基-β-D-硫代半乳糖苷(IPTG)和5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)购自生工生物工程(上海)股份有限公司。PCR扩增仪,Techne公司;酶标仪,BioTek公司。
2 方法 2.1 产β-半乳糖苷酶菌株的分离筛选 2.1.1 初筛吸取1 mL已振摇的土壤悬液,加入装有50 mL 1/4 TSB培养基的锥形瓶内,混合均匀,于4 ℃培养48 h得到增殖培养液。无菌生理盐水梯度稀释(10-3、10-4、10-5)培养液,每个稀释度吸取100 μL悬液均匀涂布到添加有X-Gal和IPTG的1/4 TSB培养基平板上,置于15 ℃恒温培养箱中培养6-15 d,当菌落出现蓝白色变化时进行初筛,挑取蓝色菌落分离纯化3次。
2.1.2 复筛挑取初筛获得的蓝色单菌落接种到5.0 mL复筛培养基中,15 ℃、150 r/min振荡培养,培养结束后测定菌体密度OD600。4 ℃、12 000 r/min离心10 min收集菌体,0.1 mol/L磷酸盐缓冲液(pH 7.0)洗涤菌体2次后,加入100 μL 1% (体积比)的乙酸乙酯振摇,4 ℃放置4 h,再加入100 μL 0.1 mol/L磷酸盐缓冲液(pH 7.0)即得β-半乳糖苷酶粗酶液,通过测定粗酶液的β-半乳糖苷酶活力筛选高产β-半乳糖苷酶的菌株。
2.2 oNP标准曲线的绘制以磷酸缓冲液(pH 7.0)分别稀释配制终浓度为0.02、0.05、0.10、0.15、0.20、0.40、0.60 μmol/mL的邻硝基苯酚(oNP)标准溶液。以pH 7.0的磷酸缓冲液为空白,在波长420 nm处测定各浓度oNP的吸光值,绘制得到OD420与oNP浓度的标准曲线(y=1.410 5x-0.003 7,R2=0.999 5)。
2.3 β-半乳糖苷酶活力的测定通过邻硝基苯-β-D-半乳糖苷(oNPG)法测定粗酶液的β-半乳糖苷酶活力。在50 μL oNPG的磷酸缓冲液(pH 7.0)中加入50 μL粗酶液,15 ℃反应15 min或37 ℃反应10 min后,吸取200 μL在冰箱预冷的NaCO3 (0.5 mol/L)终止反应,充分混匀后于波长420 nm处测定吸光值。为去除溶液的背景吸光值,以加热灭活的粗酶液与oNPG反应的样品作为对照。酶活定义:1 min水解oNPG生成1 μmol oNP所需的酶量定义为1个酶活单位。计算酶活E (U/mL)的公式为:
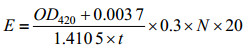
|
式中:OD420:420 nm波长处测定的吸光值;N:粗酶液稀释倍数;t:粗酶液与底物反应的时间;1.410 5和0.003 7:来自OD420与oNP浓度间的标准曲线回归公式。
2.4 产酶菌株的鉴定 2.4.1 形态观察对筛选纯化菌株的菌落形态进行观察,然后挑取少许菌体进行革兰氏染色观察。取少量菌体于1 mL 4% (体积比)戊二醛溶液中固定并进行梯度脱水处理,用扫描电子显微镜进行进一步的细胞形态观察。
2.4.2 生理生化鉴定参考《伯杰氏细菌鉴定手册》[11]进行部分生理生化特征鉴定,包括糖发酵试验、明胶水解试验、淀粉水解试验、硫化氢生成试验和运动性试验。
2.4.3 16S rRNA基因序列分析采用尿素法提取产酶菌株的基因组DNA[10]。以产酶菌株的基因组DNA为模板,采用16S rRNA基因通用引物27f (5′-AGAGTTTGATCMTGGCTC AG-3′)和1492r (5′-TACGGYTACCTTGTTACGACT T-3′)扩增16S rRNA基因[12]。PCR反应体系:2×Taq PCR Master mix 25 μL,正、反向引物(10 μmol/L)各1 μL,模板DNA 1 μL,ddH2O 22 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 40 s,72 ℃ 1 min,循环30次;72 ℃ 10 min。将扩增的PCR产物回收后与pMD19-T载体连接,转化大肠杆菌DH5α后,提取转化子质粒进行测序。测定出的序列提交GenBank数据库用来比对分析。获得相关种属的16S rRNA基因序列,在MEGA 6.0软件中使用邻接法(Neighbor-Joining method)构建系统发育树,采用Bootstrap法对进化树分支聚类的稳定性进行评价,重复1 000次,初步确定产酶菌株的种属分类地位。
2.5 产酶条件研究 2.5.1 培养时间对产酶的影响将培养好的种子培养液以2%的接种量接种到30 mL发酵培养基中,20 ℃、180 r/min振荡培养,每隔6 h或12 h测酶活性及菌体生物量(OD600),3个平行实验,重复2次,取平均值。
2.5.2 培养温度对产酶的影响将培养好的种子培养液以2%的接种量接种到装有10 mL发酵培养基中,分别在15、20、25 ℃条件下180 r/min摇瓶培养,每隔6 h或12 h测定酶活性及菌体生物量(OD600),3个平行,重复2次,取平均值。
2.5.3 碳源对产酶的影响将乳糖替换为葡萄糖、蔗糖、麦芽糖和可溶性淀粉,分别加入到培养基中作为碳源,不同碳源的质量浓度与发酵培养基中的乳糖浓度一致。分别接种2%的LW106菌液于30 mL上述发酵培养基中,将摇床条件设为温度20 ℃、转速180 r/min,培养90 h,记录菌体生物量(OD600)和酶活性,每种碳源3个平行,重复2次,取平均值。
2.5.4 培养基初始pH对产酶的影响分别以醋酸盐缓冲液(HAc-NaAc)、磷酸盐缓冲液(NaH2PO4-Na2HPO4)和硼酸盐缓冲液(Na2B4O7·10H2O-NaOH)配制不同初始pH的发酵培养基,使得初始培养基pH分别为3.0、4.0、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5,20 ℃培养90 h,测定不同初始pH培养条件下的菌体生物量(OD600)和酶活性,每个pH条件3个平行,重复2次。
2.5.5 接种量对产酶的影响分别以2%、3%、4%、6%、8%、10%的接种量接种到50 mL的发酵培养基中,20 ℃培养90 h测酶活。
2.6 酶学性质初步研究 2.6.1 β-半乳糖苷酶的初步纯化冰浴条件下超声破碎细胞(功率为125 W,工作3 s停8 s,共15 min)获得粗酶液。向粗酶液中缓慢加入硫酸铵固体粉末,盐析分离50%-60%饱和度的沉淀,复溶于0.02 mol/L磷酸盐缓冲液(pH 7.0),于14 kD透析袋中透析过夜,获得初步纯化的β-半乳糖苷酶。
2.6.2 温度对酶活力的影响(1) 最适温度。得到的酶液在4、10、15、20、25、30、35、40、50、60 ℃分别与底物反应10 min,测定OD420,每个温度设3个平行。以其中最大酶活为100%,计算得到相对酶活性。(2)热稳定性。制得的酶液分别在4、10、15、20、25、30、35、40、50、60 ℃放置4 h,取出后立即冷却,每个温度设3个平行。酶液与底物30 ℃反应10 min后测定OD420,以未经处理的酶活为100%,计算得到剩余酶活。
2.6.3 pH对酶活力的影响(1) pH对酶活的影响。分别配制不同pH (3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0)的柠檬酸-磷酸缓冲液,将酶液分别与上述缓冲液混匀,30 ℃条件下与底物反应10 min,测定OD420,不同pH做3个平行,将最高点酶活定为100%,计算得到相对酶活。(2) pH对酶稳定性的影响。配制不同pH (3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0)的缓冲液,将酶液分别与等量的上述缓冲溶液混合均匀,30 ℃水浴中保温3 h,再加入底物反应15 min,测定其OD420,每个pH设3个平行,并以未经处理时的酶活为100%,计算得到剩余酶活。
2.6.4 金属离子对酶活力的影响在酶反应体系中分别加入终浓度为10 mmol/L的Ca2+、Mg2+、Cu2+、Na+、K+、Mn2+金属离子,每种金属离子设3个平行,以不添加金属离子时的酶活为100%,计算得到相对酶活。
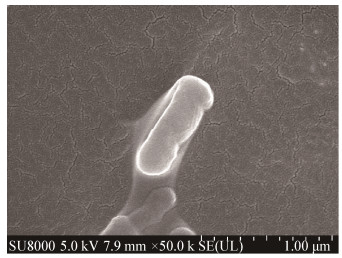
3 结果与分析 3.1 菌株的鉴定 3.1.1 菌株的形态特征和生理生化特征菌株LW106培养5 d后,形成1 mm至2 mm的扁平圆形菌落,菌落表面光滑,边缘整齐,较湿润,呈浅黄色乳状,不透明,革兰氏染色为阳性,扫描电镜观察显示该菌株细胞形态为不规则短杆状(图 1)。对菌株LW106进行生理生化实验(表 1)结果表明,菌株LW106发酵糖类弱产酸,淀粉水解试验呈阳性,明胶水解试验显阴性,硫化氢试验呈阴性,半固体穿刺培养显示该菌株具有运动能力。
|
| 图 1 LW106菌株细胞的扫描电镜 Figure 1 Scanning electron micrograph of LW106 cell |
|
|
| 试验项目 Test item |
结果 Result |
| 蔗糖发酵Sucrose fermentation | ○ |
| 阿拉伯糖发酵Arabinose fermentation | ○ |
| 鼠李糖发酵Rhamnose fermentation | ○ |
| 甘露糖发酵Mannose fermentation | ○ |
| 麦芽糖发酵Maltose fermentation | ○ |
| 木糖发酵Xylose fermentation | ○ |
| 葡萄糖发酵Glucose fermentation | ○ |
| 半乳糖发酵Galactose fermentation | ○ |
| 乳糖发酵Lactose fermentation | ○ |
| 明胶水解Gelatin hydrolysis | - |
| 淀粉水解Starch hydrolysis | + |
| 硫化氢生成H2S production | - |
| 运动性Motility | + |
| 注:○:弱产酸;+:阳性;-:阴性. Note: ○: Weak acid production; +: Positive; -: Negative. |
|
对LW106菌株的16S rRNA基因序列进行扩增,获得大小约为1 500 bp的扩增片段(GenBank登录号为MH064254)。测定的基因序列与GenBank数据库中的序列进行相似性比对,发现菌株LW106的16S rRNA基因序列与叶球形微杆菌(Microbacterium phyllosphaerae) P369/06 (99%)、叶球形微杆菌(M. phyllosphaerae) HWG-A23 (99%)、叶球形微杆菌(M. phyllosphaerae) IHBB 11136 (99%)的16S rRNA基因序列相似性最高。系统进化分析(图 2)显示LW106与M.phyllosphaerae IHBB 11136、M. phyllosphaerae HWG-A23及微杆菌(Microbacterium sp.) W21菌株以60%的支持率聚成一簇。因此,初步将菌株LW106鉴定为微杆菌Microbacterium sp. LW106。

|
| 图 2 菌株LW106的系统进化分析 Figure 2 Phylogenetic tree of strain LW106 注:括号中序号为参照菌株在GenBank中的登录号;分支点上的数字表示置信度;比例尺表示碱基替换率,0.001表示0.1%的替换率[13]. Note: The sequence numbers in parentheses correspond to the GenBank accession numbers of the reference strains; The numbers at branch points represent confidence level; The bar scale indicates the rate of substitution per base, 0.001 represents a replacement rate of 0.1%. |
|
|
LW106菌株在15、20、25 ℃培养的生长曲线和产酶曲线如图 3所示。菌株LW106在20 ℃培养时,其菌体浓度增长最快,但在25 ℃培养时,产酶水平增长最快,最高可达1.499±0.107 U/mL,因此可选择25 ℃作为菌株LW106的最适产酶温度。

|
| 图 3 培养时间和温度对菌株LW106生长(A)及产酶(B)的影响 Figure 3 Effects of culture time on LW106 growth (A) and β-galactosidase production (B) |
|
|
不同培养基初始pH对菌株LW106产酶的影响如图 4所示,培养基初始pH 7.0对菌株LW106产β-半乳糖苷酶最有利。

|
| 图 4 培养基初始pH对产酶的影响 Figure 4 Effect of initial pH on production of β-galactosidase from LW106 |
|
|
以1% (质量体积比)的比例分别添加乳糖、葡萄糖、蔗糖、麦芽糖和可溶性淀粉,作为培养基的唯一碳源,摇瓶发酵培养90 h后菌株LW106产β-半乳糖苷酶的结果如图 5所示,可溶性淀粉为菌株LW106产酶的最适碳源,说明菌株LW106能够较好地水解利用可溶性淀粉产β-半乳糖苷酶。

|
| 图 5 不同碳源对LW106产酶的影响 Figure 5 Effect of carbon source on β-galactosidase production of LW106 |
|
|
培养基成分及发酵条件不变,将接种量分别设为2%、3%、4%、6%、8%、10%,测定接种量对菌株产β-半乳糖苷酶的影响(图 6)。当接种量为3%时,菌株产β-半乳糖苷酶的活力最高,达到2.208±0.043 U/mL。

|
| 图 6 接种量对LW106产酶的影响 Figure 6 Effect of inoculation amount on production of β-galactosidase from LW106 |
|
|
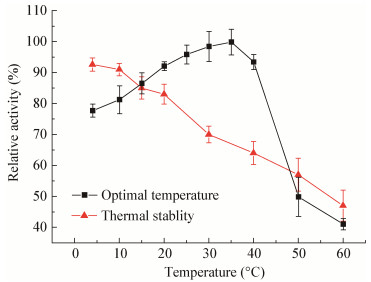
菌株LW106所产β-半乳糖苷酶的最适作用温度在35 ℃左右(图 7),4 ℃下相对酶活约为78%。低温下该酶的稳定性较好,4 ℃条件下保温4 h,剩余酶活约93%。随着温度的升高,酶的稳定性下降,60 ℃保温4 h,剩余酶活仅约47%。
|
| 图 7 酶的最适温度及热稳定性 Figure 7 The optimal temperature and thermal stability of β-galactosidase from LW106 |
|
|
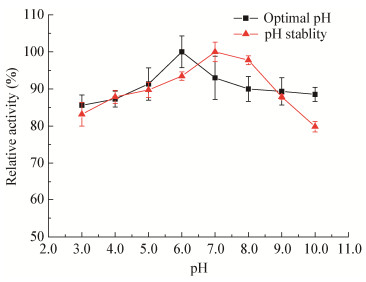
在pH 6.0左右,菌株所产β-半乳糖苷酶具有最高酶活(图 8),在pH 5.0-7.0之间能保持较高酶活。在pH为7.0时,该酶4 ℃保温4 h的剩余酶活最高;当保存pH低于6.0或高于8.0时,酶的稳定性明显降低。
|
| 图 8 酶的最适pH及pH稳定性 Figure 8 The optimal pH and pH stability of β-galactosidase from LW106 |
|
|
不同金属离子对菌株LW106所产β-半乳糖苷酶酶活的影响结果如图 9所示。10 mmol/L的Cu2+对酶活性有弱抑制作用,Na+、Mg2+、K+对酶活性无明显影响,Mn2+和Ca2+对菌株LW106所产β-半乳糖苷酶有一定的激活作用。

|
| 图 9 金属离子对酶活的影响 Figure 9 Effects of metal ions on the β-galactosidase activity |
|
|
本研究从天山一号冰川中筛选出一株低温β-半乳糖苷酶产生菌,对其进行形态学、生理生化和16S rRNA基因序列分析,鉴定为微杆菌Microbacterium sp. LW106。截至本文投稿前,来源于微杆菌属(Microbacterium)菌株低温β-半乳糖苷酶的报道应属首次[14],已有的相关文献报道的产生低温β-半乳糖苷酶的菌株主要是节杆菌属(Arthrobacter)和假交替单胞菌属(Pseudoalteromonas)菌株[6, 15-18]。近年来也有从拉恩氏菌属(Rahnella)[4, 19]、沙雷氏菌属(Serratia)[20]及海单胞菌属(Marinomonas)[21]分离产低温β-半乳糖苷酶菌株的报道,但产酶水平普遍较低(1-3 U/mL)。对菌株LW106产酶条件的研究表明,该菌的最适产酶温度为25 ℃,最佳碳源为可溶性淀粉,最适初始pH为7.0,最佳接种量为3%,最佳产酶条件下的产酶量可达2.208±0.043 U/mL。
不同来源的β-半乳糖苷酶酶学特性存在较大差异,来源于低温微生物中的β-半乳糖苷酶并不一定是低温β-半乳糖苷酶。分离自日本北海道土壤中的嗜冷乳糖节杆菌(Arthrobacter psychrolactophilus) F1、F2、F3、F4和F5菌株所产β-半乳糖苷酶的最适温度为10 ℃,在0 ℃仍能保留80%的酶活,其中菌株F1、F3和F5中还存在一个最适反应温度为30 ℃的β-半乳糖苷酶同功酶[9]。从新疆天山冻土中分离的拉恩氏菌(Rahnella sp.) R3菌株所产的胞内低温半乳糖苷酶最适反应温度为45 ℃,温度为15 ℃时的酶活为最高酶活的40%,4 ℃时的酶活仅为最高酶活的23%[20];从低温微生物中获得的低温β-半乳糖苷酶的最适作用温度通常在25-35 ℃,最适pH为6.0-8.0[21-23]。本研究中菌株LW106所产低温β-半乳糖苷酶的最适反应温度为35 ℃,4 ℃时相对酶活约为78%,表明具有较好的低温适应性。与已报道的其他低温β-半乳糖苷酶不同,以oNPG为底物时,Na+对该菌株所产低温β-半乳糖苷酶的酶活性基本没有抑制作用,Ca2+对该酶活性还具有一定的激活作用。鲜牛乳的pH在6.0-7.0左右,而且牛乳中含有金属离子Na+和Ca2+[24],因此,有必要对菌株LW106所产低温β-半乳糖苷酶以乳糖为底物的酶学特性,以及在低温牛乳体系中水解乳糖的特性进行进一步的分析。
| [1] |
Zhang SZ. Enzyme Preparation Industry[M]. Beijing: Science Press, 1984: 655-670. (in Chinese) 张树政. 酶制剂工业[M]. 北京: 科学出版社, 1984: 655-670. |
| [2] |
Li YQ. Studies on β-galactosidase produced by filamentous fungi[D]. Tianjin: Master's Thesis of Tianjin Institute of Light Industry, 2000 (in Chinese) 李玉强.丝状真菌β-半乳糖苷酶的研究[D].天津: 天津轻工业学院硕士学位论文, 2000 http://cdmd.cnki.com.cn/article/cdmd-10057-2000000658.htm |
| [3] |
Qin Y, Ning ZX, Hu XY. Advance of application and research in β-galactoxidase[J]. Journal of Shenyang Agricultural University, 2000, 31(6): 595-599. (in Chinese) 秦燕, 宁正祥, 胡新宇. β-半乳糖苷酶的应用研究进展[J]. 沈阳农业大学学报, 2000, 31(6): 595-599. DOI:10.3969/j.issn.1000-1700.2000.06.019 |
| [4] |
Shen LL. Screening and mutation breeding of a strain producing cold-adapted lactase and the study on optimization of fermentation conditions and its crude enzymatic properties[D]. Wuxi: Master's Thesis of Jiangnan University, 2013 (in Chinese) 沈莲莲.低温乳糖酶产生菌株的选育、产酶条件优化及其粗酶性质研究[D].无锡: 江南大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10295-1013309123.htm |
| [5] |
Karasová P, Spiwok V, Malá Š, et al. β-galactosidase activity in psychrotrophic microorganisms and their potential use in food industry[J]. Czech Journal of Food Sciences, 2002, 20(2): 43-47. |
| [6] |
Cieśliński H, Kur J, Białkowska A, et al. Cloning, expression, and purification of a recombinant cold-adapted beta-galactosidase from antarctic bacterium Pseudoalteromonas sp. 22b[J]. Protein Expression and Purification, 2005, 39(1): 27-34. |
| [7] |
Ghosh M, Pulicherla KK, Rekha VPB, et al. Cold active β-galactosidase from Thalassospira sp. 3SC-21 to use in milk lactose hydrolysis: a novel source from deep waters of Bay-of-Bengal[J]. World Journal of Microbiology and Biotechnology, 2012, 28(9): 2859-2869. DOI:10.1007/s11274-012-1097-z |
| [8] |
Alikkunju AP, Sainjan N, Silvester R, et al. Screening and characterization of cold-active β-galactosidase producing psychrotrophic Enterobacter ludwigii from the sediments of Arctic Fjord[J]. Applied Biochemistry and Biotechnology, 2016, 180(3): 477-490. DOI:10.1007/s12010-016-2111-y |
| [9] |
Nakagawa T, Fujimoto Y, Uchino M, et al. Isolation and characterization of psychrophiles producing cold-active -galactosidase[J]. Letters in Applied Microbiology, 2003, 37(2): 154-157. DOI:10.1046/j.1472-765X.2003.01369.x |
| [10] |
Zhang M, Gu YL, Xu YL, et al. Phylogenetic and physiological diversity of cold-adapted bacteria producing β-galactosidase from permafrost sediments of the bottom layer of the Glacier No.1 in the Tianshan Mountains[J]. Acta Microbiologica Sinica, 2011, 51(12): 1605-1615. (in Chinese) 张明, 顾燕玲, 徐宇丽, 等. 天山1号冰川底部沉积层产β-半乳糖苷酶低温菌株的系统发育分析及生理多样性[J]. 微生物学报, 2011, 51(12): 1605-1615. |
| [11] |
Buchana RE, Gibbons NE. Bergey's Manual of Determinative Bacteriology[M]. 8th ed. Beijing: Science Press, 1984: 382-533. (in Chinese) 布坎南 RE, 吉本斯 NE. 伯杰氏细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984: 382-533. |
| [12] |
Li DY, Shang A, Zhang D, et al. Screening of a glycolipid biosurfactant-producing strain for kerogen biodegradation[J]. Microbiology China, 2017, 44(11): 2606-2614. (in Chinese) 李德雨, 商奥, 张迪, 等. 一株糖脂表面活性剂产生菌的筛选及干酪根降解[J]. 微生物学通报, 2017, 44(11): 2606-2614. |
| [13] |
Guan B, Zhang X, Hu YC, et al. Isolation and identification of pathogenic fungi in rotten sweet cherry from Shihezi, Xinjiang[J]. Microbiology China, 2018, 45(11): 2480-2487. (in Chinese) 关波, 张璇, 胡玉婵, 等. 新疆石河子地区甜樱桃采后腐烂致病真菌的分离鉴定[J]. 微生物学通报, 2018, 45(11): 2480-2487. |
| [14] |
Zhang YJ. Isolation and identification of a Microbacterium sp. LW106 strain producing cold-active β-galactosidase and its enzymatic properties[D]. Shihezi: Master's Thesis of Shihezi University, 2018 (in Chinese) 张宇洁.一株产低温β-半乳糖苷酶菌株Microbacterium sp. LW106的筛选鉴定、产酶条件及其酶学特性[D].石河子: 石河子大学硕士学位论文, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10759-1018884293.htm |
| [15] |
Coker JA, Sheridan PP, Loveland-Curtze J, et al. Biochemical characterization of a β-galactosidase with a low temperature optimum obtained from an Antarctic Arthrobacter isolate[J]. Journal of Bacteriology, 2003, 185(18): 5473-5482. DOI:10.1128/JB.185.18.5473-5482.2003 |
| [16] |
Hoyoux A, Jennes I, Dubois P, et al. Cold-adapted β-galactosidase from the antarctic psychrophile Pseudoalteromonas haloplanktis[J]. Applied and Environmental Microbiology, 2001, 67(4): 1529-1535. DOI:10.1128/AEM.67.4.1529-1535.2001 |
| [17] |
Pawlak-Szukalska A, Wanarska M, Popinigis AT, et al. A novel cold-active β-D-galactosidase with transglycosylation activity from the Antarctic Arthrobacter sp. 32cB - Gene cloning, purification and characterization[J]. Process Biochemistry, 2014, 49(12): 2122-2133. DOI:10.1016/j.procbio.2014.09.018 |
| [18] |
Turkiewicz M, Kur J, Białkowska A, et al. Antarctic marine bacterium Pseudoalteromonas sp. 22b as a source of cold-adapted β-Galactosidase[J]. Biomolecular Engineering, 2003, 20(4/6): 317-324. |
| [19] |
Fan YT, Hua X, Zhang YZ, et al. Cloning, expression and structural stability of a cold-adapted β-galactosidase from Rahnella sp. R3[J]. Protein Expression and Purification, 2015, 115: 158-164. DOI:10.1016/j.pep.2015.07.001 |
| [20] |
Zhang X, Hua X, Xu Q, et al. Purification and characterization of a novel cold-adapted β-galactosidase[J]. Food & Machinery, 2014, 30(3): 174-178. (in Chinese) 张雪, 华霄, 许琪, 等. 低温β-半乳糖苷酶分离纯化及酶学性质研究[J]. 食品与机械, 2014, 30(3): 174-178. |
| [21] |
Wang GX, Gao Y, Hu B, et al. A novel cold-adapted β-galactosidase isolated from Halomonas sp. S62: gene cloning, purification and enzymatic characterization[J]. World Journal of Microbiology and Biotechnology, 2013, 29(8): 1473-1480. DOI:10.1007/s11274-013-1311-7 |
| [22] |
Zhou CL, Yu Y, Li HR, et al. Screening and identification of cold-active β-galactosidase-producing bacterium and characterization of the β-galactosidase[J]. Chinese Journal of Polar Research, 2010, 22(1): 48-55. (in Chinese) 周春雷, 俞勇, 李会荣, 等. 低温β-半乳糖苷酶产生菌的筛选、鉴定、生长特性及酶学性质的初步研究[J]. 极地研究, 2010, 22(1): 48-55. |
| [23] |
Zhang B. Screening of psychrotolerant bacterium producing cold-active β-galactosidase and optimization for producing conditions of β-galactosidase[D]. Guangzhou: Master's Thesis of Guangdong Pharmaceutical University, 2011 (in Chinese) 张博.产冷活性β-半乳糖苷酶低温菌株的筛选及产酶条件的优化[D].广州: 广东药学院硕士学位论文, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10573-1011285495.htm |
| [24] |
Zeng Q, Wang YS, Sun K, et al. Preliminary studies on the screening, identification and optimum fermentative conditions of a strain Marinomonas sp. BSi20414 isolated from arctic sea ice producing β-galactosidase[J]. Chinese Journal of Polar Research, 2011, 23(2): 108-114. (in Chinese) 曾倩, 王毓舒, 孙鲲, 等. 一株分离自北极海冰的产β-半乳糖苷酶的海单胞菌(Marinomonas sp. BSi20414)的筛选、鉴定和产酶条件研究[J]. 极地研究, 2011, 23(2): 108-114. |
 2019, Vol. 46
2019, Vol. 46




