扩展功能
文章信息
- 何欢, 杨明飞, 杨美华, 康冀川
- HE Huan, YANG Ming-Fei, YANG Mei-Hua, KANG Ji-Chuan
- 塑料饲养大蜡螟幼虫肠道可培养细菌多样性
- Diversity of the culturable gut bacteria of the wax moth larvae fed with polyethylene plastic
- 微生物学通报, 2019, 46(3): 577-665
- Microbiology China, 2019, 46(3): 577-665
- DOI: 10.13344/j.microbiol.china.180540
-
文章历史
- 收稿日期: 2018-07-13
- 接受日期: 2018-10-10
- 网络首发日期: 2018-12-26
2. 贵阳护理职业学院 贵州 贵阳 550018
2. Guiyang Nursing Vocational College, Guiyang, Guizhou 550018, China
大蜡螟(Galleria mellonella)属鳞翅目、螟蛾科、蜡螟亚科、蜡螟属昆虫[1]。其幼虫,尤其是3−5龄幼虫取食蜜蜂巢脾,容易在长时间存放不加以处理的巢脾上滋生、钻蛀隧道、吐丝作茧,破坏巢脾、蛀坏蜂具,造成蜜蜂的幼虫和蛹死亡,出现“白头蛹”[2],是养蜂业的重要害虫,给养蜂业带来巨大的经济损失。大蜡螟作为农业害虫之一,早期的研究主要在于对其防治措施的探索[3]。近些年来,随着研究的不断深入,人们开始逐渐认识到大蜡螟自身不仅蛋白质含量丰富,生长周期短、食料来源丰富、易于繁殖以及可食用和饲用等优点,更重要的是其在医学、药学、生理学、农学等学科领域发挥着不可替代的作用[4-5]。目前国内外对于大蜡螟作为试验昆虫,在昆虫病原线虫、寄生蜂、新型隐球菌(Cryptococcus neoformans)、抗菌肽、抗菌免疫机制等方面的研究已取得大量的研究成果[6-9]。最近,大蜡螟幼虫所具有降解塑料的功能得到广泛的关注,并且这一功能也得到了证实[10-11]。Yang等从其肠道中分离出2株细菌菌株,并证明其在实验室环境中能够生长和分解聚乙烯塑料[11]。
昆虫与其肠道微生物建立及保持了各种共生和功能关系,这些微生物群在其进化和多样性中发挥了核心作用,且代谢能力比宿主更多样化[12]。对于异养动物来说,食物消化是为其提供生长发育、繁殖所必需的营养物质的关键过程。为了最大限度地提高消化吸收的效率,动物依靠其肠道中的共生细菌相互作用[13]。同时微生物还可以保护宿主抵御天敌[14],忍受高温[15]以及促进毒素或异生素的代谢[16],间接促进资源开发[17]。因此,对昆虫生物学的全面理解需要以微生物作为关键因素来进行研究[18]。
昆虫肠道可培养细菌群落结构分析表明:肠道微生物种群结构是一个可变的动态群落,其多样性与昆虫的种类、龄期、消化道形态、食物的喂养条件、生存环境等息息相关[19]。鳞翅目是昆虫纲中仅次于鞘翅目的第二大目,其中既有严重危害农作物的害虫,又有能够授粉和产生经济效益的益虫,对生态系统和人类影响深远,在昆虫学研究中极具代表性。近年来,随着新方法、新技术在肠道微生态学上的应用,国内外鳞翅目昆虫肠道微生物的研究也日趋热烈[20]。然而目前对于鳞翅目昆虫肠道微生物群落结构的研究主要集中于棉铃虫(Helicoverpa armigera)、稻纵卷叶虫(CInaphalocrocis medinalis)、菜青虫(Pieris rapae)和甜菜夜蛾(Spodoptera exergual)、家蚕(Bombyx mori)、粘虫(Myihimna separat)、小菜蛾(Plutella xylostella)、斜纹夜蛾(Spodoptera litur)、柞蚕(Antherea pernyi)等昆虫的研究[21-30],有关大蜡螟肠道微生物群落结构目前未有系统完整的研究报道。
本研究利用16S rRNA基因序列分析技术,对使用塑料喂食的大蜡螟幼虫肠道可培养细菌进行分类鉴定,并结合细菌菌落形态以及生理生化反应特征,将大蜡螟幼虫肠道可培养细菌鉴定到种。采用分子和常规技术相结合的方法客观、准确、全面地分析了蜡螟幼虫肠道可培养细菌的群落结构。通过研究大蜡螟幼虫肠道可培养细菌群落结构组成,不但有利于昆虫资源的开发利用,而且有利于从昆虫肠道这一特殊生境中挖掘具有特殊功能的微生物资源,用于开辟生物转化新途径,发展生物质新能源等。
1 材料与方法 1.1 实验材料 1.1.1 蜡螟幼虫实验大蜡螟幼虫购自天津惠裕德生物科技有限公司。将酒精消毒处理后无菌水冲洗干净的PE塑料喂食大蜡螟幼虫,期间不投喂其它任何饲料,一旦其咀嚼足够的PE塑料引起明显可见的外观破损时[11],收集大小相当的10条大蜡螟幼虫,在无菌条件下进行肠道解剖。
1.1.2 培养基NA培养基、MC培养基、脑心浸液培养基[31]。
1.1.3 引物序列上、下游引物为通用引物[32],27F (5′-AGAG TTTGATCCTGGCTCAG-3′)和1492R (5′-AAGTCG TAACAAGGTARCCGTA-3′),由上海捷瑞生物工程有限公司合成。
1.1.4 主要试剂和仪器细菌基因组DNA提取试剂盒、PCR Master Mix,天根生化科技(北京)有限公司。MyCycler Thermal Cycler型PCR仪,Bio-Rad公司;水平电泳仪及电泳槽,北京六一生物科技有限公司。
1.2 研究方法 1.2.1 肠道细菌的分离在无菌操作下,选取10条经过塑料喂食的大蜡螟幼虫,用75%的乙醇体表灭菌2−3 min,再用无菌水冲洗体表 3−4次除尽乙醇。解剖幼虫,取其肠道在无菌PE管中加入1 ml无菌生理盐水研磨,研磨液用无菌水生理盐水制成稀释梯度10−1−10−7的悬浮液。取10−5、10−6、10−7各梯度100 l于NA培养基、MC培养基、脑心浸液培养基平板上涂布分离,各稀释度重复3次。在30 ℃培养72 h后,根据大小、形状和颜色分离不同的细菌菌落,然后通过在培养基上继代培养纯化分离的菌株,用相差显微镜和革兰染色进行细胞形态学检查。同时为检验其是否消毒彻底,将已经过灭菌处理的蜡螟置于培养基中[33-34]。
1.2.2 细菌的菌落形态观察肠道可培养细菌在固体培养基上进行纯培养,然后分别观察细菌形状、革兰氏染色、芽孢有无、菌落形态、颜色、隆起度、边缘形状、表面状态、光泽、干湿情况、透明度等菌落特征[35]。
1.2.3 细菌DNA提取及16S rRNA基因片段的扩增采用DNA提取试剂盒提取各细菌基因组DNA。以各细菌提取的DNA为模板,利用细菌通用引物27F/1492R进行PCR扩增。PCR反应体系(30 μL):dNTPs (10 mmol/L) 0.5 μL,Taq酶(5 U/μL) 0.5 μL,10×PCR buffer 3.0 μL,引物27F和1492R (10 μmol/L)各0.5 μL,基因组DNA 1.0 μL,ddH2O 24 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,34 ℃ 1 min,72 ℃ 2 min,45个循环;72 ℃ 10 min;4 ℃保存。PCR扩增产物用1% (质量体积比)的琼脂糖凝胶电泳检测,将检测合格的样品送往生工生物工程(上海)股份有限公司测序。
1.2.4 序列统计分析与系统发育树构建双向测序获得的16S rRNA基因序列用Contig Ex-press软件拼接后提交到NCBI。从结果中选择相似性较高的序列作为参照菌株,使用ClustalW软件比对序列[36]。采用MEGA 7.0软件中的Kimura 2-parameter model模型计算进化距离,邻接法(neighbor-joining method)自举值(bootstrap) 1 000次[37]构建系统发育树。
1.2.5 序列登录号获得的16S rRNA基因序列GenBank登录号为MH569441−MH569456。
1.2.6 细菌的生理生化实验对9株芽孢杆菌属及2株肠球菌属分离菌株的纯培养液按常规方法分别接种于15种生理生化培养基和21种生理生化培养基进行生化试验,在指定时间内观察并记录试验结果。
2 结果与分析 2.1 肠道细菌的分离利用NA培养基、脑心浸液培养基、MC培养基分离大蜡螟肠道内细菌,根据菌落形态、颜色、隆起度、边缘形状、表面状态、光泽、干湿情况、透明度等特征共初步分离得40株纯培养物。其中从NA培养基中分离到28株,脑心浸液培养基分离到10株,MC培养基分离到2株纯培养物。可以看出NA培养基和脑心浸液培养基分离效果较好。
2.2 细菌纯培养的菌落特征大蜡螟幼虫肠道细菌经过纯培养后对其菌落特征进行观察归类后,得到16个不同单克隆菌株,结果如表 1所示。供试菌株在固体培养基上培养24 h后按照革兰氏染色法区别所有菌株。分析发现,16个菌株中有5个呈革兰氏阴性反应,其余11个菌株呈革兰氏阳性反应。经显微镜观察,其中10个菌体形态均为杆状,6个为球状。全部的分离细菌都可以在37 ℃生长,培养24−48 h后菌落形态明显。
| 项目 Item |
Glm4 | Glm6 | Glm11 | Glm14 | Glm15 | Glm16 | Glm17 | Glm18 | Glm19 | Glm20 | Glm22 | Glm34 | Glm38 | Glm40 | Glm44 | Glm45 |
| 细菌形状 | 球状 | 杆状 | 杆状 | 杆状 | 球状 | 卵球形 | 杆状 | 短杆 | 杆状 | 短杆 | 杆状 | 杆状 | 杆状 | 球状 | 球状 | 球状 |
| Bacterium shape | Sphcrica | Rods | Rods | Rods | Sphcrica | Oval | Sphcrica | Short rods | Rods | Short rods | Rods | Rods | Rods | Sphcrica | Sphcrica | Sphcrica |
| 革兰染色 Gram staining |
G- | G- | G- | G+ | G+ | G+ | G+ | G- | G+ | G- | G+ | G+ | G+ | G+ | G+ | G+ |
| 芽孢 | 无 | 有 | 无 | 有 | 无 | 无 | 有 | 有 | 有 | 有 | 无 | 有 | 无 | 无 | 无 | 无 |
| Spore | Not | Have | Not | Have | Not | Not | Have | Have | Have | Have | Not | Have | Not | Not | Not | Not |
| 菌落形态 | 圆型 | 展开 | 圆型 | 展开 | 圆型 | 圆型 | 圆型较大 | 圆型较大 | 圆型 | 圆型 | 圆型 | 圆型 | 圆型较大 | 圆型 | 圆型 | 圆型 |
| Colony shape | Round | Expansion | Round | Expansion | Round | Round | Large, round | Large, round | Round | Round | Round | Round | Large, round | Round | Round | Round |
| 菌落颜色 | 灰黄色 | 白色 | 蛋黄色 | 灰色 | 浅橘黄色 | 透明色 | 白色 | 浅黄色 | 灰色 | 灰白色 | 白色 | 白色 | 浅黄色 | 白色 | 粉色 | 紫红色 |
| Colony colour | Grayish yellow | White | Yellow | Gray | Pale orange | Transparent | White | Pale yellow | Gray | Grayish white | White | White | Pale yellow | White | Pink | Fuchsia |
| 菌落降起度 | 平坦 | 平坦 | 凸起 | 平坦 | 凸起 | 凸起 | 凸起 | 凸起 | 平坦 | 平坦 | 凸起 | 平坦 | 凸起 | 凸起 | 凸起 | 凸起 |
| Colony elevation | Fiat | Flat | Raised | Flat | Raised | Raised | Raised | Raised | Flat | Flat | Raised | Flat | Raised | Raised | Raised | Raised |
| 菌落表面状态 | 光滑 | 不光滑 | 光滑 | 有皱褶 | 有皱褶 | 光滑 | 光滑 | 光滑 | 不光滑 | 有皱褶 | 光滑 | 光滑 | 光滑 | 光滑 | 光滑 | 光滑 |
| Surface state of the colony | Smooth | Not smooth | Smooth | Wrinkled | Wrinkled | Smooth | Smooth | Smooth | Not smooth | Wrinkled | Smooth | Smooth | Smooth | Smooth | Smooth | Smooth |
| 菌落边缘形状 | 整齐 | 整齐 | 整齐 | 不整齐 | 不整齐 | 整齐 | 整齐 | 整齐 | 整齐 | 整齐 | 整齐 | 整齐 | 整齐 | 整齐 | 整齐 | 整齐 |
| Colony margin | Regular | Regular | Regular | Irregular | Irregular | Regular | Regular | Regular | Irregular | Irregular | Regular | Regular | Regular | Regular | Regular | Regular |
| 菌落光泽 | 有光泽 | 无光泽 | 有光泽 | 无光泽 | 无光泽 | 有光泽 | 有光泽 | 有光泽 | 无光泽 | 有光泽 | 有光泽 | 无光泽 | 有光泽 | 有光泽 | 有光泽 | 无光泽 |
| Colony gloss | Glossy | Dull | Glossy | Dull | Dull | Glossy | Glossy | Glossy | Dull | Dull | Glossy | Dull | Glossy | Glossy | Dull | Dull |
| 菌落干湿 | 湿润 | 湿润 | 湿润 | 不湿润 | 不湿润 | 湿润 | 湿润 | 湿润 | 湿润 | 不湿润 | 湿润 | 不湿润 | 湿润 | 湿润 | 湿润 | 湿润 |
| Colony consistency | Wet | Wet | Wet | Not wet | Not wet | Wet | Wet | Wet | Wet | Not wet | Wet | Not wet | Wet | Wet | Wet | Wet |
| 菌落透明程度 | 不透明 | 不透明 | 不透明 | 不透明 | 不透明 | 透明 | 不透明 | 不透明 | 不透明 | 不透明 | 半透明 | 透明 | 不透明 | 半透明 | 不透明 | 不透明 |
| Colony opacity | Opaque | Opaque | Opaque | Opaque | Opaque | Transparent | Opaque | Opaque | Opaque | Opaque | Translucent | Transparent | Opaque | Translucent | Opaque | Opaque |
16株表型差异菌株测序所得的序列提交NCBI,通过Blast与GenBank中已知16S rRNA基因序列相似性比对分析,结果表明:这些可培养细菌分属于厚壁菌门(Firmicutes)、变形菌门(Proteobacteria),共涉及4个科芽孢杆菌科(Bacillaceae)、肠球菌科(Enterococcaceae)、葡萄球菌科(Staphylococcaceae)、莫拉菌科(Moraxellaceae),包括芽孢杆菌属(Bacillus)、肠球菌属(Enterococcus)、葡萄球菌属(Staphylococcus)、不动杆菌属(Acinetobacter) 4个属(表 2)。将16个菌株序列经过Blast比对分析,ClustalW比对、剪切和MEGA 7.0软件构建系统发育树(图 1),进行系统发育分析。结果表明:大蜡螟幼虫肠道可培养细菌中,芽孢杆菌属(Bacillus) 9株,肠球菌属(Enterococcus) 4株,葡萄球菌属(Staphylococcus) 2株,不动杆菌属(Acinetobacter) 1株。可培养细菌各科属所占比例为:芽孢杆菌属56.25%,是蜡螟幼虫肠道可培养细菌的最优势细菌类群;肠球菌属25%,为次优势细菌类群;葡萄球菌属12.5%;不动杆菌属6.25%,所占比例最低。
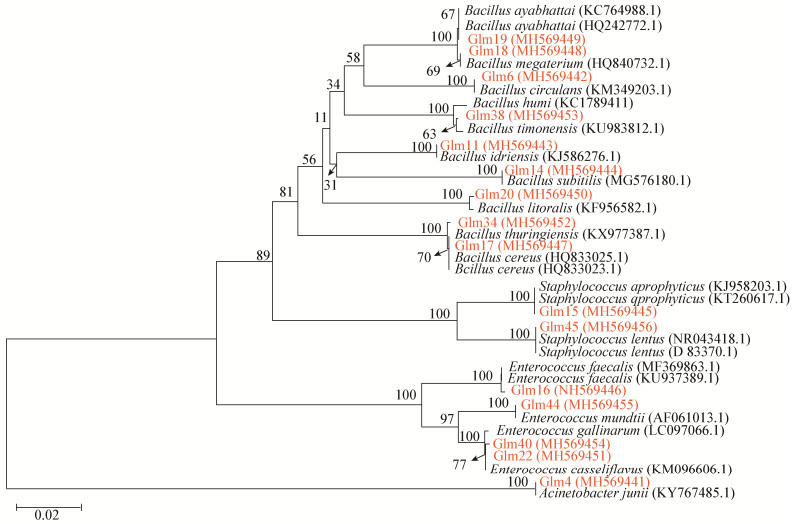
|
| 图 1 大蜡螟幼虫肠道可培养细菌16S rRNA基因序列的N-J系统发育树 Figure 1 N-J phylogenetic tree of 16S rRNA gene sequences of the culturable bacteria from larvae intestine of G. mellonella 注:括号内的数字为GenBank登录号;结点处数字为Bootstrap值;标尺代表 2%的序列分歧. Notes: Numbers in parenthesis represented GenBank accession No.; Numbers at the branch points indicated the bootstrap values; The scale bar represents 2% sequence divergence. |
|
|
| 菌株号 Strain No. |
科 Family |
属 Genus |
相近种 Nearest species |
相近种GenBank登录号 GenBank accession No. of nearest species |
相似度 Similarity (%) |
| Glm4 | Moraxellaceae | Acinetobacter | Acinetobacter junii | KY767485.1 | 99 |
| Glm15 | Staphylococcaceae | Staphylococcus | Staphylococcus saprophyticus | KT260617.1 | 99 |
| Glm45 | Staphylococcus lentus | NR 043418.1 | 99 | ||
| Glm16 | Enterococcaceae | Enterococcus | Enterococcus faecalis | KU937389.1 | 99 |
| Glm22 | Enterococcus casseliflavus | KM096607.1 | 99 | ||
| Glm40 | Enterococcus gallinarum | LC097066.1 | 99 | ||
| Glm44 | Enterococcus mundtii | AF061013.1 | 99 | ||
| Glm6 | Bacillaceae | Bacillus | Bacillus circulans | KM349203.1 | 99 |
| Glm11 | Bacillus idriensis | KJ586276.1 | 99 | ||
| Glm14 | Bacillus subtilis | MG576180.1 | 99 | ||
| Glm17 | Bacillus cereus | HQ833025.1 | 99 | ||
| Glm18 | Bacillus megaterium | HQ840732.1 | 99 | ||
| Glm19 | Bacillus aryabhattai | HQ242772.1 | 99 | ||
| Glm20 | Bacillus litoralis | KF956582.1 | 99 | ||
| Glm34 | Bacillus thuringiensis | KX977387.1 | 99 | ||
| Glm38 | Bacillus sp. | KX904715.1 | 99 |
选取具有代表性的芽孢杆菌属9株与肠球菌属2株共11株进行生理生化实验,得到如表 3和表 4所示的各细菌生理生化特征的反应结果。从表 3中可以看出,9个试验菌株在耐盐方面,除Glm38只能在1%−4% NaCl的条件下生长外,其它大多数菌株均能在1%−7% NaCl条件下生长良好。糖分解、利用试验中多呈阳性反应,表明其大都对碳素化合物均有较好的分解利用能力。除Glm6外,均能将过氧化氢分解成水和氧;均不能利用柠檬酸盐作为唯一碳源;均不能分解培养基中含硫氨基酸生成硫化氢;大多数菌都不能将苯丙氨酸氧化脱氨。从表 3可以看出,Glm22和Glm40菌株虽然对部分糖类都能够很好的利用,但是仍存在着较大差别,只有Glm22表现出对碳素化合物均有较好的分解利用能力。以上这些生理生化特性可以为进一步准确的鉴定菌种提供参考。
| 特性 Characteristics |
Glm6 | Glm11 | Glm14 | Glm17 | Glm18 | Glm19 | Glm20 | Glm34 | Glm38 |
| M.R | + | − | − | + | + | − | + | + | − |
| Nacl (%) | 1−5 | 1−7 | 1−5 | 1−7 | 1−7 | 1−5 | 1−7 | 1−7 | 1−4 |
| 3% H2O2 | − | + | + | + | + | + | + | + | + |
| D-甘露糖D-mannose | + | + | + | + | + | + | + | + | − |
| D-阿拉伯糖D-arabinose | + | − | − | + | − | + | + | + | + |
| D-甘露醇D-mannitol | + | − | − | − | + | + | + | + | − |
| 淀粉Starch | − | + | + | − | − | + | − | − | − |
| 明胶Gelatin | − | − | − | + | + | + | − | + | − |
| 甘油Glycerin | + | − | + | − | − | − | + | + | − |
| 硫化氢产生H2S production | − | − | − | − | − | + | − | − | − |
| 苯丙氨酸Phenylalanine | − | − | − | − | + | − | + | + | + |
| 柠檬酸盐Citrate | − | − | − | − | − | + | − | − | − |
| 硝酸盐Nitrate | − | + | + | + | + | + | + | + | + |
| 水杨苷Salicin | − | − | + | − | − | − | + | − | + |
| 精氨酸Lysine | + | + | + | + | + | + | + | − | + |
| 鸟氨酸脱羧酶Ornithine decarboxylase | − | + | + | − | − | − | + | − | + |
| 赖氨酸脱羧酶Lysine decarboxylase | + | + | − | − | − | + | + | − | + |
| Note: +: Positive; −: Negative. | |||||||||
| 特性Characteristics | Glm22 | Glm40 |
| 精氨酸Arginine | + | − |
| 淀粉Starch | + | − |
| 明胶Gelatin | − | − |
| V-P | + | − |
| D-阿拉伯糖D-arabinose | − | − |
| 七叶苷Esculin | + | + |
| 果糖Fructose | + | + |
| 半乳糖Galactose | + | + |
| 葡萄糖Glucose | + | + |
| 乳糖Lactose | + | + |
| 麦芽糖Maltose | + | + |
| 甘露醇Mannitol | − | + |
| 棉子糖Raffinose | − | − |
| 鼠李糖Rhamnose | + | − |
| 核糖Ribose | + | + |
| 山梨醇Sorbitol | − | − |
| 蔗糖Sucrose | + | + |
| 蜜二糖Melibiose | + | + |
| 水杨苷Salicin | + | + |
| 海藻糖Trehalose | + | + |
| 木糖Xylose | + | − |
| Note: +: Positive; −: Negative. | ||
结合菌落形态、生理生化特征实验,以及供试菌株系统发育树分析,确定了15株可培养细菌的菌种名称,其余1株芽孢杆菌属为待定种。15株可培养细菌分别是:阿耶波多氏芽孢杆菌(Bacillus aryabhattai)、巨大芽孢杆菌(Bacillus megaterium)、环状芽孢杆菌(Bacillus Circulans)、病研所芽孢杆菌(Bacillus idriensis)、枯草芽孢杆菌(Bacillus subtilis)、岸滨芽孢杆菌(Bacillus litoralis)、苏云金芽孢杆菌(Bacillus thuringiensis)、蜡样芽孢杆菌(Bacillus cereus)、腐生葡萄球菌(Staphylococcus saprophyticus)、缓慢葡萄球菌(Staphylococcus lentus)、粪肠球菌(Enterococcus faecalis)、蒙氏肠球菌(Enterococcus mundtii)、鹑鸡肠球菌(Enterococcus gallinarum)、酪黄肠球菌(Enterococcus casseliflavus)、琼氏不动杆菌(Acinetobacter junii)。菌株Glm38经系统发育树、菌落形态、生理生化实验确定为芽孢杆菌属待定种Bacillus sp.。
3 讨论与结论昆虫肠道负责将复杂的食物材料消化为更简单的营养物质,这种肠道活动因微生物的相互作用而增强。尽管传统的可培养模式只能从肠道中获得约1%的微生物[38],但是传统的微生物分离纯培养技术依然是微生物学研究中不可或缺的工具之一。因为只有通过微生物的分离培养技术,才能获得纯的菌株材料,以供进一步的鉴定种属及其功能验证,为后续更多的相关理论研究和技术应用奠定基础。如Demirci等从柳圆叶甲(Plagiodera versicolora)肠道中分离出1株可能对其具有生物防治效果的藤黄微球菌(microoccus luteus) Pv8[39]。Hinojosa等研究发现与南极藻类相关的细菌假交替单胞菌属(Pseudoalteromonas sp.)作为生物技术冷活性水解酶的来源有着巨大的潜力[40]。Yang等从大蜡螟(G. mellonella)幼虫肠道中分离出Enterobacter asburiae YT1、Bacillus sp. YP1两株能够降解塑料的细菌[11]。说明传统的微生物可培养技术可从肠道这一特殊环境中获得具潜在应用前景的微生物资源。
本研究借助传统的微生物分离培养技术从用塑料喂食的大蜡螟幼虫肠道中分离到16个细菌,分属于芽孢杆菌属(Bacillus) 9种,肠球菌属(Enterococcus) 4种,葡萄球菌属(Staphylococcus) 2种,不动杆菌属(Acinetobacter) 1种。其中15个属于厚壁菌门(Firmicutes),另一种属于γ-变形菌门(Gamma-proteobacteria)。以上结果表明厚壁菌门在大蜡螟幼虫肠道可培养细菌中占据优势地位,同时说明该门细菌可能对大蜡螟幼虫肠道生长发育、食物消化等方面起着重要作用。Paniagua等研究鳞翅目昆虫是否拥有核心肠道微生物群,比较了30种鳞翅目昆虫微生物组后发现,其中假单胞菌属、芽孢杆菌属、葡萄球菌属、肠杆菌属和肠球菌属是最常见的属[41]。在本研究中,芽孢杆菌属、肠球菌属、葡萄球菌属也为最常见属,与以上研究结果相符合。早期Gilliam从大蜡螟幼虫肠道分离出103株菌株,经过鉴定为芽孢杆菌属细菌,其中最常见的为球形芽孢杆菌Bacillus sphueriru[42]。而同样,在本研究优势属也为芽孢杆菌属,但不同的是,本研究最常见的种为枯草芽孢杆菌(Bacillus subtilis)。Jarosz从大蜡螟幼虫中分离出1株具有抗菌活性的乳酸粪链球菌(Streptococcus faecalis),属于真细菌门(Eubacteria)无孢子菌纲(Asporulales)微球菌目(Micrococcales)微球菌科(Micrococcaceas)链球菌属(Streptococcus)[43]。可能是由于培养基组分或饲养条件的不同,在本研究中并没有分离到此类菌株。Yang等在用塑料喂食大蜡螟幼虫后,从其体内分离出1株芽孢杆菌YP1和1株亚胺培南抗性阿斯肠杆菌YT1,并证实这2株菌株具有降解塑料的潜在功能[11]。大蜡螟幼虫之所以能够进行塑料的生物降解,这可能与其本身的生态学特性有关。它们长期以蜂蜡为食,而蜂蜡是由高度多样化的脂质化合物混合组成,最常见的烃键是CH2−CH2。其化学结构与PE高度相似[10]。然而昆虫的肠道内有许多不同的微生物群落,它们影响昆虫的生理、生长和发育。同样,昆虫肠道微生物种群结构不是一直稳定不变的环境,其多样性受到昆虫的种类、龄期、消化道形态、食物的喂养条件、生存环境等方面的影响[44-45]。
综上所述,本研究应用传统的可培养技术结合现代16S rRNA基因分子鉴定技术,初步揭示了塑料喂食的大蜡螟幼虫肠道细菌的多样性。一方面,为大蜡螟肠道微生物资源的有效开发利用提供一定的理论参考,同时也为其它关于大蜡螟昆虫资源的开发利用,以及对其生物防控等技术提供一定的理论依据。另一方面,在关于塑料喂食的大蜡螟肠道微生物的后续研究中,可与以蜂巢为食,同等日龄段的野生蜡螟肠道群落作一个差异性比对分析。同时以塑料为唯一碳源,积极探索这些潜在降解塑料微生物的分离、培养条件,以及对塑料的降解能力。为治理塑料垃圾所引起的环境污染提供一个新思路,新方向。
| [1] |
Türker L, Togan I, Ergezen S, et al. Novel attractants of Galleria mellonella L.(Lepidoptera Pyralidae Galleriinae)[J]. Apidologie, 1993, 24(4): 425-430. DOI:10.1051/apido:19930409 |
| [2] |
Smith TL. External morphology of the larva, pupa, and adult of the wax moth, Galleria mellonella L[J]. Journal of the Kansas Entomological Society, 1965, 38(3): 287-310. |
| [3] |
Reza J, Shila G, Shahram A. Control of the wax moth Galleria mellonella L.(Lepidoptera:Pyralidae) by the male sterile technique (MST)[J]. Archives of Biological Sciences, 2010, 62(2): 309-313. DOI:10.2298/ABS1002309J |
| [4] |
Liu QZ, Tian L, Pu HH. Utilization status of the greater wax moth, Galleria mellonella, as an experimental insect[J]. Chinese Bulletin of Entomology, 2009, 46(3): 485-489. (in Chinese) 刘奇志, 田里, 蒲恒浒. 大蜡螟作为试验昆虫资源的利用现状[J]. 昆虫知识, 2009, 46(3): 485-489. DOI:10.3969/j.issn.0452-8255.2009.03.034 |
| [5] |
Liu R, Liu QZ. Status Quo and Prospects of research and industrial development on greater wax worm at home and abroad[J]. Chinese Agricultural Science Bulletin, 2015, 31(28): 280-284. (in Chinese) 刘瑞, 刘奇志. 国内外大蜡螟研究与产业发展现状及展望[J]. 中国农学通报, 2015, 31(28): 280-284. DOI:10.11924/j.issn.1000-6850.casb15030018 |
| [6] |
Senior NJ, Bagnall MC, Champion OL, et al. Galleria mellonella as an infection model for Campylobacter jejuni virulence[J]. Journal of Medical Microbiology, 2011, 60(5): 661-669. DOI:10.1099/jmm.0.026658-0 |
| [7] |
Mukherjee K, Raju R, Fischer R, et al.Galleria mellonella as a model host to study gut microbe homeostasis and brain infection by the human pathogen Listeria monocytogenes[A]//Advances in Biochemical Engineering/Biotechnology[M].Berlin, Heidelberg: Springer, 2013: 27-39
|
| [8] |
McMillan S, Verner-Jeffreys D, Weeks J, et al. Larva of the greater wax moth, Galleria mellonella, is a suitable alternative host for studying virulence of fish pathogenic Vibrio anguillarum[J]. BMC Microbiology, 2015, 15: 127. DOI:10.1186/s12866-015-0466-9 |
| [9] |
Ibrahim AA, Mohamed HF, El-Naggar SEM, et al. Isolation and selection of entomopathogenic Fungi as biocontrol agent against the greater wax moth, Galleria mellonella L.(Lepidoptera:Pyralidae)[J]. Egyptian Journal of Pest Control, 2016, 26(2): 249-253. |
| [10] |
Bombelli P, Howe CJ, Bertocchini F. Polyethylene bio-degradation by caterpillars of the wax moth Galleria mellonella[J]. Current Biology, 2017, 27(8): R292-R293. DOI:10.1016/j.cub.2017.02.060 |
| [11] |
Yang J, Yang Y, Wu WM, et al. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms[J]. Environmental Science & Technology, 2014, 48(23): 13776-13784. |
| [12] |
Sommer F, B ckhed F. The gut microbiota--masters of host development and physiology[J]. Nature Reviews Microbiology, 2013, 11(4): 227-238. DOI:10.1038/nrmicro2974 |
| [13] |
Ventura M, Turroni F, Canchaya C, et al. Microbial diversity in the human intestine and novel insights from metagenomics[J]. Frontiers in Bioscience, 2009, 14(9): 3214-3221. |
| [14] |
Kroiss J, Kaltenpoth M, Schneider B, et al. Symbiotic streptomycetes provide antibiotic combination prophylaxis for wasp offspring[J]. Nature Chemical Biology, 2010, 6(4): 261-263. DOI:10.1038/nchembio.331 |
| [15] |
Dunbar HE, Wilson ACC, Ferguson NR, et al. Aphid thermal tolerance is governed by a Point mutation in bacterial symbionts[J]. PLoS Biology, 2007, 5(5): e96. DOI:10.1371/journal.pbio.0050096 |
| [16] |
Douglas AE. The microbial dimension in insect nutritional ecology[J]. Functional Ecology, 2009, 23(1): 38-47. DOI:10.1111/fec.2009.23.issue-1 |
| [17] |
Tsuchida T, Koga R, Matsumoto S, et al. Interspecific symbiont transfection confers a novel ecological trait to the recipient insect[J]. Biology Letters, 2011, 7(2): 245-248. DOI:10.1098/rsbl.2010.0699 |
| [18] |
Dillon RJ, Dillon VM. The gut bacteria of insects:nonpathogenic interactions[J]. Annual Review of Entomology, 2004, 49(1): 71-92. DOI:10.1146/annurev.ento.49.061802.123416 |
| [19] |
Dillon RJ, Vennard CT, Buckling A, et al. Diversity of locust gut bacteria protects against pathogen invasion[J]. Ecology Letters, 2005, 8(12): 1291-1298. DOI:10.1111/ele.2005.8.issue-12 |
| [20] |
Dillon RJ, Charnley K. Mutualism between the desert locust Schistocerca gregaria and its gut microbiota[J]. Research in Microbiology, 2002, 153(8): 503-509. DOI:10.1016/S0923-2508(02)01361-X |
| [21] |
Yang H.Diversity of gut bacteria in larval of four lepidopteran insect species[D].Nanjing: Master's Thesis of Nanjing Agricultural University, 2012(in Chinese) 杨焊.四种鳞翅目害虫肠道细菌多样性分析[D].南京: 南京农业大学硕士学位论文, 2012 |
| [22] |
Feng W.Different comparison and characterization of lipase-producing bacteria in the silkworm intestinal microflora[D].Chongqing: Master's Thesis of Southwest University, 2011(in Chinese) 冯伟.家蚕肠道微生态产脂肪细菌的分离鉴定与差异性比较[D].重庆: 西南大学硕士学位论文, 2011 |
| [23] |
Sun ZL.Effects on the intestinal microbial communities with virus infection and high temperature treatment in Silkworm, Bombyx mori[D].Suzhou: Master's Thesis of Soochow University, 2016(in Chinese) 孙振丽.病毒感染和高温处理对家蚕肠道菌群结构的影响[D].苏州: 苏州大学硕士学位论文, 2016 |
| [24] |
Xiang YQ.Comparative study of the composition and type of dominant intestinal microflora in Silkworm reared with different forages[D].Chongqing: Master's Thesis of Southwest University, 2010(in Chinese) 向芸庆.不同饲料饲养家蚕其肠道微生态优势菌群的类型组成及差异性研究[D].重庆: 西南大学硕士学位论文, 2010 |
| [25] |
He C.Molecular identification of the intestinal bacterial community of Mythimna separate (Walker) larvae[D].Xianyang: Master's Thesis of Northwest A & F University, 2012(in Chinese) 何彩.粘虫幼虫肠道细菌群的分子鉴定[D].咸阳: 西北农林科技大学硕士学位论文, 2012 |
| [26] |
Lin XL.Gut bacterial diversity of the diamondback moth and insecticidal activity to larvae by two cultivable bacteria[D].Xianyang: Doctoral Dissertation of Northwest A & F University, 2014(in Chinese) 林晓丽.小菜蛾肠道细菌多样性分析及两株细菌的杀虫活性研究[D].咸阳: 西北农林科技大学博士学位论文, 2014 |
| [27] |
Xia XF.Organizational diversity and functional characterization of microbiota in the midgut of diamondback moth, Plutella xylostella(L.)[D].Fuzhou: Doctoral Dissertation of Fujian Agriculture and Forestry University, 2014(in Chinese) 夏晓峰.小菜蛾中肠微生物多样性及其功能研究[D].福州: 福建农林大学博士学位论文, 2014 |
| [28] |
Zheng DD.Comparative study on the diversity of bacterial communities in diamondback moth (Plutella xylostella) gut at different developmental stages[D].Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2013(in Chinese) 郑丹丹.小菜蛾不同发育阶段肠道细菌多样性分析[D].福州: 福建农林大学硕士学位论文, 2013 |
| [29] |
Lan BM.Diversity and function of gut bacterial symbions of Spodoptera litura[D].Fuzhou: Master's Thesis of Fujian Agriculture and Forestry University, 2016(in Chinese) 蓝波妙.斜纹夜蛾肠道细菌多样性及其对功能研究[D].福州: 福建农林大学硕士学位论文, 2016 |
| [30] |
Zou CR.Analysis of bacterial community and the screening and identification of enzyme-producing bacteria in intestine of Antheraer pernyi[D].Hefei: Anhui Agricultural University, 2011(in Chinese) 邹昌瑞.柞蚕肠道菌群分析及产酶菌的筛选与鉴定[D].合肥: 安徽农业大学, 2011 |
| [31] |
Chen TS. Manufacture and Application of Microbial Culture Medium[M]. Beijing: China Agriculture Press, 1995: 179-184. (in Chinese) 陈天寿. 微生物培养基的制造与应用[M]. 北京: 中国农业出版社, 1995: 179-184. |
| [32] |
Zhang H, Jackson TA. Autochthonous bacterial flora indicated by PCR-DGGE of 16S rRNA gene fragments from the alimentary tract of Costelytra zealandica(Coleoptera:Scarabaeidae)[J]. Journal of Applied Microbiology, 2008, 105(5): 1277-1285. DOI:10.1111/jam.2008.105.issue-5 |
| [33] |
Nangong ZY, Yang J, Wang QY, et al. Study on histology of the alimentary canal of great wax moth Galleria mellonella larvae[J]. Journal of Agricultural University of Hebei, 2015(5): 63-67. (in Chinese) 南宫自艳, 杨君, 王勤英, 等. 大蜡螟幼虫消化道的组织学研究[J]. 河北农业大学学报, 2015(5): 63-67. |
| [34] |
Calheiros CSC, Pereira SIA, Castro PML. Culturable bacteria associated to the rhizosphere and tissues of Iris pseudacorus plants growing in a treatment wetland for winery wastewater discharge[J]. Ecological Engineering, 2018, 115: 67-74. DOI:10.1016/j.ecoleng.2018.02.011 |
| [35] |
Wang HX, Jin L, Chen QL, et al. Diversity and community structure of intestinal cultivable bacteria in adult worker-bee[J]. Microbiology China, 2017, 44(3): 620-630. (in Chinese) 王洪秀, 靳亮, 陈庆隆, 等. 蜜蜂成虫工蜂肠道可培养细菌群落结构分析[J]. 微生物学通报, 2017, 44(3): 620-630. |
| [36] |
Thompson JD, Higgins DG, Gibson TJ. CLUSTAL W:improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Research, 1994, 22(22): 4673-4680. DOI:10.1093/nar/22.22.4673 |
| [37] |
Kumar S, Stecher G, Tamura K. MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology & Evolution, 2016, 33(7): 1870-1874. |
| [38] |
Pandiarajan J, Krishnan M. Comparative bacterial survey in the gut of lepidopteran insects with different bionetwork[J]. Microbiology, 2018, 87(1): 103-115. DOI:10.1134/S0026261718010137 |
| [39] |
Demirci M, Sevim E, Demir I, et al. Culturable bacterial microbiota of Plagiodera versicolora(L.)(Coleoptera:Chrysomelidae) and virulence of the isolated strains[J]. Folia Microbiologica, 2013, 587(3): 201-210. |
| [40] |
Hinojosa VS, Asenjo J, Leiva S. Agarolytic culturable bacteria associated with three antarctic subtidal macroalgae[J]. World Journal of Microbiology & Biotechnology, 2018, 34(6): 73. |
| [41] |
Paniagua Voirol LR, Frago E, Kaltenpoth M, et al. Bacterial symbionts in Lepidoptera:Their diversity, transmission, and impact on the host[J]. Frontiers in Microbiology, 2018, 9: 556. DOI:10.3389/fmicb.2018.00556 |
| [42] |
Gilliam M. Microbes from apiarian sources:Bacillus spp.in frass of the greater wax moth[J]. Journal of Invertebrate Pathology, 1985, 45(2): 218-224. DOI:10.1016/0022-2011(85)90011-4 |
| [43] |
Jarosz J. Gut flora of Galleria mellonella suppressing ingested bacteria[J]. Journal of Invertebrate Pathology, 1979, 34(2): 192-198. DOI:10.1016/0022-2011(79)90101-0 |
| [44] |
Dillon RJ, Charnley AK. Chemical barriers to gut infection in the desert locust:in vivo production of antimicrobial phenols associated with the bacterium Pantoea agglomerans[J]. Journal of Invertebrate Pathology, 1995, 66(1): 72-75. DOI:10.1006/jipa.1995.1063 |
| [45] |
Takatsuka J, Kunimi Y. Intestinal bacteria affect growth of Bacillus thuringiensis in larvae of the oriental tea tortrix, Homona magnanima diakonoff (Lepidoptera:Tortricidae)[J]. Journal of Invertebrate Pathology, 2000, 76(3): 222-226. DOI:10.1006/jipa.2000.4973 |
 2019, Vol. 46
2019, Vol. 46




