扩展功能
文章信息
- 杨静明, 杨文聪, 刘亚月, 聂影影, 雷晓凌, 张翼
- YANG Jing-Ming, YANG Wen-Cong, LIU Ya-Yue, NIE Ying-Ying, LEI Xiao-Ling, ZHANG Yi
- 化学诱导对一株海洋来源土曲霉C23-3次生代谢产物及其生物活性的影响
- Influence of chemical induction on the secondary metabolites and biological activities of a marine-derived fungal strain Aspergillus terreus C23-3
- 微生物学通报, 2019, 46(3): 441-452
- Microbiology China, 2019, 46(3): 441-452
- DOI: 10.13344/j.microbiol.china.180651
-
文章历史
- 收稿日期: 2018-08-20
- 接受日期: 2018-12-11
- 网络首发日期: 2018-12-24
2. 广东海洋大学深圳研究院 广东 深圳 518120
2. Shenzhen Insititute of Guangdong Ocean University, Shenzhen, Guangdong 518120, China
海洋占地球总面积的71%,由于其高盐、低温、高压、低光照、寡营养等极端的生存环境,海洋微生物形成了特殊的新陈代谢系统[1-2]。海洋真菌作为海洋微生物的重要类群,具有很强的次级代谢产物合成能力,为新药的研究与开发提供了重要来源[3]。而在实验室或者人工培养条件下,真菌的大部分基因簇通常处于未表达状态,通过利用表观遗传修饰剂等小分子化学诱导剂调控的方法[4-5],能够方便、快速、有效地激活这些沉默基因簇,从而提高真菌次级代谢产物的产量并丰富其多样性,因而越来越受到研究者的重视[6-7]。
土曲霉(Aspergillus terreus)属于子囊菌门(Ascomycota)散囊菌纲(Eurotiomycetes)散囊菌目(Eurotiales)发菌科(Trichocomaceae)曲霉属(Aspergillus),是广泛存在于海洋和陆地的一种真菌。丁内酯类化合物是海洋天然产物中一类重要的次级代谢产物。文献报道此类化合物是土曲霉次级代谢产物中的代表性化合物,Yamamoto等[8]在1977年从土曲霉的发酵提取物中获得第一个丁内酯类化合物ButyrolactoneⅠ,拉开了对丁内酯类化合物研究的序幕。近年来对丁内酯类化合物的深入研究说明丁内酯环结构普遍存在于各类生物的代谢产物中,而且此类化合物具有抗致病菌、抗疟原虫活性、抗炎活性、细胞毒活性、抗氧化活性及神经保护等药理活性[9-16],有研究表明,阿尔茨海默症(Alzheimerʼs disease,AD)的发生与神经损伤有密切关系,目前较为流行的假说有氧化应激假说[17]和胆碱能缺失假说[18]。因此,研究对抗AD相关活性药物的研发具有一定的研究价值及开发潜力。
化学表观遗传修饰是近年来兴起的一种真菌次生代谢产物调控方法,它主要是采用一些小分子表观遗传修饰剂来特异或半特异地抑制化学表观遗传修饰酶的活性,对真菌的物质生成进行调控,诱导一些次级代谢产物的沉默基因簇表达[19-20],将进一步促进真菌次级代谢产物的研究。目前常用的化学表观遗传修饰剂主要分为两类:一类为组蛋白脱乙酰化酶抑制剂,另一类是DNA甲基化转移酶抑制剂[21]。组蛋白脱乙酰化酶抑制剂可通过与组蛋白去乙酰化酶的活性位点附着抑制该酶的活性,从而使组蛋白乙酰化程度提升,核小体结构松弛,便于DNA分子与转录因子及协同转录因子的结合,进而增强转录水平,刺激沉默基因的表达[4, 21-22]。DNA甲基化转移酶抑制剂可在DNA甲基转移酶的作用下,通过S-腺苷甲硫氨酸作为甲基供应者,将基因组内CpG二核苷酸中胞嘧啶的C5甲基化形成5-甲基胞嘧啶,降低DNA分子中甲基化程度,提高基因中启动子与转录调控因子识别位点的特异性,从而激活基因的转录和表达[4, 23]。另外,重金属离子也被报道可影响真菌次生代谢[24]。有研究表明,利用小分子特异性地影响次级代谢物基因簇的转录是获得多样新颖天然产物的有效途径[25]。因此,本研究选用组蛋白脱乙酰化酶抑制剂丁酸钠(Sodium butyrate)、辛二酰苯胺异羟肟酸(Suberoylanilide hydroxamic acid,SAHA)和DNA甲基化抑制剂5-氮杂胞嘧啶核苷(5-azacytidine,5-azaC)、盐酸普鲁卡因(Procaine hydrochloride)和无机盐氯化锌(ZnCl2)和氯化铜(CuCl2)共6种化学诱导剂对出发菌株Aspergillus terreus C23-3进行化学诱导调控,以期充分发掘菌株的代谢潜能,然后分析其代谢产物中丁内酯类化合物的多样性及含量,为后续开展丁内酯等化合物的发酵提取与发现提供基础条件,从而为新型抗AD等活性药物的开发提供先导化合物。
1 材料 1.1 菌株来源出发菌株为本实验室保藏的一株海洋真菌Aspergillus terreus C23-3,分离自湛江徐闻的牡丹珊瑚(Pectinia paeonia)。
1.2 培养基海水马铃薯培养基:200.0 g马铃薯块加水煮成500 mL马铃薯汁,蔗糖20.0 g,蛋白胨5.0 g,海盐20.0 g,固体培养基中加入20.0 g琼脂粉,加水定容至1 L。麦芽浸膏培养基(g/L):麦芽浸膏20.0,海盐20.0,加水定容至1 L。糙米培养基(g/L):糙米200.0,蛋白胨5.0,海盐20.0,加水定容至1 L。大豆培养基(g/L):大豆粉200.0,海盐20.0,加水定容至1 L。pH均为自然,1×105 Pa灭菌20 min备用。
1.3 主要试剂和仪器6种诱导剂:丁酸钠、SAHA、5-azaC、ZnCl2、CuCl2和盐酸普鲁卡因分别配成5个浓度梯度的贮液:250 mmol/L、25 mmol/L、250 µmol/L、25 µmol/L、2.5µmol/L。其中,SAHA和5-azaC用DMSO溶解,其余用无菌水溶解,经0.22 µm滤膜过滤除菌后待用。
碘化硫代乙酰胆碱(Acetylthiocholine,ATCh)、5, 5′-二硫代二硝基苯甲酸(Dithiobisnitrobenzoic acid,DTNB)、乙酰胆碱酯酶(Acetylcholinesterase,AChE)、牛血清白蛋白(BSA)、二苯代苦味酰自由基(1, 1-Diphenyl-2-picryl-hydrazyl,DPPH),西格玛奥德里奇(上海)贸易有限公司;Silica gel 60 F254,Merck公司;其他试剂及材料均为国产分析纯。
多功能紫外透射仪,上海精科实业有限公司;霉菌培养箱,上海博讯实业有限公司医疗器械厂;高效液相色谱仪[配二极管阵列检测器(DAD)],Agilent公司;平行蒸发仪,BUCHI有限公司;旋转蒸发仪、离心浓缩仪,上海埃朗仪器有限公司。
Agilent反相C18分析柱,填料为Poroshell 120 EC-C18,规格4.6 mm×250 mm,填料粒径4.0 µm。
2 实验方法 2.1 化学诱导初筛 2.1.1 菌株诱导前种子的制备将菌株C23-3放进28℃、湿度为80%的霉菌培养箱中活化过夜;在无菌条件下,将菌种接种到预先装有200 mL灭菌海盐马铃薯固体培养基的锥形培养瓶中;于28 ℃恒温培养箱中培养3−4 d,待菌落孢子生长茂盛备用。
2.1.2 菌株的诱导用0.85%的无菌生理盐水将上述锥形瓶中的菌种孢子洗下,摇匀。马铃薯培养基和麦芽浸膏培养基使用24孔板,每孔加入2 mL培养基和200 µL孢子悬液,28 ℃培养3 d后,加入化学诱导剂:分别设置5个诱导剂终浓度梯度(10 mmol/L、1 mmol/L、100 µmol/L、10 µmol/L、1 µmol/L),各设置一个平行;24孔板置于28 ℃、湿度为80%的霉菌培养箱中静置培养,每天观察实验温度和培养物形态并拍照记录。大米培养基和大豆培养基使用直径为50 mm的一次性无菌培养皿,将固体培养基铺满培养皿的底面,质量约8 g;吸取200µL菌悬液均匀加入对应的培养皿中,诱导剂均匀滴加到3 d培养物表面,6种诱导剂的5个终浓度各做一个平行,于28 ℃霉菌培养箱中培养。
2.1.3 菌株次生代谢产物的提取分别在第2、4周提取发酵产物。对于液体培养物,从24孔板中取出菌丝体和发酵液,3 000 r/min离心浓缩干燥4 h,加入200µL甲醇,功率500 W超声提取30 min,10 000 r/min离心30 min,取出上清液备用。对于固体培养物,将培养基及菌丝体取出一部分(约0.5 mL)放入离心管,加入0.5 mL的甲醇,超声提取30 min,10 000 r/min离心30 min,取出上清液备用。
2.1.4 菌株次生代谢产物的薄层层析紫外特征、生物活性自显影及化学显色此部分参考张翼等[26]的方法,固体培养基发酵提取物以氯仿:甲醇(体积比为5:1)为TLC展开剂,液体培养基发酵提取物以氯仿:甲醇(体积比为10:1)为展开剂,分别记录254、365 nm的紫外图像,DPPH清除活性与AChE抑制活性自显影图像,茴香醛硫酸显色及铁氰化钾-三氯化铁显色图像。
2.2 菌株的常量静置发酵及复筛 2.2.1 菌株的常量静置发酵从化学诱导初筛结果中选出6种代谢产物较丰富的诱导组,即诱导组P-丁酸钠-100 μmol/L、P-ZnCl2-10 mmol/L、P-SAHA-100 μmol/L、M-Procaine-10 mmol/L、R-SAHA-100 μmol/L、S-5-azaC-10 mmol/L进行常量静置发酵,准备500 mL三角瓶,每瓶配制200 mL培养基,分别加入2 mL菌悬液,培养方法同化学诱导初筛。
2.2.2 常量静置发酵产物的提取分别在菌株发酵的第2、3、4周进行代谢产物的提取。固体培养基发酵物用与培养基等体积的氯仿:甲醇(体积比为2:1)混合溶剂进行超声提取,时间30 min,重复提取3次,抽滤得提取物;液体培养基发酵物加入与培养基等体积的乙酸乙酯分液萃取,提取3次,合并提取物。用旋转蒸发仪将样品浓缩干燥,称重,4 ℃冷藏备用。
2.2.3 菌株常量静置发酵次生代谢产物的TLC化学显色及生物活性自显影菌株常量发酵次生代谢产物的TLC化学显色及生物活性自显影方法同化学诱导初筛。
2.2.4 HPLC法分析常量静置发酵产物中代谢产物多样性将各提取物均用色谱甲醇配成浓度为2 mg/mL的样品溶液进行HPLC分析,进样量为10 µL,洗脱条件为:0−30 min,10%−100%的乙腈-水;30−40 min,100%乙腈;40−45 min,100%−10%的乙腈-水;45−50 min,10%的乙腈-水,流速1 mL/min。DAD检测器信号采集波长为190 nm−500 nm,监测波长为254 nm和310 nm。
3 结果与分析 3.1 化学诱导初筛结果 3.1.1 菌株诱导前后表观形态对比如图 1A所示,菌株C23-3在马铃薯培养基条件下,空白组的菌丝体呈现浅棕色,边缘呈现灰黑色。而加入诱导剂CuCl2后,随着CuCl2浓度的增大,菌株的菌丝数量逐渐减少,当浓度达到10 mmol/L时,菌丝颜色由棕色变为白色;加入诱导剂ZnCl2培养14 d后,随着诱导剂浓度的增大,菌丝量变化不显著,当ZnCl2的浓度达到10 mmol/L时,菌丝颜色由棕色变为棕黑色;加入诱导剂SAHA后,随着诱导剂浓度的增大,菌丝量逐渐减少。

|
| 图 1 化学诱导菌株C23-3在第14天时的生长形态 Figure 1 Growing morphology of chemically induced strain C23-3 on the 14th day 注:A:马铃薯培养基诱导组;B:麦芽浸膏培养基诱导组.图片上方标记为加入诱导剂的浓度.空白:不加诱导剂组,其中SAHA组和5-azaC组的对照组为加了DMSO的培养物,其形态异于不含DMSO的空白对照组.上述每组一个平行. Note: A: The potato medium induction group; B: The malt extract medium induction group. The concentrations of the inducers were indicated above the picture. Blank: group without chemical inducers. The controls for the SAHA group and the 5-azaC group were cultures supplemented with DMSO, so the morphology was different from the blank control group without DMSO. One repeated well was set for each group. |
|
|
如图 1B所示,菌株C23-3在麦芽浸膏培养基条件下,空白组菌丝体颜色呈金黄色,而加入诱导剂CuCl2诱导后,随着CuCl2浓度的增大,菌丝量逐渐减少;加入诱导剂ZnCl2诱导后,观察发现随着诱导剂ZnCl2浓度的增大,菌丝体生长逐渐旺盛,当浓度达到1 mmol/L和10 mmol/L时,几乎铺满整个培养孔表面,表明ZnCl2对其生长有促进作用;加入诱导剂5-azaC后,随着5-azaC浓度的增大,菌丝的数量明显增多,菌丝颜色则由棕色变为白色;其它诱导剂在各浓度下对菌丝体形态无明显影响。
综上所述,在CuCl2、ZnCl2、SAHA和5-azaC诱导前后菌株C23-3外观形态上产生了明显变化,在真菌代谢调控的研究中,普遍发现次生代谢与菌株形态变异之间具有密切相关性[14-17],由此推测该菌株在诱导条件下代谢产物可能发生了变化或产生了新的代谢产物。为了确定在特定诱导剂的特定浓度下是否产生了新的物质,本文进一步进行了TLC指纹图谱与薄层生物活性自显影的分析。
3.1.2 诱导前后LC指纹图谱的对比用毛细管吸取微量培养发酵粗提物样品进行TLC紫外及显色分析,对比诱导前后代谢产物的TLC指纹图谱(图 2)可以发现:在大豆培养基条件下,诱导组盐酸普鲁卡因(1 mmol/L)对比空白培养基和DMSO对照的代谢产物在波长254 nm和365 nm下吸收斑点均有所增加,而且其茴香醛显色组分明显增多,DPPH自由基清除活性斑点和乙酰胆碱酯酶抑制活性斑点也有所增加;在大米培养基条件下,诱导组SAHA (10 mmol/L)对比空白培养基和DMSO对照的代谢产物在波长365 nm下吸收斑点均有所增加,DPPH自由基清除活性斑点比DMSO对照培养物也有所增加;在马铃薯培养基条件下,诱导组丁酸钠(100 µmol/L)、SAHA (100 µmol/L)对比空白培养基及DMSO对照的代谢产物在波长254 nm和365 nm下吸收斑点均有所增加,而且其茴香醛显色组分及铁氰化钾-三氯化铁显色斑点(可能为酚类物质)明显增多,DPPH自由基清除活性斑点和乙酰胆碱酯酶抑制活性斑点也有所增加;在麦芽浸膏培养基条件下,诱导组盐酸普鲁卡因(10 mmol/L)对比空白培养基的代谢产物在波长254 nm和365 nm下吸收斑点均有所增加,而且其茴香醛显色组分及铁氰化钾-三氯化铁显色斑点明显增多,DPPH自由基清除活性斑点也有所增加。由此推测,在以上诱导条件下,菌株可能产生了新的代谢产物。

|
| 图 2 菌株C23-3诱导前后发酵产物TLC指纹图谱(培养28 d) Figure 2 TLC fingerprints of the strain C23-3 fermentation products before and after induction (cultured for 28 days) 注:(1) B:空白组;D:DMSO对照组;Zn:ZnCl2;Cu:CuCl2;Bu:丁酸钠;Pro:盐酸普鲁卡因;5-a:5-azaC;浓度标在TLC板下方. (2) A1−A6:大豆基础培养基条件下诱导结果;B1−B6:大米基础培养基条件下诱导结果;C1−C6:马铃薯培养基和麦芽浸膏培养基条件下诱导结果. A1−C1:254 nm紫外图像;A2−C2:365 nm荧光图像;A3−C3:茴香醛硫酸显色;A4−C4:DPPH自由基清除活性自显影;A5−C5:乙酰胆碱酯酶抑制活性自显影;A6−C6:铁氰化钾-三氯化铁显色. Note: (1) B: The blank group; D: The DMSO control group; Zn: ZnCl2; Cu: CuCl2; Bu: Sodium butyrate; Pro: Procaine hydrochloride; 5-a: 5-azaC; The concentrations were marked below the TLC plates. (2) A1−A6: The results induced based on soybean medium; B1−B6: The results induced based on rice medium; C1−C6: The results induced based on potato medium and malt extract medium. From left to right: A1−C1: Images under 254 nm; A2−C2: Fluorescence images under 365 nm; A3−C3: Anisaldehyde sulfate colorization; A4−C4: DPPH free radical scavenging autography; A5−C5: Acetylcholinesterase inhibitory autography; A6−C6: Potassium ferricyanide-FeCl3 colorization. |
|
|
综上所述,根据化学诱导前后菌株表观形态的变化和发酵提取物TLC自显影指纹图谱的对比结果综合分析,菌株在特定的培养基条件和特定诱导剂的不同浓度下,产生了新的次级代谢产物。其中在P-丁酸钠-100 μmol/L、P-ZnCl2-10 mmol/L、P-SAHA-100 μmol/L、M-Procaine-10 mmol/L、R-SAHA-100 μmol/L、S-5-azaC-10 mmol/L这6种诱导条件下代谢产物较丰富,生物活性较显著,考虑到微量培养与通常用培养瓶进行的常量发酵之间可能存在一定差异性,为验证上述6个条件在常量发酵中的有效性,对这些条件进一步采用常规培养瓶进行了静置发酵验证试验和代谢产物分析。
3.2 常量静置发酵代谢产物的分析 3.2.1 常量静置发酵代谢产物TLC指纹图谱对常量静置发酵代谢产物做TLC紫外与显色分析及生物活性自显影,TLC紫外及茴香醛显色分析显示,6组诱导条件下的菌株C23-3第3、4周的代谢产物均有差异且产物均比较丰富(其中第4周结果见图 3);生物活性自显影表明,P-丁酸钠- 100 μmol/L、P-ZnCl2-10 mmol/L、P-SAHA-100 μmol/L、M-Procaine-10 mmol/L、R-SAHA-100 μmol/L、S-5-azaC-10 mmol/L这6组诱导条件下的代谢产物都具有明显的DPPH自由基清除活性和乙酰胆碱酯酶抑制活性(条件4略差),而且其活性成分具有较高的多样性。铁氰化钾-三氯化铁显色表明,其代谢产物中极可能含有丰富的含酚类基团化合物且与DPPH清除活性自显影所显示抗氧化活性主要斑点有很好的对应。对照微量培养与常量发酵产物的TLC指纹图谱,发现多数条件重复性较好,说明用高通量的微量培养法结合常量发酵来筛选合适的化学诱导条件是可行的。

|
| 图 3 常量静置发酵提取物及所用诱导剂的TLC指纹图谱(培养28 d) Figure 3 TLC fingerprints of the routine-scale static fermentation products and inducers (cultured for 28 days) 注:Procaine代表盐酸普鲁卡因;1:P-丁酸钠-100 μmol/L;2:P-ZnCl2-10 mmol/L;3:P-SAHA-100 μmol/L;4:M-Procaine-10 mmol/L;5:R-SAHA-100 μmol/L;6:S-5-azaC-10 mmol/L. A1、A2:254 nm紫外图像;B1、B2:365 nm荧光图像;C1、C2:茴香醛硫酸化学显色;D1、D2:DPPH自由基清除活性自显影;E1、E2:乙酰胆碱酯酶抑制活性自显影;F1、F2:铁氰化钾-三氯化铁化学显色. Note: Procaine stands for procaine hydrochloride; 1: P-Sodium butyrate-100 μmol/L; 2: P-ZnCl2-10 mmol/L; 3: P-SAHA-100 μmol/L; 4: M-Procaine-10 mmol/L; 5: R-SAHA-100 μmol/L; 6: S-5-azaC-10 mmol/L. A1, A2: Image under 254 nm; B1, B2: Fluorescence image under 365 nm; C1, C2: Anisaldehyde sulfate colorization; D1, D2: DPPH free radical scavenging autography; E1, E2: Acetylcholinesterase inhibitory autography; F1, F2: Potassium ferricyanide-FeCl3 colorization. |
|
|
利用HPLC对化学诱导后菌株常量静置发酵代谢产物进行分析,图 4结果显示经过化学诱导,菌株在不同的培养条件下均产生了丰富的代谢产物,在254 nm波长下各个诱导条件的吸收峰较多且保留时间多样。
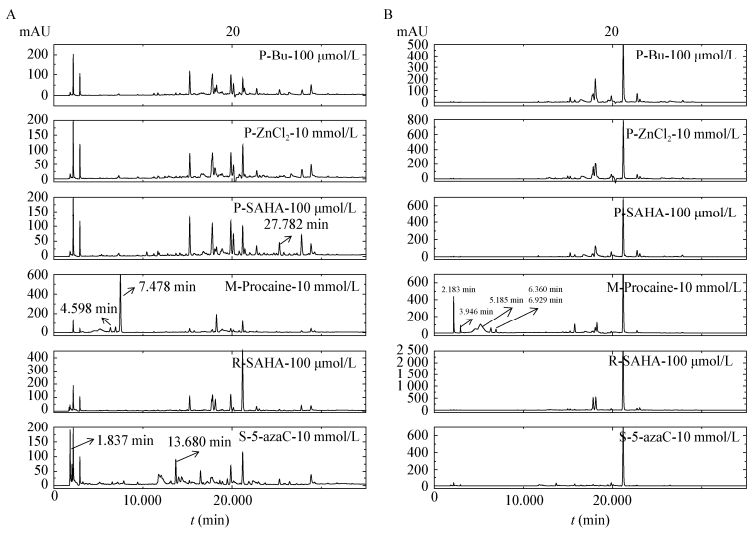
|
| 图 4 常量静置发酵代谢产物的HPLC图谱(培养28 d) Figure 4 HPLC chromatograms of routine-scale static fermentation metabolites (cultured for 28 days) 注:Bu:丁酸钠;Procaine:盐酸普鲁卡因;A:检测波长254 nm下的液相图谱;B:310 nm检测波长下的液相图谱. Note: Bu: Sodium butyrate; Procaine: Procaine hydrochloride; A: The liquid chromatograms detected under 254 nm; B: The liquid chromatograms under 310 nm. |
|
|
同种培养基、不同的诱导条件产生的代谢产物及其含量也有所差异。比如在马铃薯培养基条件下,加入诱导剂SAHA (100 μmol/L)后,254 nm波长下保留时间为27.782 min时出现明显吸收峰,而在加入诱导剂丁酸钠(100 μmol/L)、ZnCl2 (10 mmol/L)后在相同保留时间则没有出现明显吸收峰。
不同的培养基、不同的诱导剂产生的代谢产物有所差异。比如:在麦芽浸膏培养基条件下,加入诱导剂Procaine (10 mmol/L)后,254 nm波长下保留时间为4.598、7.478 min时出现吸收峰,而其它诱导组则没有出现明显的吸收峰;在大豆培养基条件下,加入诱导剂5-azaC (10 mmol/L)后,254 nm波长下保留时间为1.837、13.680 min时出现明显吸收峰,而在其它培养基及不同诱导剂培养条件下相同的保留时间则没有出现明显吸收峰;在310 nm波长下,M-Procaine-10 mmol/L诱导组在保留时间为2.183、3.946、5.185、6.360、6.929 min时出现吸收峰,而其余诱导组则没有出现明显吸收峰。
3.2.3 常量静置发酵代谢产物中丁内酯类化合物分析对6组常量静置发酵代谢产物的HPLC-DAD等吸收光谱(图 5)进行分析,参照丁内酯类化合物的紫外光谱特征(紫外最大吸收波长一般均为310 nm左右),并结合化合物标准品丁内酯Ⅰ和丁内酯Ⅱ相同分析条件下的液相图谱,可以大致判定代谢产物中不同丁内酯类化合物的多样性及其保留时间。结果表明,6种诱导条件下均能产生丁内酯Ⅰ,部分产生丁内酯Ⅱ;对比产生丁内酯类化合物的多样性,由多到少依次为:R-SAHA-100 μmol/L > M-Procaine-10 mmol/L > P-ZnCl2-10 mmol/L > P-丁酸钠-100 μmol/L > P-SAHA-100 μmol/L > S-5-azaC-10 mmol/L。

|
| 图 5 C23-3常量静置发酵代谢产物的等吸收图谱 Figure 5 Isoabsorption spectra of the metabolites of C23-3 under static fermentation 注:P:马铃薯培养基;M:麦芽浸膏培养基;R:大米培养基;S:大豆培养基;Bu:丁酸钠;Pro:盐酸普鲁卡因;Zn:ZnCl2;5-azaC:5-氮杂胞嘧啶核苷. Note: P: The potato culture medium; M: The malt extract medium; R: The rice medium; S: The soybean medium; Bu: Sodium butyrate; Pro: Procaine hydrochloride; Zn: ZnCl2; 5-azaC: 5-Azacytidine. |
|
|
综上所述,菌株C23-3通过化学诱导能产生丰富的抗氧化或AChE抑制活性次生代谢产物,包括丁内酯类化合物,而且不同诱导条件下丁内酯的种类及产量有明显差异。抗氧化剂(包括一些丁内酯类化合物)通常具有较好的神经保护活性和抗神经炎症活性,而乙酰胆碱酯酶抑制剂则可以缓解AD患者大脑海马区域的神经递质衰减[27]。因此,上述结果为今后发现新颖的抗AD先导化合物奠定了基础。
4 讨论有研究表明:海洋样品采集难度高,常规实验条件下仅有低于5%的海洋微生物被分离得到,即便是获得的微生物,在实验室培养条件下也不能完全表达其在海洋环境下所有生物合成途径的代谢产物。因此,如何最大程度地开发这些来之不易的海洋微生物资源是一项艰巨的任务。一些科研工作者利用表观遗传修饰的方法对海洋真菌进行化学诱导,研究证明通过化学表观遗传修饰可以达到发掘菌株潜能、激活沉默基因表达的目的。2010年,Wang等[28]在真菌Penicillium citreonigrum培养基中加入50 µmol/L的5-azaC,结果发现此菌株的代谢产物多样性明显提高。2011年,Vervoort等[29]用组蛋白去乙酰化抑制剂SAHA调控一株海洋沉积物来源的真菌Microascus sp.,分离纯化得到一个具有新骨架的环缩酚酸肽。Beau等[30]对海洋真菌Leucostoma persoonii采用组蛋白去乙酰化酶抑制剂丁酸钠诱导并从中获得新化合物Cytosporone R。
上述报道中都是单一培养基加入一种或者两种诱导剂进行调控,而本研究考虑了OSMAC策略(单菌株多化合物)和化学诱导手段(包括不同表观遗传修饰剂及与金属离子)的结合运用,共采用4种培养基,选用6种化学诱导剂进行化学诱导试验设计,有利于发现更好的诱导条件;况且本实验将高通量的微量培养与常量发酵法结合起来进行化学诱导条件筛选,工作效率较高,结果重复性较好,取得了较好的效果。
本实验常量发酵部分采用500 mL锥形瓶中装入200 mL培养基进行发酵,此0.4的装液比虽然也可基本满足菌株的生长和代谢,在少数研究报道中也有使用[31],但与一般此类研究报道的装液比(如0.25−0.30)相比偏高[32-34]。在进行后续的大量静置发酵研究时,可能需要进一步考察装液量对代谢产物与活性的影响,优化装液比,以更有利于菌株发酵。如进行摇瓶或液体发酵罐发酵,则还需要进一步研究装液比、搅拌速度/转速、通气速度等条件及发酵周期的影响。
菌株C23-3属土曲霉,根据研究报道,土曲霉的主要代谢次生产物芳基丁内酯(其代表为丁内酯Ⅰ)具有一定的抗神经炎症[12]、抗氧化[14]、神经损伤保护[15]、促进神经生长[35]的作用;另外,土曲霉还常会产生具有较好乙酰胆碱酯酶(AChE)抑制活性的土震素类(Territrems)化合物[36-37],而AChE也是阿尔茨海默病相关治疗药物研发的经典靶标。因此,深入挖掘土曲霉的次生代谢产物,对于开发其在缓解治疗AD药物方面的潜力具有重要意义。
5 结论本研究表明,将高通量的微量培养法与常量发酵法结合起来进行化学诱导条件筛选具有可行性。与未诱导组相比,菌株在诱导条件下次生代谢产物产生了显著差异,其TLC紫外斑点及化学显色对比空白组明显丰富,生物活性自显影斑点也发生一定变化,进一步利用HPLC分析其代谢产物,对比空白组出现新的色谱峰,说明利用小分子进行化学诱导的方法能够刺激菌株C23-3产生新的抗AD相关活性的物质,并发现了有显著差异的P-丁酸钠-100μmol/L、P-ZnCl2-10 mmol/L等6种诱导效果较好的诱导条件。在相应条件下,菌株可产生丰富的抗氧化或乙酰胆碱酯酶抑制活性成分,包括多样的丁内酯类化合物,这为活性化合物的深入研究奠定了较好的基础,对抗阿尔茨海默症药物的研发具有一定的科学意义。
| [1] |
Jiao BH, Mu J, Xu QZ, et al. The research progress on the marine microorganism-derived novel antibiotics[J]. Anti-infection Pharmacy, 2004, 1(1): 1-9. (in Chinese) 焦炳华, 穆军, 许强芝, 等. 海洋微生物来源新抗生素的研究[J]. 抗感染药学, 2004, 1(1): 1-9. DOI:10.3969/j.issn.1672-7878.2004.01.003 |
| [2] |
Wang P. Studies on the secondary metabolites of three marine actinomycetes[D]. Qingdao: Master's Thesis of Ocean University of China, 2014 (in Chinese) 王佩.三株海洋放线菌次生代谢产物研究[D].青岛: 中国海洋大学硕士学位论文, 2014 |
| [3] |
Kong FD. Studies of bioactive secondary metabolites from four marine-derived fungi[D]. Qingdao: Doctoral Dissertation of Ocean University Of China, 2015 (in Chinese) 孔凡栋.四株海洋来源真菌活性次级代谢产物的研究[D].青岛: 中国海洋大学博士学位论文, 2015 |
| [4] |
Zhou R, Liao GJ, Hu CH. Epigenetic regulation of secondary metabolite biosynthesis in filamentous fungi: a review[J]. Chinese Journal of Biotechnology, 2011, 27(8): 1142-1148. (in Chinese) 周锐, 廖国建, 胡昌华. 丝状真菌次级代谢产物生物合成的表观遗传调控[J]. 生物工程学报, 2011, 27(8): 1142-1148. |
| [5] |
Liu Y. Epigenetic modifications increase structure diversity and activity of secondary metabolites of marine fungi[D]. Beijing: Doctoral Dissertation of Chinese Academy of Sciences University, 2015 (in Chinese) 刘洋.表观遗传修饰增加海洋真菌次生代谢产物结构多样性和活性研究[D].北京: 中国科学院大学博士学位论文, 2015 |
| [6] |
Zhao Q, Min TL, Hu HF. Studies on activating silent biosynthetic gene clusters to synthesize new natural products in microorganisms[J]. World Clinical Drugs, 2014, 35(8): 501-505. (in Chinese) 赵琪, 闵涛玲, 胡海峰. 激活微生物沉默基因簇合成新型天然产物的研究[J]. 世界临床药物, 2014, 35(8): 501-505. |
| [7] |
Zhou R. Effect of epigenetic modifying agents on the pleuromutilin-produced fungus Pleurotus mutilus-04[D]. Chongqing: Master's Thesis of Southwest University, 2011 (in Chinese) 周锐.表观遗传试剂应用于截短侧耳素产生菌Pleurotus mutilus-04的初步研究[D].重庆: 西南大学硕士学位论文, 2011 |
| [8] |
Yamamoto Y, Nishimura K, Kiriyama N. Studies on the metabolic products of Aspergillus terreus. I. metabolites of the strain IFO 6123[J]. Chemical & Pharmaceutical Bulletin, 1977, 24(8): 1853-1859. |
| [9] |
Cazar ME, Schmeda-Hirschmann G, Astudillo L. Antimicrobial butyrolactone I derivatives from the Ecuadorian soil fungus Aspergillus terreus Thorn. var terreus[J]. World Journal of Microbiology and Biotechnology, 2005, 21(6/7): 1067-1075. |
| [10] |
Ospina CA, Rodríguez AD, Sánchez JA, et al. Caucanolides A-F, unusual antiplasmodial constituents from a Colombian collection of the gorgonian coral Pseudopterogorgia bipinnata[J]. Journal of Natural Products, 2005, 68(10): 1519-1526. DOI:10.1021/np050239z |
| [11] |
Gong T, Dong SH, Zhu P. Butyrolactone derivatives isolated from the marine fungus Aspergillus versicolor F62[J]. Mycosystema, 2014, 33(3): 706-712. (in Chinese) 巩婷, 董世豪, 朱平. 海洋真菌杂色曲霉F62丁内酯类化合物研究[J]. 菌物学报, 2014, 33(3): 706-712. |
| [12] |
Zhang YY, Zhang Y, Yao YB, et al. Butyrolactone-I from coral-derived fungus Aspergillus terreus attenuates neuro-inflammatory response via suppression of NF-κB pathway in BV-2 cells[J]. Marine Drugs, 2018, 16(6): 202. DOI:10.3390/md16060202 |
| [13] |
Choi K, Hong J, Lee CO, et al. Cytotoxic furanosesterterpenes from a marine sponge Psammocinia sp[J]. Journal of Natural Products, 2004, 67(7): 1186-1189. DOI:10.1021/np049922w |
| [14] |
Li LJ, Li TX, Kong LY, et al. Antioxidant aromatic butenolides from an insect-associated Aspergillus iizukae[J]. Phytochemistry Letters, 2016, 16: 134-140. DOI:10.1016/j.phytol.2016.03.014 |
| [15] |
Wei WL, Wang XT, Kusiak JW. Signaling events in amyloid β-peptide-induced neuronal death and insulin-like growth factor I protection[J]. Journal of Biological Chemistry, 2002, 277(20): 17649-17656. DOI:10.1074/jbc.M111704200 |
| [16] |
Alvarez A, Toro RA, Cáceres A, et al. Inhibition of tau phosphorylating protein kinase cdk5 prevents β-amyloid-induced neuronal death[J]. FEBS Letters, 1999, 459(3): 421-426. DOI:10.1016/S0014-5793(99)01279-X |
| [17] |
Praticò D. Oxidative stress hypothesis in Alzheimer's disease: a reappraisal[J]. Trends in Pharmacological Sciences, 2008, 29(12): 609-615. DOI:10.1016/j.tips.2008.09.001 |
| [18] |
Lawrence AD, Sahakian BJ. The cognitive psychopharmacology of alzheimer's disease: focus on cholinergic systems[J]. Neurochemical Research, 1998, 23(5): 787-794. DOI:10.1023/A:1022419712453 |
| [19] |
Williams RB, Henrikson JC, Hoover AR, et al. Epigenetic remodeling of the fungal secondary metabolome[J]. Organic & Biomolecular Chemistry, 2008, 6(11): 1895-1897. |
| [20] |
Takahashi JA, Teles APC, De Almeida Pinto Bracarense A, et al. Classical and epigenetic approaches to metabolite diversification in filamentous fungi[J]. Phytochemistry Reviews, 2013, 12(4): 773-789. DOI:10.1007/s11101-013-9305-5 |
| [21] |
Ding P. Study on the secondary metabolites from marine fungi Aspergillus sp. AA007 by chemical epigenetic modifications[D]. Zhejiang: Master's Thesis of Zhejiang Gongshang University, 2017 (in Chinese) 丁佩.化学表观遗传修饰剂激活海洋真菌Aspergillus sp. AA007次级代谢产物的研究[D].浙江: 浙江工商大学硕士学位论文, 2017 |
| [22] |
Miao F. Progress on histone deacetylase inhibtors[J]. Journal of China Prescription Drug, 2016, 14(2): 22-23. (in Chinese) 苗方. 组蛋白去乙酰化酶抑制剂的研究进展[J]. 中国处方药, 2016, 14(2): 22-23. DOI:10.3969/j.issn.1671-945X.2016.02.015 |
| [23] |
Cheng JC, Matsen CB, Gonzales FA, et al. Inhibition of DNA methylation and reactivation of silenced genes by zebularine[J]. Journal of the National Cancer Institute, 2003, 95(5): 399-409. DOI:10.1093/jnci/95.5.399 |
| [24] |
Wu B, Wu XD, Sun M, et al. Two novel tyrosinase inhibitory sesquiterpenes induced by CuCl2 from a marine-derived fungus Pestalotiopsis sp. Z233[J]. Marine Drugs, 2013, 11(8): 2713-2721. DOI:10.3390/md11082713 |
| [25] |
Pettit RK. Small-molecule elicitation of microbial secondary metabolites[J]. Microbial Biotechnology, 2011, 4(4): 471-478. DOI:10.1111/j.1751-7915.2010.00196.x |
| [26] |
Zhang Y, Bao HY, Nie YY, et al. Screening and tracing of anti-Alzheimer related bioactive constituents from marine fungi[J]. Modern Food Science and Technology, 2016, 32(11): 63-71. (in Chinese) 张翼, 鲍海燕, 聂影影, 等. 海洋真菌抗老年痴呆相关活性成分的筛选与追踪研究[J]. 现代食品科技, 2016, 32(11): 63-71. |
| [27] |
Tao JN. Advances in cholinesterase inhibitors for treatment of Alzheimer's disease[J]. Progress in Pharmaceutical Sciences, 2001, 25(4): 202-206. (in Chinese) 陶纪宁. 胆碱酯酶抑制剂治疗阿尔茨海默病的研究进展[J]. 药学进展, 2001, 25(4): 202-206. DOI:10.3969/j.issn.1001-5094.2001.04.003 |
| [28] |
Wang XR, Filho JGS, Hoover AR, et al. Chemical epigenetics alters the secondary metabolite composition of guttate excreted by an Atlantic-forest-soil-derived Penicillium citreonigrum[J]. Journal of Natural Products, 2010, 73(5): 942-948. DOI:10.1021/np100142h |
| [29] |
Vervoort HC, Drašković M, Crews P. Histone deacetylase inhibitors as a tool to up-regulate new fungal biosynthetic products: isolation of EGM-556, a cyclodepsipeptide, from Microascus sp[J]. Organic Letters, 2011, 13(3): 410-413. DOI:10.1021/ol1027199 |
| [30] |
Beau J, Mahid N, Burda WN, et al. Epigenetic tailoring for the production of anti-infective cytosporones from the marine fungus Leucostoma persoonii[J]. Marine Drugs, 2012, 10(4): 762-774. |
| [31] |
He F, Bao J, Zhang XY, et al. Asperterrestide A, a cytotoxic cyclic tetrapeptide from the marine-derived fungus Aspergillus terreus SCSGAF0162[J]. Journal of Natural Products, 2013, 76(6): 1182-1186. DOI:10.1021/np300897v |
| [32] |
Haroon MH, Premaratne SR, Choudhry MI, et al. A new β-glucuronidase inhibiting butyrolactone from the marine endophytic fungus Aspergillus terreus[J]. Natural Product Research, 2013, 27(12): 1060-1066. DOI:10.1080/14786419.2012.708659 |
| [33] |
Shen Y, Zou JH, Xie D, et al. Butyrolactone and cycloheptanetrione from mangrove-associated fungus Aspergillus terreus[J]. Chemical and Pharmaceutical Bulletin, 2012, 60(11): 1437-1441. DOI:10.1248/cpb.c12-00616 |
| [34] |
Nagia MMS, El-Metwally MME, Shaaban M, et al. Four butyrolactones and diverse bioactive secondary metabolites from terrestrial Aspergillus flavipes MM2: isolation and structure determination[J]. Organic and Medicinal Chemistry Letters, 2012, 2(1): 9. DOI:10.1186/2191-2858-2-9 |
| [35] |
Bang OS, Park EK, Yang SI, et al. Overexpression of Akt inhibits NGF-induced growth arrest and neuronal differentiation of PC12 cells[J]. Journal of Cell Science, 2001, 114(1): 81-88. |
| [36] |
Ling KH, Yang CK, Peng FT. Territrems, tremorgenic mycotoxins of Aspergillus terreus[J]. Applied Environmental Microbiology, 1979, 37(3): 355-357. |
| [37] |
Chen JW, Luo YL, Hwang MJ, et al. Territrem B, a tremorgenic mycotoxin that inhibits acetylcholinesterase with a noncovalent yet irreversible binding mechanism[J]. Journal of Biological Chemistry, 1999, 274(49): 34916-34923. DOI:10.1074/jbc.274.49.34916 |
 2019, Vol. 46
2019, Vol. 46




