扩展功能
文章信息
- 梁小夜, 许平, 董涛
- LIANG Xiao-Ye, XU Ping, DONG Tao
- 从效应蛋白视角看革兰氏阴性细菌Ⅵ型蛋白分泌系统底物转运机理
- Effector recognition and translocation by type Ⅵ protein secretion system in Gram-negative bacteria
- 微生物学通报, 2019, 46(2): 339-344
- Microbiology China, 2019, 46(2): 339-344
- DOI: 10.13344/j.microbiol.china.181024
-
文章历史
- 收稿日期: 2018-12-17
- 接受日期: 2019-01-14
- 网络首发日期: 2019-01-17
进入新世纪,组学技术的快速发展推动微生物学的研究进入新的阶段。通过微生物组学,我们发现了更多在不同自然环境下的微生物以及它们的基因组成,并且更清楚地认识到微生物在人体健康、环境修复、农业生产、海洋生态等很多方面所发挥的作用。宏观上的功能往往并非由单一细菌实现的,而是多种不同的微生物所组成的复杂群体共同作用的结果。因此,为了从机理上研究微生物组的宏观功能,我们必须同时在微观上从不同层次(包括基因、蛋白质、细胞)来探索微生物的生理活动。其中,研究细菌间微观上的相互作用机制至关重要。
为了生存细菌通过进化获得了一系列可用于细菌间以及细菌与宿主细胞竞争的武器系统。根据作用距离,可大致分为非接触式抑制和接触式抑制两类[1]。第一类的典型代表是可以扩散的抗生素等小分子化合物。这一类已经被广泛应用于医学和农业,为人类健康和社会发展发挥了至关重要的作用。第二类可以通过直接接触而作用于相邻细胞,其中包括在大肠杆菌中报道的CDI (Contact dependent inhibition)系统和本综述主要讨论的Ⅵ型蛋白分泌系统(T6SS)[2-4]。CDI和T6SS同样具有很强的杀菌能力,因此对解决病原菌耐药性问题具有潜在的应用价值。另外,同一种细菌可以拥有多种武器以获得在不同环境下的竞争优势。
T6SS广泛存在于革兰氏阴性细菌中,是一种直接接触式的细菌武器[5]。T6SS是细菌胞质中最长的管状结构之一,可作用于真核细胞,也可以作用于原核细胞[6-7]。它不需要利用表面受体,而是通过细菌间直接接触,在几毫秒内直接将底物蛋白转运至受体细菌的细胞质中[6]。T6SS最初由哈佛大学John Mekalanos实验室在霍乱弧菌(Vibrio cholera)和铜绿假单胞菌(Pseudomonas aeruginosa)中报道,现在已经在约25%的革兰氏阴性细菌中被发现,包括许多重要的人类致病菌[3-4]。过去十多年,对T6SS的结构组成、功能和调控的研究是微生物学最热门的研究领域之一。文献中也已经有了很多系统性的综述[5-6]。因此本文选择从T6SS效应蛋白的发现过程来介绍T6SS识别并转运效应蛋白的机理,以及经典的遗传学方法在T6SS的发现和研究中发挥的重要作用。
1 T6SS的组成和结构T6SS的结构主要由跨膜复合体(Membrane complex TssJLM)、基座复合体(Baseplate TssEFGK)和管状结构(VipA/B和Hcp) 3部分组成[5-6, 8-9] (图 1)。跨膜/基座复合体将管状结构固定在细胞膜上。T6SS管状结构与可收缩噬菌体的尾部结构进化上同源、结构上相似,由一组核心的保守基因编码[8, 10]。其关键的组成部件包括由Hcp蛋白六聚体组成的多层内管,包裹Hcp内管的VipA/B外鞘,以及位于Hcp管顶端的VgrG三聚体和锥形PAAR蛋白复合物[5, 11]。外鞘的收缩驱动Hcp内管及其结合的顶端蛋白VgrG和PAAR排出到细胞外或者相邻细胞内。收缩后的外鞘蛋白留存在细胞内,并被ATP蛋白酶ClpV分解成单体,以便被再循环用于另一个T6SS的装配[12-14]。值得指出的是,为了满足细胞对不可回收的分泌蛋白的重新合成的需求,编码T6SS分泌蛋白的基因与编码可循环利用的结构蛋白基因相比受到差异性调控[15]。T6SS的装配还需要两个进化上同源的结构蛋白TssA和TagA[16-18]。TssA可以和T6SS多个结构组分相结合并参与基座和管状结构的装配,但是在不同细菌内可能位于基座内(Baseplate)、管状结构末端、或者两端都存在[16-18]。TagA最近被发现能够和TssA相结合并终止管状结构的延伸[17]。由于TssA和TagA的作用机理和在T6SS内的具体位置还不完全清楚,而且还没有证据证明它们和效应蛋白相结合,因此本综述暂不予以讨论。
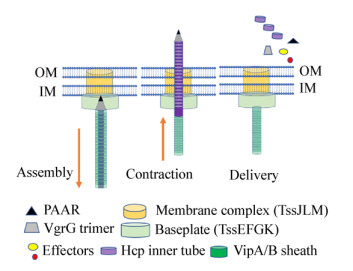
|
| 图 1 T6SS的分泌模型 Figure 1 T6SS secretion model |
|
|
位于T6SS结构最尖端的是VgrG三聚体和PAAR蛋白[5, 11]。细菌基因组可以编码多个VgrG和PAAR基因,但是每次外管的收缩只会将一个PAAR蛋白、三个VgrG蛋白,以及数百个Hcp蛋白分泌出去。如果将T6SS比喻为细菌的弓箭,那么由膜-底座复合体和外鞘组成的弓能够将由Hcp组成的箭体和VgrG-PAAR组成的箭头在几毫秒内弹射出去。外鞘收缩释放出惊人的能量(44 000 kcal/mol),相当于4 000个ATP水解释放的能量[6, 19]。并且,由于外鞘和内管的螺旋结构,收缩过程导致的管体旋转角速度能够达到约每分种12万转[6]。这为T6SS穿透受体细胞的内外膜和细胞壁提供了足够的穿透力。
2 分泌蛋白决定T6SS功能由于同种姐妹细胞之间也会发生T6SS的穿刺转运,因此物理性的穿透并不能对细胞产生致死性伤害,而T6SS的杀伤功能主要是由其分泌的蛋白的功能所决定的[5, 20-21]。T6SS的分泌蛋白主要包括起运载作用的结构蛋白和发挥生物学活性的效应蛋白。T6SS的效应蛋白一般具有对真核细胞或者原核细胞的细胞毒性[5, 22],按照结构可分为两大类。第一类是带有延伸功能域(Extended domain)的结构蛋白。例如霍乱弧菌的VgrG1和VgrG3分别具有肌动蛋白交联活性和破坏细胞壁活性的延伸功能域[23-24]。它们作为结构蛋白既是T6SS的不可或缺的组成部分,同时又都能分泌到受体细胞内,并利用延伸功能域发挥效应蛋白的作用[24-25]。这一类还包含带有延伸功能域的PAAR蛋白[11]和内管Hcp蛋白[26]。由于VgrG-PAAR-Hcp双功能蛋白其结构上的保守性,它们比较容易被识别而且其分泌机理也较简单。第二类是非结构性分泌蛋白,也称为专属效应蛋白(Dedicated effector)。这一类效应蛋白序列上相似性很低,功能多样,因此难以用生物信息学方法识别[5-6, 22]。如果将结构性的效应蛋白比喻为弓箭的箭头,专属效应蛋白是如何被识别并处在弓箭的什么位置是我们认知T6SS作用机理的核心问题之一。
3 T6SS的端部分泌蛋白识别过程在T6SS还没有被正式定义为分泌系统之前,生物信息学分析已经发现它的基因簇广泛存在于革兰氏阴性细菌中,并且其中的一些关键基因已经被发现在细菌与真核细胞的相互作用中至关重要[5]。Mekalanos实验室利用经典的遗传学手段,即转座子随机突变的方法,在霍乱弧菌中寻找对阿米巴虫的侵染非常重要的基因。通过分析失去毒性的突变体,发现并系统鉴定了T6SS的基因簇[3]。该实验室同时也在铜绿假单胞菌中报道了同源的T6SS,并发现能够从病人体内分离到对应的T6SS分泌蛋白Hcp的抗体[4]。此后,领域内迅速开展了对T6SS分泌的效应蛋白及分泌机理的研究[27-28]。可能由于T6SS是在利用真核生物与微生物相互作用时发现的,也由于其他已知的分泌系统多作用于真核细胞,因此对T6SS作用对象的研究首先聚焦在真核细胞[28-30]。然而2010年铜绿假单胞菌的T6SS被发现具有杀菌活性[20]。这项研究也首次发现3个非结构性的分泌蛋白[20],而后续研究显示它们是通过与内管蛋白Hcp的结合分泌出去[31]。由于Hcp内管是中空的,有大约4 nm的直径,理论上可以装填一定大小的分泌蛋白,因此通过Hcp内管的分泌起初被认为是主要的分泌通路[4, 20]。通过限定蛋白的分子大小、带电特征等物理性质而非蛋白序列,后续研究预测出一批类似的小分子分泌蛋白[32]。然而这个方法局限于已知的分泌蛋白所具有的物理特征。虽然霍乱弧菌的T6SS具有很强的杀菌能力[33],利用这些特征并没有在霍乱弧菌中预测出类似的效应蛋白,预示着其他类型的效应蛋白的存在。
为了避免被自身细胞杀死,T6SS需要合成脱毒蛋白,也称免疫蛋白(Immunity protein)[5, 20, 34]。免疫蛋白通过与有毒性的效应蛋白相结合来实现自我保护,而且由于免疫蛋白与效应蛋白的功能相关性,它们在基因组上的位置也是相邻的。因此,我们设计了一个利用转座子随机突变与高通量测序相结合来寻找免疫蛋白基因的遗传筛选方法[24]。免疫基因的突变体可以在T6SS失活突变体中得到,但是在T6SS活跃的菌体内无法存活。利用这个差异性存活筛选方法,我们发现了3个免疫基因,并进而识别了它们分别对应的具有杀菌活性的两个非结构性的分泌蛋白TseL和VasX,和一个有延伸功能域结构性的VgrG3[24]。但是,TseL和VasX的分子量远远大于Hcp内径所能容纳的蛋白大小,与已发现的小分子分泌蛋白没有任何同源性。这表明可能有新的分泌途径。我们发现TseL可以与VgrG3相互作用,揭示了非结构蛋白利用与端部蛋白结合实现分泌的新途径[24]。我们后来的研究发现TseL与VgrG3的结合是间接的,其直接结合的是VgrG1[35]。这也解释了在大肠杆菌里表达TseL和VgrG3时它们并不结合,但是在霍乱弧菌中形成了TseL-VgrG1-VgrG3聚合体。通过大量后续研究,与VgrG结合的分泌途径现在被认为是一个最主要的非结构蛋白的分泌途径[36-38]。
4 T6SS伴侣蛋白的发现提供了发现分泌蛋白的新工具由于TseL和VasX在序列上没有相似性,同一个T6SS分泌系统是如何识别这两种非常不同的分泌蛋白的呢?通过分析tseL和vasX的上游基因,我们发现上游基因编码一个保守的蛋白结构域DUF4123,于是预测含有DUF4123的蛋白可能与分泌有关[35]。随后的结果显示DUF4123蛋白起到伴侣蛋白作用,通过特异性的相互结合促进分泌蛋白分泌。几乎在同时,Pukatzki实验室也报道了DUF4123蛋白相同的功能[39]。由于伴侣蛋白的保守性,我们可以通过伴侣蛋白以及其对应的分泌蛋白的相关性和特异性来预测不保守的分泌蛋白。生物信息学分析表明伴侣蛋白在300多种细菌中存在,而与伴侣蛋白相关的分泌蛋白有1 000多个[35]。伴侣蛋白的发现不仅揭示了一类新的T6SS蛋白分泌途径,而且为解决T6SS非结构性的分泌蛋白很难被识别的问题提供了一个重要的手段。
5 依赖于PAAR的蛋白分泌途径端部蛋白由VgrG三聚体和一个折叠成锥形的PAAR蛋白组成。虽然已知带有延伸功能域的PAAR蛋白可以作为效应蛋白,但是PAAR是否可以像VgrG一样作为分泌蛋白的载体并不清楚。在研究伴侣蛋白时,我们发现一个与PAAR结合的分泌蛋白,证实了这种分泌途径的存在[40]。由此,T6SS依赖端部的分泌蛋白转运途径被全部揭示了(图 2)。专属效应蛋白也因此可以比喻为沾在箭头上的毒药,为T6SS这把弓箭增加了威力。

|
| 图 2 T6SS的分泌蛋白和分泌途径 Figure 2 T6SS effectors and their dependent routes of secretion |
|
|
细菌细胞内通常有多个VgrG、PAAR和其装载的效应蛋白。例如霍乱弧菌中有3个VgrG和2个PAAR蛋白,而铜绿假单胞菌里更是有10个VgrG蛋白[36, 40]。由于每个T6SS结构合成时理论上只能最多装载3个VgrG和1个PAAR,对于每个效应蛋白来讲,其分泌需要运载它的VgrG或者PAAR能够被T6SS装配。在多个VgrG和PAAR共存的情况下,是否存在某种机制可以来决定不同VgrG/PAAR/效应蛋白的运载先后顺序还不完全清楚。由于敲除一些VgrG能对其他VgrG分泌的效应蛋白起到促进或者抑制的作用,我们推测分泌蛋白的装配是由层次化的竞争性关系决定的[40]。
6 总结与展望作为一种重要的细菌武器,T6SS对细菌在竞争条件下的生存至关重要,而其对细菌的适应性或者竞争性的功能主要取决于T6SS所运载的分泌蛋白的种类和功能[41]。拥有T6SS的不同细菌在随机混合并相互竞争时,会从混合菌群逐渐演化为由多个局部的同种群落(Kin-only)组成的共生群落,并且可以使细菌群体产生一定的社会性(例如,Cheater细胞的产生)[41]。因此T6SS介导的菌群竞争对研究宏观上微生物的组成和功能至关重要。
国内在T6SS的分泌蛋白作用与机理上的研究也做出了一系列创新性的发现,主要包括T6SS对金属离子的转运[42-44],T6SS抗氧化作用[45],Hcp类效应蛋白[26],磷酸脂酶的功能[46],VgrG结合分泌蛋白的尾端关键序列[37],以及T6SS基因数据库的建立等[47]。
总之,T6SS是细菌中最重要的菌与菌、菌与环境、菌与宿主细胞的相互作用的工具之一。领域内目前对T6SS的分泌途径了解的相对比较清楚,对如何找到分泌蛋白也有一系列的方法[35, 48]。可以预见的是,未来在不同细菌中对T6SS的功能性的研究一定会带来更多新的发现。另外,从对T6SS的发现到端部分泌途径的识别过程来看,经典的微生物遗传学方法仍然是我们探索未知科学问题不可或缺的重要手段。
| [1] |
Chassaing B, Cascales E. Antibacterial weapons: targeted destruction in the microbiota[J]. Trends in Microbiology, 2018, 26(4): 329-338. |
| [2] |
Aoki SK, Pamma R, Hernday AD, et al. Contact-dependent inhibition of growth in Escherichia coli[J]. Science, 2005, 309(5738): 1245-1248. DOI:10.1126/science.1115109 |
| [3] |
Pukatzki S, Ma AT, Sturtevant D, et al. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(5): 1528-1533. DOI:10.1073/pnas.0510322103 |
| [4] |
Mougous JD, Cuff ME, Raunser S, et al. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus[J]. Science, 2006, 312(5779): 1526-1530. DOI:10.1126/science.1128393 |
| [5] |
Ho BT, Dong TG, Mekalanos JJ. A view to a kill: the bacterial type Ⅵ secretion system[J]. Cell Host & Microbe, 2014, 15(1): 9-21. |
| [6] |
Basler M. Type Ⅵ secretion system: secretion by a contractile nanomachine[J]. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 2015, 370(1679): 20150021. DOI:10.1098/rstb.2015.0021 |
| [7] |
Brackmann M, Nazarov S, Wang J, et al. Using force to punch holes: mechanics of contractile nanomachines[J]. Trends in Cell Biology, 2017, 27(9): 623-632. DOI:10.1016/j.tcb.2017.05.003 |
| [8] |
Taylor NMI, van Raaij MJ, Leiman PG. Contractile injection systems of bacteriophages and related systems[J]. Molecular Microbiology, 2018, 108(1): 6-15. |
| [9] |
van Son Nguyen, Logger L, Spinelli S, et al. Type Ⅵ secretion TssK baseplate protein exhibits structural similarity with phage receptor-binding proteins and evolved to bind the membrane complex[J]. Nature Microbiology, 2017, 2: 17103. DOI:10.1038/nmicrobiol.2017.103 |
| [10] |
Leiman PG, Basler M, Ramagopal UA, et al. Type Ⅵ secretion apparatus and phage tail-associated protein complexes share a common evolutionary origin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(11): 4154-4159. DOI:10.1073/pnas.0813360106 |
| [11] |
Shneider MM, Buth SA, Ho BT, et al. PAAR-repeat proteins sharpen and diversify the type Ⅵ secretion system spike[J]. Nature, 2013, 500(7462): 350-353. DOI:10.1038/nature12453 |
| [12] |
Kapitein N, Bönemann G, Pietrosiuk A, et al. ClpV recycles VipA/VipB tubules and prevents non-productive tubule formation to ensure efficient type Ⅵ protein secretion[J]. Molecular Microbiology, 2013, 87(5): 1013-1028. DOI:10.1111/mmi.2013.87.issue-5 |
| [13] |
Bönemann G, Pietrosiuk A, Diemand A, et al. Remodelling of VipA/VipB tubules by ClpV-mediated threading is crucial for type Ⅵ protein secretion[J]. The EMBO Journal, 2009, 28(4): 315-325. DOI:10.1038/emboj.2008.269 |
| [14] |
Basler M, Mekalanos JJ. Type 6 secretion dynamics within and between bacterial cells[J]. Science, 2012, 337(6096): 815. DOI:10.1126/science.1222901 |
| [15] |
Dong TG, Mekalanos JJ. Characterization of the RpoN regulon reveals differential regulation of T6SS and new flagellar operons in Vibrio cholerae O37 strain V52[J]. Nucleic Acids Research, 2012, 40(16): 7766-7775. DOI:10.1093/nar/gks567 |
| [16] |
Zoued A, Durand E, Brunet YR, et al. Priming and polymerization of a bacterial contractile tail structure[J]. Nature, 2016, 531(7592): 59-63. DOI:10.1038/nature17182 |
| [17] |
Santin YG, Doan T, Lebrun R, et al. In vivo TssA proximity labelling during type Ⅵ secretion biogenesis reveals TagA as a protein that stops and holds the sheath[J]. Nature Microbiology, 2018, 3(11): 1304-1313. DOI:10.1038/s41564-018-0234-3 |
| [18] |
Nazarov S, Schneider JP, Brackmann M, et al. Cryo-EM reconstruction of Type Ⅵ secretion system baseplate and sheath distal end[J]. The EMBO Journal, 2018, 37(4): e97103. DOI:10.15252/embj.201797103 |
| [19] |
Wang J, Brackmann M, Castaño-Díez D, et al. Cryo-EM structure of the extended type Ⅵ secretion system sheath-tube complex[J]. Nature Microbiology, 2017, 2(11): 1507-1512. DOI:10.1038/s41564-017-0020-7 |
| [20] |
Hood RD, Singh P, Hsu F, et al. A type Ⅵ secretion system of Pseudomonas aeruginosa targets a toxin to bacteria[J]. Cell Host & Microbe, 2010, 7(1): 25-37. |
| [21] |
Dong TG, Dong S, Catalano C, et al. Generation of reactive oxygen species by lethal attacks from competing microbes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(7): 2181-2186. DOI:10.1073/pnas.1425007112 |
| [22] |
Russell AB, Peterson SB, Mougous JD. Type Ⅵ secretion system effectors: poisons with a purpose[J]. Nature Reviews Microbiology, 2014, 12(2): 137-148. DOI:10.1038/nrmicro3185 |
| [23] |
Pukatzki S, Ma AT, Revel AT, et al. Type Ⅵ secretion system translocates a phage tail spike-like protein into target cells where it cross-links actin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(39): 15508-15513. DOI:10.1073/pnas.0706532104 |
| [24] |
Dong TG, Ho BT, Yoder-Himes DR, et al. Identification of T6SS-dependent effector and immunity proteins by Tn-seq in Vibrio cholerae[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(7): 2623-2628. DOI:10.1073/pnas.1222783110 |
| [25] |
Zheng J, Ho B, Mekalanos JJ. Genetic analysis of anti-amoebae and anti-bacterial activities of the type Ⅵ secretion system in Vibrio cholerae[J]. PLoS One, 2011, 6(8): e23876. DOI:10.1371/journal.pone.0023876 |
| [26] |
Ma JL, Pan ZH, Huang JH, et al. The Hcp proteins fused with diverse extended-toxin domains represent a novel pattern of antibacterial effectors in type Ⅵ secretion systems[J]. Virulence, 2017, 8(7): 1189-1202. DOI:10.1080/21505594.2017.1279374 |
| [27] |
Filloux A, Hachani A, Bleves S. The bacterial type Ⅵ secretion machine: yet another player for protein transport across membranes[J]. Microbiology, 2008, 154: 1570-1583. DOI:10.1099/mic.0.2008/016840-0 |
| [28] |
Pukatzki S, McAuley SB, Miyata ST. The type Ⅵ secretion system: translocation of effectors and effector-domains[J]. Current Opinion in Microbiology, 2009, 12(1): 11-17. DOI:10.1016/j.mib.2008.11.010 |
| [29] |
Ma AT, McAuley S, Pukatzki S, et al. Translocation of a Vibrio cholerae type Ⅵ secretion effector requires bacterial endocytosis by host cells[J]. Cell Host & Microbe, 2009, 5(3): 234-243. |
| [30] |
Zheng J, Leung KY. Dissection of a type Ⅵ secretion system in Edwardsiella tarda[J]. Molecular Microbiology, 2007, 66(5): 1192-1206. DOI:10.1111/mmi.2007.66.issue-5 |
| [31] |
Silverman JM, Agnello DM, Zheng HJ, et al. Haemolysin coregulated protein is an exported receptor and chaperone of Type Ⅵ secretion substrates[J]. Molecular Cell, 2013, 51(5): 584-593. DOI:10.1016/j.molcel.2013.07.025 |
| [32] |
Russell AB, Singh P, Brittnacher M, et al. A widespread bacterial type Ⅵ secretion effector superfamily identified using a heuristic approach[J]. Cell Host & Microbe, 2012, 11(5): 538-549. |
| [33] |
MacIntyre DL, Miyata ST, Kitaoka M, et al. The Vibrio cholerae type Ⅵ secretion system displays antimicrobial properties[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(45): 19520-19524. DOI:10.1073/pnas.1012931107 |
| [34] |
Li M, Le Trong I, Carl MA, et al. Structural basis for type Ⅵ secretion effector recognition by a cognate immunity protein[J]. PLoS Pathogens, 2012, 8(4): e1002613. DOI:10.1371/journal.ppat.1002613 |
| [35] |
Liang XY, Moore R, Wilton M, et al. Identification of divergent type Ⅵ secretion effectors using a conserved chaperone domain[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(29): 9106-9111. DOI:10.1073/pnas.1505317112 |
| [36] |
Hachani A, Allsopp LP, Oduko Y, et al. The VgrG proteins are "à la carte" delivery systems for bacterial type Ⅵ effectors[J]. The Journal of Biological Chemistry, 2014, 289(25): 17872-17884. DOI:10.1074/jbc.M114.563429 |
| [37] |
Bondage DD, Lin JS, Ma LS, et al. VgrG C terminus confers the type Ⅵ effector transport specificity and is required for binding with PAAR and adaptor-effector complex[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(27): E3931-E3940. DOI:10.1073/pnas.1600428113 |
| [38] |
Flaugnatti N, Le TTH, Canaan S, et al. A phospholipase A1 antibacterial Type Ⅵ secretion effector interacts directly with the C-terminal domain of the VgrG spike protein for delivery[J]. Molecular Microbiology, 2016, 99(6): 1099-1118. DOI:10.1111/mmi.13292 |
| [39] |
Unterweger D, Kostiuk B, Ötjengerdes R, et al. Chimeric adaptor proteins translocate diverse type Ⅵ secretion system effectors in Vibrio cholerae[J]. The EMBO Journal, 2015, 34(16): 2198-2210. DOI:10.15252/embj.201591163 |
| [40] |
Burkinshaw BJ, Liang XY, Wong M, et al. A type Ⅵ secretion system effector delivery mechanism dependent on PAAR and a chaperone-co-chaperone complex[J]. Nature Microbiology, 2018, 3(5): 632-640. DOI:10.1038/s41564-018-0144-4 |
| [41] |
Wong MJQ, Liang XY, Smart M, et al. Microbial herd protection mediated by antagonistic interaction in polymicrobial communities[J]. Applied and Environmental Microbiology, 2016, 82(23): 6881-6888. DOI:10.1128/AEM.02210-16 |
| [42] |
Si MR, Zhao C, Burkinshaw B, et al. Manganese scavenging and oxidative stress response mediated by type Ⅵ secretion system in Burkholderia thailandensis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(11): E2233--E2242. DOI:10.1073/pnas.1614902114 |
| [43] |
Wang TT, Si MR, Song YH, et al. Type Ⅵ secretion system transports Zn2+ to combat multiple stresses and host Immunity[J]. PLoS Pathogens, 2015, 11(7): e1005020. DOI:10.1371/journal.ppat.1005020 |
| [44] |
Lin JS, Zhang WP, Cheng JL, et al. A Pseudomonas T6SS effector recruits PQS-containing outer membrane vesicles for iron acquisition[J]. Nature Communications, 2017, 8: 14888. DOI:10.1038/ncomms14888 |
| [45] |
Wan BS, Zhang QF, Ni JJ, et al. Type Ⅵ secretion system contributes to enterohemorrhagic Escherichia coli virulence by secreting catalase against host reactive oxygen species (ROS)[J]. PLoS Pathogens, 2017, 13(3): e1006246. DOI:10.1371/journal.ppat.1006246 |
| [46] |
Jiang F, Waterfield NR, Yang J, et al. A Pseudomonas aeruginosa type Ⅵ secretion phospholipase D effector targets both prokaryotic and eukaryotic cells[J]. Cell Host & Microbe, 2014, 15(5): 600-610. |
| [47] |
Li J, Yao YF, Xu HH, et al. SecReT6: a web-based resource for type Ⅵ secretion systems found in bacteria[J]. Environmental Microbiology, 2015, 17(7): 2196-2202. DOI:10.1111/1462-2920.12794 |
| [48] |
Lien YW, Lai EM. Type Ⅵ secretion effectors: methodologies and biology[J]. Frontiers in Cellular and Infection Microbiology, 2017, 7: 254. DOI:10.3389/fcimb.2017.00254 |
 2019, Vol. 46
2019, Vol. 46