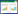扩展功能
文章信息
- 马润亭, 郭树奇, 王威, 张雪洪
- MA Run-Ting, GUO Shu-Qi, WANG Wei, ZHANG Xue-Hong
- 绿针假单胞菌GP72中aurI/aurR系统调控功能
- aurI/aurR system regulatory function in Pseudomonas chlororaphis GP72
- 微生物学通报, 2019, 46(2): 252-260
- Microbiology China, 2019, 46(2): 252-260
- DOI: 10.13344/j.microbiol.china.180240
-
文章历史
- 收稿日期: 2018-03-27
- 接受日期: 2018-05-08
- 网络首发日期: 2018-06-08
吩嗪类化合物是一类含氮的杂环化合物,属于芳香族次级代谢产物,天然吩嗪类化合物具有广谱抑菌活性,这类抗生素具有环境兼容性好、毒性低等特点,大多具有良好的应用前景[1-2]。假单胞菌属(Pseudomonas)是最早被发现的吩嗪类化合物产生菌,同时也是自然界中天然吩嗪类化合物的主要来源之一。假单胞菌来源的吩嗪次级代谢产物主要有吩嗪-1-羧酸(PCA)、1-羟基吩嗪(1-OH-PHZ)、2-羟基吩嗪(2-OH-PHZ)、绿脓菌素(PYO)以及吩嗪-1-酰胺(PCN)等[3],先由保守的吩嗪合成基因簇phzABCDEFG合成PCA,再经修饰基因作用合成其他吩嗪类衍生物[4-5]。
吩嗪类化合物的生物合成普遍是以莽草酸代谢途径的终产物分支酸为起点[3],其生物合成受到复杂的调控网络调控,随着人们对吩嗪类化合物生产菌株的深入研究,发现主要存在双元调控系统、群体感应系统、小RNA控制的转录后调控等[6]。双元调控系统在吩嗪类化合物的合成中起着关键作用,典型的双元调控系统包括一个跨膜蛋白激酶和一个细胞质内调节蛋白两部分,蛋白激酶感应外界环境的变化,进而调控相关基因的表达[7],例如GacA/GacS、RpeB/RpeA、CzcR/CzcS等。群体感应(Quorum sensing,QS)是细菌数量达到一定数目才会发生的感应现象,一般情况下由信号分子合成酶LuxI合成信号分子(Acyl-homoserine lactone,AHL),AHL可以由细胞内向外扩散,随着菌体密度的不断增加,信号分子浓度超过一定的阈值时,能够与转录调控蛋白LuxR形成复合物,从而启动下游基因的表达[8]。
绿针假单胞菌GP72是一株分离自上海郊区的甜椒根际土壤的吩嗪类化合物产生菌,主要产生PCA和2-OH-PHZ,具有生长迅速、环境友好等特点,是一株很好的生防菌株[9]。相关文献[10-12]表明,假单胞菌中存在aurI/aurR双元调控系统,属于一对群体感应基因。目前该系统只在Pseudomonas chlororaphis subsp. aurantiaca StFRB508 (StFRB508)和Pseudomonas chlororaphis subsp. aurantiaca PB-St2 (PB-St2)中有过报道[10-12]。aurI可以产生多种信号分子AHL,与AurR蛋白结合共同调控次级代谢产物吩嗪的合成。信号分子可用指示菌紫色杆菌(Chromobacterium violaceum) CV026和根癌农杆菌(Agrobacterium tumefaciens) NTL4检测。通过基因组比对发现,GP72中存在aurI/aurR双元调控系统,本文研究该双元调控系统在GP72中的调控作用。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒及引物研究所用的菌株、质粒及引物见表 1。
| Materials | Genotype, relevant characteristics and sequence (5′→3′) | Source |
| E. coli | ||
| DH5α | E. coli F-Ф80lacZΔM15 Δ(lacZYA-argF) U169 recA1 endA1 hsdR17 (rk-mk-) phoA supE44 thi-1 gyrA96 relA1 | Lab stock |
| S17-1(λpir) | res- pro mod+ integrated copy of RP4, mob+, used for incorporating constructs into P. chlororaphis | Lab stock |
| Strains | ||
| GP72 | P. chlororaphis GP72 wild-type strain | Lab stock |
| GP72ΔaurI | aurI in-frame deletion mutant of GP72 | This study |
| GP72ΔaurR | aurR in-frame deletion mutant of GP72 | This study |
| GP72ΔaurIΔaurR | aurI/aurR in-frame deletion mutant of GP72 | This study |
| Plasmids | ||
| pBbB5K-GFP | pBBR1; Kmr lacI Plac-UV5 | Lab stock |
| pBbB5K-aurI | Plasmid for aurI heterologous expression | This study |
| pBbB5K-aurR | Plasmid for aurR heterologous expression | This study |
| pK18mobsacB | Broad-host-range gene replacement vector, sacB, Kmr | Lab stock |
| pK18-aurI | pK18mobsacB containing aurI flanking region | This study |
| pK18-aurR | pK18mobsacB containing aurR flanking region | This study |
| pK18-aurI/aurR | pK18mobsacB containing aurI/aurR flanking region | This study |
| pME6522 | pVS1-p15A shuttle vector for constructing the transcriptional lacA fusion, Tcr | Lab stock |
| pME6522-phz | pME6522 containing promoter region of phenazine synthesis gene cluster | Lab stock |
| Primers | ||
| GaurIF | ATGGATAGTCGACTAAAATACTCGG | This study |
| GaurIR | TCAGAGGATGCCCTGGCG | This study |
| AurIF1 | TAACCAGTTACAACCACCCGG | This study |
| AurIR1 | CGCAGGCCATACAAATCGG | This study |
| AurIF2 | CGCCTGAATCAGAGGATGCC | This study |
| AurIR2 | GCGAAGTGGCCCCTCTTATT | This study |
| AurRF1 | ACGAGCGCACCACCTACCT | This study |
| AurRR1 | GCCAGGGCATCCTCTGATT | This study |
| AurRF2 | TCGACTATCCATGTCATGAGCTC | This study |
| AurRR2 | TACAGCCAGATTGCCGCC | This study |
| AurIRF1 | TAACCAGTTACAACCACCCG | This study |
| AurIRR1 | AGTCGAGCGCGTGAAATT | This study |
| AurIRF2 | TCGACTATCCATGTCATGAGC | This study |
| AurIRR2 | GGAACCCGATCTCGATCAT | This study |
| Note: r: Antibiotics-resistant; Km: Kanamycin; Tc: Tetracycline. | ||
LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0。固体培养基加琼脂15.0 g/L。
KB培养基(g/L):蛋白胨20.0,甘油15.0 mL,MgSO4 0.732,K2HPO4 0.514。固体培养基加琼脂15.0 g/L。
MM培养基(g/L):KH2PO4 4.5,K2HPO4 10.5,甘露醇2.0,硫酸铵(NH4)2SO4 2.0,七水合硫酸镁0.16,再加入5 mg/mL七水合硫酸亚铁1 mL,11 mg/mL二水合氯化钙1 mL,2 mg/mL四水合氯化锰1 mL。1/2LB为各成分减为原来的一半配制。高压蒸汽1×105 Pa灭菌30 min。培养基中抗生素浓度(mg/L):氨苄霉素(Amp) 100,卡那霉素(Km) 50,庆大霉素(Gm) 100,四环素(Tc) 30。
大肠杆菌在37 ℃、200 r/min培养,假单胞菌在28 ℃、180 r/min培养。根癌农杆菌NTL4和紫色杆菌CV026均在28 ℃条件下培养。
1.1.3 主要试剂和仪器Taq DNA聚合酶、Solution I连接酶、KOD-Plus-Neo高保真聚合酶、各种限制性内切酶、DNA Marker,TaKaRa公司;DNA纯化试剂盒、质粒抽提试剂盒、基因组DNA提取试剂盒,北京全式金生物技术有限公司;IPTG、X-gal、抗生素、乙腈,生工生物工程(上海)股份有限公司。
旋转蒸发仪,上海亚荣生化仪器厂;安捷伦HPLC、分析柱为反相C18色谱柱,安捷伦公司。
1.1.4 引物和PCR反应根据绿针假单胞菌GP72基因组序列设计引物(表 1),委托上海华津生物技术有限公司合成。以克隆aurI基因为例,GP72基因组为模板,通过PCR扩增全长的aurI基因的编码序列。片段扩增用KOD-Plus-Neo高保真聚合酶。PCR反应体系(50.0 μL):GP72基因组模板(10 mg/L) 0.5 μL,KOD酶(1 U/μL) 1 μL,10×Buffer 5 μL,MgCl2 3 μL,dNTPs (2.5 mmol/L) 5 μL,引物F和R (10 μmol/L)各1.5 μL,DMSO 1.5 μL,加双蒸水31 μL。PCR反应条件:94 ℃ 30 min;94 ℃ 10 s,58 ℃ 30 s (退火温度比Tm值低3 ℃),68 ℃ 50 s (1 min/kb,根据片段长度设置延伸时间),30个循环;68 ℃ 10 min。
1.2 方法 1.2.1 构建异源表达的大肠杆菌pBbB5K-aurI以GP72基因组为模板,设计克隆aurI的一对引物(表 1中GaurIF及GaurIR),通过PCR扩增目的基因aurI的序列,克隆片段与pBbB5K质粒分别用限制性内切酶EcoR I与Xho I进行双酶切,接下来用Solution I酶连接过夜,构建表达质粒pBbB5K-aurI。将表达质粒转化大肠杆菌DH5a感受态细胞,在LB平板上涂板,培养过夜。挑取白色克隆,PCR验证,PCR产物测序。其中基因组提取、质粒抽提、酶反应、DNA片段回收、连接、感受态细胞制备等均参照北京全式金生物技术有限公司相关试剂盒说明书进行,DNA测序委托上海桑尼生物科技有限公司完成。
1.2.2 信号分子的萃取及报告菌株的检测将包含表达质粒pBbB5K-aurI的大肠杆菌DH5α接种过夜培养,取适量菌液转接至100 mL的LB发酵瓶中,加卡那霉素100 μL,16 ℃、180 r/min培养至OD600为0.1后加100 μL诱导剂IPTG。再将温度调至37 ℃、180 r/min发酵培养16 h。取所有发酵液以12 000 r/min离心10 min去除菌体。用3倍体积的乙酸乙酯萃取上清液2次,旋转蒸发仪蒸干浓缩,放通风橱中干燥,再用1 mL乙腈溶解,12 000 r/min离心5 min去除沉淀,置于-20 ℃保存。
分别挑选活化过的NTL4和CV026单菌落至LB液体培养基中28 ℃、180 r/min培养过夜。再分别取100 mL的MM固体培养基和1/2LB固体培养基融化,温度降至45 ℃左右,当NTL4和CV026长至OD600为4.0-5.0时,分别将10 mL菌液全部加入MM培养基和1/2LB培养基,混合均匀倒平板。平板在超净台中打孔,发酵液蒸干样品用乙腈溶解,取20 μL加入检测平板的孔内,20 μL乙腈作为阴性对照。在28 ℃培养箱中培养36 h,观察平板颜色变化[13-14]。
1.2.3 无痕敲除aurI、aurR、aurI/aurR基因片段敲除方法以aurI基因为例,无痕敲除通过同源重组实现。在aurI基因的上下游分别取大约500 bp的片段作为上下游同源臂,各设计一对引物。以GP72基因组为模板,分别扩增上下游同源臂;再以上下游同源臂为模板,扩增融合PCR产物,该PCR片段为上下游同源臂的融合片段,不包含aurI基因。融合片段和pK18质粒酶切酶连,方法同异源表达质粒的构建,测序验证得到敲除质粒pK18-aurI。接下来敲除质粒转化到E. coli S17中,以此作为供体菌,GP72野生型菌株作为受体菌,在无抗平板上共培养。质粒pK18-aurI转入GP72后,不能在染色体外自主复制,可与GP72基因组发生同源重组。用含Amp和Km抗生素的双抗性平板筛选单交换菌株,再在含10%蔗糖的LB平板上促使其完成双交换,点板法将蔗糖平板上的单克隆分别影印在含Amp和Km抗生素的平板上,在Amp平板上生长而在Km平板不生长,即为发生双交换的菌株,PCR验证。无痕敲除aurR、aurI/aurR基因片段方法类似。
1.2.4 构建突变株的回补菌株构建表达质粒pBbB5K-aurI、pBbB5K-aurR,制备GP72ΔaurI、GP72ΔaurR电转感受态。通过电击转化将表达质粒分别转入对应敲除株,空质粒pBbB5K电转GP72ΔaurI,GP72ΔaurR作为对照,发酵测定回补菌株的总吩嗪产量。质粒pBbB5K需要诱导才能启动表达,开始发酵4 h后,菌液OD600在0.4-0.6之间,添加诱导剂IPTG至终浓度为1 mmol/L。
1.2.5 突变菌株和回补菌株生长曲线及总吩嗪产量的测定OD600值的测定、吩嗪类化合物(含PCA、2-OH-PHZ)的萃取和HPLC测定方法参照文献[15]。分别将野生型菌株和突变菌株在KB培养基中活化,接种后培养过夜,再接入发酵瓶发酵培养,发酵条件为28 ℃、180 r/min。每隔12 h取样,测菌液OD600值,发酵液12 000 r/min离心5 min,取上清液,用乙酸乙酯萃取上清液中的吩嗪类化合物,高效液相色谱(HPLC)分析,测定吩嗪类化合物的总含量。每个样品设3个平行。
1.2.6 β-半乳糖苷酶活性的测定质粒pME6522上存在编码β-半乳糖苷酶的LacZ基因。将吩嗪合成基因簇的启动子通过酶切酶连在LacZ基因的上游,构建转录融合质粒pME6522-phz,如图 1所示。野生型GP72、GP72ΔaurI、GP72ΔaurR中的β-半乳糖苷酶活性可以反映吩嗪合成基因启动子的表达水平。通过测定酶活,研究aurI/aurR双元系统对吩嗪合成基因启动子的调控作用。酶活测定按照文献[16]方法进行,每个样品设3个平行。

|
| 图 1 pME6522-phz转录融合质粒构建示意图 Figure 1 Sketch map of the constructing translational fusion plasmid pME6522-phz |
|
|
为了研究菌株GP72中aurI信号分子的合成情况,构建了aurI的异源表达质粒,在大肠杆菌DH5α表达后萃取其发酵液。用报告菌株NTL4和CV026平板检测,NTL4可以检测长链信号分子,CV026可以检测短链信号分子。实验结果如图 2所示。aurI产生的信号分子能使NTL4平板变蓝色,CV026平板变紫色,证明aurI基因能同时产生长链信号分子和短链信号分子,乙腈对照组平板周围均无变色。
|
| 图 2 MM培养基中NTL4指示菌显色(A)和空白对照组(B),1/2LB培养基中CV026指示菌显色(C)和空白对照组(D) Figure 2 NTL4 indicator bacteria in MM medium (A) and blank control group (B), CV026 indicator bacteria in 1/2LB medium (C) and blank control group (D) |
|
|
相关文献[10-11]研究表明aurI/aurR是存在于假单胞菌中的另一组群体感应元件,在绿针假单胞菌StFRB508中aurI对次级代谢产物产量无明显影响。为了研究绿针假单胞菌GP72中该双元调控系统对次级代谢产物吩嗪的调控作用,构建了敲除突变株GP72ΔaurI、GP72ΔaurR、GP72ΔaurIΔaurR。以上游同源臂的F端引物和下游同源臂的R端引物进行PCR验证,敲除突变株的PCR产物条带更小,结果如图 3所示。

|
| 图 3 敲除株GP72ΔaurI (A)、GP72ΔaurR (B)、GP72ΔaurIΔaurR (C)的电泳验证图谱 Figure 3 Verification of GP72ΔaurI (A), GP72ΔaurR (B), GP72ΔaurIΔaurR (C) by PCR 注:M1:DL8000 marker;M2:DL10000 marker;1:野生型;2:敲除株GP72ΔaurI;3:敲除株GP72ΔaurR;4:敲除株GP72ΔaurIΔaurR. Note: M1: DL8000 marker; M2: DL10000 marker; 1: Wild type; 2: GP72ΔaurI mutant; 3: GP72ΔaurR mutant; 4: GP72ΔaurIΔaurR mutant. |
|
|
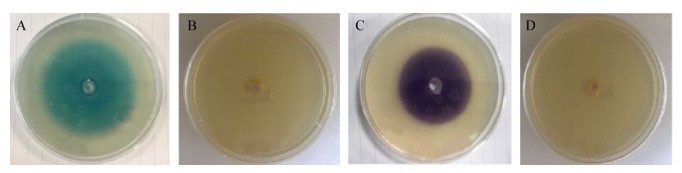
假单胞菌GP72产生的吩嗪类抗生素主要有PCA和2-OH-PHZ。通过对突变菌株的发酵研究了aurI/aurR对于菌株生长及次级代谢产物PCA和2-OH-PHZ合成的影响。结果如图 4所示,突变株的生长情况和野生型无异,说明aurI/aurR对菌株的生长无明显影响,aurI基因产生的信号分子和AurR蛋白结合调控吩嗪基因簇的表达,不影响其生长。当单独敲除aurI、aurR或者同时敲除aurI/aurR,突变株的吩嗪产量均有明显提高,约是野生型的4倍。
|
| 图 4 GP72、GP72ΔaurI、GP72ΔaurR、GP72ΔaurIΔaurR菌株生长曲线(A)及吩嗪类抗生素的产量(B) Figure 4 Cell growth (OD600) (A) and phenazines production (B) of the wild-type GP72, mutant strains GP72ΔaurI, GP72ΔaurR, and GP72ΔaurIΔaurR |
|
|
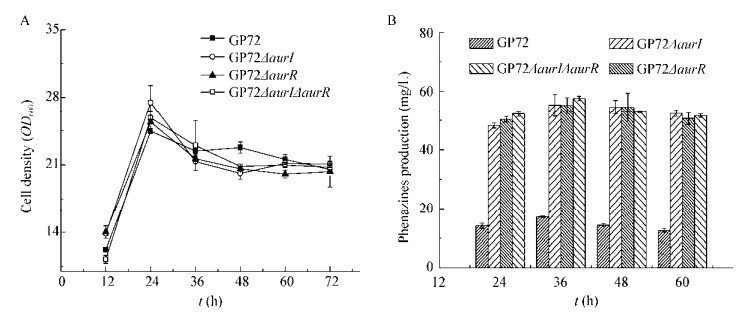
为了确定突变株的吩嗪产量升高是由敲除aurI、aurR引起的,将表达质粒pBbB5K-aurI、pBbB5K-aurR分别电转入对应敲除株GP72ΔaurI、GP72ΔaurR,得到回补菌株GP72AI/RI、GP72AR/RR,空质粒pBbB5K电转GP72ΔaurI、GP72ΔaurR的菌株GP72AI/pBbB5K、GP72AR/ pBbB5K作为对照,发酵结果如图 5所示,回补表达中总吩嗪的产量基本降为野生型水平,说明吩嗪产量的升高是由aurI、aurR的敲除引起的。
|
| 图 5 野生型菌株GP72、回补菌株GP72AI/RI、GP72AR/RR生长曲线(A)及吩嗪类抗生素的产量(B) Figure 5 Cell growth (OD600) (A) and phenazines production (B) of the wild-type GP72, complement strain GP72AI/RI, GP72AR/RR |
|
|
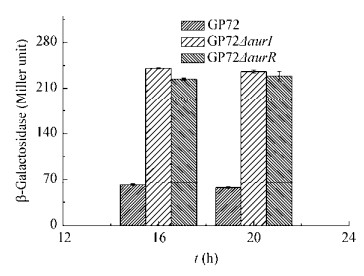
aurI/aurR对吩嗪合成基因簇转录的调控通过β-半乳糖苷酶活性反应,结果图 6所示。GP72野生型菌株中酶活大约为60 Miller unit,敲除突变株GP72ΔaurI、GP72ΔaurR中的酶活约是240 Miller unit,是野生型的4倍左右。说明分别敲除aurI/aurR双元调控系统基因都会引起吩嗪合成基因簇启动子的转录水平升高,从而引起吩嗪类物质产量的升高。
|
| 图 6 aurI/aurR对吩嗪合成基因簇启动子表达的调控 Figure 6 Regulation of aurI/aurR on the expression of phenazine gene cluster |
|
|
绿针假单胞菌GP72能产生PCA和2-OH-PHZ,具有很好的生防应用前景,因此,研究其合成的调控机制有很大的意义。据文献报道,假单胞菌StFRB508中存在双元调控系统aurI/aurR,其中aurI基因能产生信号分子C6-HSL和3-Oxo-C6- HSL[10-11]。假单胞菌PB-St2基因组上aurI基因可以产生信号分子C4-HSL、C6-HSL、C8-HSL、3-Oxo-C6-HSL、3-Oxo-C8-HSL[12]。通过对GP72基因组序列比对分析,发现其基因组上也存在aurI/aurR系统,我们的研究表明,指示菌显色实验证明aurI基因可以产生信号分子。液质联用高分辨质谱分析显示aurI基因产生信号分子C5-HSL、C6-HSL、3-OH-C8-HSL、3-Oxo-C6-HSL、3-Oxo-C8-HSL (数据未显示)。3株菌中aurI基因序列的相似性高于97%,且都产生信号分子,说明aurI/aurR系统在假单胞菌中是相对保守的。因信号分子种类和浓度差异,aurI基因的调控途径有所区别。
GP72和StFRB508两菌株的aurI基因相似性为97.83%,氨基酸的相似性为97%,但对吩嗪合成的调控方式不同。在GP72中分别敲除aurI和aurR基因,同时敲除aurI/aurR基因,次级代谢产物吩嗪类物质产量都升高,均为野生型的4倍左右,说明aurI基因产生的AHL可能是和AurR蛋白直接结合调控下游基因,进而调控吩嗪的合成,二者敲除一个或者同时敲除对产物产量的影响是相同的。β-半乳糖苷酶活性反应实验也说明aurI和aurR基因对吩嗪合成的调控作用是一致的,二者负调控吩嗪的合成。GP72中phzI/phzR系统正调控吩嗪合成[17],aurI/aurR系统负调控吩嗪合成,两个系统之间是否存在相互作用还有待研究,但从菌的生长影响分析,aurI/aurR系统对GP72的影响不如phzI/phzR系统。在StFRB508中,aurI/aurR和phzI/phzR双元调控系统均正调控吩嗪物质的产量,当两个系统同时存在时,phzI/phzR起主要调控作用,aurI/aurR对吩嗪类物质的调控作用很小;当phzI/phzR被破坏后,aurI/aurR对吩嗪类物质的影响变大[10-11]。
假单胞菌中存在着复杂的调控机制,P. chlororaphis 449和P. aureofaciens 30-84菌株中的双元调控系统csaI/csaR会影响细胞表面特性[18-19]。假单胞菌30-84的rpeA/rpeB系统和phzI/phzR系统互相作用调节吩嗪合成基因的表达[20]。在30-84菌株中,gacA或gacS基因的缺失不能合成吩嗪类物质,其通过直接调节RpoS及非编码的sRNA (RsmX、RsmY、RsmZ)间接调控吩嗪的生产[21],RsmA和RsmE还会影响诸如hcnA、phlA、aprA等次级代谢基因的表达[22]。本研究初步鉴定了GP72菌株中的aurI/aurR双元调控系统在转录水平上负调控吩嗪合成基因的表达,相关结果在一定程度上阐释了GP72中的调控机制,为后续进一步研究aurI/aurR系统和其他双元调控系统的调控关系提供了理论基础,在此基础上可以将此系统作为遗传改造的靶标,为构建高产吩嗪及吩嗪衍生物的工程菌株提供理论依据。
| [1] |
Chin-A-Woeng TFC, Bloemberg GV, Lugtenberg BJJ. Phenazines and their role in biocontrol by Pseudomonas bacteria[J]. New Phytologist, 2003, 157(3): 503-523. DOI:10.1046/j.1469-8137.2003.00686.x |
| [2] |
Pierson Ⅲ LS, Pierson EA. Metabolism and function of phenazines in bacteria: impacts on the behavior of bacteria in the environment and biotechnological processes[J]. Applied Microbiology and Biotechnology, 2010, 86(6): 1659-1670. DOI:10.1007/s00253-010-2509-3 |
| [3] |
Mavrodi DV, Blankenfeldt W, Thomashow LS. Phenazine compounds in Fluorescent pseudomonas spp. biosynthesis and regulation[J]. Annual Review of Phytopathology, 2006, 44: 417-445. DOI:10.1146/annurev.phyto.44.013106.145710 |
| [4] |
Delaney SM, Mavrodi DV, Bonsall RF, et al. phzO, a gene for biosynthesis of 2-hydroxylated phenazine compounds in Pseudomonas aureofaciens 30-84[J]. Journal of Bacteriology, 2001, 183(1): 318-327. DOI:10.1128/JB.183.1.318-327.2001 |
| [5] |
Chin-A-Woeng TFC, Thomas-Oates JE, Lugtenberg BJJ, et al. Introduction of the phzH gene of Pseudomonas chlororaphis PCL1391 extends the range of biocontrol ability of phenazine-1-carboxylic acid-producing Pseudomonas spp. strains[J]. Molecular Plant-Microbe Interactions, 2001, 14(8): 1006-1015. DOI:10.1094/MPMI.2001.14.8.1006 |
| [6] |
Heeb S, Blumer C, Haas D. Regulatory RNA as mediator in GacA/RsmA-dependent global control of exoproduct formation in Pseudomonas fluorescens CHA0[J]. Journal of Bacteriology, 2002, 184(4): 1046-1056. DOI:10.1128/jb.184.4.1046-1056.2002 |
| [7] |
Stock AM, Robinson VL, Goudreau PN. Two-component signal transduction[J]. Annual Review of Biochemistry, 2010, 69(1): 183-215. |
| [8] |
de Maeyer K, D'aes J, Hua GKH, et al. N-Acylhomoserine lactone quorum-sensing signalling in antagonistic phenazine-producing Pseudomonas isolates from the red cocoyam rhizosphere[J]. Microbiology, 2011, 157(2): 459-472. |
| [9] |
Liu HM, He YJ, Jiang HX, et al. Characterization of a phenazine-producing strain Pseudomonas chlororaphis GP72 with broad-spectrum antifungal activity from green pepper rhizosphere[J]. Current Microbiology, 2007, 54(4): 302-306. |
| [10] |
Morohoshi T, Wang WZ, Suto T, et al. Phenazine antibiotic production and antifungal activity are regulated by multiple quorum-sensing systems in Pseudomonas chlororaphis subsp. aurantiaca StFRB508[J]. Journal of Bioscience and Bioengineering, 2013, 116(5): 580-584. DOI:10.1016/j.jbiosc.2013.04.022 |
| [11] |
Morohoshi T, Yamaguchi T, Xie XN, et al. Complete genome sequence of Pseudomonas chlororaphis subsp. aurantiaca reveals a triplicate quorum-sensing mechanism for regulation of phenazine production[J]. Microbes and Environments, 2017, 32(1): 47-53. DOI:10.1264/jsme2.ME16162 |
| [12] |
Bauer JS, Hauck N, Christof L, et al. The systematic investigation of the quorum sensing system of the biocontrol strain Pseudomonas chlororaphis subsp. aurantiaca PB-St2 unveils aurI to be a biosynthetic origin for 3-Oxo-Homoserine lactones[J]. PLoS One, 2016, 11(11): e0167002. DOI:10.1371/journal.pone.0167002 |
| [13] |
Ouyang Y, Peng HS, Wang W, et al. Function of the PhzI-PhzR system in Pseudomonas chlororaphis HT66[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2016, 34(1): 5-10. (in Chinese) 欧阳夷, 彭华松, 王威, 等. 假单胞菌HT66的PhzI-PhzR调控系统的功能研究[J]. 上海交通大学学报:农业科学版, 2016, 34(1): 5-10. |
| [14] |
Sun S, Zhou L, Jin KM, et al. Quorum sensing systems differentially regulate the production of phenazine-1-carboxylic acid in the rhizobacterium Pseudomonas aeruginosa PA1201[J]. Scientific Reports, 2016, 6: 30352. DOI:10.1038/srep30352 |
| [15] |
Huang L, Chen MM, Wang W, et al. Enhanced production of 2-hydroxyphenazine in Pseudomonas chlororaphis GP72[J]. Applied Microbiology and Biotechnology, 2011, 89(1): 169-177. |
| [16] |
Lu JS, Huang XQ, Li K, et al. LysR family transcriptional regulator PqsR as repressor of pyoluteorin biosynthesis and activator of phenazine-1-carboxylic acid biosynthesis in Pseudomonas sp. M18[J]. Journal of Biotechnology, 2009, 143(1): 1-9. |
| [17] |
Peng HS, Ouyang Y, Bilal M, et al. Identification, synthesis and regulatory function of the N-acylated homoserine lactone signals produced by Pseudomonas chlororaphis HT66[J]. Microbial Cell Factories, 2018, 17: 9. DOI:10.1186/s12934-017-0854-y |
| [18] |
Veselova MA, Klein S, Bass IA, et al. Quorum sensing systems of regulation, synthesis of phenazine antibiotics, and antifungal activity in rhizospheric bacterium Pseudomonas chlororaphis 449[J]. Russian Journal of Genetics, 2008, 44(12): 1400-1408. DOI:10.1134/S102279540812003X |
| [19] |
Zhang ZG, Pierson Ⅲ LS. A second quorum-sensing system regulates cell surface properties but not phenazine antibiotic production in Pseudomonas aureofaciens[J]. Applied and Environmental Microbiology, 2001, 67(9): 4305-4315. DOI:10.1128/AEM.67.9.4305-4315.2001 |
| [20] |
Wang DP, Yu JM, Pierson Ⅲ LS, et al. Differential regulation of phenazine biosynthesis by RpeA and RpeB in Pseudomonas chlororaphis 30-84[J]. Microbiology, 2012, 158(Pt 7): 1745-1757. |
| [21] |
Wang DP, Lee SH, Seeve C, et al. Roles of the Gac-Rsm pathway in the regulation of phenazine biosynthesis in Pseudomonas chlororaphis 30-84[J]. MicrobiologyOpen, 2013, 2(3): 505-524. DOI:10.1002/mbo3.2013.2.issue-3 |
| [22] |
Kay E, Dubuis C, Haas D. Three small RNAs jointly ensure secondary metabolism and biocontrol in Pseudomonas fluorescens CHA0[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(47): 17136-17141. DOI:10.1073/pnas.0505673102 |
 2019, Vol. 46
2019, Vol. 46