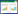扩展功能
文章信息
- 袁雪梅, 王敏, 张强, 白华, 周帆, 刘鹏飞, 张康, 邢继红, 董金皋
- YUAN Xue-Mei, WANG Min, ZHANG Qiang, BAI Hua, ZHOU Fan, LIU Peng-Fei, ZHANG Kang, XING Ji-Hong, DONG Jin-Gao
- 灰葡萄孢丝裂原活化蛋白激酶编码基因bmp1和bmp3的功能
- Function of mitogen-activated protein kinase encoding genes bmp1 and bmp3 in Botrytis cinerea
- 微生物学通报, 2019, 46(2): 243-251
- Microbiology China, 2019, 46(2): 243-251
- DOI: 10.13344/j.microbiol.china.180503
-
文章历史
- 收稿日期: 2018-06-28
- 接受日期: 2018-08-30
- 网络首发日期: 2018-09-11
丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号途径在植物病原真菌有性生殖、细胞壁完整性、菌丝侵染、附着胞形成、致病力和胁迫响应等方面起到非常重要的调控作用[1]。酿酒酵母(Saccharomyces cerevisiae)有5条MAPK信号途径,分别调控有性生殖、菌丝侵入性生长、细胞壁完整性、高渗胁迫响应和子囊孢子的形成[2]。玉米瘤黑粉(Ustilago maydis)的MAPK信号途径参与调控有性生殖和寄生生长过程[3]。稻瘟菌(Magnaporche moryzae)的MAPK信号途径调控附着胞形成的后期阶段及侵入阶段[4]。灰葡萄孢(Botrytis cinerea) MAPK信号途径参与调控病菌生长发育、致病力以及响应胁迫过程,其主要包括3种类型的MAPK编码基因bmp1[5-6]、bmp3[7]和bcsak1[8-9]。bmp1基因的缺失突变体Δbmp1生长速率减慢,分生孢子的产量降低,不能穿透寄主组织,分生孢子可以在寄主植物的表面萌发,但即使在受伤的植物上也不能在宿主组织中定殖,在康乃馨的花朵和西红柿叶片上均不致病[5-6];bmp3基因的缺失突变体Δbmp3的生长速率减慢,分生孢子形成受阻,不能产生菌核,对低渗胁迫、氧化胁迫和苯吡咯的敏感性增强[7];bcsak1基因的缺失突变体Δbcsak1的生长速度下降,不能产生分生孢子,菌核产生量增加,不能穿透未受伤的植物组织,致病力明显降低,对低渗胁迫和氧化胁迫敏感性增强[8-9]。bmp3和bcsak1下游的bcreg1基因与致病力也密切相关,Δbcreg1突变体不产生分生孢子,能够穿透植物组织但不能形成致病斑[10]。TCHK-MAPK信号途径中BOS4、BOS5、BOS2与致病性密切相关,其敲除突变体致病力均完全丧失,BOS5敲除突变体菌丝的生长速率远远低于野生型菌株,虽能够穿透寄主细胞,但是菌丝的形态发生严重畸形[11]。此外,编码MAPK激酶(MAPKK) Ste7、MAPKK激酶(MAPKKK) Ste11、假定MAPK衔接蛋白Ste50的基因和Bmp1下游的Ste12转录因子也影响病菌的致病力、分生孢子的萌发、营养生长和菌核的形成等方面[7, 12]。以上结果均说明灰葡萄孢MAPK信号途径在病菌的生长发育、致病力以及响应胁迫过程中发挥重要的功能。但MAPK信号途径基因在灰葡萄孢中的功能尚未完全阐明,该信号途径对灰葡萄孢的生长发育和致病力的调控机制尚不明确。
为明确灰葡萄孢MAP激酶编码基因bmp1和bmp3在病菌生长发育、致病和响应胁迫过程中的功能,本研究利用RNAi技术构建bmp1和bmp3基因的RNAi突变体,通过将RNAi突变体的表型、致病力和对胁迫处理的敏感性与野生型BC22菌株进行比较,确定bmp1和bmp3基因的功能,为阐明MAPK信号途径对灰葡萄孢生长发育和致病力的调控机制奠定基础,同时为其它植物病原真菌中MAPK信号途径的研究提供参考。
1 材料与方法 1.1 试验材料 1.1.1 菌株和载体灰葡萄孢野生型BC22菌株、RNAi载体pK7GW1WG2、根癌农杆菌AGL-1菌株,均由河北农业大学真菌毒素与植物分子病理学实验室保存。
1.1.2 主要试剂和仪器pCRTM8/GW/TOPO® TA Cloning Kit、Gateway® LR ClonaseTM ⅡEnzyme Mix,Invitrogen公司;高保真聚合酶LA-Taq、dNTPs、大肠杆菌DH5α感受态细胞、PrimeScriptTM RT Reagent Kit with gDNA Eraser (Perfect Real Time),TaKaRa公司;RNA提取试剂Trizol up、壮观霉素、卡那霉素,北京全式金生物技术有限公司;头孢噻肟、草铵膦,Roche生物公司。SPX智能型生化培养箱,宁波江南仪器厂;基因扩增仪,东胜创新生物科技有限公司。
1.2 bmp1和bmp3基因RNAi载体的构建根据bmp1和bmp3基因的cDNA序列设计基因特异性引物(表 1)。提取灰葡萄孢野生型菌株的RNA,反转录合成cDNA,用高保真的LA-Taq对bmp1和bmp3基因的特异片段进行PCR扩增。PCR反应体系(50 μL):模板cDNA 2 μL,10×PCR buffer (含Mg2+) 5 μL,dNTPs (2.5 mmol/L) 8 μL,上、下游引物(10 μmol/L)各1 μL,LA-Taq (5 U/μL) 1 μL,ddH2O 32 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共32个循环;72 ℃ 10 min。PCR扩增产物经1%的琼脂糖凝胶电泳检测后,进行目的条带的回收、克隆。将目的基因片段与Gateway克隆载体pCR8进行连接,连接产物转化大肠杆菌DH5α感受态细胞,利用载体特异性引物M13进行阳性克隆的PCR检测,PCR检测为阳性的克隆进行测序验证,将测序鉴定正确的质粒pCR8-bmp1和pCR8-bmp3分别与RNAi载体pK7GW1WG2进行LR重组反应,反应产物转化大肠杆菌DH5α感受态细胞,阳性克隆进行PCR检测和测序验证后进行重组质粒pK7GW1WG2-bmp1和pK7GW1WG2-bmp3的提取。
| 基因名称 Genes name |
引物名称 Primers name |
引物序列 Primers sequence (5′→3′) |
产物大小 Product size (bp) |
| bmp1 | bmp1-F | AGCTCGTGCGCCTAATCCCGCCTCG | 279 |
| bmp1-R | ACTCATAGTTTCTTGGCTTCTGGATGT | ||
| bmp3 | bmp3-F | ATGGCAGACCTGCAAGGAAGAAAGGTC | 272 |
| bmp3-R | ATATCCATATCATAAAGGCAGGTAA | ||
| Kan | Kan-F | TGTAAAACGACGGCCAG | 620 |
| Kan-R | TTACGCCCCGCCCTGCCACTCAT | ||
| Tubulin | Tubulin-F | TCTGGCGAGCACGGTCTTGACGGTT | 141 |
| Tubulin-R | CTGGCTCCAAATCGACGAGGACGGCA | ||
| M13 | M13-F | TGTAAAACGACGGCCAG | 316 |
| M13-R | CCAGGAAACAGCTATGACC |
将重组质粒pK7GW1WG2-bmp1、pK7GW1WG2-bmp3分别转化农杆菌AGL-1的感受态细胞后,与灰葡萄孢野生型BC22菌株的分生孢子悬浮液(1×106个/mL)混合,涂布于IAM培养基上的硝酸纤维素膜上,20 ℃培养48 h,将硝酸纤维素膜转移至含有200 μg/mL头孢噻肟和100 μg/mL草铵膦的LCA培养基上,20 ℃培养7-12 d,直至长出转化子。
1.4 转化子的筛选与鉴定利用LCA筛选培养基对转化子进行多次抗性筛选。利用PCR和Real-time PCR技术对所获得的转化子进行分子鉴定。以各转化子的DNA为模板,利用RNAi载体的kan基因特异引物进行PCR检测。同时,以各转化子的cDNA为模板,利用bmp1和bmp3基因的特异引物进行Real-time PCR检测,以确定转化子中bmp1和bmp3基因的表达水平是否受到干扰。
1.5 RNAi突变体的表型分析将灰葡萄孢野生型BC22菌株和bmp1、bmp3基因的RNAi突变体分别接种到PDA培养基上,20 ℃黑暗条件下培养,每隔24 h测量一次菌落直径,计算各菌株的生长速率。同时进行菌落形态和菌丝形态的观察。
在培养15 d的各菌株培养皿中分别加入10 mL无菌去离子水,并以毛笔轻刷菌落表面,获得各菌株的菌体悬浮液,4层纱布过滤去除菌丝体,获得其分生孢子悬浮液,用血球计数板统计各菌株的分生孢子产量。
1.6 RNAi突变体的致病力测定将灰葡萄孢野生型BC22菌株和bmp1、bmp3基因的RNAi突变体的菌盘(Φ=8 mm)分别接种到番茄果实的表面,进行致病力测定。接种后的番茄果实置于20 ℃保湿处理,每天观察番茄接种部位的发病情况,重复3次。
1.7 RNAi突变体的穿透能力测定将灰葡萄孢野生型BC22菌株和bmp1、bmp3基因的RNAi突变体菌株分别定量接种到铺有玻璃纸的水琼脂培养上,在20 ℃条件下黑暗培养,显微镜下观察各菌株穿透玻璃纸的情况。
1.8 RNAi突变体对氧化胁迫的敏感性测定将灰葡萄孢野生型BC22菌株和bmp1、bmp3基因的RNAi突变体菌株分别接种于含10 mmol/L H2O2和250 μmol/L甲萘醌的PDA培养基上,观察各菌株对氧化胁迫的敏感性情况,并进行抑制率计算。
2 结果与分析 2.1 bmp1和bmp3基因RNAi载体的构建及农杆菌的遗传转化利用Gateway技术成功获得bmp1和bmp3基因的RNAi载体pK7GW1WG2-bmp1和pK7GW1WG2-bmp3 (图 1A)。将bmp1和bmp3基因的RNAi载体分别转化农杆菌AGL-1,菌落PCR检测均获得了目的条带(图 1B、C),表明bmp1和bmp3基因的RNAi载体成功转入农杆菌AGL-1中。
|
| 图 1 bmp1和bmp3基因RNAi载体的构建及农杆菌转化的PCR鉴定 Figure 1 Construction and Agrobacterium transformation of bmp1 and bmp3 genes RNAi vectors 注:A:bmp1和bmp3基因的RNAi载体图谱;B:pK7GW1WG2-bmp1转化农杆菌的PCR鉴定;C:pK7GW1WG2-bmp3转化农杆菌的PCR鉴定. M:DNA marker. Note: A: RNAi vector of bmp1 and bmp3 gene; B: PCR identification of Agrobacterium transformed pK7GW1WG2-bmp1; C: PCR identification of Agrobacterium transformed pK7GW1WG2-bmp3. M: DNA marker. |
|
|
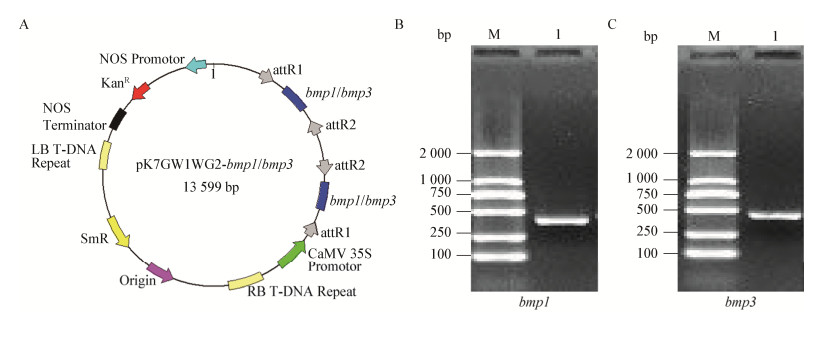
利用农杆菌介导的遗传转化方法,将bmp1和bmp3基因的RNAi载体pK7GW1WG2-bmp1和pK7GW1WG2-bmp3分别转化灰葡萄孢野生型BC22菌株,经过多次的抗性筛选后分别获得了bmp1和bmp3基因的3株RNAi转化子ibmp1-1、ibmp1-2和ibmp1-3以及ibmp3-1、ibmp3-2和ibmp3-3。PCR鉴定转化子发现各转化子中均获得了单一的目的条带,而野生型BC22菌株中无扩增产物(图 2A、B)。进一步利用Real-time PCR技术检测RNAi转化子中bmp1和bmp3基因的表达水平,发现转化子中bmp1和bmp3基因的表达水平均显著低于野生型,转化子ibmp1-1、ibmp1-2和ibmp1-3中bmp1基因的表达水平分别为野生型的0.47、0.49和0.29倍(图 2C),转化子ibmp3-1、ibmp3-2和ibmp3-3中bmp3基因的表达水平分别为野生型的0.01、0.68和0.49倍(图 2D),表明bmp1和bmp3基因的RNAi突变体构建成功。
|
| 图 2 bmp1和bmp3基因RNAi转化子的鉴定 Figure 2 Identification of bmp1 and bmp3 genes RNAi transformants 注:A:bmp1基因RNAi转化子的PCR鉴定;M:Marker;WT:野生型BC22;1:转化子ibmp1-1;2:转化子ibmp1-2;3:转化子ibmp1-3. B:bmp3基因RNAi转化子的PCR鉴定;M:Marker;WT:野生型BC22;1:转化子ibmp3-1;2:转化子ibmp3-2;3:转化子ibmp3-3. C:bmp1基因RNAi转化子中bmp1基因的表达分析. D:bmp3基因RNAi转化子中bmp3基因的表达分析. Note: A: PCR identification of bmp1 gene RNAi transformants; M: Marker; WT: Wild type BC22; 1: Transformant ibmp1-1; 2: Transformant ibmp1-2; 3: Transformant ibmp1-3. B: PCR identification of bmp3 gene RNAi transformants; M: Marker; WT: Wild-type BC22; 1: Transformant ibmp3-1; 2: Transformant ibmp3-2; 3: Transformant ibmp3-3. C: Expression analysis of bmp1 gene in RNAi transformants. D: Expression analysis of bmp3 gene in RNAi transformants. |
|
|
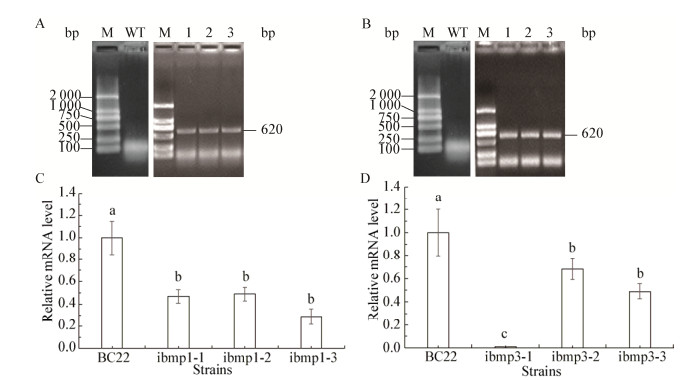
对bmp1和bmp3基因RNAi突变体的菌落形态、菌丝形态、生长速率、分生孢子产量进行分析的结果发现,与野生型BC22菌株相比,培养3 d的bmp1基因RNAi突变体的菌落和菌丝形态没有明显变化(图 3A),菌丝的生长速率明显减慢(图 3B),分生孢子产量显著降低(图 3C);bmp3基因RNAi突变体的菌落和菌丝形态也没有明显变化(图 3D),生长速率与野生型没有明显差别(图 3E),不产生分生孢子(图 3F)。结果表明,bmp1基因正调控病菌的生长、分生孢子的形成;bmp3基因正调控病菌分生孢子的形成,对病菌的生长没有影响。

|
| 图 3 bmp1和bmp3基因RNAi突变体的表型分析 Figure 3 Phenotype analysis of bmp1 and bmp3 genes RNAi mutants 注:A:bmp1基因RNAi突变体的菌落和菌丝形态;B:bmp1基因RNAi突变体的生长速率;C:bmp1基因RNAi突变体的产孢量;D:bmp3基因RNAi突变体的菌落和菌丝形态;E:bmp3基因RNAi突变体的生长速率;F:bmp3基因RNAi突变体的产孢量. Note: A: Colony and mycelial morphology of bmp1 gene RNAi mutants; B: Growth rate of bmp1 gene RNAi mutants; C: Conidiation of bmp1 gene RNAi mutants; D: Colony and mycelial morphology of bmp3 gene RNAi mutants; E: Growth rate of bmp3 gene RNAi mutants; F: Conidiation of bmp3 gene RNAi mutants. |
|
|
将野生型BC22和bmp1、bmp3基因的RNAi突变体分别接种到番茄果实的表面进行了致病力测定,结果发现,接种3 d后,野生型BC22的番茄果实表面出现了大面积的水渍状病斑,而接种bmp1和bmp3基因RNAi突变体的番茄果实表面均未出现明显的病斑(图 4),表明bmp1和bmp3基因正调控灰葡萄孢的致病力。
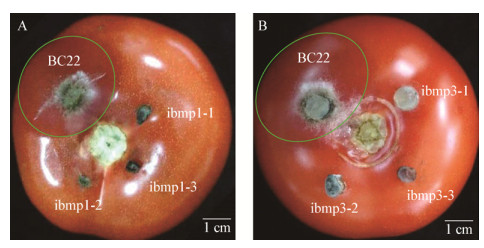
|
| 图 4 bmp1 (A)和bmp3 (B)基因RNAi突变体的致病力测定 Figure 4 Pathogenicity analysis of bmp1 (A) and bmp3 (B) genes RNAi mutants |
|
|
利用玻璃纸检测野生型BC22和bmp1、bmp3基因RNAi突变体的穿透能力,结果(图 5)发现,野生型BC22菌株能穿透玻璃纸,产生侵入菌丝,而bmp1和bmp3基因RNAi突变体均不能穿透玻璃纸,表明bmp1和bmp3基因突变影响病菌的穿透能力。
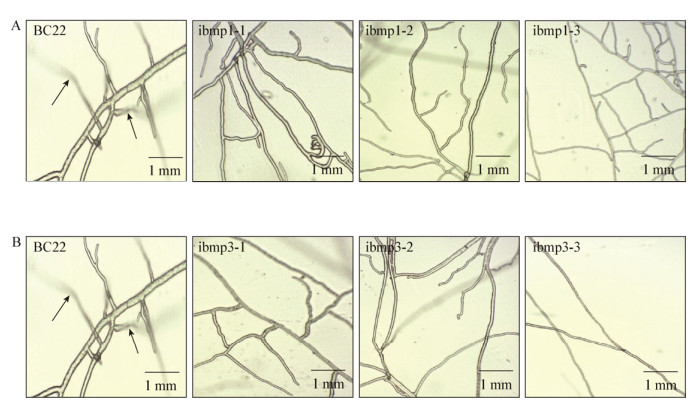
|
| 图 5 bmp1 (A)和bmp3 (B)基因RNAi突变体的穿透能力测定 Figure 5 Penetrability analysis of bmp1 (A) and bmp3 (B) genes RNAi mutants |
|
|
将野生型BC22和bmp1、bmp3基因的RNAi突变体分别接种到含有H2O2和甲萘醌的PDA培养基上,检测bmp1、bmp3基因RNAi突变体对氧化胁迫的敏感性。结果(图 6)发现,接种3 d后,野生型BC22和bmp1、bmp3基因RNAi突变体在含有H2O2和甲萘醌的PDA培养基上均受到明显抑制,bmp1基因的RNAi突变体在含有H2O2的PDA培养基上受抑制的程度显著低于野生型,而在含甲萘醌的PDA培养基上受抑制的程度显著高于野生型;bmp3基因的RNAi突变体在含有H2O2和甲萘醌的PDA培养基上受抑制的程度均显著高于野生型,表明bmp1、bmp3基因突变影响病菌对氧化胁迫的响应。

|
| 图 6 bmp1和bmp3基因RNAi突变体对H2O2和甲萘醌的敏感性测定 Figure 6 Sensitivity of bmp1 and bmp3 genes RNAi mutants to H2O2 and menadione 注:A、C:RNAi突变体过氧化氢和甲萘醌的敏感性测定;B、D:抑制率测定 Note: A, C: Sensitivity of RNAi mutants to H2O2 and menadione; B, D: Determination of inhibition rate. |
|
|
灰葡萄孢MAPK信号途径参与病菌的生长、发育和致病过程[13-15],MAP激酶编码基因bmp1参与调控菌丝生长、分生孢子形成、附着胞形成与穿透[6, 13],MAP激酶编码基因bmp3参与调控菌丝生长、分生孢子和菌核形成[7, 14-15]。本研究中,bmp1基因的RNAi突变体的表型和致病力与Δbmp1突变体(野生型菌株为B05.10)基本一致,bmp1基因的RNAi突变体生长速率明显减慢,分生孢子产量明显降低,在番茄果实的表面均不能产生明显的致病症状,此结果与Δbmp1突变体一致,表明bmp1基因正调控灰葡萄孢生长、分生孢子形成和致病力。bmp3基因的RNAi突变体的生长速率与野生型BC22菌株没有明显差别,不能产生分生孢子,在番茄果实的表面均不能产生明显的致病症状,这与Δbmp3突变体(野生型菌株为B05.10)的表型和致病力不完全相同;Δbmp3突变体生长速率减慢,分生孢子数量显著降低,不能产生菌核,致病力减弱[7],表明bmp3基因缺失突变体和表达水平降低引起的表型具有一定的差异。
灰葡萄孢MAP激酶编码基因bmp3参与病菌对渗透胁迫和氧化应激的响应[7]。Δbmp3突变体在渗透胁迫培养基上的生长速率明显降低[7]。H2O2作为一种强氧化剂,是生物体内最丰富的活性氧分子;甲萘醌能在有氧代谢细胞内产生O2-或者通过消耗NADPH减少分子氧产生超氧化物歧化酶,而胞内的超氧化物歧化酶是O2-的专一清除剂,可以将O2-转变为内源的H2O2[16]。此外,研究已经证明甲萘醌可诱导真菌产生氧化应激反应[9, 16-20]。本研究发现bmp1基因的RNAi突变体对H2O2的敏感性显著降低,对甲萘醌的敏感性显著增强;bmp3基因的RNAi突变体对H2O2和甲萘醌的敏感性均显著增强,结果表明灰葡萄孢bmp1和bmp3基因参与病菌对氧化胁迫的响应,但bmp1和bmp3基因调控病菌对氧化胁迫响应的机制尚未明确,需进一步深入研究。
| [1] |
Hamel LP, Nicole MC, Duplessis S, et al. Mitogen-activated protein kinase signaling in plant-interacting fungi: distinct messages from conserved messengers[J]. The Plant Cell, 2012, 24(4): 1327-1351. |
| [2] |
Chen RE, Thorner J. Function and regulation in MAPK signaling pathways: lessons learned from the yeast Saccharomyces cerevisiae[J]. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research, 2007, 1773(8): 1311-1340. DOI:10.1016/j.bbamcr.2007.05.003 |
| [3] |
Brefort T, Doehlemann G, Mendoza-Mendoza A, et al. Ustilago maydis as a pathogen[J]. Annual Review of Phytopathology, 2009, 47: 423-445. DOI:10.1146/annurev-phyto-080508-081923 |
| [4] |
Zhao XH, Kim Y, Park G, et al. A mitogen-activated protein kinase cascade regulating infection-related morphogenesis in Magnaporthe grisea[J]. The Plant Cell, 2005, 17(4): 1317-1329. |
| [5] |
Leroch M, Mueller N, Hinsenkamp I, et al. The signalling mucin Msb2 regulates surface sensing and host penetration via BMP1 MAP kinase signalling in Botrytis cinerea[J]. Molecular Plant Pathology, 2015, 16(8): 787-798. DOI:10.1111/mpp.2015.16.issue-8 |
| [6] |
Zheng L, Campbell M, Murphy J, et al. The BMP1 gene is essential for pathogenicity in the gray mold fungus Botrytis cinerea[J]. Molecular Plant-Microbe Interactions, 2000, 13(7): 724-732. DOI:10.1094/MPMI.2000.13.7.724 |
| [7] |
Rui O, Hahn M. The Slt2-type Map kinase Bmp3 of Botrytis cinerea is required for normal saprotrophic growth, conidiation, plant surface sensing and host tissue colonization[J]. Molecular Plant Pathology, 2007, 8(2): 173-184. |
| [8] |
Heller J, Ruhnke N, Espino JJ, et al. The mitogen-activated protein kinase BcSak1 of Botrytis cinerea is required for pathogenic development and has broad regulatory functions beyond stress response[J]. Molecular Plant-Microbe Interactions, 2012, 25(6): 802-816. DOI:10.1094/MPMI-11-11-0299 |
| [9] |
Segmüller N, Ellendorf U, Tudzynski B, et al. BcSAK1, a stress-activated mitogen-activated protein kinase, is involved in vegetative differentiation and pathogenicity in Botrytis cinerea[J]. Eukaryotic Cell, 2007, 6(2): 211-221. DOI:10.1128/EC.00153-06 |
| [10] |
Michielse CB, Becker M, Heller J, et al. The Botrytis cinerea Reg1 protein, a putative transcriptional regulator, is required for pathogenicity, conidiogenesis, and the production of secondary metabolites[J]. Molecular Plant-Microbe Interactions, 2011, 24(9): 1074-1085. DOI:10.1094/MPMI-01-11-0007 |
| [11] |
Yan LY, Yang QQ, Sundin GW, et al. The mitogen-activated protein kinase kinase BOS5 is involved in regulating vegetative differentiation and virulence in Botrytis cinerea[J]. Fungal Genetics and Biology, 2010, 47(9): 753-760. DOI:10.1016/j.fgb.2010.06.002 |
| [12] |
Schamber A, Leroch M, Diwo J, et al. The role of mitogen-activated protein (MAP) kinase signalling components and the Ste12 transcription factor in germination and pathogenicity of Botrytis cinerea[J]. Molecular Plant Pathology, 2010, 11(1): 105-119. |
| [13] |
Doehlemann G, Berndt P, Hahn M. Different signalling pathways involving a Gα protein, cAMP and a MAP kinase control germination of Botrytis cinerea conidia[J]. Molecular Microbiology, 2006, 59(3): 821-835. |
| [14] |
Choquer M, Fournier E, Kunz C, et al. Botrytis cinerea virulence factors: new insights into a necrotrophic and polyphageous pathogen[J]. FEMS Microbiology Letters, 2007, 277(1): 1-10. DOI:10.1111/fml.2007.277.issue-1 |
| [15] |
Nakajima M, Akutsu K. Virulence factors of Botrytis cinerea[J]. Journal of General Plant Pathology, 2014, 80(1): 15-23. |
| [16] |
Zhao W, Panepinto JC, Fortwendel JR, et al. Deletion of the regulatory subunit of protein kinase A in Aspergillus fumigatus alters morphology, sensitivity to oxidative damage, and virulence[J]. Infection and Immunity, 2006, 74(8): 4865-4874. DOI:10.1128/IAI.00565-06 |
| [17] |
Temple MD, Perrone GG, Dawes IW. Complex cellular responses to reactive oxygen species[J]. Trends in Cell Biology, 2005, 15(6): 319-326. DOI:10.1016/j.tcb.2005.04.003 |
| [18] |
Sun JS, Tsuang YH, Huang WC, et al. Menadione-induced cytotoxicity to rat osteoblasts[J]. Cellular and Molecular Life Sciences, 1997, 53(11/12): 967-976. |
| [19] |
Viaud M, Fillinger S, Liu WW, et al. A class Ⅲ Histidine Kinase acts as a novel virulence factor in Botrytis cinerea[J]. Molecular Plant-Microbe Interactions, 2006, 19(9): 1042-1050. DOI:10.1094/MPMI-19-1042 |
| [20] |
Hong JK, Kim HJ, Jung H, et al. Differential control efficacies of vitamin treatments against bacterial wilt and grey mould diseases in tomato plants[J]. The Plant Pathology Journal, 2016, 32(5): 469-480. DOI:10.5423/PPJ.OA.03.2016.0076 |
 2019, Vol. 46
2019, Vol. 46