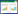扩展功能
文章信息
- 贺惠, 禹贵阳, 王先坤, 邓子新, 贺新义
- HE Hui, YU Gui-Yang, WANG Xian-Kun, DENG Zi-Xin, HE Xin-Yi
- 氨肽酶PepN1在细胞外催化杀稻瘟菌素的成熟
- Maturation of Blasticidin S is catalyzed by extracellular aminopeptidase N1
- 微生物学通报, 2019, 46(2): 223-232
- Microbiology China, 2019, 46(2): 223-232
- DOI: 10.13344/j.microbiol.china.180774
-
文章历史
- 收稿日期: 2018-10-09
- 接受日期: 2018-12-29
杀稻瘟菌素(Blasticidin S,BS)是由灰色产色链霉菌(Streptomyces griseochromogenes)产生的肽核苷类抗生素。由于良好的生物活性并且对鱼类无毒害,使它成为第一例大规模用于防治水稻稻瘟病的汞取代抗生素[1]。近年来,BS和它的抗性基因在转基因研究中被广泛用于筛选转化或转染细胞,是转基因研究中的常规试剂[2]。目前BS主要依靠化学方法合成。
由于原始产生菌遗传操作困难,我们课题组通过4次同源重组将BS合成基因簇嫁接到变铅青链霉菌染色体上,得到BS的异源表达宿主WJ2 (Streptomyces lividans WJ2)[3]。在原始产生菌和异源表达菌株的发酵液中,异源表达菌株产量低且积累了其他几种中间产物,包括脱甲基杀稻瘟菌素(Demethylblasticidin S,DBS)、亮氨酰脱甲基杀稻瘟菌素(Leucyldemethylblasiticidin S,LDBS)和亮氨酰杀稻瘟菌素(Leucylblasticidin S,LBS)(图 1)。在前期的研究中,发现大肠杆菌中存在的氨肽酶N (PepN)能够水解LBS生成BS[4] (图 2)。已经证明在灰色产色链霉菌和变铅青链霉菌中存在3个位于BS合成基因簇外的PepN同源蛋白参与LBS的水解。通过体外水解速率和体内敲除实验的比较,证明了PepN1是参与BS成熟的主要水解酶且两菌株来源的PepN1水解速率相差不大[5]。

|
| 图 1 BS原始产生菌灰色产色链霉菌与异源表达菌株变铅青链霉菌WJ2发酵产物比较 Figure 1 Comparative analysis of fermentation products of the native producer Streptomyces griseochromogenes and heterologous producer Streptomyces lividans WJ2 |
|
|
|
| 图 2 PepN水解相应底物生成BS和DBS的示意图 Figure 2 Schematic diagram to show excision of L-leucine from LBS and LDBS by PepN to form BS and DBS 注:A:PepN水解LBS成BS;B:PepN水解LDBS成DBS. Note: A: PepN hydrolyzes LBS into BS; B: PepN hydrolyzes LDBS into DBS. |
|
|
在BS生物合成途径的最后几步中,DBS亮氨酰化生成LDBS,LDBS甲基化生成LBS,最后LBS被水解脱掉一分子亮氨酸后生成BS,中间产物LDBS和LBS的抑菌活性只有最终产物BS的1/20[6]。由于清洗过的灰色产色链霉菌具有LBS水解活性[7],推测在BS的生物合成中,细胞在胞内通过亮氨酰化生成LDBS来降低化合物毒性,在通过细胞膜的过程中或在细胞外水解亮氨酸生成毒性更高的BS,从而实现细胞的自我保护[6]。已有文献报道在链霉菌中,PepN能够分泌在细胞外[8-9]。对PepN1的蛋白质一级和二级结构预测中,结果显示PepN1没有明显的跨膜区域,也没有分泌蛋白所具有的信号肽。这一点与自我保护的理论显然是相矛盾的。本研究选取PepN1为研究对象,利用制备的多克隆抗体分析PepN1在BS原始产生菌和异源表达菌株中表达水平的差异,以此来揭示异源表达菌株产量低且产物具有多样性的原因,增加对BS生物合成途径的认识,为提高BS产量提供理论依据。
1 材料与方法 1.1 实验材料 1.1.1 菌株大肠杆菌BL21 (ΔpepN)、灰色产色链霉菌(Streptomyces griseochromogenes)和变铅青链霉菌(Streptomyces lividans)由上海交通大学分子微生物学实验室保存。
1.1.2 培养基[10]大肠杆菌固体培养基为LA,液体培养基为LB。灰色产色链霉菌和变铅青链霉菌固体培养基为SFM,液体培养基为TSBY。
1.1.3 主要试剂和仪器蛋白预染Marker (Blue Plus Ⅲ Protein Marker),北京全式金生物技术有限公司;HPLC、Innoval C18 (4.6 mm×250 mm,5 μm),安捷伦科技有限公司;多克隆抗体制备,武汉爱博泰克生物科技有限公司;DAB显影试剂盒、二抗,上海翊圣生物科技有限公司;PVDF膜、透析膜,生工生物工程(上海)股份有限公司。台式超声细胞破碎仪,MSE公司。
1.2 实验方法 1.2.1 生物信息学分析氨肽酶N (PepN)同源蛋白或核苷酸序列采用NCBI BLAST引擎与各基因序列数据库进行比对。
抗原与PepN同源蛋白序列相似性使用Clustal Omega在线软件输入氨基酸序列进行比对。
1.2.2 PepN1多克隆抗体的制备灰色产色链霉菌的主要水解酶PepN1sgr与变铅青链霉菌的主要水解酶PepN1sli的氨基酸序列具有90%的相似性,根据两个蛋白一致性序列,选取处于蛋白N端和中间肽段Disorder score数值较高的肽段进行合成。Disorder score数值越高,说明选取的肽段越有可能处于蛋白的非结构区,与蛋白的原始结构越相似,免疫后获得的抗体特异性越高。合成的肽段作为抗原免疫兔子,免疫后采血纯化抗体。后续的实验中选取特异性更高的多克隆抗体E4196:1.85 mg/mL,该抗体由PepN1蛋白N端多肽(VPGTNLTREEARQRATLC)免疫兔子后纯化并浓缩得到。
1.2.3 菌体的收集与链霉菌细胞抽提物(Cell free extracts,CFE)的制备4 ℃、4 500 r/min离心10 min收集TSBY液体培养基培养后的链霉菌菌体,轻轻倒掉上清后用CFE缓冲液洗涤菌体两遍。用2 mL EP管称取相等重量菌体(0.2-0.4 g),1 mL CFE缓冲液重悬菌体后于-80 ℃保存备用。
制备CFE时,将保存的细胞样品置于冰上超声破碎。破碎后于4 ℃、12 000 r/min离心30 min,上清液即为制备好的CFE,可直接用于体外实验或冻存于-80 ℃备用。
CFE缓冲液:K3PO4 50 mmol/L,DTT 1 mmol/L,盐酸调pH至8.0。
1.2.4 蛋白质印迹法(Western blot)制备好的蛋白样品上样至SDS-PAGE胶进行电泳,使用蛋白预染Marker确定目的蛋白大小与位置。转膜:蛋白胶用ddH2O清洗后,将相同大小的PVDF膜平铺在凝胶上,在凝胶/PVDF膜两侧各平铺5张润湿的定性滤纸,玻璃棒来回滚动去除各层之间的气泡。倒入转膜液后,根据电极方向装入电泳装置中进行转膜(4 ℃冷室中,100 V,70 min)。封闭:转膜结束后,取出PVDF膜用ddH2O清洗后,置于含5%脱脂奶粉的TBST溶液中,脱色摇床(40 r/min)上封闭约2.5 h。一抗孵育:ddH2O清洗封闭后的PVDF膜3遍,置于含有一抗(制备的PepN1多克隆抗体)稀释倍数为3 000倍的TBST溶液中,脱色摇床(40 r/min)上孵育约2.5 h。二抗孵育:TBST溶液清洗孵育一抗后的PVDF膜3遍,置于含有二抗[过氧化物酶标记山羊抗兔IgG(H+L)]稀释倍数为15 000倍的TBST溶液中,脱色摇床(40 r/min)上孵育约1.5 h。显影:TBST溶液清洗PVDF膜3遍,使用DAB显影试剂盒进行显影,加ddH2O终止显影。
转膜液:Tris 3.03 g,甘氨酸14.4 g,甲醇200 mL,蒸馏水定容至1 L。
TBST溶液:1 mol/L pH 8.0的Tris-HCl 50 mL,5 mol/L的NaCl 30 mL,Tween 20 1 mL,蒸馏水定容至1 L。
1.2.5 蛋白表达与大肠杆菌细胞抽提物(CFE)的制备LB过夜培养已转入表达质粒的大肠杆菌BL21(ΔpepN),以1%接种比例接种至新的LB中,37 ℃、220 r/min培养至OD600值约0.6,加入IPTG至终浓度0.2 mmol/L,16 ℃诱导20 h,同时培养液中不加入IPTG诱导的菌液作为阴性对照。分别收集4 mL大肠杆菌菌体,0.7 mL CFE缓冲液重悬菌体后超声破碎,4 ℃、12 000 r/min离心30 min,取上清得到蛋白过表达CFE。SDS-PAGE电泳检测蛋白是否表达并进行定量。
1.2.6 硫酸铵沉淀收集细胞培养液蛋白质4 ℃、4 500 r/min离心10 min收集培养液上清,0.22 μm滤膜过滤培养液以去除残留的细胞。4 ℃冷室内使用磁力搅拌器向培养液中缓慢加入硫酸铵粉末至硫酸铵浓度为80% (25 mL液体中加入13.32 g固体硫酸铵),放置约0.5 h使蛋白充分沉淀。4 ℃、12 000 r/min离心30 min收集沉淀,2 mL缓冲液(含50 mmol/L NaCl,50 mmol/L Tris-HCl,pH 8.0)溶解沉淀,装入透析膜后在缓冲液中透析24 h。透析后使用50 kD超滤管浓缩至约200 μL。
1.2.7 HPLC检测细胞培养液LDBS水解活性利用LBS和LDBS (俄勒冈州立大学Mark Zabriskie教授馈赠)可以被PepN水解为BS和DBS的特点检测细胞培养液是否具有水解活性。反应体系中含有LDBS和收集的细胞培养液蛋白质样品,缓冲液(含50 mmol/L NaCl,50 mmol/L Tris-HCl,pH 8.0)补齐至30 μL,30 ℃反应2 h。反应后加入2 μL三氟乙酸(TFA)终止反应,加入32 μL三氯甲烷振荡1 min,常温下12 000 r/min离心10 min取上清进行HPLC分析。使用Innoval C18柱在Agilent系列1260上进行HPLC分析。流动相A相选用含有0.1% TFA的水溶液,B相为甲醇,样品以0.3 mL/min的流速洗脱,缓冲液B的浓度在40 min内从5%升至40%[11]。
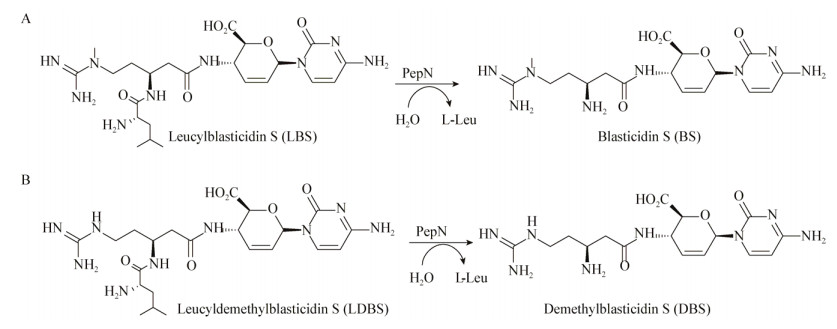
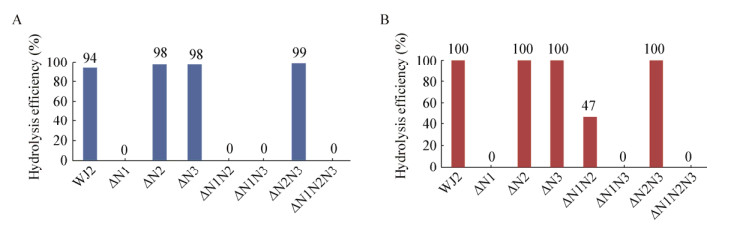
2 结果与分析 2.1 PepN1是主要负责BS成熟的水解酶通过检索灰色产色链霉菌(GenBank:CP016279.1)和变铅青链霉菌(GenBank:CP009124.1)全基因组中pepN基因序列,在两个菌株中找到3个PepN同源蛋白编码基因,并将其编码产物分别命名为PepN1sgr、PepN2sgr和PepN3sgr,以及PepN1sli、PepN2sli和PepN3sli。为了研究这3个PepN同源蛋白在BS成熟中的作用,在变铅青链霉菌WJ2中构建了pepN同源基因缺失菌株,包括分别单独缺失pepN1sli、pepN2sli和pepN3sli的菌株(ΔN1、ΔN2和ΔN3),以及双缺失菌株(ΔN1N2、ΔN1N3和ΔN2N3)和三缺失菌株(ΔN1N2N3)。使用这些菌株清洗过的细胞以及细胞抽提物(CFE)水解LBS的效率来表征水解活性。结果如图 3所示,ΔN1突变株的细胞和CFE失去水解LBS活性,而ΔN2、ΔN3和ΔN2N3这3个突变株水解LBS活性几乎没有降低。说明在3个PepN同源蛋白中,PepN1是主要负责水解LBS为BS的氨肽酶。野生型和各个突变株的细胞以及CFE水解LBS的活性基本保持一致,只有ΔN1N2突变株的细胞和CFE有差异,推测PepN3可能主要定位于细胞内,或者细胞破碎后某些金属离子有机会和PepN3接触,激活了PepN3水解LBS活性。因此选取PepN1为研究对象,分析其在原始产生菌和异源表达菌中表达与分泌的差异,以期解释BS异源表达菌株产量低且组分多的原因。
|
| 图 3 pepN同源基因缺失突变株和野生型WJ2清洗过的细胞以及细胞抽提物(CFE)水解LBS活性分析 Figure 3 Activity analysis of hydrolyzing LBS by cells and cell free extracts (CFE) of mutants lacking pepN homologues genes and wild-type strain WJ2 注:A:突变株清洗过的细胞水解LBS活性分析;B:突变株的CFE水解LBS活性分析. Note: A: Activity analysis of hydrolyzing LBS by cells of mutant strains; B: Activity analysis of hydrolyzing LBS by CFE of mutant strains. |
|
|
将上述6个PepN同源蛋白序列与制备多克隆抗体所使用的抗原序列进行比较,结果显示抗原序列与PepN1有很高的相似性,其他同源蛋白也有7-12个氨基酸与抗原序列相同(图 4)。由于多克隆抗体具有抗原决定簇多样的特点,除了研究对象PepN1外,其他同源蛋白也有一定几率能够与抗体结合。同时,这6个PepN同源蛋白的分子质量较为接近,有可能会影响对PepN1表达量的判断。

|
| 图 4 PepN同源蛋白与抗原氨基酸序列相似性分析 Figure 4 Similarity analysis of amino acid sequence between PepN homologous protein and antigen |
|
|
为了确定制备所得的多克隆抗体对PepN1识别的特异性,使用禹贵阳博士在变铅青链霉菌S. lividans WJ2中构建的系列pepN同源基因缺失菌株的CFE进行蛋白质免疫印迹(Western blot)。如图 5A所示,在Western blot显影图中,只有ΔN2、ΔN3和出发菌株S. lividans WJ2这3个菌株的CFE样品显影后出现PepN1对应大小条带,其他突变株没有出现任何条带,说明制备所得的多克隆抗体识别PepN1特异性较高。

|
| 图 5 PepN1多克隆抗体特异性分析 Figure 5 Assay of the specificity for PepN1 polyclonal antibody 注:A:使用制备的PepN1多克隆抗体对缺失pepN同源基因的突变株和野生型菌株WJ2的CFE进行印迹特异性分析;B:使用制备的PepN1多克隆抗体对大肠杆菌中纯化链霉菌来源的PepN同源蛋白的菌株CFE进行印迹特异性分析. Note: A: Blot specificity analysis was performed on the CFE of mutants lacking pepN homologues genes and wild-type strain WJ2 using the prepared PepN1 polyclonal antibody; B: Blot specificity analysis was performed on the CFE of the strains expressing Streptomyces-derived PepN homologous protein in E. coli using the prepared PepN1 polyclonal antibody. |
|
|
由于PepN2和PepN3两个蛋白可能在细胞内表达量较低而不能在Western blot中显影,为了排除这一可能性,使用禹贵阳博士构建的在大肠杆菌中分别表达PepN1sli、PepN2sli、PepN3sli、PepN1sgr、PepN2sgr和PepN3sgr这6个蛋白菌株的CFE,Western blot检测抗体与这6个蛋白结合情况。在大量表达PepN同源蛋白的情况下,PepN1特异性识别抗体能力很高,因此显影条带颜色较深。PepN2能够识别抗体,但特异性很低,因此条带较弱,而PepN3则完全不能特异性识别抗体(图 5B)。说明制备所得的多克隆抗体识别PepN1特异性很高,PepN2和PepN3同源蛋白的存在对使用Western blot研究PepN1蛋白在体内表达水平变化的影响不大。
2.3 BS原始产生菌和异源表达菌株细胞内PepN1表达水平BS的异源表达菌株S. lividans WJ2发酵产物相比原始产生菌灰色产色链霉菌不仅产量低,还积累了一部分中间产物。在前期的研究中证明PepN1sgr和PepN1sli都很稳定,且水解LBS的速率几乎没有差异[4]。说明产物的组分多样性可能是因为PepN1表达水平的差异造成的。选取在TSBY培养基上培养2-6 d菌丝体的CFE分别与PepN1抗体进行杂交检测,结果如图 6A所示,S. lividans WJ1 (无BS合成基因簇)与S. lividans WJ2杂交条带在2-6 d变化趋势相同,说明外源基因的导入对PepN1蛋白表达没有影响。灰色产色链霉菌在2-6 d中一直有PepN1杂交条带,且蛋白量几乎没有变化。不同的是,S. lividans WJ2样品在2 d和3 d有PepN1杂交条带,从第4天开始杂交条带减少甚至消失(图 6B)。说明S. lividans WJ2中PepN1可能在培养后期被降解或者分泌到细胞外。

|
| 图 6 Western blot分析PepN1体内蛋白表达水平 Figure 6 Analysis of the PepN1 expression level by Western blot 注:A:BS异源表达菌株S. lividans WJ2与未导入BS合成基因簇的菌株S. lividans WJ1在第2-6天体内PepN1蛋白表达水平的变化;B:BS异源表达菌株S. lividans WJ2与原始产生菌灰色产色链霉菌在第2-6天体内PepN1蛋白表达水平的变化. Note: A: Analysis of PepN1 expression level in the Blasticidin S heterologous producer S. lividans WJ2 and S. lividans WJ1 (without BS biosynthetic gene cluster) from the 2nd to 6th day; B: Analysis of PepN1 expression level in the Blasticidin S heterologous producer S. lividans WJ2 and the native producer S. griseochromogenes from the 2nd to 6th day. |
|
|
为了追踪S. lividans WJ2细胞内在培养后期消失的PepN1,用硫酸铵沉淀收集原始产生菌和异源表达菌这两种菌株培养液中的蛋白进行分析。选取TSBY液体培养基培养第2-4天以及第6天的培养液为实验材料,用80%的硫酸铵沉淀收集灰色产色链霉菌和S. lividans WJ2培养液蛋白并透析浓缩后,通过蛋白胶检测能够发现灰色产色链霉菌培养液中含有大量蛋白,而S. lividans WJ2培养液中蛋白量较低,两个样品蛋白量有很大差异。为了避免S. lividans WJ2样品因浓度过低而影响判断,将S. lividans WJ2的样品冻干浓缩至1/4并提高上样量进行杂交,分析培养液中是否含有PepN1。结果如图 7所示,在灰色产色链霉菌培养液中含有PepN1,因而能与抗体杂交出现条带,而S. lividans WJ2培养液样品即使在浓缩后仍然没有杂交条带。该结果说明灰色产色链霉菌PepN1的表达水平较高,并将一部分PepN1分泌在细胞外,而S. lividans WJ2则没有。结合两菌株的发酵结果(图 1),表明高活性的BS主要是在细胞外形成的,而S. lividans WJ2中BS的生成可能是细胞内的PepN1以及附着在细胞外表面的PepN1所致。

|
| 图 7 Western blot分析细胞培养液中是否含有PepN1 Figure 7 Western blot analysis of the presence of PepN1 in the cell culture medium 注:因S. lividans WJ2样品浓度较低,将S. lividans WJ2培养液硫酸铵沉淀物透析并浓缩后,冻干样品提高样品浓度.进行Western blot检测时S. lividans WJ2上样量为10 μL,而灰色产色链霉菌上样量为5 μL. Note: Due to the low protein concentration of S. lividans WJ2 sample, its protein precipitates of culture medium by ammonium sulfate were dialyzed and concentrated. The sample was lyophilized to increase the sample concentration. The sample loaded for S. lividans WJ2 was 10 μL in the Western blot, while that for S. griseochromogenes is 5 μL. |
|
|
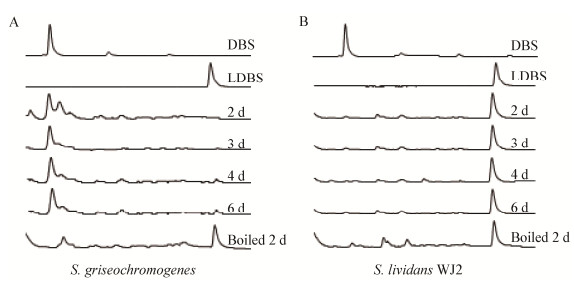
为了更直观地展现出灰色产色链霉菌能够将PepN1分泌到细胞外,使用硫酸铵沉淀收集了培养液中的蛋白,并用培养液中的蛋白来水解LDBS,HPLC检测产物的生成来测试培养液中LDBS的水解活性(以LDBS替代LBS来检测蛋白的水解活性)。如图 8A所示,灰色产色链霉菌样品将LDBS全部转化为DBS,这与Western blot结果是一致的,表明灰色产色链霉菌分泌了一部分PepN1在细胞外。而S. lividans WJ2样品在2 h的反应中只有微弱的水解活性,培养液中几乎没有PepN1存在(图 8B)。
|
| 图 8 HPLC检测细胞培养液样品水解LDBS活性 Figure 8 Analysis of LDBS hydrolytic activity of cell culture medium by HPLC 注:A:HPLC分析BS异源表达菌株S. lividans WJ2第2-4天和第6天培养液样品水解LDBS活性;B:HPLC分析BS原始产生菌灰色产色链霉菌第2-4天和第6天培养液样品水解LDBS活性.反应条件为30 ℃ 2 h. Boiled 2 d表示将第2天样品高温失活后加入反应体系,以此作为水解反应的阴性对照. Note: A: Analysis of hydrolyzed LDBS activity of BS heterologous producer S. lividans WJ2 on day 2-4 and day 6 by HPLC; B: Analysis of hydrolyzed LDBS activity of BS native producer S. griseochromogenes on day 2-4 and day 6 by HPLC. The reaction conditions were 30 ℃ 2 h. The boiled protein from supernatant of day 2 culture was used as the negative control. |
|
|
氨肽酶广泛存在于原核和真核生物中,大部分为氨肽酶属金属酶[12],这些氨肽酶因其功能的不同而被定位于细胞不同位置。约97%的氨肽酶存在于可溶性组分中,其中的65%存在于细胞质中,16%存在于革兰氏阳性菌细胞周质或革兰氏阴性菌细胞壁中,16%被分泌到细胞外[13]。氨肽酶起多种作用,例如翻译后修饰、蛋白成熟、降解激素、信号肽和营养物质的再循环等[12-13]。关于PepN的亚细胞定位已有一些报道,例如在变铅青链霉菌(S. lividans 66)中过表达时,在细胞培养液中检测到PepN条带且具有活性[8]。在乳酸乳球菌中,完整的细胞和细胞抽提物有PepN的活性,细胞培养液中未检测到,免疫金标记显示PepN位于细胞内[14-15]。在大肠杆菌中,通过电子显微镜观察不溶产物的生成,认为PepN由镁离子桥介导产生与细胞外表面的静电相互作用[16-17]。
本研究利用Western blot分析了BS原始产生菌和异源表达菌株培养液中PepN1的存在。结果显示原始产生菌能够分泌一部分PepN1在培养液中,这对于BS的生产和细胞的自我保护是有利的。而异源表达菌株细胞内PepN1在培养后期逐渐消失,且没有在培养液中检测到,说明在异源表达菌株中PepN1不能分泌到培养液中,限制了BS的成熟,这是导致异源表达菌株产量低且积累其他中间产物的原因。
讨论1:变铅青链霉菌中PepN1的去向。通过Western blot测定2-6 d中细胞内外PepN1的含量,发现变铅青链霉菌到3-4 d就停止合成PepN1,4 d之后则检测不到PepN1。一方面合成的PepN1被外排至细胞外表面,但是并没有分泌到培养液中,因为2-6 d的WJ2细胞有水解LBS的活性;另一方面,PepN1可能发生自我剪切或者被其他蛋白酶水解。
讨论2:LBS或者LDBS在细胞外水解生成对应的终产物。BS生物合成途径中,LDBS是BS合成的一个关键中间产物,它在细胞内的合成有两个作用:DBS的细胞毒性和BS相似,胍基侧链Beta位氨基需要被亮氨酰化形成LDBS来降低其细胞内毒性[7];另一方面是由合成过程的先后顺序决定的,只有LDBS能被甲基化转化为LBS,而DBS不能直接甲基化形成BS[11]。如果PepN1在细胞内负责LDBS的水解,那么DBS的亮氨酰化则是徒劳的,合成途径就会在DBS亮氨酰化和去亮氨酸水解之间循环,细胞不会白做无用功,所以LDBS的水解不太可能发生在细胞内。同样,LBS的水解如果发生在细胞内,则会产生高毒性的BS影响细胞的生长,所以LDBS和LBS被水解成对应的DBS和BS应该是在细胞外生成的。
讨论3:清洗过的细胞水解活性导致发酵液中一部分BS的积累。在变铅青链霉菌WJ2的细胞培养液和培养后期细胞裂解液中几乎检测不到PepN1,也没有检测到LDBS或LBS的水解活性。但仍然能在WJ2发酵液中检测到BS和DBS。我们推测它们是由细胞壁外表面的PepN1水解LBS和LDBS而形成的。因为BS原始产生菌灰色产色链霉菌和异源表达菌株WJ2第2-6天清洗过的细胞均具有水解活性,这部分蛋白的水解效率较低,可能因菌丝体聚集而减少了与溶液中LDBS或LBS作用的机会,所以WJ2发酵液中也能检测到部分BS的生成。
所有细菌中经典的蛋白分泌途径包括Sec和Tat途径[17-18],需要目的蛋白具有信号肽或者跨膜结构域。对PepN1蛋白结构的预测中没有发现信号肽及明显的跨膜结构域,这意味着PepN1可能通过其他途径被分泌到细胞外。比较灰色产色链霉菌和变铅青链霉菌基因组中的分泌系统相关基因,发现灰色产色链霉菌中有10个基因编码七型分泌系统(Type Ⅶ secretion system)蛋白,变铅青链霉菌中有7个基因编码七型分泌系统蛋白。经过序列相似性比对,发现有4对相同功能注释基因的相似性很低,其中3个基因在灰色产色链霉菌基因组中相邻。七型分泌系统最早于2003年从分枝杆菌中被发现[19],是革兰氏阳性菌中一种独特的蛋白分泌系统[20]。在分枝杆菌中已鉴定出毒力小蛋白质EsxA和EsxB是由七型分泌系统分泌,这些分泌蛋白没有可识别的分泌信号肽序列[21-22]。PepN1也没有可识别的信号肽序列,推测PepN1的分泌很可能与七型分泌系统相关,这些猜测还需要后续实验进行验证。PepN1分泌途径的探索能够完善BS生物合成途径,增强对肽核苷类抗生素生物合成的认识,对于生物合成基因簇中存在的簇外基因参与生物合成也具有一定借鉴意义。
| [1] |
Takeuchi S, Hirayama K, Ueda K, et al. Blasticidin S, a new antibiotic[J]. The Journal of Antibiotics, 1958, 11(1): 1-5. |
| [2] |
IzuMi M, Miyazawa H, Kamakura T, et al. Blasticidin S-resistance gene (bsr): a novel selectable marker for mammalian cells[J]. Experimental Cell Research, 1991, 197(2): 229-233. DOI:10.1016/0014-4827(91)90427-V |
| [3] |
Li L, Wu J, Deng ZX, et al. Streptomyces lividans Blasticidin S deaminase and its application in engineering a Blasticidin S-producing strain for ease of genetic manipulation[J]. Applied and Environmental Microbiology, 2013, 79(7): 2349-2357. DOI:10.1128/AEM.03254-12 |
| [4] |
Yu GY, Li L, Liu XY, et al. The standalone aminopeptidase PepN catalyzes the maturation of Blasticidin S from leucylblasticidin S[J]. Scientific Reports, 2015, 5: 17641. DOI:10.1038/srep17641 |
| [5] |
Yu GY. Study on maturation mechanism of Blasticidin S and improvement of its yields[D]. Shanghai: Doctoral Dissertation of Shanghai Jiao Tong University, 2017 (in Chinese) 禹贵阳.杀稻瘟菌素的成熟机制及产量提高研究[D].上海: 上海交通大学博士学位论文, 2017 |
| [6] |
Zhang QB, Cone MC, Gould SJ, et al. Reevaluation of the final steps in the biosynthesis of Blasticidin S by Streptomyces griseochromogenes and identification of a novel self-resistance mechanism[J]. Tetrahedron, 2000, 56(5): 693-701. DOI:10.1016/S0040-4020(99)01060-1 |
| [7] |
Zhang QB. Advanced studies of Blasticidin S biosynthesis[D]. Oregon: Oregon State University, 1998
|
| [8] |
Butler MJ, Aphale JS, Binnie C, et al. The aminopeptidase N-encoding pepN gene of Streptomyces lividans 66[J]. Gene, 1994, 141(1): 115-119. |
| [9] |
Hatanaka T, Arima J, Uraji M, et al. Characterization, cloning, sequencing, and expression of an aminopeptidase N from Streptomyces sp. TH-4[J]. Applied Microbiology and Biotechnology, 2007, 74(2): 347-356. DOI:10.1007/s00253-006-0669-y |
| [10] |
Kieser T, Bibb MJ, Chater KF, et al. Practical Streptomyces Genetics[M]. Norwich: The John Innes Foundation, 2000.
|
| [11] |
Wang XK, Du AQ, Yu GY, et al. Guanidine N-methylation by BlsL is dependent on acylation of beta-amine arginine in the biosynthesis of Blasticidin S[J]. Frontiers in Microbiology, 2017, 8: 1565. DOI:10.3389/fmicb.2017.01565 |
| [12] |
Taylor A. Aminopeptidases: structure and function[J]. FASEB Journal, 1993, 7(2): 290-298. DOI:10.1096/fasebj.7.2.8440407 |
| [13] |
Gonzales T, Robert-Baudouy J. Bacterial aminopeptidases: properties and functions[J]. FEMS Microbiology Reviews, 1996, 18(4): 319-344. |
| [14] |
van Alen-Boerrigter IJ, Baankreis R, de Vos WM. Characterization and overexpression of the Lactococcus lactis pepN gene and localization of its product, aminopeptidase N[J]. Applied and Environmental Microbiology, 1991, 57(9): 2555-2561. |
| [15] |
Tan PST, Chapot-Chartier MP, Pos KM, et al. Localization of peptidases in Lactococci[J]. Applied and Environmental Microbiology, 1992, 58(1): 285-290. |
| [16] |
Murgier M, Pelissier C, Lazdunski A, et al. Aminopeptidase N from Escherichia coli: unusual interactions with the cell surface[J]. European Journal of Biochemistry, 1977, 74(3): 425-433. DOI:10.1111/ejb.1977.74.issue-3 |
| [17] |
Addlagatta A, Gay L, Matthews BW. Structure of aminopeptidase N from Escherichia coli suggests a compartmentalized, gated active site[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(36): 13339-13344. DOI:10.1073/pnas.0606167103 |
| [18] |
Bagnoli F, Rappuoli R. Protein and Sugar Export and Assembly in Gram-Positive Bacteria[M]. Cham: Springer, 2017.
|
| [19] |
Stanley SA, Raghavan S, Hwang WW, et al. Acute infection and macrophage subversion by Mycobacterium tuberculosis require a specialized secretion system[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(22): 13001-13006. DOI:10.1073/pnas.2235593100 |
| [20] |
Abdallah AM, Gey Van Pittius NC, Champion PAD, et al. Type Ⅶ secretion—mycobacteria show the way[J]. Nature Reviews Microbiology, 2007, 5(11): 883-891. DOI:10.1038/nrmicro1773 |
| [21] |
Houben ENG, Korotkov KV, Bitter W. Take five — Type Ⅶ secretion systems of Mycobacteria[J]. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research, 2014, 1843(8): 1707-1716. DOI:10.1016/j.bbamcr.2013.11.003 |
| [22] |
Abdallah AM, Verboom T, Hannes F, et al. A specific secretion system mediates PPE41 transport in pathogenic mycobacteria[J]. Molecular Microbiology, 2006, 62(3): 667-679. |
 2019, Vol. 46
2019, Vol. 46