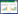扩展功能
文章信息
- 周培富, 赵宇中, 谢建平
- ZHOU Pei-Fu, ZHAO Yu-Zhong, XIE Jian-Ping
- 结核分枝杆菌毒力因子蛋白酪氨酸磷酸酶PtpA转录调控和分泌机理
- Transcriptional and secretion of Mycobacterium tuberculosis virulence factor protein tyrosine phosphatase A (PtpA)
- 微生物学通报, 2019, 46(12): 3483-3490
- Microbiology China, 2019, 46(12): 3483-3490
- DOI: 10.13344/j.microbiol.china.190281
-
文章历史
- 收稿日期: 2019-04-04
- 接受日期: 2019-09-04
- 网络首发日期: 2019-09-29
2. 西南大学生命科学学院 现代生物医药研究所 重庆 400715
2. Institute of Modern Biopharmaceuticals, School of Life Sciences, Southwest University, Chongqing 400715, China
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,简称结核菌)感染引起的慢性传染病。据世界卫生组织(World health organization,WHO) 2018年发布的全球结核病疫情报告:2017年全球共有约1 000万结核病患者(其中9%为HIV阳性),死亡160万病例(其中含HIV阳性患者30万)。因此,结核病仍然是全球最致命的传染病之一,近年来超越艾滋病成为全球由单一病原微生物感染导致死亡的头号杀手(2017年全球因HIV导致的死亡人数为94万,其中30万为结核病阳性)[1]。世界各地出现越来越多的耐多药结核菌(Multidrug- resistant TB,MDR-TB)和广泛耐药结核菌(Extensively drug-resistant TB,XDR-TB)[1]及与人类免疫缺陷病毒(Human immunodeficiency virus,HIV)共感染等多种因素使全球结核病疫情的控制仍然面临严峻考验。因此,对结核菌致病机理研究、药物靶标鉴定及药物研发等迫在眉睫。
在感染过程中,结核菌可分泌一系列效应分子对宿主巨噬细胞进行调控,干扰和逃逸宿主免疫。结核菌作为致病菌的“成功”之处在于它能够在宿主巨噬细胞中存活并繁殖[2-3]。通常,人体受到感染时,巨噬细胞吞噬外源微生物形成吞噬体,吞噬体逐渐成熟并与溶酶体融合,从而对外源微生物进行蛋白水解消化,将抗原呈递到巨噬细胞表面,进一步诱导机体免疫反应[4-5]。然而,结核菌能够抑制吞噬体的成熟及其与溶酶体的融合过程,进而逃避巨噬细胞的杀伤[3, 6]。由于结核菌干扰了吞噬体成熟,巨噬细胞不能将抗原呈递到细胞表面[7-8],因此在其感染人体后,导致巨噬细胞IFNγ响应[9-10]、细胞因子水平、活性氧及活性氮中间产物降低[11]并抑制宿主细胞凋亡[12]。结核菌对宿主巨噬细胞的这些生物功能的影响主要归功于其分泌到宿主中的一系列效应分子,主要包括一些蛋白质及脂质[3, 6]。蛋白酪氨酸磷酸酶(Protein tyrosine phosphatase A,PtpA)就是其中之一。
1 蛋白酪氨酸磷酸酶PtpA协助结核菌逃避宿主免疫结核菌PtpA由rv2234基因编码,分子量约为17.5 kD,属于低分子量蛋白酪氨酸磷酸酶,能催化磷酸对硝基苯酯(p-Nitrophenylphosphate,pNPP)、髓鞘碱性蛋白(Myelin basic protein,MBP)及其它含磷酸化酪氨酸多肽中的酪氨酸去磷酸化,且活性受到磷酸酶抑制剂正钒酸钠的抑制[13-14]。
结核菌感染巨噬细胞以后将PtpA分泌进入巨噬细胞[13-14]。早期研究发现异源表达结核菌PtpA的鼠巨噬细胞Raw 264.7对结核菌、耻垢分枝杆菌(Mycobacterium smegmatis)及酵母聚糖的吞噬能力降低[15]。进一步的研究证实,PtpA进入宿主巨噬细胞后,能够竞争性地结合Host adapter TAB 3蛋白的泛素相互作用结构域(Ubiquitin-interacting domain),干扰其对泛素链的感应,中断NF-kB信号途径,最终抑制由TAB 3介导的宿主天然免疫[16] (图 1)。PtpA还通过竞争性结合宿主泛素连接酶TRIM27的RING结构域,抑制其酶活性,阻断由TRIM27介导激活的JNK/p38 MAPK信号通路,抑制由该通路介导的宿主天然免疫和细胞凋亡[17];不仅如此,PtpA还同时利用其C-末端的位于α-螺旋5中的泛素相互作用基序样区域(Ubiquitin- interacting motif-like region,UIML)与宿主细胞中的泛素发生非共价结合,使得其自身酸酶活性增强,进而促进对宿主蛋白激酶Jnk、p38和VPS33B的去磷酸化活性[16]。对Jnk、p38两个激酶的去磷酸化进一步抑制了它们介导的天然免疫[16]。再者,PtpA还能结合巨噬细胞空泡膜上H+-ATPase复合体中的H亚基,借此靠近同型液泡融合和液泡蛋白分选复合体(Homotypic vacuole fusion and vacuole protein sorting complex,HOPS),并对其组成亚基(Human class C vacuolar protein sorting VPS33B,VPS33B)去磷酸化,阻断由这2个复合体介导的吞噬体与溶酶体的融合及后续的酸化[18-20](图 1)。进一步的研究还发现PtpA能对宿主糖原合酶激酶(Glycogen synthase kinase 3α,GSK3α)的Tyr279去磷酸化,降低GSK3α诱导细胞凋亡的能力,促进结核菌在早期感染过程中的存活[21] (图 1)。最新的研究还发现PtpA能够与宿主细胞质中的6-磷酸果糖激酶及3个线粒体蛋白(三功能酶、ATP合成酶、硫醌氧化还原酶)相互作用,这些酶均涉及宿主能量代谢,且体外证实PtpA能够对三功能酶去磷酸化,暗示其对宿主能量代谢及能量状态的调控[22] (图 1)。此外,PtpA还能进入宿主细胞的细胞核,以转录调控因子的方式结合宿主特异DNA区域并调控相关基因表达,通过调控部分重要的基因如GADD45A的表达来调节宿主细胞的固有免疫、细胞增殖和迁移等[23]。综上,结核菌PtpA通过抑制宿主巨噬细胞天然免疫、细胞凋亡和阻断吞噬体成熟及与溶酶体融合等方式逃逸宿主免疫,为结核菌进一步建立持留性感染奠定基础[16, 18, 21, 24]。

|
| 图 1 结核分枝杆菌蛋白酪氨酸磷酸酶PtpA调控宿主功能概况 Figure 1 Regulation of host by Mycobacterium tuberculosis protein tyrosine phosphatase PtpA |
|
|
在结核菌中,ptkA-ptpA-rv2235组成一个操纵子。在基因转录层面,Srivastava等曾利用体内表达技术将包含有结核菌ptkA基因启动子片段的质粒转入卡介苗(Bacillus calmette-guerin,BCG)中,在感染J774A.1鼠巨噬细胞后,该启动子介导报告基因上调表达,经实时定量PCR证实ptkA基因在结核菌和BCG感染巨噬细胞后上调表达,在36 h时达到最高,之后逐渐下降但始终高于未感染的对照组[25]。此外,ptkA还在结核菌感染免疫活性小鼠后上调表达[26]。由于ptpA与ptkA处于同一操纵子,因此ptpA也在上述情况中表达上调。基因敲除的研究也很好地印证了PtpA的上述功能:结核菌H37Rv ∆ptpA缺失突变菌株和野生型菌株相比,在感染人巨噬细胞THP-1后存活能力严重受损,且其抑制吞噬体和溶酶体融合的能力也大幅降低[24]。然而,也有证据显示H37Rv ∆ptpA缺失突变菌株在小鼠感染模型中并没有表现出生长缺陷,这可能是由于小鼠模型并不适用于研究PtpA的宿主调控功能[27]。综上,PtpA对宿主多条途径的干扰在很大程度上帮助了结核菌逃逸宿主免疫并建立持留性感染。
在结核菌ptkA-ptpA-rv2235操纵子中,ptkA基因的缺失也使得结核菌在THP-1巨噬细胞中的生存能力下降,抑制吞噬体酸化的能力降低[28];而对于rv2235基因,异源表达了结核菌rv2235基因的耻垢分枝杆菌与野生型相比,能更有效地抵抗人巨噬细胞THP-1的杀伤[29],说明结核菌ptkA-ptpA- rv2235操纵子在结核菌感染宿主后发挥了重要的作用。
3 结核菌PtpA受多种翻译后修饰调控功能越重要,受到的调控就越严密。结核菌PtpA发挥如此重要的功能,因此也受到了多层面的调控。在蛋白磷酸化修饰方面,一方面是PtpA受蛋白酪氨酸磷酸激酶(Protein tyrosine kinase,PtkA)磷酸化调控[19]。PtkA由rv2232基因编码,分子量约30.5 kD,是结核菌中第一个被鉴定的蛋白酪氨酸激酶[19],也是目前已知的结核菌中唯一一个专一性磷酸化酪氨酸的蛋白激酶[部分真核样丝氨酸/苏氨酸蛋白激酶(eSTPK)为双特异性蛋白激酶,具有蛋白酪氨酸激酶活性[30]]。PtkA通过磷酸化Tyr128和Tyr129两个相邻酪氨酸残基位点来增强其酪氨酸磷酸酶活性[31]。另一方面,几个eSTPKs (PknA、PknB、PknD、PknH、PknE和PknL)能够对PtpA磷酸化,其中PknA通过对PtpA蛋白Thr45位点的磷酸化来增强其蛋白酪氨酸磷酸酶活性[31],而其它eSTPKs对PtpA的磷酸化则对其蛋白磷酸酶活性没有影响,但是否调控了其它如底物特性、底物亲和性等还有待进一步研究。
最新的研究还发现PtpA的半胱氨酸残基Cys53能够被巯基亚硝基化(S-亚硝基化)修饰,修饰后蛋白的稳定性、最大催化速率降低,但不改变其底物亲和性[32]。亚硝基化主要是由于NO与蛋白半胱氨酸残基上的巯基形成共价键,在宿主巨噬细胞中,NO是一种重要的杀菌物质,这也暗示宿主可能利用NO来对PtpA进行巯基亚硝基化修饰,尽可能抵消PtpA对宿主巨噬细胞的干扰。
4 结核菌PtpA是重要药靶,但其抑制剂的开发备受困扰由于PtpA对结核菌逃逸宿主免疫及建立持留性感染非常重要,而且PtpA被分泌进入宿主细胞,靶向PtpA的药物可以不用穿透结核菌厚而疏水的细胞壁,避免了药物穿透性差的问题;同时,药物在结核菌细胞外抑制PtpA的功能,避免药物对结核菌的直接作用而快速筛选产生耐药,因此PtpA早已成为抗结核新药开发的重要靶点[20, 33]。利用天然或合成小分子化合物库筛选、蛋白结构解析和靶向药物设计筛选及结构改造等,已经找到了一些有效的抑制剂,其中部分抑制剂对结核菌PtpA的半抑制浓度低至每升几微摩尔到几十微摩尔[20, 34]。然而,靶向结核菌PtpA最大的障碍在于抑制剂的“专一性”:结核菌PtpA蛋白与人的同源蛋白酪氨酸磷酸酶hLMW-PTP具有37%的一致性,且很多涉及酶活性的关键残基均较保守,特别是催化活性中心的C(X)5R(S/T)[20],所以很多PtpA的有效抑制剂都对宿主细胞具有不同程度的毒性,这就要求抑制剂必须具有很高的特异性;另一方面,PtpA很多抑制剂的结构在某种程度上都模拟了蛋白酪氨酸磷酸酶的底物,通常是高度带负电性的,这又很大程度上限制了抑制剂的细胞通透性[20]。
5 揭示结核菌PtpA转录调控机制及分泌机制将为阻断其功能提供新思路 5.1 研究结核菌PtpA转录调控机制具有重要意义结核菌ptkA-ptpA-rv2235基因操纵子片段排列在分枝杆菌属乃至放线菌目中高度保守。结核菌ptpA (rv2234)基因与ptkA (rv2232)和rv2235 (保守膜蛋白)基因在基因组中紧密顺序排列,3个基因之间存在首位重叠(图 2)。在已测序的分枝杆菌中分析发现,结核菌H37Rv中ptkA-ptpA-rv2235基因片段及其上游550 bp的序列在分枝杆菌中同样具有高度的保守性,即便是一些序列相似度较低的菌(海分枝杆菌、耻垢分枝杆菌等)中,3个基因的首位重叠关系也非常一致(图 2)。这样的基因排布在放线菌目中的红球菌属(Rhodococcus)、棒状杆菌属(Corynebacterium)、戈登氏菌属(Gordonia)、Amycolicicoccus和分枝杆菌属(Mycobacterium)等属中都很保守[35]。
|
| 图 2 结核菌ptkA-ptpA-rv2235操纵子序列分析 Figure 2 Sequence of Mtb ptkA-ptpA-rv2235 operon 注:括号中数值表示各菌中对应基因与结核菌中基因的相似度;绿色碱基代表起始密码,红色碱基代表终止密码,蓝色碱基代表起始密码子与终止密码子共用的碱基;这3个基因均出现重叠. Note: The values in brackets denote the sequence similarity with the genes in Mtb; The green and red bases represents the start code and stop code respectively, while the blue base is shared by start code and stop code. Gene overlap was shown between these genes. |
|
|
结核菌ptkA-ptpA-rv2235操纵子的启动子隐藏在其上游约550 bp序列中。Cowley等在将结核菌ptpA基因的启动子转入牛分枝杆菌BCG中检测转录情况时,引入的序列包括几乎全部ptpA基因(缺少3′端3个密码子序列)及其上游1 514 bp序列,因此也包括了整个ptkA基因序列及其上游547 bp序列(图 2)。这段序列能够在牛分枝杆菌BCG中启动转录,说明该操纵子的启动子序列和涉及转录因子结合的序列均包括在其上游547 bp序列中,而该段序列在快生型的耻垢分枝杆菌中却不能被启动[14]则说明结核菌中涉及ptpA基因转录调控因子或负责识别启动子序列的σ因子与耻垢分枝杆菌存在差异,但与牛分枝杆菌相同。然而,结核菌编码13个σ因子,我们对该操纵子上游的序列进行分析,并未发现目前基于实验和生物信息学分析得出的部分σ因子(如SigC、SigD、SigE、SigF、SigH和SigL)的启动子识别序列[36]。这可能是由于参与该基因启动子识别的是另外的σ因子,或者是目前报道的关于上述几种σ因子的识别序列还有限。针对ptkA-ptpA-rv2235操纵子转录调控,还有如下科学问题需要解答:(1)结核菌编码13个σ因子,是哪一个或哪几个负责该操纵子启动子的识别?识别序列是什么?(2)结核菌还编码约140个转录调控因子,有哪些会参与该操纵子的转录调控呢?调控机制是怎样的?(3) σ因子和转录调控因子通常缺乏信号感应能力,因此需要接受“上游蛋白”的信号指令,是哪一个或哪一些“上游蛋白”感应胞外或胞内信号,并指导和调控转录调控因子及σ因子对该操纵子的转录调控?揭示这些问题将有助于揭示结核菌在感染宿主后是如何启动该操纵子基因,特别是ptpA基因的转录,以适应和对抗宿主免疫杀伤这一重要过程,对了解结核菌的致病机理具有重要意义;同时,理清该操纵子转录调控通路,为进一步探索将其中重要的蛋白作为新的药物靶标,从源头上抑制PtpA奠定基础,以绕开直接靶向抑制PtpA蛋白本身面临的各种困难;再者,结核菌ptkA-ptpA-rv2235操纵子在分枝杆菌属及放线菌目中相对保守,其转录调控机制将为揭示其它细菌中该操纵子的转录调控提供参考。
5.2 研究结核菌PtpA分泌机制具有重要意义2002年,研究者就已经证实结核菌PtpA被结核菌分泌到胞外[14]。随后,鸟分枝杆菌亚种(Mycobacterium avium subsp. paratuberculosis)的PtpA同源蛋白Map-PtpA也被证实具有相同的蛋白酪氨酸磷酸酶活性,并在感染过程中分泌进入宿主[37]。但该蛋白在分枝杆菌及具有该保守蛋白的其它物种中,其分泌机制依然不清楚(图 3)。
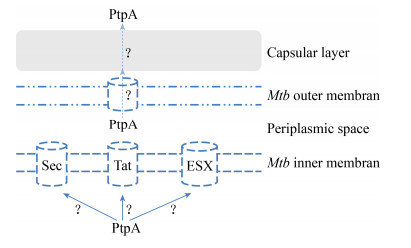
|
| 图 3 结核菌PtpA未知分泌机制 Figure 3 Unknown secretion mechanism of Mycobacterium tuberculosis PtpA |
|
|
结核菌拥有3种蛋白分泌系统,除在细菌中保守存在的Sec分泌系统(Sec1和Sec2)和双精氨酸分泌系统外,还具有独特的ESX分泌系统(ESX-1、ESX-2、ESX-3、ESX-4和ESX-5)[38]。在上述分泌系统中,具体是哪一个分泌系统介导了PtpA的分泌及其分泌机制仍不清楚。此外,结核菌除具有细菌典型的细胞质膜外,外面还依次包裹着具有分枝菌酸的外膜层及荚膜层(含阿拉伯甘露聚糖、α-葡聚糖、糖脂和蛋白等)[39]。PtpA经某一分泌系统转运跨过结核菌的内膜后是如何穿过结核菌外膜的(图 3)?是否还需要蛋白协助其穿越结核菌荚膜层?理清PtpA的分泌机制,将为进一步探索将其中重要的蛋白作为新的药物靶标,从源头上抑制PtpA奠定基础,以绕开直接靶向抑制PtpA蛋白本身面临的各种困难。同时,结核菌PtpA在分枝杆菌属及部分致病菌中相对保守,其分泌机制将为揭示其它细菌中该毒力因子的分泌机制提供参考。
6 展望综上所述,结核菌PtpA在介导结核菌调控和逃逸宿主免疫、帮助结核菌在宿主中存活并建立持留性感染等过程中发挥重要作用。对结核菌PtpA的研究长期以来多集中在其宿主相互作用蛋白的鉴定及调控通路的研究、药物设计及筛选评价等方面。然而,结核菌PtpA在分枝杆菌及其它很多非致病细菌中保守存在,这也暗示了PtpA对细菌本身可能也发挥了某些重要的生理功能,尽管目前在结核菌中对ptpA基因进行缺失突变后其体外生长并未受到影响,但可能还有很多生理表型没有被发掘。因此,对结核菌PtpA的研究,除上文中论述的对其转录调节机制及分泌机制进行研究之外,还有必要进一步研究PtpA是否对结核菌细胞自身发挥什么功能,这可以从进一步鉴定PtpA在结核菌中的去磷酸化底物蛋白着手,揭示其细胞生理功能,为揭示PtpA在其它微生物中的生理作用提供参考。
| [1] |
WHO. Global tuberculosis report 2018[R]. Geneva: WHO, 2018.
|
| [2] |
Sturgill-Koszycki S, Schlesinger PH, Chakraborty P, et al. Lack of acidification in Mycobacterium phagosomes produced by exclusion of the vesicular proton-ATPase[J]. Science, 1994, 263(5147): 678-681. DOI:10.1126/science.8303277 |
| [3] |
Poirier V, Av-Gay Y. Mycobacterium tuberculosis modulators of the macrophage's cellular events[J]. Microbes and Infection, 2012, 14(13): 1211-1219. DOI:10.1016/j.micinf.2012.07.001 |
| [4] |
Korb VC, Chuturgoon AA, Moodley D. Mycobacterium tuberculosis: manipulator of protective immunity[J]. International Journal of Molecular Sciences, 2016, 17(3): 131. DOI:10.3390/ijms17030131 |
| [5] |
Russell DG. Mycobacterium tuberculosis and the intimate discourse of a chronic infection[J]. Immunological Reviews, 2011, 240(1): 252-268. |
| [6] |
Armstrong JA, Hart PD. Response of cultured macrophages to Mycobacterium tuberculosis, with observations on fusion of lysosomes with phagosomes[J]. Journal of Experimental Medicine, 1971, 134(3): 713-740. DOI:10.1084/jem.134.3.713 |
| [7] |
Moreno C, Mehlert A, Lamb J. The inhibitory effects of mycobacterial lipoarabinomannan and polysaccharides upon polyclonal and monoclonal human T cell proliferation[J]. Clinical and Experimental Immunology, 1988, 74(2): 206-210. |
| [8] |
Saini NK, Baena A, Ng TW, et al. Suppression of autophagy and antigen presentation by Mycobacterium tuberculosis PE_PGRS47[J]. Nature Microbiology, 2016, 1(9): 16133. DOI:10.1038/nmicrobiol.2016.133 |
| [9] |
Sibley LD, Hunter SW, Brennan PJ, et al. Mycobacterial lipoarabinomannan inhibits gamma interferon-mediated activation of macrophages[J]. Infection and Immunity, 1988, 56(5): 1232-1236. |
| [10] |
Feng JY, Pan SW, Huang SF, et al. Depressed gamma interferon responses and treatment outcomes in tuberculosis patients: a prospective cohort study[J]. Journal of Clinical Microbiology, 2018, 56(10): e00664-18. |
| [11] |
Chan J, Fan XD, Hunter SW, et al. Lipoarabinomannan, a possible virulence factor involved in persistence of Mycobacterium tuberculosis within macrophages[J]. Infection and Immunity, 1991, 59(5): 1755-1761. |
| [12] |
Zhai WJ, Wu FJ, Zhang YY, et al. The immune escape mechanisms of Mycobacterium tuberculosis[J]. International Journal of Molecular Sciences, 2019, 20(2): 340. DOI:10.3390/ijms20020340 |
| [13] |
Koul A, Choidas A, Treder M, et al. Cloning and characterization of secretory tyrosine phosphatases of Mycobacterium tuberculosis[J]. Journal of Bacteriology, 2000, 182(19): 5425-5432. DOI:10.1128/JB.182.19.5425-5432.2000 |
| [14] |
Cowley SC, Babakaiff R, Av-Gay Y. Expression and localization of the Mycobacterium tuberculosis protein tyrosine phosphatase PtpA[J]. Research in Microbiology, 2002, 153(4): 233-241. DOI:10.1016/S0923-2508(02)01309-8 |
| [15] |
Castandet J, Prost JF, Peyron P, et al. Tyrosine phosphatase MptpA of Mycobacterium tuberculosis inhibits phagocytosis and increases actin polymerization in macrophages[J]. Research in Microbiology, 2005, 156(10): 1005-1013. DOI:10.1016/j.resmic.2005.05.013 |
| [16] |
Wang J, Li BX, Ge PP, et al. Mycobacterium tuberculosis suppresses innate immunity by coopting the host ubiquitin system[J]. Nature Immunology, 2015, 16(3): 237-245. DOI:10.1038/ni.3096 |
| [17] |
Wang J, Teng JLL, Zhao DD, et al. The ubiquitin ligase TRIM27 functions as a host restriction factor antagonized by Mycobacterium tuberculosis PtpA during mycobacterial infection[J]. Scientific Reports, 2016, 6: 34827. DOI:10.1038/srep34827 |
| [18] |
Wong D, Bach H, Sun J, et al. Mycobacterium tuberculosis protein tyrosine phosphatase (PtpA) excludes host vacuolar-H+-ATPase to inhibit phagosome acidification[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(48): 19371-19376. DOI:10.1073/pnas.1109201108 |
| [19] |
Bach H, Wong D, Av-Gay Y. Mycobacterium tuberculosis PtkA is a novel protein tyrosine kinase whose substrate is PtpA[J]. Biochemical Journal, 2009, 420(2): 155-160. |
| [20] |
Wong D, Chao JD, Av-Gay Y. Mycobacterium tuberculosis- secreted phosphatases: from pathogenesis to targets for TB drug development[J]. Trends in Microbiology, 2013, 21(2): 100-109. DOI:10.1016/j.tim.2012.09.002 |
| [21] |
Poirier V, Bach H, Av-Gay Y. Mycobacterium tuberculosis promotes anti-apoptotic activity of the macrophage by PtpA protein-dependent dephosphorylation of host GSK3α[J]. Journal of Biological Chemistry, 2014, 289(42): 29376-29385. DOI:10.1074/jbc.M114.582502 |
| [22] |
Margenat M, Labandera AM, Gil M, et al. New potential eukaryotic substrates of the mycobacterial protein tyrosine phosphatase PtpA: hints of a bacterial modulation of macrophage bioenergetics state[J]. Scientific Reports, 2015, 5: 8819. DOI:10.1038/srep08819 |
| [23] |
Wang J, Ge PP, Qiang LH, et al. The mycobacterial phosphatase PtpA regulates the expression of host genes and promotes cell proliferation[J]. Nature Communications, 2017, 8: 244. DOI:10.1038/s41467-017-00279-z |
| [24] |
Bach H, Papavinasasundaram KG, Wong D, et al. Mycobacterium tuberculosis virulence is mediated by PtpA dephosphorylation of human vacuolar protein sorting 33B[J]. Cell Host & Microbe, 2008, 3(5): 316-322. |
| [25] |
Srivastava V, Rouanet C, Srivastava R, et al. Macrophage-specific Mycobacterium tuberculosis genes: identification by green fluorescent protein and kanamycin resistance selection[J]. Microbiology, 2007, 153(3): 659-666. DOI:10.1099/mic.0.2006/000547-0 |
| [26] |
Talaat AM, Lyons R, Howard ST, et al. The temporal expression profile of Mycobacterium tuberculosis infection in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(13): 4602-4607. DOI:10.1073/pnas.0306023101 |
| [27] |
Grundner C, Cox JS, Alber T. Protein tyrosine phosphatase PtpA is not required for Mycobacterium tuberculosis growth in mice[J]. FEMS Microbiology Letters, 2008, 287(2): 181-184. DOI:10.1111/j.1574-6968.2008.01309.x |
| [28] |
Wong D, Li W, Chao JD, et al. Protein tyrosine kinase, PtkA, is required for Mycobacterium tuberculosis growth in macrophages[J]. Scientific Reports, 2018, 8(1): 155. DOI:10.1038/s41598-017-18547-9 |
| [29] |
Miller BH, Shinnick TM. Identification of two Mycobacterium tuberculosis H37Rv ORFs involved in resistance to killing by human macrophages[J]. BMC Microbiology, 2001, 1: 26. DOI:10.1186/1471-2180-1-26 |
| [30] |
Kusebauch U, Ortega C, Ollodart A, et al. Mycobacterium tuberculosis supports protein tyrosine phosphorylation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(25): 9265-9270. DOI:10.1073/pnas.1323894111 |
| [31] |
Zhou PF, Li W, Wong D, et al. Phosphorylation control of protein tyrosine phosphatase A activity in Mycobacterium tuberculosis[J]. FEBS Letters, 2015, 589(3): 326-331. DOI:10.1016/j.febslet.2014.12.015 |
| [32] |
Matiollo C, Ecco S, Menegatti ACO, et al. S-nitrosylation of Mycobacterium tuberculosis tyrosine phosphatase A (PtpA) induces its structural instability[J]. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, 2013, 1834(1): 191-196. DOI:10.1016/j.bbapap.2012.10.007 |
| [33] |
Mascarello A, Chiaradia-Delatorre LD, Mori M, et al. Mycobacterium tuberculosis-secreted tyrosine phosphatases as targets against tuberculosis: exploring natural sources in searching for new drugs[J]. Current Pharmaceutical Design, 2016, 22(12): 1561-1569. DOI:10.2174/1381612822666160112130539 |
| [34] |
Sens L, de Souza ACA, Pacheco LA, et al. Synthetic thiosemicarbazones as a new class of Mycobacterium tuberculosis protein tyrosine phosphatase A inhibitors[J]. Bioorganic & Medicinal Chemistry, 2018, 26(21): 5742-5750. |
| [35] |
Chao JD, Wong D, Av-Gay Y. Microbial protein-tyrosine kinases[J]. Journal of Biological Chemistry, 2014, 289(14): 9463-9472. DOI:10.1074/jbc.R113.520015 |
| [36] |
Rodrigue S, Provvedi R, Jacques PÉ, et al. The σ factors of Mycobacterium tuberculosis[J]. FEMS Microbiology Reviews, 2006, 30(6): 926-941. DOI:10.1111/j.1574-6976.2006.00040.x |
| [37] |
Bach H, Sun J, Hmama Z, et al. Mycobacterium avium subsp. paratuberculosis PtpA is an endogenous tyrosine phosphatase secreted during infection[J]. Infection and Immunity, 2006, 74(12): 6540-6546. DOI:10.1128/IAI.01106-06 |
| [38] |
van der Woude AD, Luirink J, Bitter W. Getting across the cell envelope: mycobacterial protein secretion[A]//Pieters J, McKinney JD. Pathogenesis of Mycobacterium Tuberculosis and its Interaction with the Host Organism[M]. Berlin, Heidelberg: Springer, 2012: 109-134
|
| [39] |
Sani M, Houben ENG, Geurtsen J, et al. Direct visualization by cryo-EM of the mycobacterial capsular layer: a labile structure containing ESX-1-secreted proteins[J]. PLoS Pathogens, 2010, 6(3): e1000794. DOI:10.1371/journal.ppat.1000794 |
 2019, Vol. 46
2019, Vol. 46