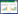扩展功能
文章信息
- 庄炜, 杨雪琴, 于晓莉, 颜庆云, 连英丽, 王成, 钟秋萍, 贺志理
- ZHUANG Wei, YANG Xue-Qin, YU Xiao-Li, YAN Qing-Yun, LIAN Ying-Li, WANG Cheng, ZHONG Qiu-Ping, HE Zhi-Li
- 微生物驱动的滨海湿地N2O产生及其机制研究进展
- N2O generation by microbes in coastal wetlands: a review
- 微生物学通报, 2019, 46(12): 3440-3452
- Microbiology China, 2019, 46(12): 3440-3452
- DOI: 10.13344/j.microbiol.china.190130
-
文章历史
- 收稿日期: 2019-02-24
- 接受日期: 2019-06-17
- 网络首发日期: 2019-07-15
2. 南方海洋科学与工程广东省实验室(珠海) 广东 珠海 519000;
3. 湖南农业大学农学院 湖南 长沙 410128;
4. 中山大学南海研究院 广东 广州 510275
2. Southern Marine Science and Engineering Guangdong Laboratory (Zhuhai), Zhuhai, Guangdong 519000, China;
3. College of Agronomy, Hunan Agricultural University, Changsha, Hunan 410128, China;
4. South China Sea Institution, Sun Yat-Sen University, Guangzhou, Guangdong 510275, China
一氧化二氮(Nitrous oxide,N2O)作为仅次于二氧化碳(CO2)和甲烷(CH4)的第三大温室气体,其增温潜势约是二氧化碳的298倍,是甲烷的12倍[1]。联合国政府间气候变化专门委员会(Intergovernmental panel on climate change,IPCC)报告显示,大气中的N2O以每年0.2%−0.3%的速度增长,使得全球气候变暖问题日趋严峻[2]。此外,N2O可通过迁移扩散进入平流层,并在太阳能的作用下与臭氧(O3)发生一系列光化学反应生成氮氧化物,导致O3不断消耗,从而破坏臭氧层[3]。N2O与O3生成的各类氮氧化物可继续与空气中的氧分子和水分子发生化学反应生成硝酸,继而融入雨水中形成酸雨。此外,在一定气象条件下,N2O极易转换成二次污染颗粒形成雾霾[3],对大气环境具有复合污染效能。因此,N2O的产生和排放对全球气候变化至关重要。
滨海湿地是陆地向海洋过渡的一类特殊的生态系统,包括河口、红树林、盐沼、潮汐盐湿地和新生潮汐湿地等,是独特的动态过滤器和营养转换器,承接着来自陆地中人类活动带来的大量含氮物质,在全球氮生物地球化学循环中发挥着重要作用。滨海湿地可通过反硝化、硝化、硝化-反硝化耦合等途径产生N2O,被认为是N2O重要的自然来源。随着人类活动的增加,滨海湿地氮负荷增加明显刺激了微生物的代谢过程,导致N2O排放明显增加[4]。因此,深入研究滨海湿地N2O排放具有重要的生态意义。
滨海湿地中N2O具有多种产生途径,目前研究较多的包括:硝化中间产物NH2OH氧化产生N2O[5];硝化菌反硝化过程产生N2O[5];硝化-反硝化耦合产生N2O[6]。近年来,陆续有新的N2O产生过程相继被报道,如好氧反硝化和部分亚硝化厌氧氨氧化过程产生N2O[7]。由于滨海湿地系统中碳、氮、硫循环活跃,氮循环与碳、硫循环及金属元素循环耦合也可能产生N2O。碳、氮循环产生的简单有机质可被用作氮、硫及金属循环的营养、能量或电子供体,如反硝化型厌氧甲烷氧化(Denitrifying anaerobic methane oxidation,DAMO)过程以甲烷为电子供体,能达到脱氮、减缓温室效应的目的[8]。随着分子生态学技术的快速发展,近年来对滨海湿地N2O的研究有了新的进展,因此,本文将对滨海湿地微生物介导的N2O产生过程、排放机制及时空变化进行综述,并对相关领域的发展进行讨论。
1 微生物驱动的滨海湿地N2O产生过程微生物驱动的N2O产生机制研究始于20世纪70年代,在农田、草地和森林生态系统中研究较为深入,而对滨海湿地生态系统N2O的产生及排放机制研究较少。尽管滨海湿地生态系统的时空多变与微生物复杂的相互作用使得微生物驱动的氮循环及N2O产生过程和机制尚不明晰,但目前参与滨海湿地N2O产生的关键微生物及相关过程已相继被报道。
1.1 滨海湿地中介导N2O产生的关键微生物研究表明参与滨海湿地N2O产生过程的相关微生物种类繁多,主要是在反硝化、硝化及其他相关氮循环过程的功能微生物(图 1)[5, 9-10]。其中,具有反硝化功能的微生物多为兼性厌氧化能异养菌,例如芽孢杆菌属(Bacillus)、弧菌属(Vibrio)、黄杆菌属(Flavobactrium)、假单胞菌属(Pseudomonas)、产碱杆菌属(Alcalogenes)、微球菌(Micrococcus)、产气单胞菌属(Aeromonas)、气杆菌属(Aerobacter)、短杆菌(Brevibacterium)等。它们产生的N2O主要以反硝化作用中间产物的形式出现,但对于另一些类别反硝化功能微生物,例如铜绿假单胞菌(Pseudomonas aeruginosa),它产生的N2O则是作为反硝化作用的最终产物[11]。

|
| 图 1 滨海湿地生态系统中N2O产生和氮循环的主要过程及其功能微生物 Figure 1 The schematic representation of major microbial pathways and microbes for N2O production and nitrogen cycling in coastal wetland ecosystems 注:氨(羟胺)氧化和硝化反硝化(AOA:氨氧化古菌;AOB:氨氧化细菌)、硝化反硝化、亚硝酸盐氧化(NOB:亚硝酸氧化细菌)、反硝化(异养菌)、硝酸盐异化还原铵(DNRA:硝酸盐异化还原菌)、厌氧氨氧化(Anammox:厌氧氨氧化菌)和全程硝化(Comammox:全程硝化菌)等途径. Note:The pathways include ammonium (Hydroxylamine) oxidation (AOA and AOB) and nitrifier denitrification, nitrite oxidation (NOB), heterotrophic denitrification (Heterotrophic bacteria), anammox (Anaerobic ammonia oxidizers), dissimilatory nitrate reduction to ammonium (Dissimilatory nitrate reducing bacteria, DNRA) and complete ammonia oxidation (Comammox, by complete ammonia oxidizers). |
|
|
氨氧化过程是由氨氧化古菌(Ammonia oxidizing archaea,AOA)或氨氧化细菌(Ammonia oxidizing bacteria,AOB)执行。滨海湿地生态系统中AOA的主要优势菌属包括Nitrosopumilus、Nitrosophsera、Nitrosocaldus、Nitrosotalea,而AOB包括β-变形菌纲的亚硝化单胞菌(Nitrosomonas)与亚硝化螺菌属(Nitrosospira)以及γ-变形菌纲的亚硝化球菌属(Nitrosococcus)等[12]。其中AOA只能通过中间产物NO和羟胺的非生物反应产生N2O[13],而AOB可以在硝化-反硝化耦合作用中产生N2O,也可以在羟胺氧化中产生的一氧化氮还原酶(Nor)的催化作用下产生N2O。此外,在AOB和全程硝化菌培养中,N2O也可以通过细胞外中间产物NO和羟胺的非生物反应产生[14]。此外,硝化过程、硝化-反硝化耦合过程、硝化菌反硝化过程以及好氧反硝化过程等都与N2O的产生息息相关,但关于滨海湿地在这些过程中产生N2O的功能微生物报道较少,原因可能为区分这些过程中产生N2O的功能微生物具有一定困难,而且参与氮转化的微生物存在多种多样的新陈代谢功能,很多微生物可以同时参与氮循环的多个过程[5, 15](图 1)。
1.2 滨海湿地氮循环中N2O的产生过程随着工业化的发展,外源氮输入的增加改变了滨海湿地土壤的碳氮比,进而影响N2O的排放。大量研究表明,随着滨海湿地外源氮的增加,沉积物中NH4+-N和NO3−-N含量增加,微生物硝化、反硝化过程活跃,导致N2O产生速率明显增加,这一现象在波多黎各红树林沉积物[16]、美国南卡罗来那滨海平原[17]和我国三江沼泽湿地[18]都已观察到。但也有相关研究发现,过量的氮输入对硝化和反硝化过程均有抑制作用[18]。因此,目前关于外源氮输入对滨海湿地N2O产生的影响仍不明确。
N2O的产生及转化受氮循环途径中多个过程的影响,比如反硝化过程、硝化过程、硝化-反硝化耦合过程、好氧反硝化过程、厌氧氨氧化过程等,了解各个氮素转化过程(固氮过程、硝化过程、反硝化过程、厌氧氨氧化过程、氨氧化过程、同化过程)的氮通量有助于了解滨海湿地N2O的产生潜力,而各个氮素转化过程的关键基因与酶则可以促进对每个反应过程的定性分析与研究。氮循环相关过程的全球氮通量及对应的基因/酶总结见表 1。
| 氮素转化过程Nitrogen-transforming processes | 陆地氮通量Terrestrial nitrogen flux (Tg/year) | 海洋氮通量Marine nitrogen flux (Tg/year) | 基因/酶Gene/Enzyme | 参考文献Reference |
| Nitrogen fixation | 110 | 180 | nifHDK; anfHGDK; vnfHGDK; nifH | [19] |
| Nitrification | 990 | 6 000 | amoA; hao; nxrB; nirK | [5] |
| Denitrification | 430 | 2 125 | narG; nirS; nirK; norB; nosZ | [19] |
| Anammox | 0 | 125 | hzo; Nir; Nor | [5] |
| Ammonification | 1 450 | 8 800 | hcp; norZ; gdh; ureC; cNor; qNor; CuANor; P450Nor; Hcp; NO-D | [20] |
| Assimilation | 2 110 | 12 800 | Nas/nasA; cNir; Cyn/cynS; Ure/ureABC | [21] |
虽然与其他形式的氮通量相比,N2O的氮通量相对较小,但是它对环境影响却很大[3]。在各个氮素转化过程中,海洋氮通量显著高于陆地氮通量,尤其是与N2O产生密切相关的反硝化过程与氨氧化过程(表 1)。河口和沿海湿地面积仅占海洋区域的20%,但滨海湿地的N2O通量却占海洋总量的一半以上[5],因此需加强对滨海湿地氮循环产生N2O相关过程的了解及研究,以便进一步探究N2O的产生及排放机制。
1.2.1 氮循环产生N2O的常见过程及其机制氮循环过程产生的N2O是大气中N2O的主要来源,可产生N2O的常见过程主要包括反硝化细菌反硝化过程、硝化菌反硝化过程、好氧反硝化过程、硝化过程以及硝化-反硝化耦合过程等。其中,反硝化是把NO3−等含氮化合物还原为NO2、NO、N2O及N2的过程[5],被认为是沿海湿地生态系统中N损失的主要机制[22]。反硝化过程不仅限于细菌,某些真菌也能进行反硝化活动,其反硝化系统在含铜亚硝酸盐还原酶(NirK)和P450一氧化氮还原酶的共同作用下,可将亚硝酸盐还原为N2O[23]。但Wrage等[24]认为在高含氮量、低有机物、低O2和低pH的生境中,由硝化菌反硝化过程(NH3→NH2OH→NO2−→NO→N2O)产生的N2O占N2O总产量的30%之多。因此,在滨海湿地这一高含氮量与低有机物的生境中,由硝化菌驱动的反硝化过程也可能是N2O的一个重要来源。
硝化作用的第一步为氨氧化(NH3→NH2OH/ HNO→N2O→NO2−),由amoA编码的单氧酶(Amo)催化氨氧化过程,此过程是由氨氧化细菌(AOB)[25-27]和氨氧化古生菌(AOA)[28]完成,N2O的来源为NH2OH不完全氧化成NO2−的副产物或者AOB反硝化的最终产物[29]。有研究表明,由于硝化作用的影响,退潮时滨海湿地沉积物中N2O过饱和度较涨潮时高出约10倍[30]。此外,滨海湿地土壤反硝化作用一般受到NO3−供给的限制[31],而NO3−是反硝化过程产生N2O的关键底物,因此硝化-反硝化耦合作用(Nitrification-coupled denitrification,NCD:NH3→NH2OH→NO2−→NO3−→NO2−→NO →N2O)[32]对滨海湿地N2O的产生至关重要。已有研究表明河口沉积物中的硝化-反硝化(NCD)过程通过产生N2O造成了大量的氮损失,在某些情况下去除了10%−80%的人为氮污染[33]。
研究表明,在滨海湿地生态系统中,当底泥含有高浓度铵和Eh呈正值时,N2O的产生主要归因于硝化作用[16, 34];而当底泥硝酸盐含量高且沉积物Eh为负值时,N2O的产生主要归因于反硝化作用[35]。现在关于滨海湿地硝化过程、反硝化过程以及硝化-反硝化耦合过程产N2O机制的研究已有很多,但仍然无法准确区分这些途径分别产生的N2O[4]。因此需要进一步借助同位素示踪和合成微生物群落,对滨海湿地氮循环中N2O产生及调控机制进行深入研究。
1.2.2 氮循环中N2O产生的其他可能机制由于周期性的潮汐作用,滨海湿地生态系统具有时空多变性以及微生物种类多的特点。例如,与海洋生境类似,滨海湿地沉积物容易形成厌氧环境,厌氧氨氧化过程也极有可能存在于滨海湿地生境中,成为全球N2O产生的重要来源。
厌氧氨氧化过程产生N2O也称为去毒过程[36-37]。厌氧氨氧化(Anammox)途径(NO2−→NO+NH4+→ N2H4→N2)包括还原亚硝酸盐和铵的电子供体肼(N2H4),随后氧化为N2,滨海湿地此过程一般是由生长缓慢的Candidatus scalindua属的细菌介导[38-39]。中间产物NO可作为氧化还原酶在AOA、AOB、NOB、反硝化细菌或异化硝酸还原(Dissimilatory nitrate reduction to ammonium,DNRA)细菌产生N2O的重要底物,但其不能被Anammox细菌直接还原[40]。由于AOA含有亚硝酸盐还原酶(Nir)的同源基因[41],并且能编码参与硝化-反硝化的NO还原酶(Nor)的基因,所以它们也可以产生N2O[42-43]。
全程硝化过程(NH3→NH2OH/HNO→NO2−→ NO3−)[38]主要由全程氨氧化微生物执行。研究表明,Comammox在土壤中与AOB、AOA共存,并且均利用氨作为氮源,利用CO2作为碳源,所以它们之间很可能存在着对底物和能源的竞争,进一步增加了硝化过程产生N2O的复杂进程[44]。此外,Comammox可主导硝化作用全过程,输出硝态氮,为反硝化作用提供反应底物[45]。因此,全程硝化过程为反硝化提供底物产生N2O的比例,以及是否存在全程硝化过程与反硝化过程的耦合等都需要进一步的研究。
虽然滨海湿地中关于厌氧氨氧化过程及完全反硝化过程的研究较少,但以上过程产N2O的相关机理在实验室纯培养[46-47]、海洋[48-49]、污水反应器[36]等已有研究,因此急需找到滨海湿地这些过程中的分子标记与功能微生物,进一步研究滨海湿地通过产生厌氧氨氧化和完全硝化过程产生N2O的关键微生物类型及其相关机制。
1.3 滨海湿地氮循环与碳、硫和金属元素循环耦合过程的N2O产生在滨海湿地生态系统中,氮循环与碳(C)、硫(S)循环及重金属氧化耦合的过程也可能产生N2O,如甲烷氧化、硫氧化与反硝化的耦合过程[50-51];铁耦合反硝化、厌氧氨氧化的过程以及锰耦合厌氧氨氧化的过程都能生成N2O或N2,从而去除氮素[52-53]。
1.3.1 碳-氮耦合过程N2O产生及其可能机制湿地生态系统碳储量约为770×108 t,占全球的20%–30%,占陆地生物圈碳素的35%,是全球最大的碳库[54]。在许多生态系统中,亚硝酸盐型甲烷厌氧氧化(N-DAMO)过程以甲烷为电子供体,与反硝化耦合产生N2O[50]而达到脱氮的目的[55]。此外,与氨氧化细菌相似,在羟胺氧化和亚硝酸盐还原过程中,嗜甲烷细菌也可通过一氧化氮还原酶(Nor)催化产生N2O[56]。目前甲烷氧化与反硝化耦合过程的微生物群落主要从淡水生态系统中富集[50, 57],由宏基因组序列确定,所有富集培养物都由NC 10门组成[58],但在世界范围内关于这些细菌存在于滨海湿地的报道较少[50]。
硝酸盐还原为亚硝酸盐的基因(narGHJI,napAB)、亚硝酸转化为NO的基因(nirSJFD/GH/L)以及NO转化为N2O的基因(norZ,qnor)都在NC 10的基因组中存在,相关蛋白Nap、Nir和Nor也有表达,但缺失了N2O还原为N2的基因簇(nosZDFY)[50]。这表明甲烷氧化与反硝化耦合过程的微生物(NC 10)具有产生N2O的潜力,可能是滨海湿地产生N2O的一个重要自然来源。
甲烷厌氧氧化(Anaerobic methane oxidation,AMO)与反硝化反应常发生在沉积物中氧/缺氧界面附近,如滨海湿地的水陆交接处。AMO与细菌反硝化作用耦合的相关报道表明,甲氧基可能在低氧条件下将甲烷氧化为甲醇或乙酸酯,从而驱动反硝化作用[55]。
1.3.2 硫-氮耦合过程N2O产生及其可能机制滨海湿地中硫元素含量较高,主要来源于包括动植物体被微生物分解利用释放的硫以及海水周期性涨落潮带来的硫酸盐。随着沉积物深度的增加,生物可利用的氧气浓度越来越低,盐度和总硫含量逐渐增加[59]。
在富含NO3−和NO2−且缺氧的条件下,硫化物氧化与硝酸盐还原有很强的耦合作用[60],SO42−可以快速地被还原,随后迅速地被氧化,该过程中NO3−和NO2−被还原产生N2O[51]。在Saanich湾河口湿地硫化物含量较低但富含硝酸盐的土壤沉积物中,已经发现了一个具有完整硫化物氧化和硝酸盐还原基因的微生物群落[60]。此外,硫酸盐还原耦合氮循环产生的NO3−,也可作为反硝化等过程细菌产生N2O的反应底物。研究表明,硫化物氧化速率和硝酸还原亚硝酸盐速率由硫化物的浓度决定,硫化物的添加可加强硝酸盐还原为N2O的能力[60]。
最近研究表明,海洋中存在自发进行的硫-氮耦合过程[61],这种过程类似于在其他强氧化还原的滨海湿地沉积物系统中观察到的硫化物/硝酸盐界面的氮硫循环。与此同时,也有研究证明亚硝酸盐、N2和N2O可能都是这种耦合过程的产物[61-62],可以推测,滨海湿地沉积物中富含硝酸盐的无氧区域,也可能存在硫-氮耦合产生N2O的过程。
1.3.3 氮-铁耦合过程N2O产生及其可能机制铁与氮循环密切相关,现在关于氮-铁耦合机制研究比较成熟的包括:与Fe(Ⅲ)耦合的厌氧氨氧化(AAOFe)、与Fe(Ⅱ)耦合的氨氧化(Feammox)以及反硝化(NDFO)过程。Fe(Ⅱ)为反硝化过程贡献的电子比例可高达30%[63],Fe(Ⅲ)则可以促进厌氧氨氧化过程产生NO3−、NO2−或N2[64-66]。可见,氮-铁耦合过程可为滨海湿地产生N2O的关键微生物提供大量的电子受体以及丰富的底物。
(1) 氨氧化与Fe(Ⅲ)还原耦合的微生物过程(Feammox)可以产生氮气(N2)或NO2−[66],产生的NO2−可通过反硝化作用转化为N2O。已有研究证实滨海湿地生态系统中Feammox的存在,并发现其主要影响因素为潮汐涨落以及TOC含量[67]。
(2) 厌氧氨氧化过程还可以耦合Fe(Ⅲ)产生NO3−、NO2−或N2[64-66] (AAOFe),但仍不清楚在滨海湿地此过程是否产生N2O,以及产生的N2O是由厌氧氨氧化菌直接产生,还是由于NO的解毒作用产生。在许多生态系统中都发现了这一过程,例如滨海湿地土壤[65-66, 68]、旱地土壤[69]和连续流膜反应器[70]。尤其是在富含铁酸盐等低晶铁矿物的环境下,厌氧氨氧化可以与铁还原相结合[52]。与已知的3种微生物过程(硝化、反硝化和厌氧氨氧化)类似,AAOFe在氮损失中也起着重要的作用,能生成N2O或N2从而去除氮素[52]。AAOFe产生N2O存在两种可能的机制:NH4+氧化耦合铁还原和利用铁氧化释放的O2进行NH4+氧化直接产生N2O,或通过生成NO3−和NO2−为反硝化反应产生N2O提供底物。
(3) 硝酸盐-亚铁耦合反应NDFO (Nitrate- dependent Fe(Ⅱ) oxidation)包括生物过程和非生物过程:生物过程中Fe(Ⅱ)可被多种反硝化微生物氧化产生N2O和N2[71];在非生物过程中,亚硝酸盐与Fe(Ⅱ)发生化学反硝化产生NO和N2O[72]。
在NDFO过程中,如果有合适的电子受体可供硝化细菌使用,Fe(Ⅱ)可以直接向硝酸盐提供电子[73]。此外,N2O作为一种有效的电子受体,可以在NDFO过程中与Fe(Ⅱ)反应。而且Fe(Ⅱ)提供的电子与硝酸盐生成N2O所接受的电子的比率为130.7%[63],说明Fe(Ⅱ)提供的电子超过了生成N2O所需要的电子。N2O可以接受Fe(Ⅱ)提供的多余电子,进一步还原为N2。因此,通过比较Fe(Ⅱ)提供的电子以及硝酸盐产生N2O所需要的电子数量可以看出,在淹水沉积物中高浓度的Fe(Ⅱ)有助于彻底脱氮,降低N2O排放。Fe(Ⅱ)作为电子供体在反硝化过程中起着重要的作用,在富含Fe(Ⅱ)的情况下可以减少滨海湿地沉积物N2O的排放。因此,氮-铁耦合过程作为一种被遗忘的N2O产生途径[74],可能对滨海湿地N2O排放的调控起重要的作用。
1.3.4 氮-锰耦合过程N2O产生及其可能机制锰氧化物(Manganese oxide)作为一种强有力的氧化剂,可以在氮循环中改变或创造新的氧化途径[75],锰可以作为电子受体在厌氧条件下参与硝化反应,产生NO3−[75]或N2[76],进而与氮循环耦合。
在滨海湿地生态系统中,锰氧化物含量较高[53]。有研究发现厌氧锰氧化物促进了Arcachon湾(西南大西洋法国海岸)淤泥质潮间带沉积物的硝化与反硝化作用,包括锰氧化物和硝酸盐的还原以及潜在的厌氧反硝化作用[76]。通过富集分离得到菌株的脱氮微生物M4AY14可以在硝酸盐缺乏的情况下促进NO3−的产生,并可以将产生的NO3−进一步还原为N2O。此外,该海岸沉积物大多数其他分离物都隶属于Shewanella属,能够同时利用硝酸盐和锰氧化物作为电子受体,参与反硝化反应[76]。一些滨海湿地沉积物中NH4+的浓度是氮氧化物的100多倍,沉积物可通过厌氧氨氧化耦合锰还原产生N2O,以减少NH4+的积累[53]。可见在滨海湿地沉积物中,锰耦合反硝化过程或厌氧氨氧化过程可增加温室气体N2O的产生。但由于氮、锰循环中锰氧化物介导的反硝化过程与厌氧氨氧化过程不同微生物群落间相互作用的复杂性,氮-锰耦合过程介导的N2O产生及其机制需进一步研究。
2 滨海湿地N2O排放时空动态滨海湿地由于地形地貌的差异、海洋和河流的交汇及潮汐作用,各种理化性质在不同时空差异极大[77],从而影响微生物多样性的分布及功能,导致滨海湿地N2O排放的时间及空间动态变化,其近年来的研究见表 2。
| 湿地类型Marsh type | 地点Location | 生长植被/生境Vegetation/ecosystem | N2O通量N2O fluxes (mg/(m2·h)) | 观测季节Observation season | 参考文献Reference |
| Coastal marsh | Yellow River estuary, China | Phragmites australis, Suaeda salsa, Tamarix chinensis | 0.011 7 (−0.005 1−0.080 5) | Spring | [78] |
| Yangtze River estuary, China | Scirpus mariqueter | 0.069 9 | Summer | [79] | |
| Mudflat | −0.027 6 | Autumn | [80] | ||
| P. australi, S. mariqueter | (−0.009 6−0.007 9) | ||||
| Min River estuary, China | Cyperus malaccensis | (0.019 5−0.051 4) | Autumn | [81] | |
| Spartina alterniflora | 0.010 8 (−0.023 0−0.046 6) | Autumn | [82] | ||
| 0.009 2 (0.003 7−0.015 7) | Spring | ||||
| Dagu estuary (Jiaozhou Gulf), China | P. australis | (−0.128 9−0.151 1) | Winter | [83] | |
| Eastern Antarctica (coastal tundra marsh) | Wolong Wet tundra | 0.006 9 (−0.020 6−0.085 6) | Winter | [84] | |
| Mesic tundra | 0.001 8 (−0.005 3-0.050 8) | ||||
| Dry tundra | 0.019 8 (0.006 4−0.027 1) | ||||
| 0.024 8 (0.012 8−0.039 8) | |||||
| Tuanjie Ponds | 0.000 041 (−0.005 9−0.012 6) | ||||
| Shallow fens | 0.010 5 (−0.003 6−0.012 1) | ||||
| Lake Nakaumi (coastal lagoon), Japan | Carex rugulosa, P. australis, Solidago altissima | 0.02 (−0.01−0.06) | Summer | [85] | |
| Sand shore | 0.03 (0.02−0.05) | ||||
| Fildes Peninsula, Maritime Antarctic | Adenocystis utricularis | 0.001 8 (0.000 8−0.002 5) | Winter | [86] | |
| Mangrove swamp | Jiulongjiang estuary, China | Kandelia candel | (0.002 9−0.195 3) | Summer | [87] |
| Brisbane River, Queensland, Australia | Avocennia marina, Aegiceras corniculatu | (−0.004−0.065) | Spring | [88] | |
| Deep Bay region, Futian, South China | Kandelia obovata, Acanthus ilicifolius, Bruguiera gymnorrhiza | 0.757 2 | Summer | [89] | |
| Deep Bay region, Mai Po, South China | Magueyes Island, Puerto Rico Rhizophora mangle | (0.150 9−0.417 6) | |||
| Magueyes Island, Puerto Rico | Rhizophora mangle | 0.022 (0.002 2−0.061 6) | Spring | [34] | |
| Moreton Bay, Queensland, Australia | A. marina | (−0.002−0.014) | Autumn | [35] |
一般而言,红树林湿地比其他海岸沼泽N2O排放量要高,夏季N2O的排放量比冬季略高,原因可能为不同的地理位置、植被类型与季节部分理化性质有所不同,例如温度、孔隙水含量、有机碳含量,而微生物对这些理化性质的响应情况不同,使得滨海湿地N2O的排放具有时空特异性。
研究表明,温度变化对滨海湿地N2O季节性浓度变化影响显著,通过影响土壤有机质的分解速率、土壤微生物的活动等,从而显著影响N2O的产生[90]。许多红树林湿地生态系统在养分水平上没有明显的空间差异,但几乎所有观测记录的边缘温度都略高于森林位置;此外,滨海湿地沉积物的微传感器分析表明,与中心位置相比,边缘地带的氮转化活性也更高[34]。因此,N2O排放从光滩到红树林内部逐渐减少[34]的原因可能是植被降低了沉积土壤的温度,从而降低了微生物的氮转化活性。冬季三江平原沼泽湿地是N2O的汇,而随着土壤温度的升高逐渐成为N2O的源[91]。因此,在一定的范围内,温度升高有利于增加微生物的活性,尤其是硝化微生物与反硝化微生物,从而增加N2O的排放。
在滨海湿地中,季节性N2O浓度变化的另一个主要因素是孔隙水[37, 54]。由于众多洞穴的存在,大量的潮水可携带丰富的营养物质与可溶解性无机碳(Dissolved inorganic carbon,DIC)渗入沉积物[92],为微生物提供充足的碳源与氮源,提高微生物的氮素转化速率,从而增加N2O的排放潜力。已有许多研究表明,CO2、N2O和CH4浓度的潮汐模式与营养物质、DIC之间存在很强的相关性,孔隙水的潮汐抽水是影响滨海湿地沉积物中营养物含量和温室气体排放的重要影响因素[37, 54]。在这些空间尺度上,特定地点的条件,如地形、温度、坡度和物种组成可能决定季节、日温度和水循环的影响[88]。由于地形地貌的差异、海洋和河流的交汇及潮汐作用,河口湿地各种理化性质在时空上差异极大[77],这些因素都会不同程度地影响微生物的分布及功能,从而影响N2O的排放。
此外,季节性的可溶解性有机碳(Dissolved organic carbon,DOC)含量变化已被证实会影响河口湿地沉积物的反硝化速率[93-94],其原因可能是DOC作为电子受体,反硝化过程进行的速率较快,并不能完全将NO3–和N2O还原为N2[95]。例如,由于夏季降雨较多,Burdekin岸和Fitzro岸的DOC有一定程度增加,导致两种红树林溪流中反硝化作用产生的N2O明显增加[90]。
此外,在滨海湿地的同一季节中,不同植被的N2O排放量有明显差异(表 2),原因可能为滨海湿地植物本身对根际微生物群落有很强的影响,而根际微生物群落是产生N2O的主要场所[23]。有研究表示,同一季节中芦苇湿地的反硝化速率则明显低于其它植被覆盖的滨海湿地,但仍然超过了无植被的河口沉积物[96]。因此,植被可降低根际微生物的反硝化速率,从而降低滨海湿地沉积物N2O的排放量。可见,滨海湿地N2O排放量与温度、植被类型以及DOC的季节情况关系密切,但对于滨海湿地N2O排放时空动态下微生物驱动的滨海湿地N2O的排放及产生机制的研究仍不够深入,需要进一步研究氮循环以及氮循环耦合碳、硫以及金属循环中与N2O产生的相关机制,进而发展减少N2O排放的生物技术。
3 滨海湿地生态系统N2O减排的微生物调控由微生物驱动下N2O还原成氮气的反硝化过程,是减少N2O排放的主要途径。反硝化过程中N2O的产生主要取决于一氧化二氮还原酶(Nos)的活性,目前催化该反应的酶仅有Nos酶[97]。因此,为减少滨海湿地生态系统中的N2O排放,可以考虑提高沉积物中Nos酶的活性,从而促进N2O转化为N2,减少全球N2O的排放,减缓全球变暖。
Morales等[98]介绍了近端调控因素(如温度、湿度、氮供应)和远端调控因素(如土壤类型、植被类型、微生物功能多样性、地理)并提出了一个有趣的假设:远端调控因子选择微生物种群建立遗传机制;而近端调控基因转录因子控制潜在表达[98],所以想要从根本上控制滨海湿地N2O的排放需要从远端调节因子入手。有研究表明,特别在那些较低的N2O库容量的滨海湿地土壤中,提高沉积物中Nos酶的活性、减少N2O排放的效果会更明显[99]。此外,来自于变形菌门、拟杆菌门、绿菌门的多种多样的细菌与来自于泉古菌门、嗜盐菌门的古生菌都能产生Nos酶[100]。一些真核生物,比如有孔虫类或者网足虫目也可以减少N2O,但其机制尚不清楚[9]。黄杆菌可消耗大量由其他微生物产生的N2O,而这种特殊的N2O消耗作用为黄杆菌在沉积物中提供了一个专一的生态位[30]。滨海湿地存在丰富的黄杆属菌,为减少N2O排放提供了可能,但其减排效果仍缺乏定量分析。因此,对于氮循环微生物减少滨海湿地N2O排放的机制还需要进一步深入的研究。
利用土壤-植物根际-微生物相互作用有利于减少滨海湿地N2O的排放[96],不同植被对滨海湿地土壤中微生物的作用效果不同,导致N2O的产生量也有明显差异。例如互花米草的入侵会显著降低滨海湿地土壤细菌α-多样性,改变土壤细菌群落结构和组成,促进滨海湿地中与产生N2O相关功能微生物的生长[101],导致沿海黑麦草盐沼土壤[102]、红树林湿地的土壤[102]N2O排放的增加。此外,陆源性营养物输入中的氮元素被微生物转化为植物可吸收的模式,而不是以N2O的方式将氮素排出滨海湿地生态系统,有利于氮元素的高效利用和减少温室气体N2O的排放,但在滨海湿地种植人工植被也需要考虑植物与N2O排放的关系,例如红树林比互花米草更能减少N2O的排放[103]。可见,虽然有许多研究已经发现滨海湿地植被与微生物驱动N2O排放之间的联系,也开始有植物根系改变微生物功能基因的相关研究[104],但植物调节土壤微生物产生N2O的机制仍不清楚,有待进一步研究。
最近研究表明,关键微生物基因可成功预测地下水中N2O的浓度[105],并在微观尺度上了解N2O产生与环境因子之间的相互关系,但与应用于宏观尺度的实际调控仍有很大的距离[23]。在调控不同类型滨海湿地N2O排放时,需要综合考虑滨海湿地N2O的源/汇功能,兼顾近端调控因素(如温度、湿度、氮供应)和远端调控因素(如土壤类型、植被类型、微生物功能多样性、地理),结合生态学、分子生物学、微生物学、物理学、生物地球化学和数学建模方法,构建基于微生物驱动的N2O产生/排放的生态功能预测模型,为减少滨海湿地N2O排放提供可执行的科学依据。
4 展望滨海湿地生态系统可保护生物多样性和调节全球气候变化,对水生和陆地生态系统均具有重要意义。但由于目前关于微生物产生N2O的研究仍不够全面,滨海湿地微生物驱动的N2O产生及调控机制仍需要在以下方向进行更深入的探究:
(1) 利用微生物组学技术揭示N2O产生的新过程、新机制。结合传统的富集培养、分离等手段,并通过宏基因组、宏转录组、代谢组分析深度挖掘滨海湿地生态系统中N2O产生的关键微生物、基因及新代谢通路,揭示N2O产生过程及调控机制,特别是新过程、新机制。
(2) 评估微生物驱动的各N2O产生过程对滨海湿地生态系统N2O排放的贡献。确定各N2O产生过程的分子标记,揭示N2O产生功能微生物多样性形成和环境调控机制及其主要的环境驱动因子,从而为减少滨海湿地生态系统N2O的排放和减缓全球气候变化提供科学依据。
(3) 利用微生物驱动的各种脱氮机制,研发新型微生物技术(如微生物组工程),实现滨海湿地N2O的减排,从而达到减缓全球变暖的目的。
(4) 利用环境因子和微生物数据预测滨海湿地N2O的排放。建立开放共享的滨海湿地微生物数据库,并构建基于微生物驱动的N2O产生/排放生态功能预测模型,以此预测滨海湿地N2O排放等生态系统功能。
| [1] |
IPCC. Climate change 2013: The physical science basis. Working group I contribution to the fifth assessment report of the intergovernmental panel on climate change[R]. Cambridge: IPCC, 2013
|
| [2] |
IPCC. Climate change 2007: The physical science basis. Contribution of working group I to the fourth assessment report of the intergovernmental panel on climate change[R]. Cambridge: IPCC, 2007
|
| [3] |
Ravishankara AR, Daniel JS, Portmann RW. Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century[J]. Science, 2009, 326(5949): 123-125. DOI:10.1126/science.1176985 |
| [4] |
Xie WX, Cui YQ, Du HN, et al. The research progress of N2O emission regularity in wetlands and the nitrogen interaction on its emission[J]. Advanced Materials Research, 2015, 1073-1076: 154-158. |
| [5] |
Kuypers MMM, Marchant HK, Kartal B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
| [6] |
Barnes J, Upstill-Goddard RC. The denitrification paradox: the role of O2 in sediment N2O production[J]. Estuarine, Coastal and Shelf Science, 2018, 200: 270-276. DOI:10.1016/j.ecss.2017.11.018 |
| [7] |
Ma C, Jensen MM, Smets BF, et al. Pathways and controls of N2O production in nitritation – anammox biomass[J]. Environmental Science & Technology, 2017, 51(16): 8981-8991. |
| [8] |
Cai WJ, Hu XP, Huang WJ, et al. Acidification of subsurface coastal waters enhanced by eutrophication[J]. Nature Geoscience, 2011, 4(11): 766-770. DOI:10.1038/ngeo1297 |
| [9] |
Piña-Ochoa E, Hogslund S, Geslin E, et al. Widespread occurrence of nitrate storage and denitrification among Foraminifera and Gromiida[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(3): 1148-1153. DOI:10.1073/pnas.0908440107 |
| [10] |
Stein LY. Eukaryotic evolution: an ancient breath of nitrate[J]. Current Biology, 2018, 28(16): R875-R877. DOI:10.1016/j.cub.2018.06.029 |
| [11] |
Zumft WG. Cell Biology and molecular basis of denitrification[J]. Microbiology and Molecular Biology Reviews, 1997, 61(4): 533-616. |
| [12] |
Lipsewers YA, Bale NJ, Hopmans EC, et al. Seasonality and depth distribution of the abundance and activity of ammonia oxidizing microorganisms in marine coastal sediments (North Sea)[J]. Frontiers in Microbiology, 2014, 5: 472. |
| [13] |
Caranto JD, Lancaster KM. Nitric oxide is an obligate bacterial nitrification intermediate produced by hydroxylamine oxidoreductase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(31): 8217-8222. DOI:10.1073/pnas.1704504114 |
| [14] |
Liu SR, Han P, Hink L, et al. Abiotic conversion of extracellular NH2OH contributes to N2O emission during ammonia oxidation[J]. Environmental Science & Technology, 2017, 51(22): 13122-13132. |
| [15] |
He ZL, Xu MY, Deng Y, et al. Metagenomic analysis reveals a marked divergence in the structure of belowground microbial communities at elevated CO2[J]. Ecology Letters, 2010, 13(5): 564-575. DOI:10.1111/j.1461-0248.2010.01453.x |
| [16] |
Muñoz-Hincapié M, Morell JM, Corredor JE. Increase of nitrous oxide flux to the atmosphere upon nitrogen addition to red mangroves sediments[J]. Marine Pollution Bulletin, 2002, 44(10): 992-996. DOI:10.1016/S0025-326X(02)00132-7 |
| [17] |
Aelion CM, Shaw JN, Wahl M. Impact of suburbanization on ground water quality and denitrification in coastal aquifer sediments[J]. Journal of Experimental Marine Biology and Ecology, 1997, 213(1): 31-51. |
| [18] |
Song CC, Zhang LH, Wang YY, et al. Annual dynamics of CO2, CH4, N2O emissions from freshwater marshes and affected by nitrogen fertilization[J]. Environmental Science, 2006, 27(12): 2369-2375. (in Chinese) 宋长春, 张丽华, 王毅勇, 等. 淡水沼泽湿地CO2、CH4和N2O排放通量年际变化及其对氮输入的响应[J]. 环境科学, 2006, 27(12): 2369-2375. DOI:10.3321/j.issn:0250-3301.2006.12.001 |
| [19] |
Gruber N, Galloway JN. An Earth-system perspective of the global nitrogen cycle[J]. Nature, 2008, 451(7176): 293-296. DOI:10.1038/nature06592 |
| [20] |
He ZL, Deng Y, van Nostrand JD, et al. GeoChip 3.0 as a high-throughput tool for analyzing microbial community composition, structure and functional activity[J]. The ISME Journal, 2010, 4(9): 1167-1179. DOI:10.1038/ismej.2010.46 |
| [21] |
Großkopf T, Mohr W, Baustian T, et al. Doubling of marine dinitrogen-fixation rates based on direct measurements[J]. Nature, 2012, 488(7411): 361-364. DOI:10.1038/nature11338 |
| [22] |
Seitzinger S, Harrison JA, Böhlke JK, et al. Denitrification across landscapes and waterscapes: a synthesis[J]. Ecological Applications, 2006, 16(6): 2064-2090. DOI:10.1890/1051-0761(2006)016[2064:DALAWA]2.0.CO;2 |
| [23] |
Thomson AJ, Giannopoulos G, Pretty J, et al. Biological sources and sinks of nitrous oxide and strategies to mitigate emissions[J]. Philosophical Transactions of the Royal Society B-Biological Sciences, 2012, 367(1593): 1157-1168. DOI:10.1098/rstb.2011.0415 |
| [24] |
Wrage N, Velthof GL, Oenema O, et al. Acetylene and oxygen as inhibitors of nitrous oxide production in Nitrosomonas europaea and Nitrosospira briensis: a cautionary tale[J]. FEMS Microbiology Ecology, 2004, 47(1): 13-18. |
| [25] |
Schreiber F, Wunderlin P, Udert KM, et al. Nitric oxide and nitrous oxide turnover in natural and engineered microbial communities: biological pathways, chemical reactions, and novel technologies[J]. Frontiers in Microbiology, 2012, 3: 372. |
| [26] |
Hooper AB, Terry KR. Hydroxylamine oxidoreductase of Nitrosomonas: production of nitric oxide from hydroxylamine[J]. Biochimica et Biophysica Acta (BBA) - Enzymology, 1979, 571(1): 12-20. DOI:10.1016/0005-2744(79)90220-1 |
| [27] |
Purkhold U, Pommerening-Röser A, Juretschko S, et al. Phylogeny of all recognized species of ammonia oxidizers based on comparative 16S rRNA and amoA sequence analysis: implications for molecular diversity surveys[J]. Applied and Environmental Microbiology, 2000, 66(12): 5368-5382. DOI:10.1128/AEM.66.12.5368-5382.2000 |
| [28] |
Brochier-Armanet C, Boussau B, Gribaldo S, et al. Mesophilic crenarchaeota: proposal for a third archaeal phylum, the Thaumarchaeota[J]. Nature Reviews Microbiology, 2008, 6(3): 245-252. DOI:10.1038/nrmicro1852 |
| [29] |
Shaw LJ, Nicol GW, Smith Z, et al. Nitrosospira spp. can produce nitrous oxide via a nitrifier denitrification pathway[J]. Environmental Microbiology, 2006, 8(2): 214-222. DOI:10.1111/j.1462-2920.2005.00882.x |
| [30] |
Marchant HK, Tegetmeyer HE, Ahmerkamp S, et al. Metabolic specialization of denitrifiers in permeable sediments controls N2O emissions[J]. Environmental Microbiology, 2018, 20(12): 4486-4502. DOI:10.1111/1462-2920.14385 |
| [31] |
Yang WH, Silver WL. Gross nitrous oxide production drives net nitrous oxide fluxes across a salt marsh landscape[J]. Global Change Biology, 2016, 22(6): 2228-2237. DOI:10.1111/gcb.13203 |
| [32] |
Kool DM, Dolfing J, Wrage N, et al. Nitrifier denitrification as a distinct and significant source of nitrous oxide from soil[J]. Soil Biology and Biochemistry, 2011, 43(1): 174-178. DOI:10.1016/j.soilbio.2010.09.030 |
| [33] |
Zhu WJ, Wang C, Hill J, et al. A missing link in the estuarine nitrogen cycle?: coupled nitrification-denitrification mediated by suspended particulate matter[J]. Scientific Reports, 2018, 8(1): 2282. DOI:10.1038/s41598-018-20688-4 |
| [34] |
Bauza JF, Morell JM, Corredor JE. Biogeochemistry of nitrous oxide production in the red mangrove (Rhizophora mangle) forest sediments[J]. Estuarine, Coastal and Shelf Science, 2002, 55(5): 697-704. DOI:10.1006/ecss.2001.0913 |
| [35] |
Kreuzwieser J, Buchholz J, Rennenberg H. Emission of methane and nitrous oxide by Australian mangrove ecosystems[J]. Plant Biology, 2003, 5(4): 423-431. DOI:10.1055/s-2003-42712 |
| [36] |
Castro-Barros CM, Daelman MRJ, Mampaey KE, et al. Effect of aeration regime on N2O emission from partial nitritation-anammox in a full-scale granular sludge reactor[J]. Water Research, 2015, 68: 793-803. DOI:10.1016/j.watres.2014.10.056 |
| [37] |
Call M, Maher DT, Santos IR, et al. Spatial and temporal variability of carbon dioxide and methane fluxes over semi-diurnal and spring–neap–spring timescales in a mangrove creek[J]. Geochimica et Cosmochimica Acta, 2015, 150: 211-225. DOI:10.1016/j.gca.2014.11.023 |
| [38] |
van Kessel MAHJ, Speth DR, Albertsen M, et al. Complete nitrification by a single microorganism[J]. Nature, 2015, 528(7583): 555-559. DOI:10.1038/nature16459 |
| [39] |
Kartal B, Van Niftrik L, Keltjens JT, et al. Anammox—growth physiology, cell biology, and metabolism[J]. Advances in Microbial Physiology, 2012, 60: 211-262. DOI:10.1016/B978-0-12-398264-3.00003-6 |
| [40] |
Strous M, Pelletier E, Mangenot S, et al. Deciphering the evolution and metabolism of an anammox bacterium from a community genome[J]. Nature, 2006, 440(7085): 790-794. DOI:10.1038/nature04647 |
| [41] |
Bartossek R, Nicol GW, Lanzen A, et al. Homologues of nitrite reductases in ammonia-oxidizing archaea: diversity and genomic context[J]. Environmental Microbiology, 2010, 12(4): 1075-1088. DOI:10.1111/j.1462-2920.2010.02153.x |
| [42] |
Tourna M, Stieglmeier M, Spang A, et al. Nitrososphaera viennensis, an ammonia oxidizing archaeon from soil[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(20): 8420-8425. DOI:10.1073/pnas.1013488108 |
| [43] |
Walker CB, de la Torre JR, Klotz MG, et al. Nitrosopumilus maritimus genome reveals unique mechanisms for nitrification and autotrophy in globally distributed marine crenarchaea[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(19): 8818-8823. DOI:10.1073/pnas.0913533107 |
| [44] |
Stoecker K, Bendinger B, Schöning B, et al. Cohn's Crenothrix is a filamentous methane oxidizer with an unusual methane monooxygenase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(7): 2363-2367. DOI:10.1073/pnas.0506361103 |
| [45] |
Daims H, Lebedeva EV, Pjevac P, et al. Complete nitrification by Nitrospira bacteria[J]. Nature, 2015, 528(7583): 504-509. DOI:10.1038/nature16461 |
| [46] |
Goreau TJ, Kaplan WA, Wofsy SC, et al. Production of NO2– and N2O by nitrifying bacteria at reduced concentrations of oxygen[J]. Applied and Environmental Microbiology, 1980, 40(3): 526-532. |
| [47] |
Wang W, Cai ZC, Zhong WH, et al. Research advances in aerobic denitrifiers[J]. Chinese Journal of Applied Ecology, 2007, 18(11): 2618-2625. (in Chinese) 王薇, 蔡祖聪, 钟文辉, 等. 好氧反硝化菌的研究进展[J]. 应用生态学报, 2007, 18(11): 2618-2625. |
| [48] |
Santoro AE, Buchwald C, Mcilvin MR, et al. Isotopic signature of N2O produced by marine ammonia-oxidizing archaea[J]. Science, 2011, 333(6047): 1282-1285. DOI:10.1126/science.1208239 |
| [49] |
Löscher CR, Kock A, Könneke M, et al. Production of oceanic nitrous oxide by ammonia-oxidizing archaea[J]. Biogeosciences, 2012, 9(7): 2419-2429. DOI:10.5194/bg-9-2419-2012 |
| [50] |
Ettwig KF, Butler MK, Le Paslier D, et al. Nitrite-driven anaerobic methane oxidation by oxygenic bacteria[J]. Nature, 2010, 464(7288): 543-548. DOI:10.1038/nature08883 |
| [51] |
Al Azhar M, Canfield DE, Fennel K, et al. A model-based insight into the coupling of nitrogen and sulfur cycles in a coastal upwelling system[J]. Journal of Geophysical Research: Biogeosciences, 2014, 119(3): 264-285. DOI:10.1002/2012JG002271 |
| [52] |
Bao P, Li GX. Sulfur-driven iron reduction coupled to anaerobic ammonium oxidation[J]. Environmental Science & Technology, 2017, 51(12): 6691-6698. |
| [53] |
Fernandes SO, Javanaud C, Aigle A, et al. Anaerobic nitrification-denitrification mediated by Mn-oxides in meso-tidal sediments: implications for N2 and N2O production[J]. Journal of Marine Systems, 2015, 144: 1-8. DOI:10.1016/j.jmarsys.2014.11.011 |
| [54] |
Maher DT, Santos IR, Leuven JRFW, et al. Novel use of cavity ring-down spectroscopy to investigate aquatic carbon cycling from microbial to ecosystem scales[J]. Environmental Science & Technology, 2013, 47(22): 12938-12945. |
| [55] |
Raghoebarsing AA, Pol A, van de Pas-Schoonen KT, et al. A microbial consortium couples anaerobic methane oxidation to denitrification[J]. Nature, 2006, 440(7086): 918-921. DOI:10.1038/nature04617 |
| [56] |
Arp DJ, Stein LY. Metabolism of inorganic N compounds by ammonia-oxidizing bacteria[J]. Critical Reviews in Biochemistry and Molecular Biology, 2003, 38(6): 471-495. DOI:10.1080/10409230390267446 |
| [57] |
Cheng C, Shen XX, Xie HJ, et al. Coupled methane and nitrous oxide biotransformation in freshwater wetland sediment microcosms[J]. Science of the Total Environment, 2019, 648: 916-922. DOI:10.1016/j.scitotenv.2018.08.185 |
| [58] |
Rappé MS, Giovannoni SJ. The uncultured microbial majority[J]. Annual Review of Microbiology, 2003, 57: 369-394. DOI:10.1146/annurev.micro.57.030502.090759 |
| [59] |
Wu H, Ding ZH, Liu Y, et al. Methylmercury and sulfate-reducing bacteria in mangrove sediments from Jiulong River Estuary, China[J]. Journal of Environmental Sciences, 2011, 23(1): 14-21. DOI:10.1016/S1001-0742(10)60368-3 |
| [60] |
Canfield DE, Stewart FJ, Thamdrup B, et al. A cryptic sulfur cycle in oxygen-minimum-zone waters off the Chilean coast[J]. Science, 2010, 330(6009): 1375-1378. DOI:10.1126/science.1196889 |
| [61] |
Walsh DA, Zaikova E, Howes CG, et al. Metagenome of a versatile chemolithoautotroph from expanding oceanic dead zones[J]. Science, 2009, 326(5952): 578-582. DOI:10.1126/science.1175309 |
| [62] |
Jensen MM, Petersen J, Dalsgaard T, et al. Pathways, rates, and regulation of N2 production in the chemocline of an anoxic basin, Mariager Fjord, Denmark[J]. Marine Chemistry, 2009, 113(1/2): 102-113. |
| [63] |
Wang ML, Hu RG, Zhao JS, et al. Iron oxidation affects nitrous oxide emissions via donating electrons to denitrification in paddy soils[J]. Geoderma, 2016, 271: 173-180. DOI:10.1016/j.geoderma.2016.02.022 |
| [64] |
Clément JC, Shrestha J, Ehrenfeld JG, et al. Ammonium oxidation coupled to dissimilatory reduction of iron under anaerobic conditions in wetland soils[J]. Soil Biology and Biochemistry, 2005, 37(12): 2323-2328. DOI:10.1016/j.soilbio.2005.03.027 |
| [65] |
Shrestha J, Rich JJ, Ehrenfeld JG, et al. Oxidation of ammonium to nitrite under iron-reducing conditions in wetland soils: laboratory, field demonstrations, and push-pull rate determination[J]. Soil Science, 2009, 174(3): 156-164. DOI:10.1097/SS.0b013e3181988fbf |
| [66] |
Sawayama S. Possibility of anoxic ferric ammonium oxidation[J]. Journal of Bioscience and Bioengineering, 2006, 101(1): 70-72. |
| [67] |
Li XF, Hou LJ, Liu M, et al. Evidence of nitrogen loss from anaerobic ammonium oxidation coupled with ferric iron reduction in an intertidal wetland[J]. Environmental Science & Technology, 2015, 49(19): 11560-11568. |
| [68] |
Ding LJ, An XL, Li S, et al. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence[J]. Environmental Science & Technology, 2014, 48(18): 10641-10647. |
| [69] |
Yang WH, Weber KA, Silver WL. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction[J]. Nature Geoscience, 2012, 5(8): 538-541. DOI:10.1038/ngeo1530 |
| [70] |
Huang S, Jaffé PR. Characterization of incubation experiments and development of an enrichment culture capable of ammonium oxidation under iron-reducing conditions[J]. Biogeosciences, 2015, 12(3): 769-779. DOI:10.5194/bg-12-769-2015 |
| [71] |
Roden EE. Microbial iron-redox cycling in subsurface environments[J]. Biochemical Society Transactions, 2012, 40(6): 1249-1256. DOI:10.1042/BST20120202 |
| [72] |
Kampschreur MJ, Kleerebezem R, de Vet WWJM, et al. Reduced iron induced nitric oxide and nitrous oxide emission[J]. Water Research, 2011, 45(18): 5945-5952. DOI:10.1016/j.watres.2011.08.056 |
| [73] |
Carlson HK, Clark IC, Blazewicz SJ, et al. Fe(Ⅱ) oxidation is an innate capability of nitrate-reducing bacteria that involves abiotic and biotic reactions[J]. Journal of Bacteriology, 2013, 195(14): 3260-3268. DOI:10.1128/JB.00058-13 |
| [74] |
Zhu X, Silva LCR, Doane TA, et al. Iron: the forgotten driver of nitrous oxide production in agricultural soil[J]. PLoS One, 2013, 8(3): e60146. DOI:10.1371/journal.pone.0060146 |
| [75] |
Bartlett R, Mortimer RJG, Morris K. Anoxic nitrification: evidence from humber estuary sediments (UK)[J]. Chemical Geology, 2008, 250(1/2/3/4): 29-39. |
| [76] |
Javanaud C, Michotey V, Guasco S, et al. Anaerobic ammonium oxidation mediated by Mn-oxides: from sediment to strain level[J]. Research in Microbiology, 2011, 162(9): 848-857. DOI:10.1016/j.resmic.2011.01.011 |
| [77] |
Lotze HK, Lenihan HS, Bourque BJ, et al. Depletion, degradation, and recovery potential of estuaries and coastal seas[J]. Science, 2006, 312(5781): 1806-1809. DOI:10.1126/science.1128035 |
| [78] |
Sun ZG, Wang LL, Mou XJ, et al. Spatial and temporal variations of nitrous oxide flux between coastal marsh and the atmosphere in the Yellow River estuary of China[J]. Environmental Science and Pollution Research, 2014, 21(1): 419-433. DOI:10.1007/s11356-013-1885-5 |
| [79] |
Wang DQ, Chen ZL, Wang J, et al. Summer-time denitrification and nitrous oxide exchange in the intertidal zone of the Yangtze Estuary[J]. Estuarine, Coastal and Shelf Science, 2007, 73(1/2): 43-53. |
| [80] |
Wang DQ, Chen ZL, Sun WW, et al. Methane and nitrous oxide concentration and emission flux of Yangtze Delta plain river net[J]. Science in China Series B: Chemistry, 2009, 52(5): 652-661. DOI:10.1007/s11426-009-0024-0 |
| [81] |
Zhang YX, Zeng CS, Tong C, et al. Tidal action and tread affecting nitrous oxide fluxes in intertidal Cyperus malaccensis var. brevifolius marsh[J]. Ecology and Environmental Sciences, 2012, 21(4): 641-646. (in Chinese) 张永勋, 曾从盛, 仝川, 等. 潮汐作用下短叶茳芏湿地N2O排放规律及踩踏干扰研究[J]. 生态环境学报, 2012, 21(4): 641-646. DOI:10.3969/j.issn.1674-5906.2012.04.009 |
| [82] |
Zhang YX, Zeng CS, Huang JF, et al. Effects of human-caused disturbance on nitrous oxide flux from Cyperus malaccensis marsh in the Minjiang River estuary[J]. China Environmental Science, 2013, 33(1): 138-146. (in Chinese) 张永勋, 曾从盛, 黄佳芳, 等. 人为干扰对闽江河口短叶茳芏湿地N2O排放的影响[J]. 中国环境科学, 2013, 33(1): 138-146. DOI:10.3969/j.issn.1000-6923.2013.01.020 |
| [83] |
Xie WX, Zhao QS, Zhang F, et al. Characteristics of N2O flux in estuary wetland of Jiaozhou bay in autumn and winter[J]. Scientia Geographica Sinica, 2011, 31(4): 464-469. (in Chinese) 谢文霞, 赵全升, 张芳, 等. 胶州湾河口湿地秋冬季N2O气体排放通量特征[J]. 地理科学, 2011, 31(4): 464-469. |
| [84] |
Zhu RB, Liu YS, Ma J, et al. Nitrous oxide flux to the atmosphere from two coastal tundra wetlands in eastern Antarctica[J]. Atmospheric Environment, 2008, 42(10): 2437-2447. DOI:10.1016/j.atmosenv.2007.12.016 |
| [85] |
Hirota M, Senga Y, Seike Y, et al. Fluxes of carbon dioxide, methane and nitrous oxide in two contrastive fringing zones of coastal lagoon, Lake Nakaumi, Japan[J]. Chemosphere, 2007, 68(3): 597-603. DOI:10.1016/j.chemosphere.2007.01.002 |
| [86] |
Sun LG, Zhu RB, Xie ZQ, et al. Emissions of nitrous oxide and methane from Antarctic Tundra: role of penguin dropping deposition[J]. Atmospheric Environment, 2002, 36(31): 4977-4982. DOI:10.1016/S1352-2310(02)00340-0 |
| [87] |
Alongi DM, Pfitzner J, Trott LA, et al. Rapid sediment accumulation and microbial mineralization in forests of the mangrove Kandelia candel in the Jiulongjiang Estuary, China[J]. Estuarine, Coastal and Shelf Science, 2005, 63(4): 605-618. DOI:10.1016/j.ecss.2005.01.004 |
| [88] |
Allen DE, Dalal RC, Rennenberg H, et al. Spatial and temporal variation of nitrous oxide and methane flux between subtropical mangrove sediments and the atmosphere[J]. Soil Biology and Biochemistry, 2007, 39(2): 622-631. DOI:10.1016/j.soilbio.2006.09.013 |
| [89] |
Chen GC, Tam NFY, Ye Y. Summer fluxes of atmospheric greenhouse gases N2O, CH4 and CO2 from mangrove soil in South China[J]. Science of the Total Environment, 2010, 408(13): 2761-2767. DOI:10.1016/j.scitotenv.2010.03.007 |
| [90] |
Murray R, Erler D, Rosentreter J, et al. A seasonal source and sink of nitrous oxide in mangroves: insights from concentration, isotope, and isotopomer measurements[J]. Geochimica et Cosmochimica Acta, 2018, 238: 169-192. DOI:10.1016/j.gca.2018.07.003 |
| [91] |
Song CC, Wang YY, Wang YS, et al. Dynamics of CO2, CH4 and N2O emission fluxes from mires during freezing and thawing season[J]. Environmental Science, 2005, 26(4): 7-12. (in Chinese) 宋长春, 王毅勇, 王跃思, 等. 季节性冻融期沼泽湿地CO2、CH4和N2O排放动态[J]. 环境科学, 2005, 26(4): 7-12. |
| [92] |
Stieglitz TC, Clark JF, Hancock GJ. The mangrove pump: the tidal flushing of animal burrows in a tropical mangrove forest determined from radionuclide budgets[J]. Geochimica et Cosmochimica Acta, 2013, 102: 12-22. |
| [93] |
Eyre BD, Maher DT, Squire P. Quantity and quality of organic matter (detritus) drives N2 effluxes (net denitrification) across seasons, benthic habitats, and estuaries[J]. Global Biogeochemical Cycles, 2013, 27(4): 1083-1095. DOI:10.1002/2013GB004631 |
| [94] |
Ferguson A, Eyre B, Gay J, et al. Benthic metabolism and nitrogen cycling in a sub-tropical coastal embayment: spatial and seasonal variation and controlling factors[J]. Aquatic Microbial Ecology, 2007, 48(2): 175-195. |
| [95] |
Firestone MK, Davidson EA, Andreae MO, et al. Microbiological basis of NO and N2O production and consumption in soil[J]. Exchange of Trace Gases Between Terrestrial Ecosystems and the Atmosphere, 1989, 47: 7-21. |
| [96] |
Zhang Y, Ji GD, Wang C, et al. Importance of denitrification driven by the relative abundances of microbial communities in coastal wetlands[J]. Environmental Pollution, 2019, 244: 47-54. DOI:10.1016/j.envpol.2018.10.016 |
| [97] |
Wu B, Liu FF, Weiser MD, et al. Temperature determines the diversity and structure of N2O-reducing microbial assemblages[J]. Functional Ecology, 2018, 32(7): 1867-1878. DOI:10.1111/1365-2435.13091 |
| [98] |
Morales SE, Jha N, Saggar S. Biogeography and biophysicochemical traits link N2O emissions, N2O emission potential and microbial communities across New Zealand pasture soils[J]. Soil Biology and Biochemistry, 2015, 82: 87-98. DOI:10.1016/j.soilbio.2014.12.018 |
| [99] |
Philippot L, Andert J, Jones CM, et al. Importance of denitrifiers lacking the genes encoding the nitrous oxide reductase for N2O emissions from soil[J]. Global Change Biology, 2011, 17(3): 1497-1504. DOI:10.1111/j.1365-2486.2010.02334.x |
| [100] |
Cabello P, Roldán MD, Moreno-Vivián C. Nitrate reduction and the nitrogen cycle in archaea[J]. Microbiology, 2004, 150(11): 3527-3546. DOI:10.1099/mic.0.27303-0 |
| [101] |
Wang HT, Su JQ, Zheng TL, et al. Insights into the role of plant on ammonia-oxidizing bacteria and archaea in the mangrove ecosystem[J]. Journal of Soils and Sediments, 2015, 15(5): 1212-1223. DOI:10.1007/s11368-015-1074-x |
| [102] |
Zhang YH, Wang L, Xie XJ, et al. Effects of invasion of Spartina alterniflora and exogenous N deposition on N2O emissions in a coastal salt marsh[J]. Ecological Engineering, 2013, 58: 77-83. DOI:10.1016/j.ecoleng.2013.06.011 |
| [103] |
Gao GF, Li PF, Zhong JX, et al. Spartina alterniflora invasion alters soil bacterial communities and enhances soil N2O emissions by stimulating soil denitrification in mangrove wetland[J]. Science of the Total Environment, 2018, 653: 231-240. |
| [104] |
Shi SJ, Herman DJ, He ZL, et al. Plant roots alter microbial functional genes supporting root litter decomposition[J]. Soil Biology and Biochemistry, 2018, 127: 90-99. DOI:10.1016/j.soilbio.2018.09.013 |
| [105] |
He ZL, Zhang P, Wu LW, et al. Microbial functional gene diversity predicts groundwater contamination and ecosystem functioning[J]. mBio, 2018, 9: e02435-17. |
 2019, Vol. 46
2019, Vol. 46