扩展功能
文章信息
- 刘芳彤, 樊浩楠, 沈立新, 李博
- LIU Fang-Tong, FAN Hao-Nan, SHEN Li-Xin, LI Bo
- 细菌铁离子摄取系统与宿主免疫
- Iron acquisition by bacterial and adaptive immune responses
- 微生物学通报, 2019, 46(12): 3432-3439
- Microbiology China, 2019, 46(12): 3432-3439
- DOI: 10.13344/j.microbiol.china.190059
-
文章历史
- 收稿日期: 2019-01-19
- 接受日期: 2019-04-02
- 网络首发日期: 2019-04-22
绝大多数细菌在生长繁殖过程都需要铁、锰、锌等过渡金属元素[1]。这些金属元素在金属蛋白的合成、折叠构象的稳定及许多生理生化反应中发挥重要作用[2]。其中,铁离子参与了包括电子传递、呼吸作用、DNA合成、三羧酸循环等诸多重要的生物学过程[3]。
铁在生理条件下主要以还原型的Fe2+和氧化型的Fe3+两种形式存在,还原型与氧化型可以相互转换,这种性质使它适合于作为一种生物催化剂或电子载体参与生命活动。对于宿主来说,有效控制细菌对自身铁的利用是抗菌的关键。对于细菌来说,为满足自身的代谢和繁殖,必须打破宿主对于铁元素的限制,获得铁元素。因此,了解细菌中铁摄取和铁稳态的调节机制及其与免疫的关系对控制细菌的感染十分重要。
1 铁在细菌中的重要作用首先,铁与一些关键机制相关,如细胞呼吸、三羧酸循环、核糖体组装及再循环、抗氧化应激和DNA合成及损伤修复等[4]。如大肠杆菌(Escherichia coli)中的SoxR蛋白,在细胞内以二聚体的形式存在,每个单体含有一个[2Fe-2S]中心,是感知氧化胁迫的分子开关,在感受到氧化刺激后可以激活一系列抗氧化基因的表达[5]。本课题组对铜绿假单胞菌(Pseudomonas aeruginosa,PAO1)铁离子转运系统的研究表明,铁离子转运复合体fpvWXYZCDEF在PAO1的抗氧化应激中起重要作用。fpvWXYZCDEF的失活导致PAO1对H2O2的敏感性明显增加,同时导致PAO1细胞膜结构发生改变[6]。
其次,铁是许多代谢酶类活性中心所必需的金属元素辅基,包括细胞色素氧化酶、超氧化物歧化酶、过氧化氢酶[7]等。末端氧化酶是呼吸链的重要组成部分,大多数末端氧化酶有一个Fe-Cu双金属活性位点,能够将氧气还原成水[8]。
此外,铁与病原菌的毒力、生物膜的形成等密切相关。在肠道沙门氏菌(Salmonella enterica)中,铁离子的浓度与其Ⅲ型分泌系统(T3SS)的表达密切相关,该菌的入侵主要是在T3SS的介导下完成[9]。在类鼻疽伯克氏菌(Burkholderia pseudomallei)中,摄取铁主要依赖于pvdA基因编码的鸟氨酸-N5-加氧酶和orbA基因编码的外膜受体,pvdA和orbA基因是类鼻疽伯克氏菌毒力的必需基因[10]。大肠杆菌中fyuA基因的表达量与铁离子浓度成正相关[11],fyuA基因与大肠杆菌生物膜的形成和细菌毒性有关[12]。在空肠弯曲杆菌(Campylobacter jejuni)中,Fe2+和Fe3+可以提高生物膜中总活性氧的含量,通过氧化应激刺激其生物膜的形成。同时Fe2+和Fe3+均显著提高空肠弯曲杆菌细胞外多糖的产量[13]。
尽管铁对于细菌的生长繁殖至关重要,但过量的铁也会产生毒性。在富氧条件下,Fe2+主要是通过Fenton反应产生毒性。在Fenton反应中,Fe2+与过氧化氢反应形成羟基自由基,羟基自由基会无选择性地氧化所有的生物分子,包括DNA、蛋白质和脂类,引起DNA的断裂、蛋白质的失活和细胞质膜的破坏[14]。因此,细菌对铁离子的摄取必须受到精确严格的调控。
2 细菌中铁的摄取铁是细菌不可或缺的矿物营养,然而在宿主体内,游离的铁非常少。Fe3+与转铁蛋白、乳铁蛋白等特定的蛋白质结合在一起[15],Fe2+则形成血红素,存在于血红蛋白中[16]。为了满足自身生长繁殖的需求,细菌进化出了以这些物质作为铁源的摄取系统。
2.1 三价铁离子的摄取细菌可以通过分泌铁载体摄取Fe3+。铁载体是一种Fe3+特异性的螯合剂,对Fe3+具有超强的络合力[17]。根据铁载体螯合基团的化学性质不同可将其分为异羟肟酸型、邻苯二酚型、羧盐型[18-19]。铁载体能够与宿主体内的转铁蛋白、乳铁蛋白等铁结合蛋白竞争Fe3+,从而形成可溶性的Fe3+-铁载体复合体,这种复合体可以特异性地与细菌细胞外膜上的铁载体受体蛋白(Outer-membrane receptors,OMRs)相结合,最终被转运至细胞周质中,转运过程通过TonB系统提供能量。TonB系统由内膜蛋白ExbB、ExbD和周质蛋白TonB组成,ExbB和ExbD蛋白的配合物可以转化细胞质膜的质子动力势能,并通过TonB蛋白传递给外膜上的铁载体[20]。细胞周质中的Fe3+-铁载体复合体与周质结合蛋白(Periplasmic binding proteins,PBPs)相结合,形成Fe3+-铁载体-PBPs复合物。最后Fe3+-铁载体-PBPs复合物由ABC转运蛋白介导,通过内膜进入胞浆[21]。进入细胞后,Fe3+-铁载体-PBPs复合物中的Fe3+被铁还原酶还原为Fe2+,Fe2+与铁载体的亲和力低,从而被释放[22]。
ABC转运蛋白是一类广泛参与多种离子转运的跨膜蛋白[23]。本课题组研究证明fpvCDEF和fpvWXYZ (PA2403–PA2406)构成了一个ABC转运蛋白复合物,由两个操纵子fpvWXYZCDE和fpvF组成。fpvWXYZCDEF编码的ABC转运蛋白复合物对PAO1在限铁条件下的生长、抗氧化和毒力作用具有重要影响。突变体PAO1(ΔfpvCDEF)和野生型PAO1相比,由于fpvWXYZCDE的缺失导致其生长缺陷,对H2O2的敏感性增加,毒性降低[6]。
除了分泌高亲和力的铁载体竞争Fe3+外,一些细菌还进化出直接利用转铁蛋白或乳铁蛋白中Fe3+的机制。大多数革兰氏阴性菌都可以通过产生转铁蛋白结合蛋白(TBPs)或乳铁蛋白结合蛋白(LBPs)的方式利用宿主转铁蛋白或乳铁蛋白中的Fe3+。细菌分泌的TBPs或LBPs与宿主的转铁蛋白或乳铁蛋白结合后,通过外膜上的转运蛋白TBP或LBP,将转铁蛋白或乳铁蛋白中的Fe3+透过细胞质膜运输到细胞内,整个系统由TonB系统提供能量[24]。如脑膜炎奈瑟菌(Neisseria meningitidis)可同时表达利用转铁蛋白和乳铁蛋白的摄取系统,但优先利用转铁蛋白[24]。
2.2 二价铁离子转运系统大多数革兰氏阳性菌存在直接吸收血红素而获得铁元素的转运系统[24]。细菌外膜上的血红素受体可以直接与血红素或血红蛋白结合并将血红素或血红蛋白转运至周质,通过ABC转运蛋白转运至胞质降解或利用,整个过程由TonB系统提供能量。金黄色葡萄球菌(Staphylococcus aureus)铁依赖性表面决定系统(Iron-regulated surface determinant,Isd)可从血红蛋白中获取Fe2+[25]。如图 1所示,金黄色葡萄球菌的Isd系统由IsdA、IsdB、IsdC、IsdDEF、IsdG、IsdH以及IsdI组成[25]。IsdB、IsdH是主要的血红蛋白受体,IsdA可以结合游离的血红素或接受来自IsdB和IsdH的血红素。IsdB、IsdH与血红蛋白结合后将血红素转移到IsdC,IsdC嵌入细胞壁,将血红素转移到膜上的血红素转运复合体IsdDEF。血红素由IsdDEF转运到细胞质中[26],最后被血红素氧化酶IsdG、IsdI分解,获得Fe2+[27-28]。

|
| 图 1 金黄色葡萄球菌Isd系统[28] Figure 1 The iron-regulated surface determinant (Isd) in S. aureus[28] 注:在金黄色葡萄球菌中,IsdH和IsdB是Hb的主要受体. IsdA可以接受来自IsdB和IsdH的血红素,也可以结合游离血红素.血红素转移到IsdC,IsdC位于细胞壁,将血红素转移到膜复合体IsdDEF. IsdDEF将血红素转运到细胞质中供完整利用,或由IsdG和IsdI降解. Note: In S. aureus, IsdH and IsdB are the primary Hb receptor. IsdA can accept heme from IsdB and IsdH or bind free heme. Heme is transferred to IsdC, which is embedded in the cell wall and transits heme to the membrane complex IsdDEF. IsdDEF transports heme to the cytoplasm for utilization intact or for degradation by the heme oxygenases IsdG and IsdI. |
|
|
除直接的血红素转运系统外,还存在间接的血红素转运系统[29]。如革兰氏阴性菌中存在的Hemophore蛋白介导的血红素转运系统[30]。Hemophore首先与血红蛋白相结合并从中分离血红素,然后携带着血红素的Hemophore与细菌外膜上的受体结合,使受体构象发生改变,将血红素传递至该受体[31]。血红素穿过受体蛋白的通道进入周质,最后通过周质结合蛋白和ABC转运系统将血红素转移至细胞内被降解利用[32]。如铜绿假单胞菌等分泌的HasA型血红素载体[33]和流感嗜血杆菌(Haemophilus influenzae)分泌的HxuA型血红素载体[34],均可从血红素蛋白中摄取血红素。
除此之外,细菌也可以产生分泌的或位于膜上的铁还原酶,将Fe3+还原成更容易溶解的Fe2+形式,并通过Feo、Yfe、Efe等转运系统来摄取Fe2+[35-36]。其中Feo转运系统最为重要,大约80%的革兰氏阴性菌都存在Feo转运系统。Feo转运系统由feo操纵子编码,由两个可溶性细胞质蛋白FeoA、FeoC和一个膜蛋白FeoB组成[37]。FeoA在不同细菌中有很强的保守性[38]。鲍氏不动杆菌(Acinetobacter baumannii)中由A1S-0242编码的FeoA蛋白参与铁的摄取。在肺炎感染过程中发现A1S-0242被过表达。A1S-0242基因的失活导致鲍氏不动杆菌对人肺泡上皮细胞的黏附能力下降约75%,生物膜形成减少,氧化应激敏感性增加,毒性显著降低[39]。FeoC只存在于变形杆菌属[40]。FeoB是Feo系统的主要组成部分,几乎存在于所有细菌中[41]。FeoB是一种内膜蛋白,由N端G蛋白样的可溶性结构域与跨膜螺旋域和C端跨膜多面体域组成。C端的跨膜多面体结构域形成可以转运Fe2+的孔隙[42]。Fe2+与FeoB蛋白的跨膜螺旋域相结合,同时FeoA蛋白与FeoB蛋白相互作用,激活G蛋白水解GTP释放能量,并引起FeoB蛋白的构象发生改变,FeoB蛋白构象的改变使其跨膜多面体结构域利用G蛋白水解GTP释放的能量将Fe2+从孔隙转运到细胞内[42]。在嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)中,FeoA的SH3结构域与FeoB的G蛋白域之间相互作用,作为激活因子调控FeoB依赖的亚铁吸收活性。SH3结构域同时也是细菌细胞壁识别和结合以及金属结合的靶向区域[43]。FeoC是一种螺旋蛋白,含有4个保守的半胱氨酸残基,能够与FeoB蛋白的N端绑定,防止FeoB蛋白被蛋白酶水解[42]。在肺炎克雷伯菌(Klebsiella pneumoniae) FeoC (KpFeoC)中半胱氨酸作为配体与Fe-S簇结合。KpFeoC通过Fe-S簇与氧或铁的配位来调控Feo转运体的功能[44]。
3 细菌铁摄取系统的调控细菌的铁稳态对于其生存繁殖至关重要,所以铁元素摄取必须受到严格的调控。在细菌中铁的摄取主要是由铁摄取调节蛋白(Ferric uptake regulator,Fur)调控[45]。Fur蛋白在细菌中广泛存在,尤其是在革兰氏阴性菌中,Fur蛋白对于调控铁的摄取和利用起着至关重要的作用[46]。大肠杆菌中铁载体合成基因(D-fep、E-fep、C-fep、G-fep)及其特异受体(FecA、FepA、FhuA、FhuE)的表达均受Fur蛋白调控[47]。同样,Fur蛋白也调控血红素转运系统中ABC转运系统、TonB系统的表达[48]。
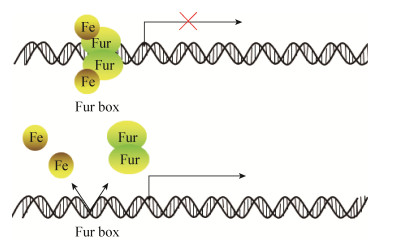
Fur蛋白的序列具有高度同源性,蛋白的结构也很相似:其N端有一个DNA结合结构域,C端组氨酸丰富,有二聚化的结构域和包括二价铁离子结合位点在内的多个金属离子结合位点。如大肠杆菌Fur蛋白的C端有一个用于稳定Fur二聚体构象的锌离子结合位点[46]。Fur蛋白可以与其调节基因启动子上一段富含A、T核苷酸的回文序列相结合,这段序列高度保守,被称为Fur box[49]。如图 2所示,当细菌细胞内铁离子充足时,Fur单体可以与Fe2+结合,形成Fe2+-Fur复合物,再二聚化形成Fe2+-Fur复合物的二聚体,二聚体识别并结合到铁摄取相关基因启动子上游的Fur box上,占据了该基因的启动子识别位点,抑制该基因表达。当细胞内铁缺乏时,二聚体解聚,对于铁摄取相关基因的抑制解除,细菌对于铁的摄取能力提升[50]。
|
| 图 2 Fur蛋白调控机制 Figure 2 Fur regulatory mechanism 注:当铁元素充足时,Fur可与Fe2+结合形成Fe2+-Fur复合物二聚体.二聚体识别并与Fur box结合,抑制下游基因的表达.当铁元素缺乏时,二聚体解聚,解除对铁摄取相关基因的抑制. Note: When iron is abundant, Fur can combine with Fe2+ to form a dimer of Fe2+-fur complex. The dimer recognizes and binds to the Fur box inhibiting the expression of this gene. When iron deficiency occurs, the dimer depolymerizes and the inhibition of iron uptake related genes is relieved. |
|
|
Fur蛋白除调控铁摄取相关基因的表达外,还影响铁储存蛋白Bfr、FtnA和FtnB的表达[48]。在铁缺乏时Fur蛋白可以抑制一些含铁蛋白的表达,以降低铁的消耗,提高铁的利用效率[47]。总之,Fur蛋白可以通过对铁离子摄取、储存和利用的全局调控,来维持细菌体内的铁稳态。
耶尔森氏菌(Yersinia)通过HmuRSTUV血红素吸收系统利用血红素和血红蛋白中的铁。HmuR是一种依赖于TonB系统的血红素和血红蛋白外膜受体。HmuTUV是一种内膜ABC转运蛋白,它将血红素和血红蛋白从周质空间转运到细胞质中,使其在细胞质中被HmuS降解。hmuR和hmuSTUV均是在铁的限制条件下表达的。hmuR的表达受Fur蛋白的调控。在铁限制条件下,Fur蛋白从hmuR启动子处解离使hmuR蛋白表达。而hmuSTUV的表达,需要全局调控因子IscR从hmuR和hmuS基因间区域的启动子处起作用。在低铁环境中,Fur和IscR的差异表达可以最大限度地促进血红素的吸收和利用[51]。
除受Fur蛋白调控外,Feo转运系统还受RstA/RstB双组分调控系统的调控。RstA/RstB系统是由膜蛋白RstB及其同源的反应调节蛋白RstA组成的典型的双组分调控系统。在沙门氏菌(Salmonella)中,Fe2+充足时,Fe2+可以作为一种信号分子激活RstB蛋白,RstB蛋白又作用于RstA使RstA蛋白发生磷酸化。RstA蛋白磷酸化后可直接与feoA启动子结合并激活feoAB操纵子编码Fe2+转运体FeoB。FeoB蛋白的大量表达导致Fe2+摄入增加,这使得Fe2+-Fur复合物的水平提高,从而令Fur调节蛋白对目标基因产生过度抑制,降低细菌摄取Fe2+的能力,抑制沙门氏菌的生长[52]。
4 与铁摄取相关的抗感染免疫和抗菌治疗针对细菌生存繁殖对铁稳态的严重依赖,可将病原菌的铁获取系统作为抗菌治疗的靶点,开发针对病原菌铁稳态的化合物治疗细菌感染,同时可基于该系统研发疫苗。
4.1 细菌铁摄取与免疫调节铁的分布是宿主抵御病原体入侵的一种先天免疫机制[53]。即使在没有感染的情况下,人体铁代谢的方式也确保了致病微生物很难接触到铁。人体内80%以上的铁都被隔离在红细胞内的血红蛋白复合物中[54]。即使病原体进化出了通过溶解红细胞释放血红蛋白最终从血红素中摄取铁的机制,也必须与宿主清除被破坏的红细胞的机制相竞争。沙门氏菌等病原菌可以激活巨噬细胞进行红细胞吞噬,巨噬细胞利用膜上的SR-A和CD36等受体结合并吞噬受损红的细胞[55]。
细胞外游离铁的缺乏是限制入侵病原菌利用铁的有效手段。转铁蛋白与细胞外的铁具有很高的亲和力,在健康人群中,转铁蛋白的饱和量通常小于50%[56]。当转铁蛋白结合能力饱和时,血浆中一些亲和力较低的分子,如白蛋白、柠檬酸盐和氨基酸等也会与铁螯合,以减少可被病原菌利用的胞外游离铁的含量[25]。乳铁蛋白是一种糖蛋白,与游离铁也有很高的亲和力。黏膜分泌物中含有高浓度的乳铁蛋白,构成了黏膜表面的铁限制[57]。
降低感染处铁的含量也是抵抗病原菌的一种免疫机制。在炎症条件下引起的低铁血症可抑制病原菌对铁的利用。Cartwright等[58]在研究中记录了低铁血症,他们在给犬肌肉注射金黄色葡萄球菌后注意到犬血浆中的铁含量急剧下降。一种多肽Hepcidin参与了这种低铁反应。在Hepcidin敲除的小鼠中,炎症条件下的低铁血症不存在或明显减弱[59]。如图 3所示,炎症过程中Hepcidin水平的提高导致运铁蛋白降解,限制了fpn1介导的肠道铁吸收和铁从所有来源进入血清,同时增强肝脏和脾脏巨噬细胞的铁固存,使血清铁水平迅速下降[60]。Hepcidin主要由肝脏产生,肝脏中Hepcidin的释放受到促炎性细胞因子和内质网未折叠蛋白反应的诱导。除了在肝脏中产生Hepcidin外,中性粒细胞和巨噬细胞也会合成Hepcidin,从而降低感染病灶处的铁含量[61]。炎症条件下Hepcidin的升高主要是白介素-6 (IL-6)浓度的升高所致。其他细胞因子如IL-62、15、16也可以部分替代IL-6对Hepcidin的刺激作用[59]。
Lcn2是一种由中性粒细胞、巨噬细胞等免疫细胞产生的抗菌和免疫调节肽。它的主要功能是结合儿茶酚类铁载体,限制病原菌对Fe3+的利用。值得注意的是,沙门氏菌可以通过改变铁载体的结构来规避Lcn2的作用。沙门氏菌中iroA基因簇编码的酶和受体将糖基附着在铁载体上,使其体积增大,Lcn2无法中和,同时保留了铁载体与铁结合的能力[55]。
感染部位吞噬细胞的激活也限制了病原菌对铁的利用。促炎性细胞因子降低了吞噬细胞表面转铁蛋白受体的表达,从而促进了细胞内铁转运蛋白Nramp1的表达。Nramp1是一种二价金属离子转运体,可降低细胞内的铁含量,从而限制该区域内可被病原菌利用的铁[62]。
为了应对宿主体内随时变化的铁离子浓度,细菌必需准确感知宿主体内铁离子浓度的变化并及时做出反应,才能成功建立感染。本课题组的研究发现,在不影响细菌生长的前提下,缺铁条件下PAO1中fpvWXYZCDE的转录较铁充足条件下增加了10倍左右,而在缺铁培养基中补加0.2 mmol/L的FeCl3可以将fpvWXYZCDE的转录恢复到铁充足条件下的水平[6]。
4.2 铁摄取系统可作为抗菌治疗的靶点目前,针对病原体铁稳态的抗菌化合物可大致分为两类:一类是针对铁摄取系统合成的抗菌化合物,另一类是利用铁摄取系统的选择性来开发靶向抗生素[24]。在前一类化合物中,以铁载体的合成为目标的抗菌化合物最为典型。对氨基水杨酸(P-aminosalicyic acid,PAS)是最早被用于治疗结核病的抗菌素之一,它抑制了结核杆菌(Mycobacterium tuberculosis)铁载体分枝杆菌素的合成。在此之后,大量针对铁载体生物合成的抑制剂被开发出来。
开发针对铁转运系统的第二类新型抗菌素,是将铁载体与抗生素进行共价连接,产生抗菌化合物。与铁载体偶联能降低内酰胺类、万古霉素和氟喹诺酮类抗生素的最小抑菌浓度。与铁载体结合的β-内酰胺MC-1对铜绿假单胞菌在体外和体内的活性都有抑制作用[63]。
目前已研制出几种针对病原体铁摄取系统的疫苗。Alteri等使用了大规模的疫苗学方法确定了尿路致病性大肠杆菌疫苗的候选抗原,并发现了通过针对6种外膜铁受体产生的免疫作用可以抵抗泌尿道感染[64]。
5 小结和展望铁是生命活动所必需的重要金属元素,广泛参与合成蛋白质、核酸以及呼吸作用等各种生理活动。铁元素的缺乏和过量都会影响细菌的生存和繁殖。到目前为止,虽然人们对铁元素在细菌中的转运及调控等进行了广泛的研究,但仍有许多问题需要继续探索。如:铁载体如何合成及分泌;转铁蛋白结合蛋白和乳铁蛋白结合蛋白能否被重复利用;微生物体内存在多种铁离子转运系统,而哪种在其入侵宿主过程中起主要作用,结合我们对PAO1中金属离子转运系统的研究推测,细菌中存在一类铁特异性的高亲和力转运系统,在细菌入侵、定殖等铁离子极度缺乏的情况下起主要作用,而另一类非特异性的低亲和力转运系统在铁离子充足的情况下发挥作用。相信未来对于细菌铁元素的摄取及调控机制的研究将更加深入和具体。
| [1] |
Becker KW, Skaar EP. Metal limitation and toxicity at the interface between host and pathogen[J]. FEMS Microbiology Reviews, 2014, 38(6): 1235-1249. DOI:10.1111/1574-6976.12087 |
| [2] |
Palmer LD, Skaar EP. Transition metals and virulence in bacteria[J]. Annual Review of Genetics, 2016, 50: 67-91. DOI:10.1146/annurev-genet-120215-035146 |
| [3] |
Taudte N, German N, Zhu YG, et al. Restoration of growth by manganese in a mutant strain of Escherichia coli lacking most known iron and manganese uptake systems[J]. BioMetals, 2016, 29(3): 433-450. DOI:10.1007/s10534-016-9927-3 |
| [4] |
Porcheron G, Dozois CM. Interplay between iron homeostasis and virulence: Fur and RyhB as major regulators of bacterial pathogenicity[J]. Veterinary Microbiology, 2015, 179(1/2): 2-14. |
| [5] |
Lo FC, Chen CL, Lee CM, et al. A study of NO trafficking from dinitrosyl-iron complexes to the recombinant E. coli transcriptional factor SoxR[J]. JBIC Journal of Biological Inorganic Chemistry, 2008, 13(6): 961-972. DOI:10.1007/s00775-008-0383-6 |
| [6] |
Gao L, Guo ZS, Wang Y, et al. The two-operon-coded ABC transporter complex FpvWXYZCDEF is required for Pseudomonas aeruginosa growth and virulence under iron-limiting conditions[J]. The Journal of Membrane Biology, 2018, 251(1): 91-104. |
| [7] |
Cornelis P, Wei Q, Andrews SC, et al. Iron homeostasis and management of oxidative stress response in bacteria[J]. Metallomics, 2011, 3(6): 540-549. DOI:10.1039/c1mt00022e |
| [8] |
Melo AMP, Teixeira M. Supramolecular organization of bacterial aerobic respiratory chains: from cells and back[J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 2016, 1857(3): 190-197. DOI:10.1016/j.bbabio.2015.11.001 |
| [9] |
Jones MA, Hulme SD, Barrow PA, et al. The Salmonella pathogenicity island 1 and Salmonella pathogenicity island 2 type Ⅲ secretion systems play a major role in pathogenesis of systemic disease and gastrointestinal tract colonization of Salmonella enterica serovar Typhimurium in the chicken[J]. Avian Pathology, 2007, 36(3): 199-203. DOI:10.1080/03079450701264118 |
| [10] |
Duangurai T, Indrawattana N, Pumirat P. Burkholderia pseudomallei adaptation for survival in stressful conditions[J]. BioMed Research International, 2018, 2018: 3039106. |
| [11] |
Schubert S, Rakin A, Heesemann J. The Yersinia high-pathogenicity island (HPI): evolutionary and functional aspects[J]. International Journal of Medical Microbiology, 2004, 294(2/3): 83-94. |
| [12] |
Hancock V, Ferrières L, Klemm P. The ferric yersiniabactin uptake receptor FyuA is required for efficient biofilm formation by urinary tract infectious Escherichia coli in human urine[J]. Microbiology, 2008, 154(1): 167-175. |
| [13] |
Oh E, Andrews KJ, Jeon B. Enhanced biofilm formation by ferrous and ferric iron through oxidative stress in Campylobacter jejuni[J]. Frontiers in Microbiology, 2018, 9: 1204. DOI:10.3389/fmicb.2018.01204 |
| [14] |
Zhao XL, Drlica K. Reactive oxygen species and the bacterial response to lethal stress[J]. Current Opinion in Microbiology, 2014, 21: 1-6. DOI:10.1016/j.mib.2014.06.008 |
| [15] |
Moos T, Morgan EH. Transferrin and transferrin receptor function in brain barrier systems[J]. Cellular and Molecular Neurobiology, 2000, 20(1): 77-96. DOI:10.1023/A:1006948027674 |
| [16] |
Ghigo JM, Létoffé S, Wandersman C. A new type of hemophore-dependent heme acquisition system of Serratia marcescens reconstituted in Escherichia coli[J]. Journal of Bacteriology, 1997, 179(11): 3572-3579. DOI:10.1128/jb.179.11.3572-3579.1997 |
| [17] |
Saha M, Sarkar S, Sarkar B, et al. Microbial siderophores and their potential applications: a review[J]. Environmental Science and Pollution Research, 2016, 23(5): 3984-3999. DOI:10.1007/s11356-015-4294-0 |
| [18] |
Neilands JB. Siderophores: structure and function of microbial iron transport compounds[J]. Journal of Biological Chemistry, 1995, 270(45): 26723-26726. DOI:10.1074/jbc.270.45.26723 |
| [19] |
Wyckoff EE, Allred BE, Raymond KN, et al. Catechol siderophore transport by Vibrio cholerae[J]. Journal of Bacteriology, 2015, 197(17): 2840-2849. DOI:10.1128/JB.00417-15 |
| [20] |
Jordan LD, Zhou YY, Smallwood CR, et al. Energy-dependent motion of TonB in the Gram-negative bacterial inner membrane[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(28): 11553-11558. DOI:10.1073/pnas.1304243110 |
| [21] |
Schalk IJ, Guillon L. Fate of ferrisiderophores after import across bacterial outer membranes: different iron release strategies are observed in the cytoplasm or periplasm depending on the siderophore pathways[J]. Amino Acids, 2013, 44(5): 1267-1277. DOI:10.1007/s00726-013-1468-2 |
| [22] |
Carpenter C, Payne SM. Regulation of iron transport systems in Enterobacteriaceae in response to oxygen and iron availability[J]. Journal of Inorganic Biochemistry, 2014, 133: 110-117. DOI:10.1016/j.jinorgbio.2014.01.007 |
| [23] |
Wang CY, Karpowich N, Hunt JF, et al. Dynamics of ATP-binding cassette contribute to allosteric control, nucleotide binding and energy transduction in ABC transporters[J]. Journal of Molecular Biology, 2004, 342(2): 525-537. |
| [24] |
Cassat JE, Skaar EP. Iron in infection and immunity[J]. Cell Host & Microbe, 2013, 13(5): 509-519. |
| [25] |
Hammer ND, Skaar EP. Molecular mechanisms of Staphylococcus aureus iron acquisition[J]. Annual Review of Microbiology, 2011, 65: 129-147. DOI:10.1146/annurev-micro-090110-102851 |
| [26] |
Grigg J, Vermeiren CL, Heinrichs DE, et al. Heme coordination by Staphylococcus aureus IsdE[J]. The Journal of Biological Chemistry, 2007, 282(39): 28815-28822. |
| [27] |
Skaar EP, Gaspar AH, Schneewind O. IsdG and IsdI, heme-degrading enzymes in the cytoplasm of Staphylococcus aureus[J]. Journal of Biological Chemistry, 2004, 279(1): 436-443. DOI:10.1074/jbc.M307952200 |
| [28] |
Choby JE, Skaar EP. Heme synthesis and acquisition in bacterial pathogens[J]. Journal of Molecular Biology, 2016, 428(17): 3408-3428. DOI:10.1016/j.jmb.2016.03.018 |
| [29] |
Anzaldi LL, Skaar EP. Overcoming the heme paradox: heme toxicity and tolerance in bacterial pathogens[J]. Infection and Immunity, 2010, 78(12): 4977-4989. DOI:10.1128/IAI.00613-10 |
| [30] |
Wandersman C, Delepelaire P. Bacterial iron sources: from siderophores to hemophores[J]. Annual Review of Microbiology, 2004, 58: 611-647. DOI:10.1146/annurev.micro.58.030603.123811 |
| [31] |
Contreras H, Chim N, Credali A, et al. Heme uptake in bacterial pathogens[J]. Current Opinion in Chemical Biology, 2014, 19: 34-41. DOI:10.1016/j.cbpa.2013.12.014 |
| [32] |
Foster AW, Patterson CJ, Robinson NJ, et al. Metallomics and the cell[J]. Coordination Chemistry Reviews, 2013, 257(21/22): 3072-3073. |
| [33] |
Létoffé S, Redeker V, Wandersman C. Isolation and characterization of an extracellular haem-binding protein from Pseudomonas aeruginosa that shares function and sequence similarities with the Serratia marcescens HasA haemophore[J]. Molecular Microbiology, 1998, 28(6): 1223-1234. DOI:10.1046/j.1365-2958.1998.00885.x |
| [34] |
Cope LD, Thomas SE, Hrkal Z, et al. Binding of heme-hemopexin complexes by soluble HxuA protein allows utilization of this complexed heme by Haemophilus influenzae[J]. Infection and Immunity, 1998, 66(9): 4511-4516. |
| [35] |
Perry RD, Bobrov AG, Kirillina O, et al. Yersinia pestis transition metal divalent cation transporters[J]. Advances in Experimental Medicine and Biology, 2012, 954: 267-279. |
| [36] |
Sepúlveda Cisternas I, Salazar JC, García-Angulo VA. Overview on the bacterial iron-riboflavin metabolic axis[J]. Frontiers in Microbiology, 2018, 9: 1478. DOI:10.3389/fmicb.2018.01478 |
| [37] |
Kim H, Lee H, Shin D. The FeoA protein is necessary for the FeoB transporter to import ferrous iron[J]. Biochemical and Biophysical Research Communications, 2012, 423(4): 733-738. DOI:10.1016/j.bbrc.2012.06.027 |
| [38] |
Weaver EA, Wyckoff EE, Mey AR, et al. FeoA and FeoC are essential components of the Vibrio cholerae ferrous iron uptake system, and FeoC interacts with FeoB[J]. Journal of Bacteriology, 2013, 195(21): 4826-4835. DOI:10.1128/JB.00738-13 |
| [39] |
Álvarez-Fraga L, Vázquez-Ucha JC, Martínez-Guitián M, et al. Pneumonia infection in mice reveals the involvement of the feoA gene in the pathogenesis of Acinetobacter baumannii[J]. Virulence, 2018, 9(1): 496-509. DOI:10.1080/21505594.2017.1420451 |
| [40] |
Hung KW, Juan TH, Hsu YL, et al. NMR structure note: the ferrous iron transport protein C (FeoC) from Klebsiella pneumoniae[J]. Journal of Biomolecular NMR, 2012, 53(2): 161-165. DOI:10.1007/s10858-012-9633-6 |
| [41] |
Lau CKY, Krewulak KD, Vogel HJ. Bacterial ferrous iron transport: the Feo system[J]. FEMS Microbiology Reviews, 2016, 40(2): 273-298. |
| [42] |
Cartron ML, Maddocks S, Gillingham P, et al. Feo-transport of ferrous iron into bacteria[J]. Biometals, 2006, 19(2): 143-157. DOI:10.1007/s10534-006-0003-2 |
| [43] |
Kalidasan V, Joseph N, Kumar S, et al. Iron and virulence in Stenotrophomonas maltophilia: all we know so far[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 401. DOI:10.3389/fcimb.2018.00401 |
| [44] |
Hsueh KL, Yu LK, Chen YH, et al. FeoC from Klebsiella pneumoniae contains a [4Fe-4S] cluster[J]. Journal of Bacteriology, 2013, 195(20): 4726-4734. DOI:10.1128/JB.00687-13 |
| [45] |
Beauchene NA, Mettert EL, Moore LJ, et al. O2 availability impacts iron homeostasis in Escherichia coli[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(46): 12261-12266. DOI:10.1073/pnas.1707189114 |
| [46] |
Fillat MF. The FUR (ferric uptake regulator) superfamily: diversity and versatility of key transcriptional regulators[J]. Archives of Biochemistry and Biophysics, 2014, 546: 41-52. DOI:10.1016/j.abb.2014.01.029 |
| [47] |
McHugh JP, Rodríguez-Quiñones F, Abdul-Tehrani H, et al. Global iron-dependent gene regulation in Escherichia coli. A new mechanism for iron homeostasis[J]. Journal of Biological Chemistry, 2003, 278(32): 29478-29486. DOI:10.1074/jbc.M303381200 |
| [48] |
Kim IH, Wen YC, Son JS, et al. The Fur-iron complex modulates expression of the quorum-sensing master regulator, SmcR, to control expression of virulence factors in Vibrio vulnificus[J]. Infection and Immunity, 2013, 81(8): 2888-2898. DOI:10.1128/IAI.00375-13 |
| [49] |
Pich OQ, Carpenter BM, Gilbreath JJ, et al. Detailed analysis of Helicobacter pylori Fur-regulated promoters reveals a Fur box core sequence and novel Fur-regulated genes[J]. Molecular Microbiology, 2012, 84(5): 921-941. DOI:10.1111/j.1365-2958.2012.08066.x |
| [50] |
Troxell B, Hassan HM. Transcriptional regulation by Ferric Uptake Regulator (Fur) in pathogenic bacteria[J]. Frontiers in Cellular and Infection Microbiology, 2013, 3: 59. |
| [51] |
Schwiesow L, Mettert E, Wei YH, et al. Control of hmu heme uptake genes in Yersinia pseudotuberculosis in response to iron sources[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 47. DOI:10.3389/fcimb.2018.00047 |
| [52] |
Jeon J, Kim H, Yun JE, et al. RstA-promoted expression of the ferrous iron transporter FeoB under iron-replete conditions enhances Fur activity in Salmonella enterica[J]. Journal of Bacteriology, 2008, 190(22): 7326-7334. DOI:10.1128/JB.00903-08 |
| [53] |
Ganz T, Nemeth E. Iron homeostasis in host defence and inflammation[J]. Nature Reviews Immunology, 2015, 15(8): 500-510. DOI:10.1038/nri3863 |
| [54] |
Soares MP, Weiss G. The Iron age of host-microbe interactions[J]. EMBO Reports, 2015, 16(11): 1482-1500. DOI:10.15252/embr.201540558 |
| [55] |
Nairz M, Dichtl S, Schroll A, et al. Iron and innate antimicrobial immunity—Depriving the pathogen, defending the host[J]. Journal of Trace Elements in Medicine and Biology, 2018, 48: 118-133. DOI:10.1016/j.jtemb.2018.03.007 |
| [56] |
Barber MF, Elde NC. Escape from bacterial iron piracy through rapid evolution of transferrin[J]. Science, 2014, 346(6215): 1362-1366. DOI:10.1126/science.1259329 |
| [57] |
Baker HM, Baker EN. A structural perspective on lactoferrin function[J]. Biochemistry and Cell Biology, 2012, 90(3): 320-328. DOI:10.1139/o11-071 |
| [58] |
Cartwright GE, Lee GR. Annotation: The anaemia of chronic disorders[J]. British Journal of Haematology, 1971, 21(2): 147-153. DOI:10.1111/j.1365-2141.1971.tb03424.x |
| [59] |
Ganz T. Iron and infection[J]. International Journal of Hematology, 2018, 107(1): 7-15. DOI:10.1007/s12185-017-2366-2 |
| [60] |
Armitage AE, Lim PJ, Frost JN, et al. Induced disruption of the iron-regulatory hormone hepcidin inhibits acute inflammatory hypoferraemia[J]. Journal of Innate Immunity, 2016, 8(5): 517-528. DOI:10.1159/000447713 |
| [61] |
Nairz M, Haschka D, Demetz E, et al. Iron at the interface of immunity and infection[J]. Frontiers in Pharmacology, 2014, 5: 152. |
| [62] |
Jabado N, Jankowski A, Dougaparsad S, et al. Natural resistance to intracellular infections: natural resistance– associated macrophage protein 1 (Nramp1) functions as a pH-dependent manganese transporter at the phagosomal membrane[J]. The Journal of Experimental Medicine, 2000, 192(9): 1237-1248. DOI:10.1084/jem.192.9.1237 |
| [63] |
McPherson CJ, Aschenbrenner LM, Lacey BM, et al. Clinically relevant gram-negative resistance mechanisms have no effect on the efficacy of MC-1, a novel siderophore-conjugated monocarbam[J]. Antimicrobial Agents and Chemotherapy, 2012, 56(12): 6334-6342. DOI:10.1128/AAC.01345-12 |
| [64] |
Alteri CJ, Hegan EC, Sivick KE, et al. Mucosal immunization with iron receptor antigens protects against urinary tract infeetion[J]. PLoS Pathogens, 2009, 5(9): e1000586. DOI:10.1371/journal.ppat.1000586 |
 2019, Vol. 46
2019, Vol. 46