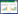扩展功能
文章信息
- 杨秀清, 刘亚妮, 席婧雯
- YANG Xiu-Qing, LIU Ya-Ni, XI Jing-Wen
- 原儿茶酸的生物转化
- Biotransformation of protocatechuic acid
- 微生物学通报, 2019, 46(12): 3378-3387
- Microbiology China, 2019, 46(12): 3378-3387
- DOI: 10.13344/j.microbiol.china.190083
-
文章历史
- 收稿日期: 2019-01-26
- 接受日期: 2019-03-12
- 网络首发日期: 2019-04-24
原儿茶酸别名3, 4-二羟基苯甲酸(Protocatechuic acid,PCA),为白色至褐色结晶性粉末,在空气中氧化变色,广泛存在于植物、糙米、水果、中草药中,是多种中药的主要活性成分和多种药物的前体物质,其生物学功效具有抗氧化、抗菌、抗肿瘤、抗炎等作用[1-5],此外还能添加于食物和化妆品中以延迟氧化[6-7]。目前国内市场对PCA的需求量逐年增长,其生产方法主要采用化学化工法从植物中抽提。在实验室水平下紫丁香叶中PCA的提取率最高仅能达到0.075 9 mg/g[8];利用超声波提取PCA的平均含量为0.623 mg/g[9];还有些学者利用酶解法提取鸡血藤中的PCA,发现果胶酶比纤维素酶的提取率高,但优化条件后PCA提取率仅为2.88%[10];利用超临界二氧化碳从半枝莲中提取PCA,最高提取率为64.094±2.756 μg/g[11]。以上方法不仅造成植物资源的浪费,而且提取工艺复杂耗时长,在多步提取过程中PCA有不同程度的损耗,提取率低,同时用化工法抽提过程中基于化工原料的使用会产生多重污染物。
目前国内外学者对PCA的研究主要集中于提取工艺的优化以及生物学效应探究,但由于化工法提取PCA存在多种缺陷,使得PCA的生物转化成为研究的新方向[12-13]。国外的部分研究利用4-羟基苯甲酸羟化酶和去甲基化酶进行了PCA的生物转化。如Okai等利用谷氨酸棒杆菌F (Ubi C)将大肠杆菌体内的分支酸-丙酮酸裂解酶进行异源表达,在葡萄糖培养条件下利用4-羟基苯甲酸羟化酶将胞外产生的4-HBA转化为PCA,其产量最高达1 168.1±11.6 mg/L[14];同时他们还利用香草醛去甲基化酶将阿魏酸转化为PCA,其产率为62.8%[15]。国内也有学者利用鼠李糖乳杆菌将天然花青素转化为PCA,转化率为30%-40%[16]。我们课题组通过基因组和转录组测序数据分析了在联苯培养条件下红球菌R04联苯下游途径的基因表达水平,发现红球菌R04参与苯甲酸代谢的对羟基苯甲酸-3-羟化酶基因在联苯条件下显著上调表达[17]。实验过程中发现红球菌R04菌悬液中加入ρ-HBA 6 h后,反应液和细胞内均未检测到对羟基苯甲酸,表明红球菌能够代谢ρ-HBA。我们将红球菌R04中对羟基苯甲酸-3-羟化酶基因重组至大肠杆菌细胞内表达,该基因表达产物可将ρ-HBA转化为PCA并泵出胞外。如图 1所示,ρ-HBA在ρ-HBA羟化酶的作用下转化生成PCA。
|
| 图 1 原儿茶酸的生物转化途径 Figure 1 Biotransformation pathway of protocatechuic acid |
|
|
本研究拟建立一种绿色高效的生物酶催化法来生产PCA,底物ρ-HBA可通过化学方法工业合成,成本低、易获取[18]。通过构建重组工程菌BL21(DE3)/pET21a(+)-ρ-HBA-3H诱导表达对羟基苯甲酸-3-羟化酶并进行生物转化,并且对转化条件进行优化。
1 材料与方法 1.1 材料 1.1.1 菌株、载体及培养基菌株Rhodococcus sp. R04、E. coli DH5α、E. coli BL21(DE3)和质粒pET-21a(+)均由本实验室保存。所用培养基为LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,氯化钠5.0;基础矿物盐培养基(g/L):KH2PO4 2.93,K2HPO4·3H2O 5.87,MgSO4·7H2O 0.30,FeSO4·7H2O 0.01,NaCl 0.20,(NH4)2SO4 5.00,NiSO4·7H2O 0.006,CaCl2 0.03,丁二酸钠1.00,微量元素盐溶液200 μL。微量元素盐溶液(g/L):Na3-Citrate·2H2O 0.18,FeSO4·7H2O 0.034,CoCl2·6H2O 0.005,Na2MoO4·2H2O 0.005,CuSO4·5H2O 0.004,MnCl2·4H2O 0.002,ZnCl2 0.003,H3BO3 0.002。基础矿物盐培养基使用时添加10 mmol/L葡萄糖作为碳源。
1.1.2 主要试剂和仪器限制性内切酶Hind Ⅲ和EcoR Ⅰ购自TaKaRa公司;FastPfu DNA Polymerase以及T4 DNA Ligase购自北京全式金生物技术有限公司;琼脂糖凝胶DNA回收试剂盒(Agarose Gel DNA Recovery Kit)和普通质粒小提试剂盒(Plasmid DNA Miniprep Kit)购自中科瑞泰(北京)生物科技有限公司;氨苄青霉素购自Sigma-Aldrich公司;对羟基苯甲酸(4-羟基苯甲酸)及原儿茶酸(3, 4-二羟基苯甲酸)购自生工生物工程(上海)股份有限公司;其他化学试剂购自太原市津海有限公司。
PCR仪,MJ Reserch公司;超声波细胞粉碎机,宁波新芝生物科技股份有限公司;Waters 1525 Binary HPLC Pump和Waters 2487 Dual Absorbance Detector,Waters公司。
1.2 方法 1.2.1 对羟基苯甲酸-3-羟化酶基因片段扩增使用酚-氯仿法提取红球菌R04的基因组,以红球菌R04基因组为模板,以P1 (5′-TAGAATTCA ATGCAACCCGCACGGTC-3′,含EcoR Ⅰ位点)和P2 (5′-TAAAGCTTTCAGCGGTCGGGCCGG-3′,含Hind Ⅲ位点)为引物,PCR扩增对羟基苯甲酸-3-羟化酶基因ρ-HBA-3H。引物由生工生物工程(上海)股份有限公司合成。PCR反应体系(50 μL):基因组DNA (50 ng/μL) 1 μL,引物P1、P2 (10 μmol/L)各3 μL,dNTPs (2.5 mmol/L) 5 μL,FastPfu DNA Polymerase (2.5 U/μL) 0.5 μL,5×FastPfu buffer 10 μL,ddH2O 27.5 μL;PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,58 ℃ 30 s,72 ℃ 1.5 min,循环30次;72 ℃ 10 min,4 ℃保存。凝胶电泳分离纯化PCR产物并切胶回收。
1.2.2 重组质粒的构建及鉴定将pET-21a(+)质粒与回收片段ρ-HBA-3H分别进行Hind Ⅲ和EcoR Ⅰ双酶切,酶切产物用T4 DNA连接酶连接后转化至E. coli DH5α感受态细胞,转化产物涂布至含50 mg/L氨苄青霉素的LB平板,37 ℃培养过夜。挑取平板上的单菌落,接入含50 mg/L氨苄青霉素的LB液体培养基,37 ℃、200 r/min振荡培养10-12 h后提取质粒,测序确认pET-21a(+)中插入的ρ-HBA-3H基因序列正确,得到pET21a(+)/ρ-HBA-3H重组质粒。
1.2.3 对羟基苯甲酸-3-羟化酶的诱导表达将重组质粒和pET-21a(+)空质粒分别转化至大肠杆菌E. coli BL21(DE3)感受态细胞,转化产物涂布至含50 mg/L氨苄青霉素的LB平板。经37 ℃培养过夜,挑取含有重组质粒的大肠杆菌及含有pET-21a(+)空质粒的对照大肠杆菌转化子,接入含50 mg/L氨苄青霉素的LB液体培养基,37 ℃、200 r/min培养8-10 h。然后以2%接种量接种至含50 mg/L氨苄青霉素的LB液体培养基,37 ℃、200 r/min培养至OD600约为0.6时,加入0.1 mmol/L IPTG进行低温诱导表达,16 ℃培养过夜得到发酵液。4 ℃、8 000 r/min离心10 min收集菌体,菌体用20 mmol/L Tris-HCl (pH 8.0)重悬。40 W超声15 min破碎细胞,12 000 r/min离心10 min取上清,经SDS聚丙烯酰胺凝胶电泳检测蛋白表达。
1.2.4 对羟基苯甲酸和原儿茶酸的光谱特性以及标准曲线的制作精密称取适量ρ-HBA和PCA的标准样品,溶于20 mmol/L Tris-HCl (pH 8.0)缓冲液中,配制浓度范围在10-200 μg/mL的标准样品,然后进行紫外全波长扫描以获得其紫外吸光光谱。根据扫描结果选择测定波长,将不同浓度(ρ-HBA浓度梯度为0、25、50、100、200 μg/mL;PCA浓度梯度为0、50、100、200、500 μg/mL)的ρ-HBA和PCA的标准样品20 μL注入高效液相色谱仪中,测定峰面积,并以峰面积和进样量(单位μg)的线性关系绘制标准曲线。
1.2.5 原儿茶酸的生物转化工程菌的处理:将重组大肠杆菌E. coli BL21 (DE3)经0.1 mmol/L IPTG诱导后,发酵液于4 ℃、8 000 r/min离心10 min收集菌体,菌体用20 mmol/L Tris-HCl (pH 8.0)缓冲液洗涤,重复洗涤2次后用相同的缓冲液重悬菌体至OD600值为3.0。
产物原儿茶酸的检测:取OD600值为3.0的菌液50 mL,加入200 μg/mL ρ-HBA,200 r/min振荡反应2-4 h后,取1 mL反应液12 000 r/min离心5 min,取上清液,采用高效液相色谱(HPLC)检测ρ-HBA的消耗率以及PCA的生成率。Waters C18色谱柱[4.6 mm×150 mm,5 μm];流动相:9%乙腈和91%的水(用磷酸调pH至2.5);柱温:室温;检测波长250 nm;流速:1 mL/min;进样量:20 μL[19]。
1.2.6 原儿茶酸的转化率及回收率转化率的计算:以1.2.4中测定的标准曲线为计算依据,运用高效液相法检测PCA的生成量,从而对应得到ρ-HBA实际转化量,它与ρ-HBA反应初始总含量的比值乘以100%即为转化率。
回收率的计算:采用样品加标回收法计算,在实验样品中加入定量的标准物质,实验样品(未加标)与加标样品按相同的步骤进行分析,加标样品与未加标样品所得结果之差同加入标准物质的理论值之比即为样品加标回收率[20]。精密称取PCA标准样品溶于20 mmol/L Tris-HCl (pH 8.0)缓冲液中,配制100、150、200 μg/mL三种不同浓度的标样溶液;经IPTG诱导后的重组工程菌菌液与200 μg/mL ρ-HBA混合摇瓶反应2-4 h后,取1 mL反应液12 000 r/min离心5 min,取上清液;将得到的上清液分别与缓冲液(未加标样品)和上述3种不同浓度的标样溶液(加标样品)等体积混合,将20 μL混合液注入高效液相色谱仪,测定并计算含量,得到回收率。
1.2.7 原儿茶酸生物转化过程的条件优化氧气对转化率的影响:实验组反应体系是OD600为3.0的菌液50 mL中加入终浓度为200 μg/mL的ρ-HBA,37 ℃静置反应3 h;对照组反应体系相同,37 ℃、200 r/min振荡反应3 h。每组设3个平行试验,HPLC检测反应速率。
Mg2+对转化率的影响:实验组反应体系是OD600为3.0的菌液50 mL中加入终浓度为200 μg/mL的ρ-HBA,然后分别加入终浓度为1、2、5、10 mmol/L的Mg2+,37 ℃、200 r/min振荡反应3 h;对照组不添加Mg2+,其余条件相同。每组设3个平行试验,HPLC检测反应速率。
Triton X-100对转化率的影响:实验组反应体系是OD600为3.0的菌液50 mL中加入终浓度为200 μg/mL的ρ-HBA,然后分别添加0.1%、0.2%、0.5%、1.0%的Triton X-100,37 ℃、200 r/min振荡反应3 h;对照组不添加Triton X-100,其余条件相同。每组设3个平行试验,HPLC检测反应速率。
吐温-80对转化率的影响:实验组反应体系是OD600为3.0的菌液50 mL中加入终浓度为200 μg/mL的ρ-HBA,然后分别添加1%、2%、4%、8%的吐温-80,37 ℃、200 r/min振荡反应3 h;对照组不添加吐温-80,其余条件相同。每组设3个平行试验,HPLC检测反应速率。
连续转化对转化率的影响:(1)反应体系是OD600为3.0的菌液50 mL中加入终浓度为200 μg/mL的ρ-HBA,37 ℃、200 r/min振荡反应3 h;(2)将反应液于4 ℃、8 000 r/min离心10 min弃上清,收集菌体;(3)菌体用20 mmol/L Tris-HCl (pH 8.0)的缓冲液洗涤2次后用相同的缓冲液重悬菌体至OD600为3.0;(4)加入ρ-HBA至终浓度为200 μg/mL,37 ℃、200 r/min振荡反应3 h;(5)重复(2)-(4)步;以上每一次转化结束后经HPLC检测反应速率。
补充碳源对转化率的影响:连续转化实验中,在每轮反应初始时向反应液中补充1 mL (每50 mL反应液) 10%的葡萄糖(Glucose,G)作为菌株碳源,其余步骤与连续转化实验相同。每一步反应结束后通过HPLC检测反应速率。
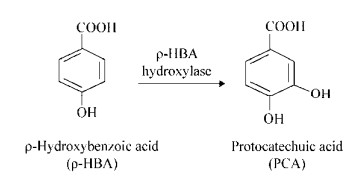
2 结果与分析 2.1 对羟基苯甲酸-3-羟化酶的基因克隆与鉴定以红球菌R04总DNA为模板,PCR扩增获得对羟基苯甲酸-3-羟化酶基因ρ-HBA-3H。该基因片段大小为1 285 bp,图 2为扩增出的ρ-HBA-3H基因特异性片段。
|
| 图 2 对羟基苯甲酸-3-羟化酶基因的PCR扩增 Figure 2 PCR amplification of ρ-HBA-3H gene 注:M:1 kb DNA marker;1、2:对羟基苯甲酸-3-羟化酶基因ρ-HBA-3H PCR产物. Note: M: 1 kb DNA marker; 1, 2: The PCR products of the ρ-HBA-3H gene. |
|
|
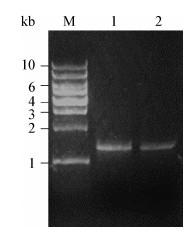
将连接产物转化至E. coli DH5α感受态细胞中,通过菌落PCR筛选阳性克隆,结果见图 3。泳道9是含pET-21a(+)空白质粒的大肠杆菌DH5α为模板作为筛选的阴性对照,其PCR产物大小约为200 bp;泳道5和泳道8是正确的阳性克隆片段,片段大小约为1 500 bp,阳性克隆片段经华大公司测序确认pET-21a(+)中插入的ρ-HBA-3H基因序列正确,得到pET21a(+)/ρ-HBA-3H重组质粒。

|
| 图 3 重组质粒的菌落PCR扩增筛选 Figure 3 Colony PCR amplification identification of recombinant plasmid 注:M:1 kb DNA marker;1-8:阳性克隆片段;9:阴性对照. Note: M: 1 kb DNA marker; 1-8: Positive clone fragment; 9: Negative control. |
|
|
重组基因工程菌BL21(DE3)/pET21a(+)-ρ- HBA-3H经0.1 mmol/L IPTG诱导表达对羟基苯甲酸-3-羟化酶,超声破碎细胞通过SDS聚丙烯酰胺凝胶电泳检测蛋白表达。该酶基因大小为1 285 bp,其蛋白分子量大小约为47.12 kD;由图 4可见,经IPTG诱导后含有重组质粒pET21a(+)/ρ-HBA-3H的大肠杆菌超声破碎上清液45 kD左右出现一条明显的主带,与预测的理论分子量(47.12 kD)一致,说明对羟基苯甲酸-3-羟化酶在大肠杆菌中诱导表达成功。

|
| 图 4 ρ-HBA-3H蛋白的SDS-PAGE分析 Figure 4 SDS-PAGE analysis for the expression of ρ-HBA-3H protein 注:M:蛋白质Marker;1:经0.1 mmol/L IPTG诱导的含pET-21a(+)的细胞破碎上清液;2:经0.1 mmol/L IPTG诱导的含pET21a(+)/ρ-HBA-3H的细胞破碎上清液. Note: M: Protein marker; 1: Supernatant of cell lysate containing pET-21a(+) induced by 0.1 mmol/L IPTG; 2: Supernatant of cell lysate containing pET21a(+)/ρ-HBA-3H induced by 0.1 mmol/L IPTG. |
|
|
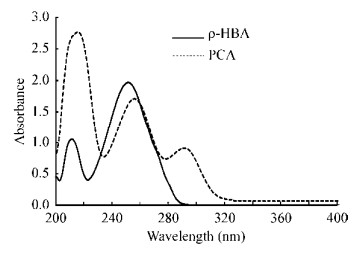
利用紫外全波长扫描获得ρ-HBA和PCA的紫外吸光光谱,从全波长扫描图(图 5)可知,ρ-HBA在250 nm处有最大吸收峰,在210 nm处有一较小的吸收峰,PCA在218 nm和256 nm处有吸收峰。两者在250 nm左右有大致相同的吸收峰,为了在同一波长下检测两种物质,后续的HPLC试验选择250 nm为检测波长。
|
| 图 5 对羟基苯甲酸和原儿茶酸的紫外吸光光谱 Figure 5 The UV absorbance spectrum of ρ-HBA and PCA |
|
|
根据紫外光谱图确定检测波长为250 nm,图 6为标准品ρ-HBA和PCA的高效液相色谱图,PCA出峰时间约为8 min,ρ-HBA约为12 min,该结果说明所采用的流动相能将ρ-HBA和PCA较好分离,不会对实验结果造成干扰。

|
| 图 6 对羟基苯甲酸和原儿茶酸的高效液相色谱图 Figure 6 HPLC chromatogram of ρ-HBA and PCA |
|
|
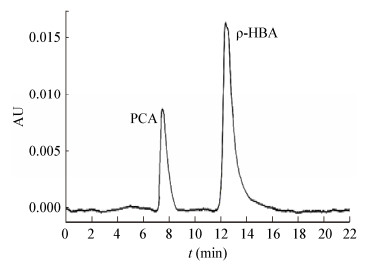
取OD600值为3.0的菌液50 mL,加入200 μg/mL ρ-HBA,200 r/min振荡反应一段时间后将反应液离心后取上清注入高效液相色谱仪中,如图 7所示,在8 min和12 min时分别出现了PCA和ρ-HBA吸收峰,说明经过反应后部分ρ-HBA已经转化为PCA。
|
| 图 7 产物原儿茶酸的检测 Figure 7 Detection of PCA |
|
|
从表 1可知,产物原儿茶酸的平均回收率为90.98%,说明所建立的HPLC检测条件能够使转化产物基线分离,并且分离效果较好,适用于反应液中PCA的分析。
| Items | Loading system (10 μL+10 μL) | |||
| S+Buffer | S+100 μg/mL Standard PCA | S+150 μg/mL Standard PCA | S+200 μg/mL Standard PCA | |
| Total area | 5 738 422±77 | 7 481 983±124 | 8 040 789±231 | 8 699 376±96 |
| Area difference | 0 | 1 743 561±143 | 2 302 367±169 | 2 960 954±103 |
| Corresponding quality difference (μg) | 0 | 0.933±0.015 | 1.337±0.005 | 1.810±0.113 |
| Theoretical quality difference (μg) | 0 | 1.0±0.3 | 1.5±0.2 | 2.0±0.2 |
| Recoveries (%) | - | 93.30±0.31 | 89.13±1.32 | 90.50±0.52 |
| Average recoveries (%) | 90.98±0.06 | |||
| RSD (%) | 1.1±0.2 | |||
| 注:S:实验样品. -:无数据. Note: S: The experimental sample. -: No data. | ||||
氧气对转化率的影响:实验组和对照组反应液经HPLC检测,反应3 h后,静置的反应液中只有少量的PCA生成,而振荡反应液中有大量PCA生成,且ρ-HBA几乎完全被转化(表 2)。表明对羟基苯甲酸-3-羟化酶在催化生成PCA的过程中需要提供充足的氧气。
| Groups | Reaction conditions | 2 h amount of PCA (μmol) |
3 h amount of PCA (μmol) |
2 h transformation rate of ρ-HBA (%) |
3 h transformation rate of ρ-HBA (%) |
| A | Static | 0.26±0.02 | 2.35±0.28 | 0.40±0.12 | 3.20±0.11 |
| Oscillation | 60.93±0.25 | 67.18±0.55 | 84.10±0.24 | 92.70±0.15 | |
| B | Addition 5 mmol/L Mg2+ | 58.67±1.04 | 67.54±1.23 | 80.90±0.22 | 93.20±0.19 |
| Not addition Mg2+ | 61.01±1.23 | 67.34±1.07 | 84.20±0.32 | 93.00±1.29 | |
| C | Addition 0.2% Triton X-100 | 54.84±0.36 | 64.40±2.03 | 75.70±1.04 | 88.90±0.14 |
| Not addition Triton X-100 | 55.49±0.22 | 64.95±0.39 | 76.60±0.34 | 89.60±0.21 | |
| D | Addition 2% Tween-80 | 69.85±0.31 | 69.86±1.64 | 96.40±0.61 | 96.10±1.32 |
| Not addition Tween-80 | 55.48±0.57 | 67.60±0.34 | 76.50±0.42 | 93.30±1.14 |
Mg2+对转化率的影响:分别将对照组和添加Mg2+的实验组在反应进行1、2、3 h后取样,经HPLC检测,发现两组实验在各时间段内原儿茶酸的生成量相差不大(表 2),但2 h PCA的生成量和ρ-HBA转化率与对照组相比有稍微下降。实验组中添加不同浓度Mg2+的实验结果之间几乎没有差别,表明添加Mg2+对反应催化效率影响较小。
Triton X-100对转化率的影响:将Triton X-100溶于缓冲液中,经HPLC检测,在8 min和12 min时均无特异峰出现,说明添加Triton X-100不会对实验结果造成干扰。分别将实验组和对照组在反应进行1、2、3 h后取反应液经HPLC检测,发现两组实验中在各时间段内PCA的生成量相差不大,实验组中添加不同浓度Triton X-100的实验结果也几乎无差别。表明添加Triton X-100不能改变大肠杆菌细胞通透性而增加ρ-HBA进入胞内的速率,即不会影响反应催化的效率(表 2)。
吐温-80对转化率的影响:将吐温-80溶于缓冲液中,经HPLC检测,在8 min和12 min时均无特异峰出现,说明添加吐温-80不会对实验结果造成干扰。分别将实验组和对照组在反应进行1、2、3 h后取反应液经HPLC检测,发现不同时间添加吐温-80的实验组中PCA的产量均高于对照组,实验组在2 h时ρ-HBA几乎转化完全,而对照组则需3-4 h才能转化完全(表 2)。实验组中添加不同浓度吐温-80的实验结果之间差别很小,表明添加吐温-80能够改变大肠杆菌细胞膜的通透性,有利于ρ-HBA与PCA的跨膜运输,从而提高PCA的产量。
连续转化和补充碳源对转化率的影响:在预实验中发现,转化3-4 h后反应液经HPLC检测,12 min处没有出现底物的吸收峰,即ρ-HBA已完全消耗,产物峰面积达到最大,4 h后产物不再增加;但是随着时间增加,产物在后续的摇瓶发酵过程中逐渐减少,至7 h后彻底消失。为了减少PCA的损耗和增加重组工程菌的利用率,设计了连续转化实验,对工程菌重复利用使其可以多次催化底物ρ-HBA。此外,在连续转化实验基础上对反应体系进行优化,加入了葡萄糖,一方面可以为工程菌提供正常生存所需的碳源,另一方面可以减少工程菌对PCA的吸收,从而降低其损耗量。表 3为连续转化实验添加碳源前后底物ρ-HBA转化率及产物PCA的产量,从中能明显看出增加碳源能够有效增加工程菌的转化效率,减少PCA的损耗。可计算得出在未补充葡萄糖的条件下,连续转化反应完成后每升反应液可生产0.92 g PCA,补充葡萄糖后PCA产量可达1.156 g/L。
| Groups | ρ-HBA transformation rate (%) |
Amount of PCA (g/L) |
| First round of control | 92.91±0.31 | 0.415±0.021 |
| First round of addition G | 91.98±1.25 | 0.411±0.016 |
| Second round of control | 77.08±2.34 | 0.338±0.082 |
| Second round of addition G | 89.22±0.57 | 0.398±0.058 |
| Third round of control | 37.47±3.26 | 0.167±0.036 |
| Third round of addition G | 77.83±1.61 | 0.347±0.064 |
随着生物科学的不断发展,生物转化已逐渐应用于天然产物的研究中,与化学提取法相比,生物转化反应具有高效、高选择性、反应清洁、产物单一等优点,符合绿色化学的要求[13];而运用化学法提取活性成分会对环境造成一定程度的污染[8-11]。本研究成功构建了对羟基苯甲酸-3-羟化酶的高效表达菌株BL21(DE3)/pET21a(+)-ρ-HBA-3H,并运用该工程菌细胞首次实现了原儿茶酸的生物转化。连续转化基础上,补充葡萄糖后PCA产量可达1.156 g/L。Okai等利用4-羟基苯甲酸羟化酶进行PCA生物转化的产量达1 168.1±11.6 mg/L[14]。本研究与Okai等研究的PCA产量基本相当,不同之处在于所用的酶和原料不同,Okai等首先利用分支酸-丙酮酸裂解酶将葡萄糖转化为胞外的4-HBA,然后在4-羟基苯甲酸羟化酶作用下将4-HBA转化为PCA,而本研究则是直接利用对羟基苯甲酸-3-羟化酶将底物ρ-HBA转化为PCA,更为直接高效。本实验反应上清中PCA的回收率基本可达90%以上,实现了PCA的高效率、无污染的绿色生产,可以预见,此方法将为其他重要发酵产品的工业化生产提供重要的理论研究基础。
条件优化实验说明了Mg2+、Triton X-100对转化效率影响较小甚至无影响,但增加反应体系的溶氧量及添加适量的吐温-80能够促进转化反应的进行,同时实验结果表明增加适量葡萄糖能够有效增加工程菌的转化效率,同时能够有效减少PCA的消耗。胡纯铿等发现添加适当浓度的Mg2+能显著降低受冲击菌体的细胞膜透性,提高菌体的耐酒精存活率[21]。本研究发现2 h PCA的生成量和ρ-HBA转化率有稍微下降可能与这一原因有相关性。有研究表明使用吐温-80可以显著提高药物的渗透性,并且对细胞增殖、形态和运动没有影响[22]。本研究中添加吐温-80能够改变大肠杆菌细胞膜的通透性,有利于ρ-HBA与PCA的跨膜运输,提高PCA的产量。同时吐温-80对菌种生长有一定的促进作用,但Trition X-100对菌种生长影响较小,从而影响发酵的产量[23]。除上述影响转化效率的因素外,我们还对不同的诱导温度、不同的反应温度以及细胞冻存前后等条件下的转化进行了实验,发现诱导温度为16 ℃、反应温度为37 ℃时转化效率最高,冻存时间48 h之内转化率微弱下降,将菌体冻存7 d以上,转化率下降较为明显。在预实验过程中出现PCA损耗的现象,7 h后反应液中的PCA可被完全消耗掉。我们将PCA标准样品置于摇床之中,7 h后检测标准样品只出现微弱氧化,说明反应液中的PCA是被大肠杆菌吸收代谢而非自然氧化损耗,所以转化反应结束后应将反应上清液与菌体及时分离开。
目前生物转化研究的主流仍然停留在整体细胞催化水平,对催化酶展开的研究则相对较少,且固定化技术的应用也为生物转化提供新的发展方向。与游离细胞相比,固定化细胞具有细胞密度高、反应速度快、耐毒害能力强、微生物流失少和产物分离容易等优点[24-25]。本研究中对羟基苯甲酸-3-羟化酶以活性形式存在于细胞中,产物生成后随即被泵出细胞,但连续转化实验发现随着转化次数的增加,底物的转化率和产物的生成量均降低,分析原因可能是菌体细胞的活力随时间的增加而降低,且细胞处于游离状态,产物后期与细胞分离时也会造成一定的损耗。如果研究中能将细胞或者酶进行固定化,可以预见,PCA的产量还会进一步提高,这将为工业化生产提供理论研究基础。
4 结论本研究成功构建了对羟基苯甲酸-3-羟化酶的高效表达菌株BL21(DE3)/pET21a(+)-ρ-HBA-3H,通过生物转化PCA产量可达1.156 g/L,反应上清液中PCA回收率达90%以上;条件优化实验表明Mg2+、Triton X-100对转化效率影响较小甚至无影响,但增加反应体系的溶氧量及添加适量的吐温- 80能够促进转化反应的进行,同时反应液在连续转化基础上适量补充葡萄糖能够有效增加工程菌的转化效率,减少PCA的消耗。
| [1] |
Adefegha SA, Oboh G, Ejakpovi Ⅱ, et al. Antioxidant and antidiabetic effects of gallic and protocatechuic acids: a structure-function perspective[J]. Comparative Clinical Pathology, 2015, 24(6): 1579-1585. DOI:10.1007/s00580-015-2119-7 |
| [2] |
Ajiboye TO, Habibu RS, Saidu K, et al. Involvement of oxidative stress in protocatechuic acid-mediated bacterial lethality[J]. MicrobiologyOpen, 2017, 6(4): e472. |
| [3] |
Tsao SM, Hsia TC, Yin MC. Protocatechuic acid inhibits lung cancer cells by modulating FAK, MAPK, and NF-B pathways[J]. Nutrition and Cancer, 2014, 66(8): 1331-1341. DOI:10.1080/01635581.2014.956259 |
| [4] |
Winter AN, Brenner MC, Punessen N, et al. Comparison of the neuroprotective and anti-inflammatory effects of the anthocyanin metabolites, protocatechuic acid and 4-hydroxybenzoic acid[J]. Oxidative Medicine and Cellular Longevity, 2017, 2017: 6297080. |
| [5] |
Kakkar S, Bais S. A review on protocatechuic acid and its pharmacological potential[J]. ISRN Pharmacology, 2014, 2014: 952943. |
| [6] |
Yin MC, Chao CY. Anti-Campylobacter, anti-aerobic, and anti-oxidative effects of roselle calyx extract and protocatechuic acid in ground beef[J]. International Journal of Food Microbiology, 2008, 127(1/2): 73-77. |
| [7] |
Zillich OV, Schweiggert-Weisz U, Hasenkopf K, et al. Release and in vitro skin permeation of polyphenols from cosmetic emulsions[J]. International Journal of Cosmetic Science, 2013, 35(5): 491-501. DOI:10.1111/ics.12072 |
| [8] |
Zhao DW, Wang PH. Study on the extraction technology of protocatechuic acid from Syringa oblata Lindl. leaves[J]. Medicinal Plant, 2011, 2(9): 49-51. |
| [9] |
Li Y, Yang DB, Hai P, et al. Ultrasonic extraction of protocatechuic acid from Schisandra chinensis[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2009, 18(8): 11-12. (in Chinese) 李艳, 杨道宾, 海鹏, 等. 超声波提取五味子中原儿茶酸的工艺研究[J]. 中国民族民间医药, 2009, 18(8): 11-12. DOI:10.3969/j.issn.1007-8517.2009.08.006 |
| [10] |
Liu YB, Zhang ZH. Technical study of enzymatic hydrolysis in extracting of protocatechuic acid in net cliffbean[J]. Journal of Xinxiang Medical College, 2014, 31(10): 800-802. (in Chinese) 刘仰斌, 张志花. 酶解法提取鸡血藤原儿茶酸的工艺研究[J]. 新乡医学院学报, 2014, 31(10): 800-802. |
| [11] |
Yang YC. Extraction of protocatechuic acid from Scutellaria barbata D. Don using supercritical carbon dioxide[J]. Journal of Supercritical Fluids, 2013, 81: 55-66. DOI:10.1016/j.supflu.2013.04.007 |
| [12] |
Williams KM, Martin WE, Smith J, et al. Production of protocatechuic acid in Bacillus thuringiensis ATCC33679[J]. International Journal of Molecular Sciences, 2012, 13(12): 3765-3772. |
| [13] |
Wang YD, Cheng GG, Yu XY, et al. Research progress of biotransformation in natural product chemistry[J]. Chemical and Bioengineering, 2010, 27(2): 7-10, 14. (in Chinese) 王煜丹, 程桂广, 余旭亚, 等. 生物转化在天然产物化学中的研究进展[J]. 化学与生物工程, 2010, 27(2): 7-10, 14. DOI:10.3969/j.issn.1672-5425.2010.02.002 |
| [14] |
Okai N, Miyoshi T, Takeshima Y, et al. Production of protocatechuic acid by Corynebacterium glutamicum expressing chorismate-pyruvate lyase from Escherichia coli[J]. Applied Microbiology and Biotechnology, 2016, 100(1): 135-145. DOI:10.1007/s00253-015-6976-4 |
| [15] |
Okai N, Masuda T, Takeshima Y, et al. Biotransformation of ferulic acid to protocatechuic acid by Corynebacterium glutamicum ATCC 21420 engineered to express vanillate O-demethylase[J]. AMB Express, 2017, 7: 130. DOI:10.1186/s13568-017-0427-9 |
| [16] |
Liao ZL, Li HR, Fang X, et al. Method for carrying out whole-cell catalysis on natural anthocyanin by utilizing microorganisms and transforming natural anthocyanin into protocatechuic acid and application: CN, 107058409 A[P]. 2017-08-18 (in Chinese) 廖振林, 李汉荣, 方祥, 等.一种用微生物全细胞催化天然花青素转化原儿茶酸的方法和应用: 中国, 107058409 A[P]. 2017-08-18 |
| [17] |
Yang XQ, Xi JW. Transcriptomic and benzoate metabolic pathways of Rhodococcus sp. R04 cultured in biphenyl[J]. Acta Microbiologica Sinica, 2015, 55(7): 851-862. (in Chinese) 杨秀清, 席婧雯. 联苯培养条件下红球菌R04转录表达和苯甲酸代谢途径解析[J]. 微生物学报, 2015, 55(7): 851-862. |
| [18] |
Huang SH, Zeng HW, Xiang JR, et al. Synthesis of p-hydroxybenzoic acid[J]. Chemical Engineer, 1989, 20(5): 5-7. (in Chinese) 黄绍华, 曾汉维, 象经荣, 等. 对羟基苯甲酸的合成[J]. 化学工程师, 1989, 20(5): 5-7. |
| [19] |
Hu XW, Zhao QW. Determination of protocatechuic acid, protocatechualdehyde in Feng Han Gan Mao Ning granules by RP-HPLC[J]. Chinese Journal of Modern Applied Pharmacy, 2002, 19(1): 53-56. (in Chinese) 胡晓炜, 赵青威. RP-HPLC法测定风寒感冒宁冲剂中原儿茶酸、原儿茶醛的含量[J]. 中国现代应用药学, 2002, 19(1): 53-56. DOI:10.3969/j.issn.1007-7693.2002.01.026 |
| [20] |
Han Y, Xiong ZL, Yang CJ, et al. Determination of protocatechuic acid in rat plasma by high performance liquid chromatography[J]. Chinese Journal of Chromatography, 2007, 25(2): 207-210. (in Chinese) 韩  , 熊志立, 杨春娟, 等. 高效液相色谱法测定大鼠血浆中的原儿茶酸[J]. 色谱, 2007, 25(2): 207-210. DOI:10.3321/j.issn:1000-8713.2007.02.016 , 熊志立, 杨春娟, 等. 高效液相色谱法测定大鼠血浆中的原儿茶酸[J]. 色谱, 2007, 25(2): 207-210. DOI:10.3321/j.issn:1000-8713.2007.02.016 |
| [21] |
Hu CK, Bai FW, An LJ. Mechanism for Mg2+ to enhance ethanol tolerance of fusant SPSC[J]. Journal of Dalian University of Technology, 2004, 44(2): 228-232. (in Chinese) 胡纯铿, 白凤武, 安利佳. 镁离子提高融合株SPSC耐酒精性能机制[J]. 大连理工大学学报, 2004, 44(2): 228-232. DOI:10.3321/j.issn:1000-8608.2004.02.014 |
| [22] |
Staurouskaya AA, Potapova TV, Rosenblat VA, et al. The effect of non-ionic detergent tween 80 on colcemid-resistant transformed mouse cells in vitro[J]. International Journal of Cancer, 2010, 15(4): 665-672. |
| [23] |
Duan YY, Zhao W, Cao DP, et al. Effects of surfactants on production of sodium gluconate[J]. The Food Industry, 2014, 35(10): 118-120. (in Chinese) 段莹莹, 赵伟, 曹大鹏, 等. 表面活性剂对葡萄糖酸钠发酵的影响[J]. 食品工业, 2014, 35(10): 118-120. |
| [24] |
Webb C. The role of cell immobilization in fermentation technology[J]. Australian Journal of Biotechnology, 1989, 3(1): 50-55. |
| [25] |
Wang CX, Zhang TJ, Xiao YQ, et al. Continuous production of glycyrrtinic acid 3-O-mono-β-D-glucuronide by immobilized cells[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(15): 301-307. (in Chinese) 王彩霞, 张腾江, 肖玉清, 等. 固定化细胞连续生产单葡萄糖醛酸基甘草次酸[J]. 农业工程学报, 2016, 32(15): 301-307. DOI:10.11975/j.issn.1002-6819.2016.15.042 |
 2019, Vol. 46
2019, Vol. 46