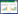扩展功能
文章信息
- 崔丙健, 高天明, 陈琳
- CUI Bing-Jian, GAO Tian-Ming, CHEN Lin
- 异育银鲫养殖环境典型病原微生物检测和细菌群落解析
- Typical pathogenic microorganisms detection and bacterial community analysis of gibel carp (Carassius auratus gibelio) breeding environment
- 微生物学通报, 2019, 46(12): 3363-3377
- Microbiology China, 2019, 46(12): 3363-3377
- DOI: 10.13344/j.microbiol.china.190105
-
文章历史
- 收稿日期: 2019-02-14
- 接受日期: 2019-07-02
- 网络首发日期: 2019-07-10
2. 中国科学院生态环境研究中心 环境生物技术重点实验室 北京 100085;
3. 中国科学院大学资源与环境学院 北京 100049
2. CAS Key Laboratory of Environmental Biotechnology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;
3. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049, China
江苏省是我国重要的水产养殖基地,也是鲫的主要养殖区,主要集中在苏北地区,其产量和产值居全国首位[1]。近年来,对于鲫影响最大的病害主要是由病毒引起的鱼鳃出血病、细菌引起的大红鳃病和寄生虫引起的孢子虫病。“宿主-病原-环境”平衡被打破是引发各类病原疾病暴发的根本原因,水产病害频发已成为制约水产养殖业健康发展的重要障碍。目前大多数研究主要集中于鲫个体(肠道)的病原检测和病理研究,而与宿主直接相关的养殖环境关注较少。鱼类与微生物以水体作为共有的环境,两者的微生物群落之间会发生更为直接的相互作用,从而影响养殖环境和鱼类的健康状况。
存活于养殖池塘中的病原尽管只占微生物群落的很少一部分,但在一定环境条件的刺激下会大量增殖,最终可能导致水产疾病的暴发流行。尤其是近几年,由鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus Ⅱ,CyHV-2)引发的病毒性鱼鳃出血病的流行,给养殖户带来了严重的经济损失。该病于2009年在苏北地区部分塘口零星出现,2011年后在盐城地区开始大面积的暴发性扩散,鲫病毒性出血病通常可并发或继发寄生虫与细菌感染。20世纪90年代日本西部养殖的金鱼发生疱疹病毒性造血器官坏死病大流行,死亡率几乎达到了100%,这是有关CyHV-2的首次报道[2]。Wang等[3]于2011年9-10月采集发病塘样本,通过病理学观察和PCR检测首次报道了我国鲫感染该病的发生。在早期病原确定之后,相继建立了PCR、荧光定量PCR和环介导等温扩增(Loop-mediated isothermal amplification,LAMP) PCR等分子检测技术[4-6]。高敏敏等[7]研究报道了CyHV-2在池塘环境中的存在状态以及水平和垂直传播途径的可能性。Minamoto等[8]利用定量PCR方法对云南省滇池和洱海自然水体中包括CyHV-2在内的多种病毒进行了定量监测,结果表明虽然没有发现致病性病毒疾病的暴发,但证明了病毒在水环境中存在的普遍性。南方地区鱼类气单胞菌败血症主要是由维氏气单胞菌和嗜水气单胞菌感染引起的,并且常出现这两种菌的复合感染[9]。Fichi等[10]对Arno River支流暴发疾病的鱼体进行寄生虫学、细菌学、组织学和病毒学检查,详细报道了与细菌性病原Aeromonas sobria感染相关的CyHV-2的检测。鱼体受伤、越冬鱼池放养密度过高或其他病原引起的继发感染等都易导致鱼体表面感染水霉菌。王浩等[11]建立并优化了LAMP技术检测水霉菌孢子及其菌丝体的方法。张楠等[12]采集了7个主要淡水养殖区的60株疑似致病性水霉菌,应用分子技术进行分类确定了多子水霉和寄生水霉是主要的致病性水霉菌。粘孢子虫病已经成为危害鲫养殖最严重的寄生虫病,李丹[13]以武汉单极虫(Thelohanellus wuhanensis)、洪湖碘泡虫(Myxobolus honghuensis)、丑陋圆形碘泡虫(M. turpisrotundus)和吴李碘泡虫(M. wulii)为研究对象,建立了快速准确的多重PCR检测方法,为粘孢子虫病原体早期防控提供技术支撑。与陆生动物相比,水产动物完全生活于水环境中,宿主微生物直接受水环境微生物组成的影响。同样地,由于粪便直接排入水中,肠道微生物也影响环境微生物的组成,两者的微生物群落结构更相近。宿主的微生物主要来源于饲喂的微生态制剂和环境微生物,养殖环境的微生物群落很大程度上影响鱼类的健康状况[14]。
本文以鲫养殖池塘为研究对象,利用定量PCR和T-RFLP方法检测分析养殖水体和沉积物中典型的病原微生物丰度,以及探讨不同阶段养殖环境细菌群落组成变化,这将有助于养殖环境的微生态平衡调控,并为指导生产上病原微生物的快速诊断和疾病早期预警提供重要依据。
1 材料与方法 1.1 材料 1.1.1 样品点描述采样地点位于江苏省盐城市大丰区(32°56′N,120°56′E)和射阳县(33°46′N,120°15′E)。选择养殖模式和条件相同的高密度独立封闭主养异育银鲫养殖塘,混养草鱼和鲢鱼等。池塘面积约10-20 hm2,养殖期间不换水,以补水为主,池塘水位1.8-2.0 m,放养密度22 500-30 000尾/hm2。根据鱼类的摄食和残饵情况,由自动投料机每天投喂4次,增氧方式为水车式和叶轮式两种。
1.1.2 主要试剂和仪器pGEM-T Easy载体、GoTaq® qPCR Master Mix,Promega公司;2×PCR PreMix,北京睿博兴科生物科技公司;LB固体和液体培养基,生工生物工程(上海)股份有限公司;Fast DNA SPIN Kit for Soil、FastPrep-24 instrument with the QuickPrepTM Adapter,MP Biomedicals公司;E.Z.N.A™ Gel Extraction Kit、E.Z.N.A.® Plasmid Mini Kit I Spin Kit,Omega Bio-tek公司。Gel Doc™ XR+成像系统、CFX Connect™荧光定量PCR检测系统,Bio-Rad公司;NanoDrop 2000,Thermo Fisher公司;无菌水样采集袋,青岛海博生物公司;便携式多参数水质分析仪,哈希公司。
1.1.3 样品采集采样时间2016年4-8月,样品采自大丰区和射阳县的两个水产养殖场,每个养殖场选择两个异育银鲫养殖池塘作为研究对象。每个池塘对角线两端及对角线交点上各设一个样点分别采集水体和底泥,各取5个重复样品。利用500 mL的无菌水样采集袋采集低于水面30 cm的表层水,沉积物样品利用开口采泥器采集塘底表层底泥,去除杂物后装入无菌样品袋中。水体和沉积物样品放入冷藏箱中保存运输,并于采样后24 h内进行处理。样品命名:大丰两个池塘样品编号分别为DF1和DF2,射阳两个池塘样品编号分别为SY1和SY2,W代表水体样品,S代表沉积物样品。
1.2 方法 1.2.1 样品预处理利用便携式多参数水质分析仪现场测定pH、温度、氧化还原电位(Oxidation-reduction potential,ORP)和溶解氧(Dissolved oxygen,DO)等水质指标。
采集的样品于实验室内进行预处理及分析,取一定量的水样参照国家标准检测方法[15-16]测定化学需氧量(Chemical oxygen demand,COD)、亚硝酸盐(NO2-N)、硝酸盐(NO3-N)、氨氮(NH3-N)、总磷(Total phosphate,TP)。另取水样静置5-10 min,待杂质沉淀后,利用真空抽滤装置以0.22 μm微孔滤膜过滤,截留微生物颗粒的滤膜对折4次,置于1.5 mL离心管。水体中病毒的浓缩采用阳离子包膜过滤的方法进行[17]。底泥样品冷冻干燥后,均质过筛(0.9 mm,20目)。上述预处理样品-20 ℃冷冻保存用于微生物分析。
1.2.2 基因组DNA提取滤膜样品用无菌剪刀剪碎,然后与冻干过筛后的沉积物样品(500 mg)分别使用Fast DNA SPIN Kit for Soil提取总基因组DNA,具体步骤参照试剂盒说明书。取5 μL基因组DNA溶液用1.0%的琼脂糖凝胶电泳检测提取效果,采用NanoDrop 2000测定浓度及纯度(A260/A280值在1.8-2.0之间),然后保存于-80 ℃冰箱备用。
1.2.3 定量标准曲线构建及定量PCR根据文献[18-23]报道的相关病原菌特异性引物序列(表 1)进行常规PCR扩增反应,扩增产物用1.0%的琼脂糖凝胶电泳验证目的条带大小,并利用E.Z.N.A™ Gel Extraction Kit进行切胶回收纯化。纯化后的PCR产物与pGEM-T Easy载体连接后导入感受态细胞DH5α,涂布筛选阳性克隆。经PCR鉴定为阳性的克隆子转入LB液体培养基扩大培养,取1.5 mL培养菌液送测序公司对插入基因片段进行鉴定,测序结果通过NCBI的BLAST (http://www.ncbi.nih.gov/blast/)进行序列同源性检索比对。利用E.Z.N.A.® Plasmid Mini Kit I Spin Kit提取质粒DNA,并测定浓度,根据质粒浓度计算基因拷贝数。将已知拷贝数的质粒l0倍梯度稀释作为标准模板,进行荧光定量PCR扩增。
| 病原名称 Pathogen name |
引物序列 Primer sequences (5′→3′) |
扩增子大小 Amplicon size (bp) |
退火温度 Annealing temperature (℃) |
参考文献 References |
| 嗜水气单胞菌 A. hydrophila |
F: CAAGAACAAGTTCAAGTGGCCA R: ACGAAGGTGTGGTTCCAGT |
309 | 59 | [18] |
| 温和气单胞菌 A. sobria |
F: TAAAGGGAAATAATGACGGCG R: GGCTGTAGGTATCGGTTTTCG |
249 | 59 | [18] |
| 维氏气单胞菌 A. veronii |
F: GAGGAAAGGTTGGTAGCTAATAA R: CGTGCTGGCAACAAAGGACAG |
658 | 60 | [19] |
| 鲤疱疹病毒Ⅱ型 CyHV-2 |
F: TCGGTTGGACTCGGTTTGTG R: CTCGGTCTTGATGCGTTTCTTG Probe: CCGCTTCCAGTCTGGGCCACTACC |
170 | 58 | [20] |
| 水霉属 Saprolegnia spp. |
F: GTCAAATACCCAACTGCTTG R: CTATTAATCATTACCTCGGTGTGC |
693 | 60 | [21] |
| 碘泡虫属 Myxobolus spp. |
F: AGACACTGGGAGGTGGTGAC R: CACTGCGTGATCCAACTACG |
196 | 52 | [22] |
| 细菌总数 Total bacteria |
F: ACTCCTACGGGAGGCAGCAG R: ATTACCGCGGCTGCTGG |
200 | 60 | [23] |
定量PCR反应在CFX Connect™荧光定量PCR检测系统上进行,反应体系:GoTaq® qPCR Master Mix 12.5 μL,上、下游引物(0.5 μmol/L)各0.5 μL,模板1 μL,加无菌ddH2O补齐至25 μL,反应于八联排管中进行。荧光定量PCR反应条件为:95 ℃ 2 min;94 ℃ 15 s,52-60 ℃ 30 s,72 ℃ 45 s,40个循环;72 ℃ 10 min。熔解曲线条件:95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s,所有反应均设置3个重复,起始模板浓度由Ct值确定。每轮反应均以无菌ddH2O代替模板DNA作为阴性对照。
1.2.4 T-RFLP分析以基因组DNA为模板,利用细菌16S rRNA基因的通用引物27F和926R进行PCR扩增(引物27F的5′端用FAM荧光标记)[24]。PCR反应条件:95 ℃ 5 min;95 ℃ 45 s,50 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。重复3次,3次PCR产物进行混合,以减少扩增带来的误差。PCR产物用E.Z.N.A™ Gel Extraction Kit纯化,纯化后的PCR产物用四碱基的限制性内切酶Hha I (GCG^C)进行酶切(37 ℃,3 h)。酶切产物送至北京睿博兴科生物技术有限公司利用ABI基因分析仪3730xl DNA analyzer进行T-RFLP检测。
1.3 数据处理T-RFLP图谱用GeneMarker (V1.75)软件进行分析,选择的内标为GS600liz。根据峰面积定量限制性内切片段(T-RFs),舍去 < 50 bp和 > 900 bp的片段,计算微生物群落结构多样性香农指数(Shannon,H)、辛普森指数(Simpson,D)、物种均度(E)及相对丰度(S),本分析中舍去了相对丰度 < 1%的T-RFs[25]。采用移动窗口分析方法(Moving-window analysis)分析群落结构的动态变化[26]。基于TRFs的峰面积大小,利用在线工具MICA Ⅲ TRFLP analysis (PAT+) program进行比对分析,推测酶切片段匹配的菌群类别(http://mica.ibest.uidaho.edu)。其他统计分析使用SPSS 20和Prism 6进行。
2 结果与分析 2.1 养殖水体的理化性质不同采样时间异育银鲫养殖池塘的水质参数如图 1所示,可以看出池塘养殖水体的水质指标呈现明显的季节变化趋势。养殖池塘水体理化指标监测结果表明,整个养殖周期不同池塘的理化因子随时间变化趋势基本一致,在夏季高温影响较大。养殖水体的pH变化范围为(7.5±0.2)-(9.8±0.4),其中最大值出现在大丰的两个池塘。水温呈季节性变化范围为(19.9±2.0)-(35.3±0.2) ℃。水体ORP的范围在(147±27)-(220±8) mV之间。养殖中后期,随着水温升高,水体中亚硝酸盐和氨氮等还原性物质累积,消耗大量的氧气,DO变化幅度较大[(2.14±0.7)-(18.0±0.5) mg/L]。大丰养殖池塘的DO呈现过饱和现象,而射阳样点的两个池塘DO则变化不大,并且在养殖后期偏低。水体亚硝酸盐含量以5-7月射阳采集的样品最高,COD变化范围为(13±2)-(109±16) mg/L,硝酸盐变化范围较大[(0.11±0.01)-(0.29±0.01) mg/L],氨氮变化范围为(0.033±0.015)-(0.105±0.015) mg/L,总磷在(0.037±0.002)-(0.42±0.02) mg/L之间变化。

|
| 图 1 不同采样时间养殖池塘水质参数 Figure 1 The physiochemical properties of aquaculture water from different ponds |
|
|
为了检验实时荧光定量PCR反应的线性关系和动态范围,利用构建的病原菌质粒进行10倍梯度稀释建立标准曲线。在6-8个稀释梯度确定的标准曲线中,扩增效率范围为93.5%-114.3%,相关系数R2为0.985-0.995,斜率在-3.736--3.020之间,可以看出Ct值和lg基因拷贝数之间具有良好的线性关系(表 2)。
| 病原名称 Pathogen name |
相关系数 R2 |
线性关系 Linear relation |
扩增效率 Efficiency (%) |
Ct范围 Samples Ct range |
| 嗜水气单胞菌A. hydrophila | 0.993 | Y=-3.020×lgX+40.66 | 114.3 | 19.29-27.74 |
| 温和气单胞菌A. sobria | 0.985 | Y=-3.489×lgX+47.31 | 93.5 | 28.44-35.63 |
| 维氏气单胞菌A. veronii | 0.995 | Y=-3.736×lgX+48.19 | 95.7 | 16.62-23.36 |
| 鲤疱疹病毒Ⅱ型CyHV-2 | 0.991 | Y=-3.095×lgX+37.61 | 110.4 | 28.52-36.32 |
| 水霉属Saprolegnia spp. | 0.988 | Y=-3.424×lgX+46.46 | 103.0 | 25.64-27.76 |
| 碘泡虫属Myxobolus spp. | 0.989 | Y=-3.480×lgX+38.76 | 107.8 | 25.66-29.67 |
| 细菌总数Total bacteria | 0.990 | Y=-3.298×lgX+38.76 | 101.1 | 14.06-15.58 |
利用实时荧光定量PCR对采集自不同时间养殖池塘的水体样品中的病原微生物进行定量检测,结果如图 2所示。水体中病原菌的丰度分别为:嗜水气单胞菌5.18-8.08 lgcopies/L、温和气单胞菌5.67-9.10 lgcopies/L、维氏气单胞菌5.71-8.72 lgcopies/L、鲤疱疹病毒2.74- 5.45 lgcopies/L、水霉菌6.01-8.83 lgcopies/L和孢子虫2.88-4.74 lgcopies/L。从图 2中可以看出,大丰和射阳4个养殖池塘中病原菌的数量随时间呈现不同的变化趋势,其中DF2和SY2样品病原菌丰度普遍高于DF1和SY2。水体中细菌总数的丰度变化范围为9.5-11.1 lgcopies/L,不同样点池塘之间并未观察到显著差异。
|
| 图 2 池塘养殖水体病原微生物丰度 Figure 2 Concentrations of pathogenic microorganisms in pond waters Note: A: A. hydrophila; B: A. sobria; C: A. veronii; D: CyHV-2; E: Myxobolus spp.; F: Saprolegnia spp.. |
|
|
水体环境因子与病原菌的相关性分析结果显示,A. sobria和A. veronii与pH和温度变化呈显著正相关(R > 0,P < 0.05),而A. hydrophila、A. sobria和A. veronii与COD呈负相关(R < 0,P < 0.05)。CyHV-2丰度变化与pH、温度和溶解氧呈显著正相关(R > 0,P < 0.05),而与总磷呈负相关(R < 0,P < 0.05)。Myxobolus spp.与温度和溶解氧呈负相关(R < 0,P < 0.05),而与硝酸盐含量呈显著正相关(R > 0,P < 0.01)。可以看出上述环境因子是影响病原菌丰度的重要因素。同时,病原菌之间的Pearson相关系数分析结果显示CyHV-2和Saprolegnia spp.与Aeromonas spp.存在显著相关性(R < 0,P < 0.01),表明鱼鳃出血病疫情发生可能会导致继发和并发的细菌性疾病几率有所增加(表 3)。
| 环境因子 Environmental factors |
嗜水气单胞菌 A. hydrophila |
温和气单胞菌 A. sobria |
维氏气单胞菌 A. veronii |
鲤疱疹病毒Ⅱ型 CyHV-2 |
水霉属 Saprolegnia spp. |
碘泡虫属 Myxobolus spp. |
| pH | 0.400 | 0.469* | 0.470* | 0.473* | 0.065 | -0.130 |
| Temperature | 0.163 | 0.557* | 0.657** | 0.615** | -0.163 | -0.789** |
| DO | 0.404 | 0.437 | 0.436 | 0.586* | -0.086 | -0.706** |
| COD | -0.517* | -0.662** | -0.665** | -0.098 | -0.474* | 0.180 |
| NO2-N | -0.296 | -0.010 | 0.124 | -0.309 | 0.054 | -0.051 |
| NO3-N | 0.120 | -0.150 | -0.309 | -0.342 | 0.298 | 0.681** |
| NH3-N | 0.147 | -0.113 | -0.136 | -0.050 | 0.199 | 0.298 |
| TP | -0.196 | -0.271 | -0.262 | -0.484* | 0.070 | 0.200 |
| 嗜水气单胞菌 A. hydrophila |
1.000 | 0.845** | 0.812** | 0.738** | 0.685** | -0.349 |
| 温和气单胞菌 A. sobria |
1.000 | 0.956** | 0.470* | 0.543* | -0.555* | |
| 维氏气单胞菌 A. veronii |
1.000 | 0.451** | 0.491* | -0.635** | ||
| 鲤疱疹病毒Ⅱ型 CyHV-2 |
1.000 | -0.273 | -0.326 | |||
| 水霉属 Saprolegnia spp. |
1.000 | 0.020 | ||||
| 碘泡虫属 Myxobolus spp. |
1.000 | |||||
| 注:*:在0.05水平(双侧)上显著相关;**:在0.01水平(双侧)上显著相关. Note: *: P < 0.05, significant difference; **: P < 0.01, extremely significant difference. | ||||||
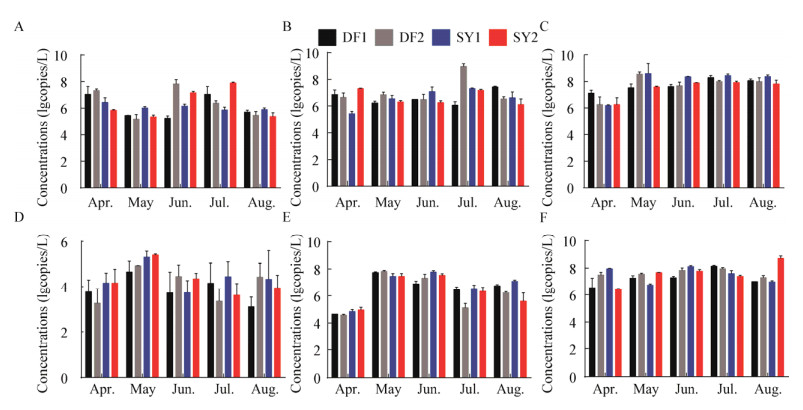
沉积物样品中的病原菌丰度结果见图 3,分别为:嗜水气单胞菌3.49-6.05 lgcopies/g、温和气单胞菌3.63-6.24 lgcopies/g、维氏气单胞菌4.29- 8.15 lgcopies/g、鲤疱疹病毒2.29-4.47 lgcopies/g、水霉菌3.89-6.17 lgcopies/g和孢子虫2.89- 4.66 lgcopies/g。沉积物中细菌总数的丰度变化范围为7.06-9.57 lgcopies/g,可以看出水体中的病原菌丰度高于沉积物。上述病原菌丰度的变化趋势与水体中基本一致,表现为样点池塘DF2和SY2丰度高于DF1和SY1。
|
| 图 3 养殖池塘沉积物病原微生物丰度 Figure 3 Concentrations of pathogenic microorganisms in pond sediments Note: A: A. hydrophila; B: A. sobria; C: A. veronii; D: CyHV-2; E: Myxobolus spp.; F: Saprolegnia spp.. |
|
|
利用内切酶Hha I对大丰和射阳养殖池塘的水体和沉积物细菌群落进行PCR-RFLP分析。细菌的多样性指数结果如表 4所示,不同时期池塘水体和沉积物细菌群落多样性存在一定的差异,可以看出淡水养殖池塘沉积物的细菌群落结构较水体复杂。水体和沉积物中细菌T-RFs数量分别在11-29和20-32之间,Shannon-wiener指数在1.44-2.87和2.44-3.25之间。大丰养殖池塘的水体和沉积物中T-RFs片段数量分别为17-29和20-30;射阳养殖池塘的T-RFs数量分别为11-26和22-32,结合多样性指数分析可以看出沉积物的群落多样性较丰富。本研究利用移动窗口分析方法来评价养殖环境微生物群落结构的动态变化,水体细菌群落呈现低度-中度水平变化,其群落结构的平均变化率为14.28%和6.08%;沉积物中菌群结构属于中度-高度水平变化,平均变化率分别为17.8%和22.7%,表明沉积物细菌群落动态变化幅度大于水体。
| 样品名称 Sample ID |
取样时间 Sample time |
水体样品 Water samples |
沉积物样品 Sediment samples |
|||||||
| S | H | D | J | S | H | D | J | |||
| DF1 | Apr. | 22 | 2.51 | 1.68 | 0.56 | 30 | 3.07 | 2.38 | 0.72 | |
| May | 17 | 2.14 | 1.28 | 0.50 | 27 | 2.96 | 2.15 | 0.71 | ||
| Jun. | 24 | 2.53 | 1.87 | 0.52 | 20 | 2.44 | 1.67 | 0.57 | ||
| Jul. | 25 | 2.54 | 1.97 | 0.51 | 24 | 2.81 | 1.93 | 0.69 | ||
| Aug. | 17 | 2.33 | 1.29 | 0.60 | 25 | 2.84 | 1.99 | 0.68 | ||
| DF2 | Apr. | 23 | 2.69 | 1.72 | 0.64 | 23 | 2.70 | 1.86 | 0.65 | |
| May | 17 | 2.31 | 1.28 | 0.60 | 30 | 3.19 | 2.31 | 0.81 | ||
| Jun. | 26 | 2.52 | 2.07 | 0.48 | 26 | 2.98 | 2.03 | 0.76 | ||
| Jul. | 29 | 2.87 | 2.28 | 0.61 | 26 | 2.85 | 2.16 | 0.66 | ||
| Aug. | 17 | 2.29 | 1.30 | 0.58 | 27 | 2.86 | 2.15 | 0.77 | ||
| SY1 | Apr. | 25 | 2.32 | 1.97 | 0.41 | 31 | 3.25 | 2.39 | 0.83 | |
| May | 19 | 2.21 | 1.44 | 0.48 | 30 | 3.12 | 2.31 | 0.75 | ||
| Jun. | 25 | 2.50 | 1.96 | 0.49 | 32 | 3.15 | 2.43 | 0.73 | ||
| Jul. | 17 | 2.09 | 1.28 | 0.42 | 22 | 2.71 | 1.69 | 0.68 | ||
| Aug. | 11 | 1.44 | 0.90 | 0.38 | 26 | 2.86 | 2.02 | 0.67 | ||
| SY2 | Apr. | 25 | 2.40 | 1.97 | 0.44 | 24 | 2.75 | 1.96 | 0.65 | |
| May | 22 | 2.24 | 1.70 | 0.43 | 31 | 3.13 | 2.37 | 0.74 | ||
| Jun. | 26 | 2.59 | 2.04 | 0.51 | 32 | 3.20 | 2.49 | 0.76 | ||
| Jul. | 15 | 1.85 | 1.38 | 0.39 | 31 | 3.07 | 2.38 | 0.70 | ||
| Aug. | 17 | 2.14 | 1.41 | 0.40 | 28 | 3.00 | 2.18 | 0.72 | ||
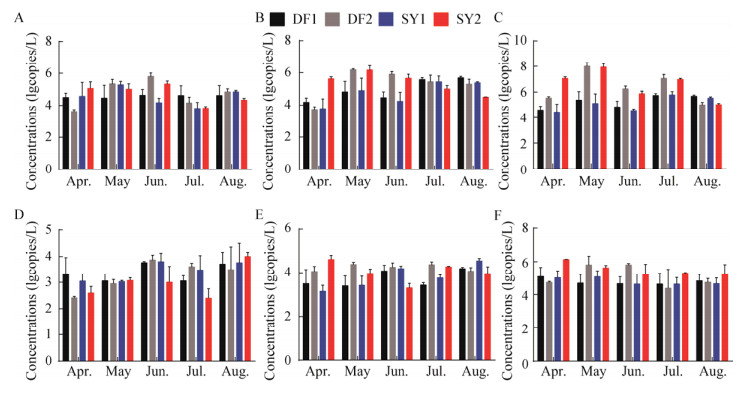
大丰和射阳养殖池塘不同取样时间水体的细菌群落相对丰度如图 4A所示,主要集中于77-96 bp、197-209 bp和508-596 bp之间分布,其中的优势片段为84 bp (0%-7.4%)、89 bp (9.0%- 27.1%)、94 bp (0%-5.6%)、200 bp (1.4%-5.1%)、202 bp (0%-5.1%)、203 bp (0%-6.1%)、533 bp (0%-12.0%)、538 bp (0%-15.0%)、560 bp (0%-14.3%)和567 bp (0%-22.7%),Others代表T-RFs相对丰度 < 1%的片段。从图 4中可以看出两个样点不同养殖池塘的细菌群落结构相似,T-RFs片段相对丰度随时间变化存在差异。大丰养殖池塘中84 bp相对丰度在呈现先升后降的趋势,而射阳养殖池塘则反之。大丰两个养殖池塘DF1和DF2中,89 bp的T-RF片段的相对丰度随时间逐渐降低,而射阳样点SY1和SY2的相对丰度则逐渐升高。大丰和射阳养殖池塘不同取样时间沉积物的细菌群落相对丰度如图 4B所示,优势菌群在两个样点的养殖池塘中均有分布且相对丰度存在差异,变化幅度范围分别为为77 bp (0%-3.6%)、87 bp (1.1%-13.7%)、89 bp (19.9%-41.5%)、200 bp (4.4%-27.7%)、202 bp (0%-16.6%)、203 bp (0%-8.1%)、362 bp (0%-7.0%)、364 bp (0%-11.1%)、562 bp (0%-11.1%)和564 bp (0%-18.0%)。养殖水体与沉积物样品共有部分T-RFs片段(89、200、202、203 bp),并且沉积物中的T-RFs相对丰度高于水体。
|
| 图 4 养殖池塘水体(A)和沉积物(B) T-RFs相对丰度 Figure 4 The top ten relative abundances of T-RFs from water (A) and sediment (B) |
|
|
为了解析细菌T-RFLP图谱中不同T-RF片段代表的微生物类群,基于MiCA (http://mica.ibest.uidaho.edu/pat.php) T-RFLP analysis (PAT+)在线分析,通过RDA 16S rRNA基因数据库查询比对结果,推测相应的T-RFs片段所代表的种属菌群。如表 5所示,优势T-RFs片段所代表的菌群主要归属于Proteobacteria、Firmicutes、Bacteroidetes、Actinobacteria和Chloroflexi。
| 水体/沉积物T-RFs片段 T-RFs fragment (bp) |
属水平 Genus |
门水平 Phylum |
| 77 | Delftia sp. | Proteobacteria |
| 84 | Enterococcus sp. | Firmicutes |
| 87 | Capnocytophaga sp. | Bacteroidetes |
| 89 | Flavobacterium sp. | Bacteroidetes |
| 94 | - | Uncultured bacterium |
| 200 | Clostridium sp. | Firmicutes |
| 202 | Mycobacterium sp. | Actinobacteria |
| 203 | Polaromonas sp. | Proteobacteria |
| 362 | Bacillus sp. | Firmicutes |
| 364 | Corynebacterium sp. | Actinobacteria |
| 533 | - | Uncultured bacterium |
| 538 | - | Chloroflexi |
| 560 | Clostridium sp. | Firmicutes |
| 562 | - | Proteobacteria |
| 564 | Arhodomonas sp. | Proteobacteria |
| 567 | Comamonas sp. | Proteobacteria |
| 注:-:MiCA在线比对不能确定的种属. Note: -: Taxon was not clearly identified based on MiCA alignment. | ||
封闭式养殖池塘是一个相对较脆弱且易于调控的生态系统,养殖水体和沉积物是池塘生态系统的重要组成部分。在高密度集约化养殖条件下通过饲料残留和水产动物粪便使输入水体的营养盐过多,加速水体的富营养化过程,不仅恶化了养殖水体,也会降低鱼类的抗应激能力[27]。两个样点养殖池塘水质指标存在差异,在整个养殖周期随时间变化幅度较大。淡水养殖最佳的pH值范围为6.5-8.5,是反映水体水质状况的一个综合指标。pH过高或过低会对养殖水体中物质的存在形式及转化过程产生影响,ORP过低使水体处于还原态,利于还原性有害物质亚硝酸盐和硫化氢的产生和积累[28]。可以看出两个样点池塘的ORP基本稳定,变化趋势也较相近。养殖水体的溶解氧(DO)含量直接影响水产动物的代谢能力及生长状况。大丰样点池塘DO的变化幅度较大,在夏季大丰样点的两个池塘达到最大值。我国渔业水质标准规定溶氧一般要求≥3 mg/L,鲫的适宜范围为4-5 mg/L。DO的季节性变化较显著,特别是在夏季容易受到温度和光合作用的影响出现过饱和或过低的现象。COD是反映水中可氧化物质的常用指标,同时也反映水中浮游生物的多少。COD含量与饵料投喂和人工调控有关,水体中藻类增加也是影响COD含量增高的主要原因之一[29]。氨氮、亚硝酸盐和硝酸盐是养殖水体中可溶性无机氮的主要组成部分,其主要来源于饲料和鱼类排泄物,在一定条件下可以相互转化。在养殖水体中,氨氮和亚硝酸盐对鱼类会产生毒性,并且过高的浓度易导致水体的富营养化。理论上,淡水池塘的亚硝酸盐浓度要控制在0.1 mg/L,而射阳样点池塘的亚硝酸盐含量明显高于大丰,最大值达到0.728 mg/L[30]。养殖水环境受物质输入或消耗的直接影响,高密度养殖模式使残留饵料和排泄物等大量累积,造成水体中有机物和营养盐含量过高,溶解氧降低,导致养殖环境恶化。上述环境因子变化使水生动物易产应激反应,也是疾病暴发的重要诱因之一。
近年来研究人员开展了一系列鲫病原分离鉴定的研究[31-32],但关于这些病原在养殖期间的丰度变化尚没有系统描述,因此本研究利用分子方法对采自江苏地区典型异育银鲫养殖池塘的水体和沉积物样品中的病原微生物进行鉴定,并利用定量PCR方法比较分析病原微生物的丰度变化特征。养殖池塘水体和沉积物病原微生物的定量结果显示,病原微生物在夏季高温时段的丰度较高,并且养殖水体中的丰度高于沉积物。大红鳃病与鲫造血器官坏死病是江苏地区鲫鱼养殖业中最普遍且危害最大的两种疾病,其病原主要是气单胞菌属和鲤疱疹病毒Ⅱ。传染性疾病的发生与环境和宿主敏感性有关,采集自江苏省大宗淡水鱼养殖池塘的健康塘和发病塘的水体和鱼类样本中分离到89株气单胞菌属,分析结果发现,无论在健康塘还是发病塘中,维氏气单胞菌分布最广泛且数量最多,其次是嗜水气单胞菌[33]。定量结果显示CyHV-2的丰度出现最大值时段,气单胞菌属的丰度相应有所增加,表明气单胞菌属与CyHV-2的暴发存在一定的关联,推测这两类病原在养殖环境中可能会维持一定的丰度。DF2和SY2水体和沉积物中病原菌的丰度较高,当外界环境条件发生变化时出现细菌性败血症和病毒性出血症混合感染和继发感染的几率会随之增加。细菌和病毒混合感染现象普遍存在于水产养殖中,气单胞菌属感染淡水鱼类的临床症状与CyHV-2极为相似。多项研究报道了从感染CyHV-2病鱼器官和组织中分离到了嗜水气单胞菌(A. hydrophila)和温和气单胞菌(A. sobria)[34-35]。粘孢子虫是鱼类的一种寄生虫性病原,可寄生于鱼类的各种器官组织。顾伟[36]对江苏地区鲫寄生粘孢子虫种类进行了调查和分类研究,通过形态学和18S rRNA基因序列比对结果发现由喉部寄生的洪湖碘泡虫引起的“喉孢子虫病”和由肝胰脏寄生的吴李碘泡虫引起的“腹孢子虫病”的危害最为严重。淡水鱼类水霉病为非原发性疾病,主要是由腐生性水霉菌在鱼体受伤后引起的继发性真菌感染。Ke等[37]基于形态学、生理学和分子学特性比较分析了分离自异育银鲫和斑马鱼的两株水霉菌,阐明了水霉菌的分类地位有助于该病原疾病的防控。国内外文献报道主要集中于病原体的定性描述,本研究也证实了异育银鲫典型病原在养殖环境中的普遍性。由于鱼类生活在水生环境中,它们将直接接触包括潜在病原体在内的各种微生物,加强养殖环境病原菌的鉴定和定量监测有助于在疾病暴发早期采取相应的控制策略。通过优化养殖环境,增强鱼类自身的非特异性免疫机能及应激能力,从而提高其抵抗各类病原感染的能力。
池塘水体和沉积物是养殖生态系统的重要组成部分,池塘内发生的生物化学转化过程都有各种微生物的参与。因此,池塘的微生物群落组成变化以及对有机物和氮磷的代谢分解能力对养殖环境有很大影响。由于养殖环境的特殊性,其内部的微生物群落结构与组成受到各种因素的影响,如养殖模式、饵料种类、环境因子、疾病暴发、投放药物及微生态制剂等。在养殖过程中,养殖水环境中的微生物会发生一定的规律性变化,该变化可以反映养殖生态系统的健康状况。目前,关于异育银鲫养殖环境微生物群落的报道较少。本研究利用T-RFLP技术对不同时期池塘水体和沉积物样品中的细菌群落变化进行分析,发现养殖池塘水体和沉积物中的微生物群落结构类似,优势菌群处于动态变化中,沉积物中的细菌多样性高于水体。刘志刚等[38]研究罗非鱼池塘养殖环境菌群结构变化也发现底泥中微生物多样性最高,并且肠道与水体菌群的相似性较高,结果表明罗非鱼链球菌病发病塘水体和底泥中有益菌丰度降低和致病菌丰度升高反映了养殖环境出现恶化,但其与肠道中病原菌的丰度水平无直接关系,高温、低溶氧等环境因子变化是肠道致病菌大量增殖的重要诱因。本研究水体和沉积物中共有的优势菌群主要是Proteobacteria、Bacteroidetes和Actinobacteria,这与文献报道的研究结果一致[39]。水体和沉积物微生物群落是池塘生态系统的重要组成部分,在促进有机质分解、加速营养盐释放和保持良好养殖环境等方面具有重要意义。同时,也是多种潜在致病微生物的储库,如Flavobacterium sp.、Clostridium sp.、Mycobacterium sp.和Corynebacterium sp.等。唐凌等[40]研究草鱼与鲫养殖池塘底泥中细菌群落多样性,发现Cetobacterium、Prolixibacter、Rhodocyclus和Desulfomicrobium等优势菌属与脱氮除鳞及有机质降解有关,还存在Xanthomonas等致病性细菌。研究发现健康养殖鱼塘底泥中乳酸菌属和芽孢杆菌属等益生菌的相对含量高于致病性气单胞菌属和弧菌属[41]。She等[42]利用16S rRNA基因测序比较分析健康和发病鱼体肠道微生物,结果发现感染CyHV-2异育银鲫肠道中Plesiomonas的丰度增加显著,认为可以将其作为病毒感染的微生物标志物。池塘系统中的微生物种群组成变化及代谢能力对养殖环境影响很大,一方面养殖水环境丰富的微生物群落结构能够很好地维持池塘系统的微生态平衡,减少水产病害的发生;另一方面解析养殖环境因子变化和病原疾病暴发期间微生物群落组成和变化特征,有助于指导养殖过程中采取针对性的管理措施调控水质和防控疾病发生。本文利用T-RFLP图谱对各样本进行分析,结果表明不同时间和地域差异是造成细菌群落变化的主要原因,同时结合数据库在线比对确定了样点的优势菌属主要为Flavobacterium sp.、Bacillus sp.和Mycobacterium sp.。T-RFLP方法被广泛应用于环境微生物群落结构变化的研究,其能够快速、较为准确地提供微生物种类和相对丰度的信息,可较为真实地反映环境样品中微生物群落结构组成和功能。但该技术会将一些相对丰度较低的微生物种群剔除掉,造成环境样品群落多样性被低估。同时,由于数据库的不完善,某些T-RF片段难以准确匹配相对应的物种。高通量测序技术的发展促进了组学方法在环境微生物研究中的广泛应用,其可以挖掘丰度低的种群信息,较为全面和准确地反映环境微生物群落结构。为了对环境样品微生物种群信息了解的更真实和准确,应采用多种技术相结合,从而提高检测的准确度和灵敏度。因此,下一步研究工作将结合高通量测序技术针对发病期内养殖环境的微生物群落信息和特征性菌属进行数据挖掘,比较发病和健康养殖水体和底泥菌群结构与丰度的差异。
| [1] |
Chen J, Li JH, Liu XM, et al. Development status and urgent problems to be solved of gibel carp breeding industry in Jiangsu[J]. Scientific Fish Farming, 2014(12): 1-2. (in Chinese) 陈静, 李婧慧, 刘训猛, 等. 江苏鲫鱼养殖产业发展现状与产业亟待解决问题[J]. 科学养鱼, 2014(12): 1-2. |
| [2] |
Jung SJ, Miyazaki T. Herpesviral haematopoietic necrosis of goldfish, Carassius auratus (L.)[J]. Journal of Fish Diseases, 1995, 18(3): 211-220. DOI:10.1111/j.1365-2761.1995.tb00296.x |
| [3] |
Wang L, He JG, Liang L, et al. Mass mortality caused by Cyprinid Herpesvirus 2 (CyHV-2) in Prussian carp (Carassius gibelio) in China[J]. Bulletin-European Association of Fish Pathologists, 2012, 32(5): 164-173. |
| [4] |
Zhou Y, Zeng LB, Zhang H, et al. Establishment of a TaqMan real-time PCR assay for detecting the Cyprinid herpesvirusⅡ[J]. Journal of Fisheries of China, 2013, 37(4): 607-613. (in Chinese) 周勇, 曾令兵, 张辉, 等. 鲤疱疹病毒Ⅱ型TaqMan real-time PCR检测方法的建立及应用[J]. 水产学报, 2013, 37(4): 607-613. |
| [5] |
He JQ, Shi XJ, Yu L, et al. Development and evaluation of a loop-mediated isothermal amplification assay for diagnosis of Cyprinid herpesvirus 2[J]. Journal of Virological Methods, 2013, 194(1/2): 206-210. |
| [6] |
Wu T, Ding ZF, Zhu CY, et al. Epidemiological investigation and survey of gill hemorrhagic disease in silver Prussian carp (Carassius auratus gibelio)[J]. Fisheries Science, 2014, 33(5): 283-287. (in Chinese) 吴霆, 丁正峰, 朱春艳, 等. 异育银鲫鳃出血病流行病学调查和研究[J]. 水产科学, 2014, 33(5): 283-287. DOI:10.3969/j.issn.1003-1111.2014.05.004 |
| [7] |
Gao MM, Shui DZ, Wu P, et al. Analysis of pathogenesis detection and transmission route of cyprinid herpesvirusⅡ (CyHV-2) in silver crucian carp (Carassius auratus gibelio) in pond environment[J]. Jiangsu Agricultural Sciences, 2018, 46(24): 187-190. (in Chinese) 高敏敏, 税典章, 吴萍, 等. 池塘环境中异育银鲫鲤疱疹Ⅱ型病毒(CyHV-2)的检测与传播途径分析[J]. 江苏农业科学, 2018, 46(24): 187-190. |
| [8] |
Minamoto T, Pu XY, Xie J, et al. Monitoring fish pathogenic viruses in natural lakes in Yunnan, China[J]. Limnology, 2015, 16(1): 69-77. DOI:10.1007/s10201-014-0440-5 |
| [9] |
Zhang DF, Liu LH, Li NQ, et al. Epidemic characteristics of different species of Aeromonas in diseased fish in southern China[J]. Fisheries Science, 2015, 34(11): 673-682. (in Chinese) 张德锋, 刘礼辉, 李宁求, 等. 我国南方地区鱼源气单胞菌不同种类的流行特征[J]. 水产科学, 2015, 34(11): 673-682. |
| [10] |
Fichi G, Cardeti G, Cocumelli C, et al. Detection of cyprinid herpesvirus 2 in association with an Aeromonas sobria infection of Carassius carassius (L.), in Italy[J]. Journal of Fish Diseases, 2013, 36(10): 823-830. |
| [11] |
Wang H, Zhang N, Yang XL, et al. Establishment of a loop-mediated amplification assay for the specific detection of Saprolegnia and its spores[J]. Microbiology China, 2012, 39(12): 1835-1843. (in Chinese) 王浩, 张楠, 杨先乐, 等. 水霉菌环介导等温扩增检测方法的建立[J]. 微生物学通报, 2012, 39(12): 1835-1843. |
| [12] |
Zhang N, Wang H, Ding QZ, et al. Identification of major pathogenic Saprolegnia species in freshwater aquaculture of China[J]. Journal of Shanghai Ocean University, 2014, 23(1): 80-89. (in Chinese) 张楠, 王浩, 丁庆忠, 等. 我国淡水养殖动物主要致病性水霉菌病原的分析[J]. 上海海洋大学学报, 2014, 23(1): 80-89. |
| [13] |
Li D. Establishment and preliminary application of PCR detection methods for myxosporeans in Carassius auratus gibelio[D]. Wuhan: Master's Thesis of Huazhong Agricultural University, 2016 (in Chinese) 李丹.异育银鲫粘孢子虫PCR检测方法的建立与初步应用[D].武汉: 华中农业大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10504-1016155219.htm |
| [14] |
de Schryver P, Vadstein O. Ecological theory as a foundation to control pathogenic invasion in aquaculture[J]. The ISME Journal, 2014, 8(12): 2360-2368. DOI:10.1038/ismej.2014.84 |
| [15] |
National Environmental Protection Agency. GB 11607-1989 Water quality standard for fisheries[S]. Beijing: Standards Press of China, 1989 (in Chinese) 国家环境保护局. GB 11607-1989渔业水质标准[S].北京: 中国标准出版社, 1989 |
| [16] |
National Environmental Protection Agency, General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB 3838-2002 Environmental quality standards for surface water[S]. Beijing: China Environmental Press, 2002 (in Chinese) 国家环境保护总局, 国家质量监督检验检疫总局. GB 3838-2002地表水环境质量标准[S].北京: 中国环境科学出版社, 2002 |
| [17] |
Honjo MN, Minamoto T, Matsui K, et al. Quantification of cyprinid herpesvirus 3 in environmental water by using an external standard virus[J]. Applied and Environmental Microbiology, 2010, 76(1): 161-168. DOI:10.1128/AEM.02011-09 |
| [18] |
Wang GH, Clark CG, Liu CY, et al. Detection and characterization of the hemolysin genes in Aeromonas hydrophila and Aeromonas sobria by multiplex PCR[J]. Journal of Clinical Microbiology, 2003, 41(3): 1048-1054. DOI:10.1128/JCM.41.3.1048-1054.2003 |
| [19] |
Dorsch M, Ashbolt NJ, Cox PT, et al. Rapid identification of Aeromonas species using 16S rDNA targeted oligonucleotide primers: a molecular approach based on screening of environmental isolates[J]. Journal of Applied Bacteriology, 1994, 77(6): 722-726. DOI:10.1111/j.1365-2672.1994.tb02825.x |
| [20] |
Goodwin AE, Merry GE, Sadler J. Detection of the herpesviral hematopoietic necrosis disease agent (Cyprinid herpesvirus 2) in moribund and healthy goldfish: validation of a quantitative PCR diagnostic method[J]. Diseases of Aquatic Organisms, 2006, 69(2/3): 137-143. |
| [21] |
Kestrup ÅM, Thomas SH, van Rensburg K, et al. Differential infection of exotic and native freshwater amphipods by a parasitic water mold in the St. Lawrence River[J]. Biological Invasions, 2011, 13(3): 769-779. DOI:10.1007/s10530-010-9867-8 |
| [22] |
Abidi R, Fariya N, Chauhan UK. Development and standardization of PCR technique to detect myxozoan parasites and its use in identification of two exotic Myxobolus species from Indian catfish Clarias batrachus (linn.)[J]. International Journal of Fisheries and Aquatic Studies, 2015, 2(4): 374-377. |
| [23] |
Boon N, Top EM, Verstraete W, et al. Bioaugmentation as a tool to protect the structure and function of an activated-sludge microbial community against a 3-chloroaniline shock load[J]. Applied and Environmental Microbiology, 2003, 69(3): 1511-1520. DOI:10.1128/AEM.69.3.1511-1520.2003 |
| [24] |
Liu WT, Marsh TL, Cheng H, et al. Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S rRNA[J]. Applied and Environmental Microbiology, 1997, 63(11): 4516-4522. |
| [25] |
Shi Q, Bai YH, Li ZX, et al. Analysis of bacterial community in the polluted water of Dianchi lake by using T-RFLP technique[J]. Environmental Science, 2011, 32(6): 1786-1792. (in Chinese) 史青, 柏耀辉, 李宗逊, 等. 应用T-RFLP技术分析滇池污染水体的细菌群落[J]. 环境科学, 2011, 32(6): 1786-1792. |
| [26] |
Marzorati M, Wittebolle L, Boon N, et al. How to get more out of molecular fingerprints: practical tools for microbial ecology[J]. Environmental Microbiology, 2008, 10(6): 1571-1581. DOI:10.1111/j.1462-2920.2008.01572.x |
| [27] |
Xi WQ, Sun N, Yang ZQ, et al. Production and elimination of nitrite in aquaculture[J]. Scientific Fish Farming, 2017(5): 81-82. (in Chinese) 席文秋, 孙娜, 杨占全, 等. 水产养殖中亚硝酸盐的产生及其消除方法[J]. 科学养鱼, 2017(5): 81-82. |
| [28] |
Cui Y, Zeng HX, Zhang K. Monitoring and regulating technology of redox potential in aquaculture[J]. Hebei Fisheries, 2017(4): 54-55. (in Chinese) 崔玥, 曾海祥, 张凯. 水产养殖中氧化还原电位的监测与调控技术[J]. 河北渔业, 2017(4): 54-55. DOI:10.3969/j.issn.1004-6755.2017.04.018 |
| [29] |
Yang WL, Lai ZN, Liu QF, et al. Changing trend of chemical oxygen demand (CODMn) in different breeding pond and its influence factors[J]. Guangdong Agricultural Sciences, 2014, 41(8): 161-165. (in Chinese) 杨婉玲, 赖子尼, 刘乾甫, 等. 不同养殖品种池塘化学耗氧量(CODMn)变化趋势及环境影响因素[J]. 广东农业科学, 2014, 41(8): 161-165. DOI:10.3969/j.issn.1004-874X.2014.08.037 |
| [30] |
He YJ. Study on ammonia and nitrite reducing in the pond using microorganism[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2007 (in Chinese) 何义进.微生态制剂降解养殖水体氨氮及亚硝酸盐的研究[D].南京: 南京农业大学硕士学位论文, 2007 http://cdmd.cnki.com.cn/Article/CDMD-10307-2008197449.htm |
| [31] |
Liu T, Wang KY, Chen JJ, et al. Etiology investigation and histopathological study on "red-gill" of silver Prussian carp (Carassius auratus gibelio) in Yancheng city[J]. Acta Hydrobiologica Sinica, 2016, 40(5): 928-934. (in Chinese) 刘韬, 汪开毓, 陈俊杰, 等. 江苏盐城地区异育银鲫大红鳃疾病病原学研究及病理学观察[J]. 水生生物学报, 2016, 40(5): 928-934. |
| [32] |
Jiang XY. The pathogen research of crucian carp big red gill disease and carp hematopoietic organ necrosis in Sheyang[D]. Shanghai: Master's Thesis of Shanghai Ocean University, 2016 (in Chinese) 蒋新益.射阳地区异育银鲫大红鰓病与鲫造血器官坏死病病原研究[D].上海: 上海海洋大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912319.htm |
| [33] |
Wang YJ. Studies on isolation, identification & genetic diversity of Aeromonas from conventional freshwater fish ponds in Jiangsu province[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2010 (in Chinese) 王一娟.江苏地区大宗淡水鱼养殖池塘气单胞菌分离、鉴定和遗传多样性研究[D].南京: 南京农业大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10307-1012490136.htm |
| [34] |
Sahoo PK, Swaminathan TR, Abraham TJ, et al. Detection of goldfish haematopoietic necrosis herpes virus (Cyprinid herpesvirus-2) with multi-drug resistant Aeromonas hydrophila infection in goldfish: First evidence of any viral disease outbreak in ornamental freshwater aquaculture farms in India[J]. Acta Tropica, 2016, 161: 8-17. DOI:10.1016/j.actatropica.2016.05.004 |
| [35] |
Claudio C, Pastorino P, Prato R, et al. CyHV-2 outbreak associated with Aeromonas spp. in crucian carp (Carassius carassius) in piedmont (Italy)[J]. Trends in Fisheries and Aquatic Animal Health, 2017, 8: 307-314
|
| [36] |
Gu W. Investigation and taxonomic study of parasitic Myxozoan in crucian carp in Jiangsu region[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2012 (in Chinese) 顾伟.江苏地区鲫鱼寄生粘孢子虫种类调查与分类研究[D].南京: 南京农业大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10307-1013286001.htm |
| [37] |
Ke XL, Wang JG, Gu ZM, et al. Morphological and molecular phylogenetic analysis of two Saprolegnia sp. (Oomycetes) isolated from silver crucian carp and zebra fish[J]. Mycological Research, 2009, 113(5): 637-644. DOI:10.1016/j.mycres.2009.01.008 |
| [38] |
Liu ZG, Lu MX, Ke XL, et al. Correlation between microflora structure in intestinal tract and aquaculture environment of tilapia (Oreochromis niloticus) and streptococcicosis[J]. Journal of Fisheries of China, 2018, 42(10): 1635-1647. (in Chinese) 刘志刚, 卢迈新, 可小丽, 等. 尼罗罗非鱼肠道及养殖环境中菌群结构与链球菌病的相关性[J]. 水产学报, 2018, 42(10): 1635-1647. |
| [39] |
Zheng XF, Tang JY, Zhang CF, et al. Bacterial composition, abundance and diversity in fish polyculture and mussel-fish integrated cultured ponds in China[J]. Aquaculture Research, 2017, 48(7): 3950-3961. DOI:10.1111/are.13221 |
| [40] |
Tang L, Kuang SY, Liu XG, et al. Investigation of bacterial community structure in Chengdu fish-farm sediment stocked with dominated grass carp and subordinate crucian[J]. Journal of Anhui Agricultural Sciences, 2014, 42(17): 5477-5480. (in Chinese) 唐凌, 邝声耀, 刘兴国, 等. 成都平原主养草鱼搭配鲫鱼池塘底泥中的细菌群落结构分析[J]. 安徽农业科学, 2014, 42(17): 5477-5480. DOI:10.3969/j.issn.0517-6611.2014.17.050 |
| [41] |
Zhu W, Guo LY, Tang ZL, et al. Analyses of bacterial community structure and common culturable bacteria in the sediments of carp cultured ponds[J]. Science Technology and Engineering, 2019, 19(4): 259-263. (in Chinese) 朱卫, 郭丽芸, 唐忠林, 等. 鲫鱼养殖池塘底泥菌群结构及常见可培养菌分析[J]. 科学技术与工程, 2019, 19(4): 259-263. DOI:10.3969/j.issn.1671-1815.2019.04.042 |
| [42] |
She R, Li TT, Luo D, et al. Changes in the intestinal microbiota of gibel carp (Carassius gibelio) associated with Cyprinid herpesvirus 2 (CyHV-2) infection[J]. Current Microbiology, 2017, 74(10): 1130-1136. DOI:10.1007/s00284-017-1294-y |
 2019, Vol. 46
2019, Vol. 46