扩展功能
文章信息
- 毛汐语, 周雪珂, 殷鑫欢, 邓益超, 龚双燕, 李小璟, 李幽幽, 徐志文, 朱玲
- MAO Xi-Yu, ZHOU Xue-Ke, YIN Xin-Huan, DENG Yi-Chao, GONG Shuang-Yan, LI Xiao-Jing, LI You-You, XU Zhi-Wen, ZHU Ling
- 表达PEDV S和PoRV VP7蛋白的重组伪狂犬毒株构建
- Construction of recombinant pseudorabies virus strain expressing PEDV S and PoRV VP7 protein
- 微生物学通报, 2019, 46(12): 3345-3354
- Microbiology China, 2019, 46(12): 3345-3354
- DOI: 10.13344/j.microbiol.china.181002
-
文章历史
- 收稿日期: 2018-12-07
- 接受日期: 2019-09-03
- 网络首发日期: 2019-09-27
2. 动物疫病与人类健康四川省重点实验室 四川 成都 611130;
3. 四川大学生命科学学院 四川 成都 610064
2. 2 Sichuan Key Laboratory of Animal Disease and Human Health, Chengdu, Sichuan 611130, China;
3. College of Life Sciences, Sichuan University, Chengdu, Sichuan 610064, China
猪流行性腹泻是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种急性、高度接触性的肠道传染病,伴随有严重的腹泻、呕吐和脱水症状[1],初生仔猪是主要的感染对象,常会引起100%的发病率和死亡率[2]。PEDV是单股正链RNA病毒,完整的基因组大小约28 kb,含有7个开放阅读框[3],其中s基因编码病毒的纤突糖蛋白,在病毒粒子与细胞表面受体结合以及感染宿主机体后介导中和抗体的过程中发挥着重要功能[4-5]。轮状病毒(Rotavirus,RV)是重要的人兽共患病原之一,2-6周龄猪只最易感猪轮状病毒(Porcine rotavirus,PoRV),出现急性肠胃炎症状[6]。PoRV全基因组大小约为18 kb,含有11个双链RNA片段,编码的VP7蛋白是构成病毒外壳最丰富的蛋白和主要的中和抗原蛋白[7]。猪伪狂犬病毒(Pseudorabies virus,PRV)属于疱疹病毒科、水痘疱疹病毒属,基因组大小约150 kb[8]。新生仔猪感染PRV表现为神经症状和高致死性,保育和育肥猪以呼吸道症状为主,怀孕母猪会出现流产、产木乃伊胎[9-10]。
临床上PEDV、PoRV与PRV的混合感染往往使猪场面临更加严重的威胁,疫苗免疫是预防猪病的理想解决方式,但多次接种可能超出猪只免疫耐受范围,特别是哺乳仔猪和配种母猪,导致免疫应答迟缓甚至免疫抑制,一针多免是理想的解决途径。以PRV作为重组活疫苗载体的策略已经应用于多种动物疫苗的研制,如猪瘟伪狂犬二价基因重组疫苗[11],猪细小病毒和伪狂犬病毒样颗粒疫苗[12],猪瘟细小、伪狂犬三价基因重组疫苗[13],以及乙脑细小伪狂犬三价基因工程疫苗[14]等,为改善现有疫苗或者开发新疫苗提供了新的思路。本研究将PEDV s、PoRV vp7基因优势抗原表位克隆到pEGFP-gI28k转移载体中,构建伪狂犬转移质粒pEGFP-VP7.S,与PRV XJ株共转染293T细胞,成功获得共表达S和VP7蛋白的重组伪狂犬病毒gE/gI/28K缺失株,为后续伪狂犬三联基因工程疫苗的研发奠定基础。
1 材料与方法 1.1 质粒、菌株和细胞含有伪狂犬gI和28K基因序列同源臂的pEGFP-gI28k真核表达质粒由四川农业大学动物生物技术中心构建;PRV XJ、PEDV EM-P、PoRV SC-R株均由四川农业大学动物生物技术中心分离鉴定并保存;Vero、BHK-21、PK-15、293-T、MA-104细胞由四川农业大学动物生物技术中心购买并保存。
1.2 主要试剂和仪器反转录酶试剂盒(PrimeScriptTM RT Reagent Kit)、限制性内切酶(BamH I、Xho I、Sal I、Kpn I)、pMD19-T (Simple) Vector、2×Taq PCR Master Mix、2×GC Buffer、Taqhas、dNTPs、Solution I、DL2000和DL10000 DNA marker均购自宝日医生物技术(北京)有限公司;胎牛血清、DMEM细胞培养液购自Gibco公司;琼脂糖购自Sigma公司;琼脂糖凝胶纯化回收试剂盒购自天根生化科技(北京)有限公司;LipefectamineTM 3000购自Invitrogen公司;辣根过氧化物酶(HRP)标记羊抗鼠IgG (H+L)酶标二抗、质粒小量抽提试剂盒(GeneJET Plasmid Miniprep Kit)购自Thermo Fisher Scientific公司;去内毒素质粒小量抽提试剂盒购自Omega公司;TGX Stain-Free™ FastCast™ Acrylamide Kit购自Bio-Rad公司;PEDV阳性血清(鼠抗)、PoRV阳性血清(鼠抗)由四川农业大学动物生物技术中心制备并保存。
PCR仪、Gel DocTMEZ imager凝胶成像系统,Bio-Rad公司;TS100型倒置显微镜,Nikon公司;CO2细胞培养箱,Thermo Forma公司;恒压恒流电泳仪,北京六一生物科技有限公司。
1.3 含PEDV s和PoRV vp7基因的PRV转移载体的构建从NCBI上下载多条PEDV s和PoRV vp7全基因片段,利用MEGA 5.0和DNAStar的Protean软件分别对其同源性、氨基酸疏水性、抗原表位等进行预测和分析,利用Primer 5.0软件设计特异性扩增引物,上、下游引物分别引入相应的柔性肽序列(5′-ggcggcggcggcggcggctcc-3′)、酶切位点和保护性碱基,具体参照表 1。用表 1中引物分别对PEDV EM-P株和PoRV SC-R株进行扩增,得到大小为1 028 bp和1 017 bp的两条基因片段,分别连接至pMD19-T载体,用限制性内切酶Kpn I、BamH I分别对pMD-VP7和pMD-S质粒进行酶切,回收目的片段连接,构建pMD-VP7.S克隆质粒。再将pMD-VP7.S质粒和pEGFP-gI28K质粒进行Xho I、Sal I酶切连接,成功构建PRV转移载体pEGFP-VP7.S。
| 目的基因 Gene |
引物名称 Primer name |
引物序列 Primers sequence (5′→3′) |
退火温度 Anealing temperature (℃) |
酶切位点 Restriction site |
扩增长度 PCR length (bp) |
| PEDV s | S-a | GCGGTACCggcggcggcggcggcggctcc TTTGACCTTGACGATGGTTTTTAC |
60.6 | Kpn I | 1 028 |
| S-b | GCGGATCCGTCGACATCAACACT AACAGGCGTGTTGT |
BamH I, Sal I | |||
| PoRV vp7 | VP7-a | GCCTCGAGAAggcggcggcggcggcggc tccATGTATGGTATTGAATATAC |
60.2 | Xho I | 1 017 |
| VP7-b | GCGGATCCAAGCTTGGTACCATA AAAGGCAGCAGAATC |
BamH I, Hind III, Kpn I |
参照LipefectamineTM 3000转染试剂盒说明书,用Omega公司的去内毒素质粒小量抽提试剂盒提取pEGFP-VP7.S质粒,转染至生长状态良好、细胞密度为90%的293T细胞中,24 h后加入PRV XJ株病毒液(TCID50=10-7.5/0.1 mL),置37 ℃、5%的CO2条件下培养1-2 d后观察细胞病变和荧光,待细胞出现80%的病变时,置-20 ℃冰箱反复冻融3次,收集病毒液。
1.5 重组病毒的筛选将收集的病毒液用DMEM维持液梯度稀释,接种至生长于96孔板中的单层BHK-21细胞,每孔接种100 μL,置于37 ℃、5%的CO2中培养2 d,显微镜下观察并收集有细胞病变并发出绿色荧光的细胞孔中的病毒液,反复冻融3次,相同方式将收集病毒液继续接种到生长至6孔板的BHK-21细胞中,吸附1 h后,用无血清DMEM洗涤细胞,在表面覆盖含有1%低熔点琼脂糖的DMEM培养液,培养48 h后挑选含有绿色荧光的病毒噬斑,反复挑斑纯化重复操作,并结合PEDV s、PoRV vp7和PRV gE基因片段PCR筛选,得到纯化的重组病毒。
1.6 重组病毒的PCR鉴定抽提纯化的重组病毒和亲代毒株PRV XJ、PEDV、PoRV的基因组,针对PRV gE、PEDV s、PoRV vp7基因进行PCR扩增,采用表 1中的引物,PCR反应体系(50 μL):上游引物S-a/VP7-a (20 μmol/L) 2 μL,下游引物S-b/VP7-b (20 μmol/L) 2 μL,模板(291 ng/μL和173 ng/μL) 3 μL,ddH2O 18 μL,2×Taq PCR Master Mix 25 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,60.2 ℃ (vp7基因)/60.6 ℃ (s基因) 30 s,72 ℃ 1 min,35个循环;72 ℃ 7 min。gE基因上游引物:5′-ATCTGGACG TTCCTGCCC-3′;gE基因下游引物:5′-GTAGATGC AGGGCTCGTACA-3′,扩增长度为534 bp。PCR反应体系(50 μL):2× GC buffer 25 μL,dNTP mixture 5 μL,上、下游引物(20 μmol/L)各2.5 μL,ddH2O 9.5 μL,Taq HS 0.5 μL,模板(273 ng/μL) 5 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 7 min。引物由生工生物工程(上海)股份有限公司合成。
1.7 重组病毒的Western blotting鉴定将重组病毒第5代次接种于BHK-21细胞中,待出现细胞病变并且细胞将要脱落时,弃去多余的培养基,收集剩余细胞和少量细胞上清,反复冻融5次,沸水煮10 min,6 000 r/min离心5 min取上清,加入适量的5×SDS-PAGE loading buffer混匀待用。12%的SDS-PAGE电泳后将胶电转至硝酸纤维膜,设置等量的亲本PRV-XJ株接种BHK-21细胞作为阴性对照,用鼠抗的PEDV和PoRV多克隆抗体分别作为一抗(1:100),HRP标记的羊抗鼠IgG (1:1 000)作为二抗,Western blotting检测重组病毒中外源基因的表达情况。
1.8 重组病毒的稳定性鉴定制备单层的BHK-21细胞,将重组病毒在BHK-21细胞上连续传代20代,每间隔5代取样,收集第5、10、15、20代重组病毒液,抽提重组病毒的DNA制备模板,用普通PCR方法检测s基因和vp7基因以及PRV gE基因。
1.9 病毒TCID50的测定将BHK-21细胞传代96孔细胞培养板,待其长成致密单层,以10-1-10-10梯度稀释PRV (CM)株和PRV XJ株病毒液,每一稀释度做8孔重复,每孔加入稀释病毒液100 μL,同时加入100 μL细胞维持液于未接毒细胞培养孔中设置为阴性对照。随后将96孔培养板置于37 ℃、5% CO2培养箱中培养,每日在显微镜下观察并记录出现细胞病变的细胞孔数,连续观察5 d。按照Reed-Muench法计算重组病毒株和PRV XJ株的TCID50。
2 结果与分析 2.1 重组片段的扩增及蛋白分析筛选出PEDV s部分基因(475-804 aa)和PoRV vp7部分基因(17-339 aa)作为目的基因候选区域,应用DNAStar Protean软件对S蛋白和VP7蛋白二级结构进行预测,由Gamier-Robsn分析方法可知,S蛋白具有25个大小不同的β折叠、20个转角和15个不规则卷曲;VP7蛋白具有17个α螺旋、26个β折叠、20个转角和5个不规则卷曲;Chou-Fasman分析方法预测发现S蛋白有2个α螺旋、17个β折叠和34个转角;VP7蛋白具有6个α螺旋、12个大小不等的β折叠和27个大小比较均匀的转角。对S蛋白和VP7蛋白的B细胞抗原表位4个主要参数预测结果见表 2,综合分析可见S蛋白和VP7蛋白均具有良好的抗原参数。
| 预测参数 Prediction parameters |
S蛋白(aa) S protein |
VP7蛋白 VP7 protein (aa) |
| 亲水性 Hydrophilicity |
2-34, 87-116, 255-279 | 2-12, 53-74, 96-111, 205-301 |
| 潜在B细胞抗原表位 Potential B cell epitopes |
2-18, 25-43, 62-82, 96-105, 138-172, 239-279 | 2-12, 51-71, 95-112, 188-303 |
| 表面可及性 Surface probability |
27-31, 258-274 | 2-9, 96-110, 204-223, 244-300 |
| 柔韧性 Flexible regions |
5-36, 63-70, 139-171, 250-278, 289-317 | 58-68, 203-214, 242-295 |
运用表 1引物扩增得到s基因和vp7基因片段(图 1A),用限制性内切酶Kpn I、BamH I对pMD-VP7.S质粒进行双酶切鉴定,得到与预期大小一致的约1 028 bp和3 709 bp的两条片段(图 1B)。将pEGFP-VP7.S质粒DNA用Xho I、Sal I进行双酶切鉴定,获得大小约2 023 bp和6 840 bp的两条片段,与预期大小一致(图 1C),序列测定结果显示VP7.S融合基因片段成功连入pEGFP-gI28k伪狂犬转移载体,无碱基突变和缺失,相应的酶切位点和Linker序列引入位置正确,伪狂犬转移质粒pEGFP-VP7.S构建成功。
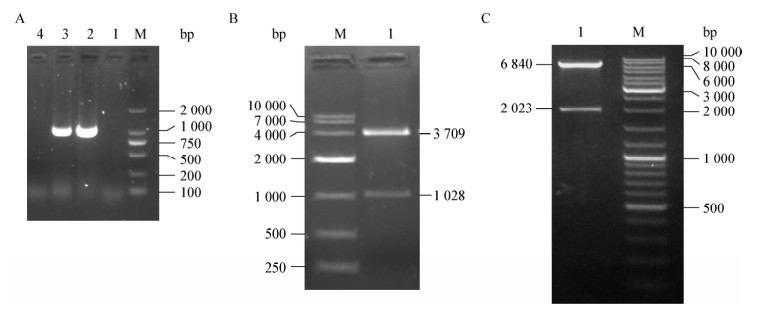
|
| 图 1 目的片段的扩增和酶切鉴定 Figure 1 Amplification and restriction enzyme digestion of the target fragment 注:A:M:DL2000 DNA marker;1:PEDV s阴性对照;2:PEDV s片段;3:PoRV vp7片段;4:PoRV vp7阴性对照. B:M:DL10000 DNA marker;1:pMD-VP7.S的Kpn I、BamH I双酶切. C:M:DL10000 DNA marker;1:pEGFP-VP7.S的Xho I、Sal I双酶切. Note: A: M: DL2000 DNA marker; 1: PEDV negative control; 2: The amplified fragment of PEDV s; 3: The amplified fragment of PoRV vp7; 4: PoRV negative control. B: M: DL10000 DNA marker; 1: Kpn I and BamH I enzyme digestion on pMD-VP7.S. C: pEGFP-VP7.S identification with Xho I and Sal I enzyme digestion. M: DL10000 DNA marker; 1: Fragments released by digestion of pEGFP-VP7.S with Xho I and Sal I enzyme. |
|
|
参照LipefectamineTM 3000转染试剂盒说明书和图 2的构建模式图,将pEGFP-VP7.S质粒DNA转染293T细胞,24 h后在倒置显微镜下可以看到细胞发出绿色荧光(图 3A),说明带有EGFP荧光蛋白的pEGFP-VP7.S质粒成功转入了293T细胞。在转染24 h后接种PRV XJ株病毒液(TCID50=10-7.5/0.1 mL),收集混合病毒液继续培养,在倒置荧光显微镜下观察具有细胞病变并发出绿色荧光的细胞孔(图 3B),收集扩大培养(图 3C),经噬斑挑选反复纯化(图 3D),直到纯化完全。

|
| 图 2 重组病毒的构建模式图 Figure 2 The construction patterns of recombinant viruses |
|
|

|
| 图 3 重组病毒的筛选(200×) Figure 3 Screening of recombinant viruses (200×) 注:A:293-T细胞转染pEGFP-VP7.S质粒24 h;B:首次观察到的重组病毒;C:扩大培养后的重组病毒;D:噬斑纯化. Note: A: 293-T cells transfected with pEGFP-VP7.S plasmid 24 h later; B: Recombinant virus observed for the first time; C: Expanded culture of recombinant virus; D: Plaque purification. |
|
|
为验证重组病毒表达外源蛋白情况,使用鼠抗PEDV高免血清和鼠抗PoRV高免血清分别作为一抗对第5代次重组毒株进行Western blotting,在大约101 kD位置,都出现与预期的分子量相当的特异性阳性条带(图 4),说明重组病毒株能正确表达S蛋白和VP7蛋白。

|
| 图 4 Western blotting分析重组PRV (CM) S-VP7蛋白的表达 Figure 4 Western blotting analysis of expression of S-VP7 protein by PRV (CM) 注:1:PRV (CM)感染细胞一抗PEDV阳性血清Western blotting;2:PRV XJ株感染细胞;3:PRV XJ株感染细胞;4:PRV (CM)感染细胞一抗PoRV阳性血清Western blotting. Note: 1: Western blotting is probed with PEDV sera; 2: PRV XJ strain infected cells; 3: PRV XJ strain infected cells; 4: Western blotting is probed with PoRV sera. |
|
|
将纯化的重组PRV (CM)病毒在BHK-21细胞上连续传代20代,分别对5、10、15、20代病毒液抽提DNA制备模板检测s、vp7和PRV gE基因,均能扩增出大小约为1 017 bp的vp7基因片段(图 5A)和大小约为1 028 bp的s基因片段(图 5B),表明s基因和vp7基因已经稳定插入到伪狂犬病毒基因组中,没有发生外源基因的丢失,gE基因扩增结果相比较亲本株未能检测到(图 5C),说明gE基因已经稳定缺失,重组病毒纯化完全,无亲本株的污染。

|
| 图 5 重组病毒的稳定性检测 Figure 5 Stability test of recombinant virus 注:外源基因的PCR鉴定. A:PEDV s片段检测(1、2、3、4:重组病毒F5、F10、F15、F20,5:PRV XJ株);B:PoRV vp7片段检测(6、7、8、9:重组病毒F5、F10、F15、F20;10:PRV XJ株);C:gE基因检测(1、2、3、4代表重组病毒;5:PRV XJ株);M:DL2000 DNA marker. Note: PCR identification of inserted genes. A: Detection of PEDV s gene; 1, 2, 3, 4: recombinant viruses F5, F10, F15 and F20; 5: PRV XJ. B: Detection of PoRV vp7 gene; 6, 7, 8, 9: PoRV vp7 recombinant viruses F5, F10, F15 and F20; 10: PRV XJ). C: Detection of gE gene; 1, 2, 3, 4 Recombinant virus; 5: PRV-XJ. M: DL2000 DNA marker. |
|
|
根据细胞病变记录结果(表 3),按照Reed-Muench法计算出重组病毒PRV (CM)株的TCID50为10-7.25/0.1 mL;PRV XJ株的TCID50为10-7.59/0.1 mL,证明重组毒株与亲本毒株在侵染细胞能力上没有太大差异。
| Dilution | Dead | Alive | Total dead | Total alive | Mortality ratio | Mortality (%) | |||||||||||||
| CM | XJ | CM | XJ | CM | XJ | CM | XJ | CM | XJ | CM | XJ | CM | XJ | ||||||
| 10-1 | 10-1 | 8 | 8 | 0 | 0 | 54 | 57 | 0 | 0 | 54 | 57 | 100 | 100 | ||||||
| 10-2 | 10-2 | 8 | 8 | 0 | 0 | 46 | 49 | 0 | 0 | 46 | 49 | 100 | 100 | ||||||
| 10-3 | 10-3 | 8 | 8 | 0 | 0 | 38 | 41 | 0 | 0 | 38 | 41 | 100 | 100 | ||||||
| 10-4 | 10-4 | 8 | 8 | 0 | 0 | 30 | 33 | 0 | 0 | 30 | 33 | 100 | 100 | ||||||
| 10-5 | 10-5 | 8 | 8 | 0 | 0 | 22 | 25 | 0 | 0 | 22 | 25 | 100 | 100 | ||||||
| 10-6 | 10-6 | 8 | 8 | 0 | 0 | 14 | 17 | 0 | 0 | 14 | 17 | 100 | 100 | ||||||
| 10-7 | 10-7 | 5 | 7 | 3 | 1 | 6 | 9 | 3 | 1 | 9 | 10 | 66.7 | 90.0 | ||||||
| 10-8 | 10-8 | 1 | 2 | 7 | 6 | 1 | 2 | 10 | 7 | 11 | 9 | 9.0 | 22.2 | ||||||
| 注:CM代表重组毒株PRV (CM);XJ代表亲本株PRV XJ株. Note: CM represents the recombinant strain PRV (CM); XJ represents the parent strain PRV XJ. | |||||||||||||||||||
PRV基因组结构清晰,遗传背景清楚,庞大的基因组可编码很多非必需基因,显示了强大的转录机制,因此可以利用基因同源重组技术对其基因组进行改造,缺失病毒复制非必需毒力基因制备弱毒疫苗,或者在缺失主要毒力基因的同时引入外源基因的优势抗原区域,制备多联基因工程疫苗,预防可能共同感染或者诱发的其他疾病,同时避免多次接种超出免疫耐受范围,特别是哺乳仔猪和配种母猪,导致免疫应答迟缓甚至免疫抑制。国内Jiang等[15]将猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV) CH la株GP5基因和LacZ基因表达盒共同连接到PRV转移载体pBdTK-Uni中,构建了含GP5基因和报告基因的转移载体pGP5-LacZ,将pGP5-LacZ与伪狂犬病弱毒疫苗Bartha-K61株基因组DNA脂质体法共转染到Vero细胞,得到重组病毒株rPRV-GP5,相比市售的PRRSV灭活疫苗,rPRV-GP5表现了更高的体液免疫和细胞免疫反应,表明PRV可作为病毒活载体开发PRV、PRRSV的二价基因工程病毒疫苗。Chen等[12]将含有猪细小病毒(Porcine parvovirus,PPV) VP2基因的质粒和PRV SA215三基因缺失株病毒DNA共转染得到重组毒株PRV SA215/VP2,免疫仔猪引发了PRV和PPV特异性体液免疫反应,对PRV病毒株攻毒可提供完全的保护。国外使用细菌人工染色体(Bacterial artificial chromosome,BAC)技术生成共表达猪H1N1病毒HA基因和PRV的疫苗,滴鼻免疫仔猪可产生高水平抗体,也能抵抗H1N1病毒的挑战[16]。
PRV广泛流行于国内外猪场,导致母猪繁殖障碍及新生仔猪急性死亡,并伴有呕吐、腹泻、震颤和运动失调症状。PEDV和PoRV是目前主要困扰世界生猪产业的主要猪病毒性腹泻病原,致病机理相似,组织嗜性一致[17],PEDV会感染各个阶段的猪只,流行病学调查显示华南地区阳性率可达43.0%[18],华中地区甚至高达60.2%[19]。PoRV感染率低,但死亡率高,与PRV、PEDV以及细菌的混合感染使猪场面临更加严重的威胁。疫苗免疫在3种病毒防控中起到十分重要的作用,近年来针对PRV的商品灭活疫苗,由于毒株的变异与当前流行毒株不匹配,免疫途径不能产生满意的黏膜免疫,导致免疫预防效果不理想[20],中国农业科学院哈尔滨兽医研究所研制的猪传染性胃肠炎、猪流行性腹泻与猪轮状病毒(G5型)三联活疫苗应用较为广泛,但是针对流行的不同基因型病毒其效果不明显[21]。目前还没有关于猪流行性腹泻、轮状病毒、伪狂犬病毒联苗的研究,因此,利用PRV作为多联活疫苗载体并且能成功同时表达S蛋白和VP7蛋白具有重要意义。
PEDV的S蛋白分为S1 (1-735 aa)和S2 (736-1 383 aa)结构域,S1区包含多个病毒主要中和表位和受体结合域,S1基因中COE基因(499-638 bp)经乳酸杆菌表达的COE蛋白具有很强的免疫原性[22],孙东波[23]鉴定出S1P1 (248-280 aa)、S1P2 (442-499 aa)、S1P3 (679-742 aa) 3个高亲和性的B细胞抗原表位和1个中和表位区SID (636-789 aa),并发现S1P3表位的抗原性极强。猪轮状病毒VP6是抗原性最强的病毒蛋白,但不能在体外中和试验中抑制病毒的复制,没有中和活性,VP7蛋白是构成病毒外壳最丰富的蛋白,为病毒外膜的重要糖蛋白和主要中和抗原蛋白,是研究PoRV基因工程疫苗的理想区域。
本研究构建了PRV转移质粒pEGFP-VP7.S,在含有人巨细胞病毒早期启动子(CMV)的pEGFP-C1真核表达质粒基础上改造,保留了质粒的荧光蛋白基因序列(EGFP)和载体本身全部的多克隆位点,插入s基因475-804 aa片段,包括已鉴定的COE区域和中和表位SID区,也包括抗原性极强的S1P3区域和vp7基因17-339 aa片段[24],无完整的病毒基因组,从根本上杜绝了毒力返祖情况的发生,1 117 bp的gI同源臂插入在pEGFP-C1 Ase1酶切位点中,28K同源臂大小为1 005 bp,插入在pEGFP-C1 Mlu1酶切位点;采用新分离的已鉴定与Bartha株同源性较低、更加接近当前流行趋势的PRV XJ株野毒株[25]作为亲本株,与pEGFP-VP7.S载体在MA-104细胞中进行自然同源重组,随着病毒的传代,同源重组成功的重组病毒株会由于EGFP的插入发出绿色荧光,并能明显看到细胞病变,将此毒株命名为PRV (CM)。
Western blotting试验表明重组病毒株能正确表达外源S蛋白和VP7蛋白,将PRV (CM)传代20代能稳定检测到外源s基因和vp7基因,但gE毒力基因呈现阴性,而亲本毒株检测不到s基因和vp7基因,gE基因阳性存在,说明重组毒株具有遗传稳定性。刘琥构建的表达猪流感HA基因和NA基因的重组伪狂犬病毒株与亲本株的TCID50相比较下降了2个数量级[26];Klingbeil将H1N1 HA基因重组伪狂犬和亲本株具有相似的增值滴度[16],而对PRV (CM)的进一步TCID50测定显示,亲本株PRV XJ株(107.59 TCID50/mL)和以该毒株作为载体的重组病毒株PRV (CM) (107.25 TCID50/mL)在BHK-21细胞上增值滴度没有明显差异,略有降低,说明外源基因片段VP7.S的插入并没有影响病毒的增殖。综合考虑VP7.S融合基因的插入不影响重组毒株PRV (CM)的基本生物学特性,并且该重组毒株使用PRV本身的宿主机制来复制和表达VP7和S蛋白,具有在翻译后更高的正确修饰、折叠的可能性,可近似模拟自然感染时的真实情况,诱导产生体液免疫和细胞免疫甚至粘膜免疫,因此可进一步研究其免疫原性,为开发PEDV、PoRV、PRV三联基因工程疫苗奠定基础。
| [1] |
Kocherhans R, Bridgen A, Ackermann M, et al. Completion of the porcine epidemic diarrhoea coronavirus (PEDV) genome sequence[J]. Virus Genes, 2001, 23(2): 137-144. DOI:10.1023/A:1011831902219 |
| [2] |
Sun DB, Wang XY, Wei S, et al. Epidemiology and vaccine of porcine epidemic diarrhea virus in China:a mini-review[J]. Journal of Veterinary Medical Science, 2016, 78(3): 355-363. DOI:10.1292/jvms.15-0446 |
| [3] |
Sun J, Li QJ, Shao CY, et al. Isolation and characterization of Chinese porcine epidemic diarrhea virus with novel mutations and deletions in the S gene[J]. Veterinary Microbiology, 2018, 221: 81-89. DOI:10.1016/j.vetmic.2018.05.021 |
| [4] |
Sun DB, Feng L, Shi HY, et al. Spike protein region (aa 636789) of porcine epidemic diarrhea virus is essential for induction of neutralizing antibodies[J]. Acta Virologica, 2007, 51(3): 149-156. |
| [5] |
Chu VC, McElroy LJ, Chu V, et al. The avian coronavirus infectious bronchitis virus undergoes direct low-pH-dependent fusion activation during entry into host cells[J]. Journal of Virology, 2006, 80(7): 3180-3188. DOI:10.1128/JVI.80.7.3180-3188.2006 |
| [6] |
Marthaler D, Rossow K, Culhane M, et al. Identification, phylogenetic analysis and classification of porcine group C rotavirus VP7 sequences from the United States and Canada[J]. Virology, 2013, 446(1/2): 189-198. |
| [7] |
Lu XH, McDonald SM, Tortorici MA, et al. Mechanism for coordinated RNA packaging and genome replication by rotavirus polymerase VP1[J]. Structure, 2008, 16(11): 1678-1688. DOI:10.1016/j.str.2008.09.006 |
| [8] |
Gu J, Hu D, Peng T, et al. Epidemiological investigation of pseudorabies in Shandong Province from 2013 to 2016[J]. Transboundary and Emerging Diseases, 2018, 65(3): 890-898. DOI:10.1111/tbed.12827 |
| [9] |
Pomeranz LE, Reynolds AE, Hengartner CJ. Molecular biology of pseudorabies virus:impact on neurovirology and veterinary medicine[J]. Microbiology and Molecular Biology Reviews, 2005, 69(3): 462-500. DOI:10.1128/MMBR.69.3.462-500.2005 |
| [10] |
Mettenleiter TC. Immunobiology of pseudorabies (Aujeszky's Disease)[J]. Veterinary Immunology and Immunopathology, 1996, 54(1/4): 221-229. |
| [11] |
Li XM, Liu RF, Tang HJ, et al. Induction of protective immunity in swine by immunization with live attenuated recombinant pseudorabies virus expressing the capsid precursor encoding regions of foot-and-mouth disease virus[J]. Vaccine, 2008, 26(22): 2714-2722. DOI:10.1016/j.vaccine.2008.03.020 |
| [12] |
Chen Y, Guo WZ, Xu ZW, et al. A novel recombinant pseudorabies virus expressing parvovirus VP2 gene:immunogenicity and protective efficacy in swine[J]. Virology Journal, 2011, 8: 307. DOI:10.1186/1743-422X-8-307 |
| [13] |
Hong Q, Qian P, Li XM, et al. A recombinant pseudorabies virus co-expressing capsid proteins precursor P1-2A of FMDV and VP2 protein of porcine parvovirus:a trivalent vaccine candidate[J]. Biotechnology Letters, 2007, 29(11): 1677-1683. DOI:10.1007/s10529-007-9459-6 |
| [14] |
Chen DS. Development of trivalent genetic engineering live veter vaccine against porcine Japanese encephalitis, porcine parvovirus and pseudorabies[D]. Ya'an: Doctoral Dissertation of Sichuan Agricultural University, 2011 (in Chinese) 陈弟诗.猪乙型脑炎病毒-细小病毒-伪狂犬病毒活载体疫苗的研究[D].雅安: 四川农业大学博士学位论文, 2011 http://cdmd.cnki.com.cn/article/cdmd-10626-1011222491.htm |
| [15] |
Jiang YB, Fang LR, Xiao SB, et al. Construction and immunogenicity of recombinant pseudorabies virus expressing the modified GP5m protein of porcine reproduction and respiratory syndrome virus[J]. Frontiers of Biology in China, 2007, 2(1): 85-91. DOI:10.1007/s11515-007-0015-5 |
| [16] |
Klingbeil K, Lange E, Teifke JP, et al. Immunization of pigs with an attenuated pseudorabies virus recombinant expressing the haemagglutinin of pandemic swine origin H1N1 influenza A virus[J]. Journal of General Virology, 2014, 95: 948-959. DOI:10.1099/vir.0.059253-0 |
| [17] |
Chen FZ. Infection and molecular characteristics of porcine epidemic diarrhea virus and application of next generation sequencing in new pathogen discovery[D]. Wuhan: Doctoral Dissertation of Huazhong Agricultural University, 2017 (in Chinese) 陈芳洲.猪流行性腹泻病毒的感染和分子特征及下一代测序技术在挖掘新病原的应用研究[D].武汉: 华中农业大学博士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10504-1018206796.htm |
| [18] |
Li ZL, Zhu L, Ma JY, et al. Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field strains in south China[J]. Virus Genes, 2012, 45(1): 181-185. |
| [19] |
Zheng FM, Huo JY, Zhao J, et al. Molecular characterization and phylogenetic analysis of Porcine Epidemic Diarrhea Virus field strains in central China during 2010-2012 outbreaks[J]. Chinese Journal of Virology, 2013, 29(2): 197-205. (in Chinese) 郑逢梅, 霍金耀, 赵军, 等. 2010-2012年华中地区猪流行性腹泻病毒分子特征和遗传进化分析[J]. 病毒学报, 2013, 29(2): 197-205. |
| [20] |
He QG, Tong GZ, Yang HC, et al. Epidemiological characterization of swine pseudorabies, eradication technologies and application[J]. Chinese Journal of Animal Science, 2015, 51(24): 68-74. (in Chinese) 何启盖, 童光志, 杨汉春, 等. 猪伪狂犬病流行病学特征、净化技术及其应用示范[J]. 中国畜牧杂志, 2015, 51(24): 68-74. DOI:10.3969/j.issn.0258-7033.2015.24.014 |
| [21] |
Yuan L. Isolation and identification of porcine rotavirus G4P[6] strain and the establishment and application of novel diagnostic methods[D]. Beijing: Doctoral Dissertation of China Agricultural University, 2018 (in Chinese) 原霖.猪轮状病毒G4P[6]株的分离鉴定及新型检测方法的建立与应用[D].北京: 中国农业大学博士学位论文, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10019-1018069330.htm |
| [22] |
Dong LN, Gao FS, Xu CB, et al. Construction and identification of the expression recombinants for PEDV COE gene in Lactococcus lactis[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(12): 1743-1747. (in Chinese) 董丽娜, 高凤山, 许崇波, 等. 表达猪流行性腹泻病毒COE基因的重组乳酸菌的构建与鉴定[J]. 畜牧兽医学报, 2008, 39(12): 1743-1747. DOI:10.3321/j.issn:0366-6964.2008.12.018 |
| [23] |
Sun DB. Identification of antigenic epitopes and screening receptor binding domain on the spike protein of porcine epidemic diarrhea virus[D]. Beijing: Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2008 (in Chinese) 孙东波.猪流行性腹泻病毒S蛋白抗原表位鉴定及受体结合域的初步筛选[D].北京: 中国农业科学院博士学位论文, 2008 http://cdmd.cnki.com.cn/Article/CDMD-82101-2008130324.htm |
| [24] |
Liu PJ. Construction and immunogenicity study of a bivalent DNA vaccine based on PoRV VP7 and PEDV S gene[D]. Chengdu: Master's Thesis of Sichuan Agricultural University, 2016 (in Chinese) 刘鹏娟.基于PoRV VP7与PEDV S基因二联DNA疫苗的构建及免疫效力评价[D].成都: 四川农业大学硕士学位论文, 2016 |
| [25] |
Liu XW. Isolation and identification of pseudorabies virus and construction of a gI/gE double gene deletion strains[D]. Chengdu: Master's Thesis of Sichuan Agricultural University, 2016 (in Chinese) 刘小琬.伪狂犬病毒的分离鉴定及gI/gE双基因缺失株的构建[D].成都: 四川农业大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10626-1017016999.htm |
| [26] |
Liu H. Construction of recombinant pseudorabies virus expressing both HA and NA gene of a swine influenza virus H1NA[D]. Wuhan: Master's Thesis of Huazhong Agricultural University, 2008 (in Chinese) 刘琥.表达猪流感H1N1 HA基因和NA基因的重组伪狂犬毒株的构建[D].武汉: 华中农业大学硕士学位论文, 2008 http://cdmd.cnki.com.cn/Article/CDMD-10504-2008203356.htm |
 2019, Vol. 46
2019, Vol. 46