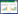扩展功能
文章信息
- 杨文飞, 熊展博, 吴旭光, 韩雨希, 王红, 徐中强, 李槿年
- YANG Wen-Fei, XIONG Zhan-Bo, WU Xu-Guang, HAN Yu-Xi, WANG Hong, XU Zhong-Qiang, LI Jin-Nian
- 黄颡鱼暴发性出血病病原菌的分离鉴定及其生物膜形成特性
- Isolation, identification and biofilm forming characteristics of pathogen causing fulminant hemorrhagic disease in yellow catfish (Pelteobagrus fulvidraco)
- 微生物学通报, 2019, 46(12): 3335-3344
- Microbiology China, 2019, 46(12): 3335-3344
- DOI: 10.13344/j.microbiol.china.190089
-
文章历史
- 收稿日期: 2019-01-28
- 接受日期: 2019-04-19
- 网络首发日期: 2019-05-31
黄颡鱼(Peteobagrus fulvidraco)是我国名优淡水养殖鱼类品种之一,因其肉嫩味美和营养丰富,其市场需求量不断扩大。但是,随着养殖面积与密度的不断提高,导致养殖环境逐渐恶化,黄颡鱼病害,尤其是细菌性疾病日益增多,给黄颡鱼养殖业造成严重的经济损失。目前报道的引起黄颡鱼细菌性疾病的病原菌主要有嗜麦芽窄食单胞菌、拟态弧菌、腐败希瓦氏菌、柱状黄杆菌、爱德华氏菌、小肠结肠炎耶尔森氏菌和嗜水气单胞菌[1-7]。
1991年Carnahan等[8]首先确定了简达气单胞菌(Aeromnas jandaei)的分类地位。随后,研究表明该菌不仅可感染水生动物,也能感染人与家畜,是一种人-畜-鱼共患病原菌[9-11]。同其他种气单胞菌一样,简达气单胞菌感染水生动物后,通过产生的溶血素、肠毒素、黏附素和生物膜等多种毒力因子的协同作用,导致疾病发生[12]。细菌生物膜(Bacterial biofilm)是细菌为适应生存环境,黏附于有生命或无生命物体表面后,被细菌自身产生的胞外多聚物基质包裹的膜状细菌群体,具有极强的耐药性和较强的毒力[13]。研究发现,自然界中99%的细菌是以生物膜形式存在,65%−80%的细菌感染是由细菌生物膜所介导的[14-15]。因此,研究病原菌生物膜形成的调控机制并最终发现适合的药物作用靶点,对防控细菌性疾病具有重要意义。
暴发性出血病是黄颡鱼养殖过程中流行地域最广、流行季节最长、造成损失最大的一种急性传染病,其病原多样[16]。2017年7月,安徽省当涂县某池塘养殖黄颡鱼突然暴发出血病。发病早期病鱼离群独游、很少进食。随后,病鱼的眼部、鳍条和尾部均有出血症状,很快漂浮水面死去。剖检死亡鱼可见鳃、脾脏、生殖腺和胃出血明显。我们在发病现场采集濒死期黄颡鱼后进行病原学检查,从病变脏器中分离鉴定到一株简达气单胞菌,且经人工感染回归试验证实其为病原菌。在此基础上,进一步对分离菌株生物膜的形成条件、形成能力及其携带的生物膜形成相关基因进行了研究,以期为从抗生物膜形成角度防治简达气单胞菌感染提供参考依据。
1 材料与方法 1.1 实验材料 1.1.1 细胞与实验鱼鲤鱼上皮瘤细胞(Epithelioma papuLosum cyprinid,EPC)购自上海海洋大学农业部渔业动植物病原库。实验用黄颡鱼(体质量约为150 g)购自农贸市场。
1.1.2 培养基、主要试剂与仪器试验中所用培养基(BHI、TSB和LB培养基)以及细菌微量生化反应管,北京陆桥技术股份有限公司;基因组DNA提取试剂盒和DNA回收试剂盒,宝生物工程(大连)有限公司;0.5%结晶紫溶液和冰醋酸,上海源叶生物科技有限公司。
医用低温保存箱,海尔特种电器有限公司;紫外可见分光光度计,上海仪电分析仪器有限公司;扫描电镜与透射电镜,日立公司。
1.2 病原的分离培养与纯化取濒死期黄颡鱼病变脏器按参考文献[17]使用EPC细胞分离病原菌。同时,将肝脏四区划线接种含10%兔血的血琼脂平板和TSB琼脂平板,30 ℃培养24 h,挑取优势菌落转种TSB琼脂平板纯化细菌。
1.3 分离菌株的人工回归感染试验将分离菌株接种TSB培养液,30 ℃、180 r/min振荡培养24 h后,采用平板倾注法测定细菌浓度,并用无菌生理盐水将菌液稀释为2×108、2×107、2×106和2×105 CFU/mL 4个浓度。实验用黄颡鱼随机分成5组,每组10尾,前4组分别腹腔注射0.2 mL 4个不同浓度的菌液,第5组腹腔注射等量生理盐水作为对照。为了减少应激反应,实验鱼先经30 mg/L的MS-222麻醉后,再进行注射。人工感染后逐日观察实验鱼的发病及死亡情况,及时剖检死亡鱼病并再次分离细菌。14 d后采用Reed-Muench法[18]计算分离菌株对黄颡鱼的半数致死量(LD50)。
1.4 分离菌株的鉴定 1.4.1 形态学检查将分离菌株接种于TSB培养液,30 ℃、180 r/min培养24 h后,按曹际等[19]报道方法制备细菌形态学检查样品,光镜和透射电镜下观察其形态、大小、结构与染色特性。
1.4.2 生化特性测定将分离菌株接种TSB琼脂平板,30 ℃培养24 h后,挑取单菌落接种细菌生化发酵管,30 ℃培养24−48 h,观察其生化特性。
1.4.3 16S rRNA基因序列测定与分析以基因组DNA提取试剂盒提取的分离菌株基因组DNA为模板,用文献[20]报道的细菌16S rRNA基因序列(X80722)设计的通用引物(上游引物:5′-AGAGTTTGATCTGGCTCAG-3′;下游引物:5′-TACGGCTACCTTGTTACGACTT-3′) PCR扩增分离菌株的16S rRNA基因。PCR反应体系:10×PCR buffer 2.5 μL,MgCl2 (25 mmol/L) 1.5 μL,dNTPs (10 mmol/L) 0.5 μL,Taq酶(5 U/μL) 0.3 μL,引物(10 μmol/L)各0.5 μL,模板2.0 μL,ddH2O 17.2 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,52 ℃ 50 s,72 ℃ 100 s,32个循环;72 ℃ 10 min。1.0%琼脂糖凝胶电泳检测PCR产物,并委托上海生物技术有限公司对其进行克隆与测序。测序结果经过拼接后进行BLAST分析,选取10条相似性较高的细菌16S rRNA基因的核苷酸序列,以MEGA 6.0中邻接(Neighbour-Joining)法构建分离菌株16S rRNA基因的系统发育进化树,并通过1 000次Bootstrap检验置信度。
1.5 分离菌株的生物膜形成能力检测 1.5.1 分离菌株生物膜形成条件的优化选取培养基种类(BHI、TSB和LB)、培养温度(25、30、35 ℃)和培养时间(48、72、96 h) 3个因素,每一因素各取3个水平,按L9(33)进行正交试验(表 1),通过测定生物膜溶解液的OD492值确定最佳成膜条件。微孔板结晶紫染色法[21]检测细菌生物膜的主要步骤为:在不同培养条件下将分离菌株培养至OD600值为0.5,取菌液加至96孔细胞培养板,200 μL/孔,按表 1中设置温度与时间进行培养,共做3个复孔,同时设置培养基做空白对照。培养结束后依次进行0.5%结晶紫染色、33%冰醋酸溶解结晶紫、酶标仪测定溶解液的OD492值,分析各试验组与空白对照组的平均OD492,以确定分离菌株形成生物膜的最佳条件。同时,参照Watnick等[22]方法使用扫描电镜观察生物膜。
| 水平 Levels |
因素Factors | ||
| A培养温度 A Incubation temperature (℃) |
B培养基种类 B Medium types |
C培养时间 C Incubation time (h) |
|
| 1 | 25 | LB | 48 |
| 2 | 30 | BHI | 72 |
| 3 | 35 | TSB | 96 |
在最佳条件下采用微孔板结晶紫染色法检测分离株的生物膜形成能力。参考文献[23]将空白对照组平均OD492值加上其3倍标准差(SD)作为细菌生物膜形成的临界值(Cutoff value,ODC),OD492值≤ODC判为无生物膜形成能力;ODC < OD492值≤2 ODC判为生物膜形成能力较弱;2ODC < OD492值≤4 ODC判为生物膜形成能力中等;OD492值> 4 ODC判为生物膜形成能力强。
1.6 分离菌株携带的生物膜形成相关基因检测根据GenBank中收录的气单胞菌LuxI家族蛋白同系物(Homolog of LuxI-type protein family)编码基因ahyⅠ、甘油-3-磷酸脱氢酶D (Glycerol-3-phosphate dehydrogenase D)编码基因glpD、S-核糖同型半胱氨酸裂解酶(S-ribosylhomocysteine lyase)编码基因luxS以及甘露糖敏感型血凝素菌毛合成蛋白Q (Mannose-sensitive hemagglutinin pili biogenesis protein Q)编码基因mshQ序列,设计合成4对特异性引物(表 2)。PCR检测分离菌株是否携带这4种生物膜形成相关基因,PCR反应体系同前述16S rRNA基因扩增体系;PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,52−57℃ (不同基因退火温度见表 2) 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。1.0%琼脂糖凝胶电泳检测PCR产物并拍照。
| 基因 Gene |
引物序列 Primer sequence (5′→3′) |
大小Size (bp) |
退火温度 Annealing temperature (℃) |
| ahyⅠ | F: CCTCGGCTGGGATGTGGAAT | 308 | 57 |
| R: CCCTGGCGAAGGCATAGACC | |||
| glpD | F: TTCCGGTTGGTGAAAGAG | 896 | 53 |
| R: TTGCGATAGGTGGTGAGC | |||
| luxS | F: ATGCCGTTATTGGACAGTTTTAC | 510 | 52 |
| R: TTAGAGGCTTTTGAGCTTCTCTT | |||
| mshQ | F: CACCTCGGCGACTTTCCA | 1 670 | 53 |
| R: CGCTGACGCTCTGTTCCAT |
病变脏器的无菌滤液接种EPC细胞,经过3代盲传均未出现细胞病变,而接种培养基后分离到几乎接近纯培养的菌落,经纯化后命名为分离菌株HSY-2。该分离菌株在TSB琼脂平板上长出无色、表面光滑隆起、边缘整齐、半透明、直径1.0 mm−1.2 mm的圆形菌落;而在兔血琼脂平板上长出直径1.2 mm−1.5 mm的乳白色圆形菌落,菌落周围出现明显溶血环。
经人工感染回归试验结果显示,发病实验鱼的外观和剖检变化与自然感染病例一致(图 1),并从病死鱼多个脏器中再次分离到大量人工感染菌,而对照组实验鱼无任何异常。由表 3可见,分离菌株HSY-2对黄颡鱼的半数致死量LD50为1.05×106 CFU/mL。结果表明分离菌株HSY-2为此次黄颡鱼暴发性出血病的病原菌。
|
| 图 1 人工感染后黄颡鱼的外观与剖检变化 Figure 1 Appearance and anatomical changes of artificially infected yellow catfish 注:A:胸鳍与眼出血;B:尾部出血;C:鳃出血;D:生殖腺与胃出血;E:脾脏出血. Notes: A: Pectoral fin and eye hemorrhage; B: Tail hemorrhage; C: Gill hemorrhage; D: Gonad and stomach hemorrhage; E: Splenic hemorrhage. |
|
|
| 组别 Group |
剂量 Dose (CFU/mL) |
注射尾数 Numbers of injected fish |
死亡尾数 Numbers of dead fish |
存活尾数 Numbers of alive fish |
累计结果Cumulative results | |||
| 生 Alive |
死 Dead |
死亡比例 Mortality ratio |
死亡率 Mortality rate (%) |
|||||
| 1 | 2×108 | 10 | 10 | 0 | 0 | 28 | 28/28 | 100 |
| 2 | 2×107 | 10 | 10 | 0 | 0 | 18 | 18/18 | 100 |
| 3 | 2×106 | 10 | 5 | 5 | 5 | 8 | 8/13 | 61.54 |
| 4 | 2×105 | 10 | 3 | 7 | 12 | 3 | 3/15 | 20 |
| 5 | 0.2 mL Physiological saline | 10 | 0 | 10 | 10 | 0 | 0/10 | 0 |
| LD50=1.05×106CFU/mL | ||||||||
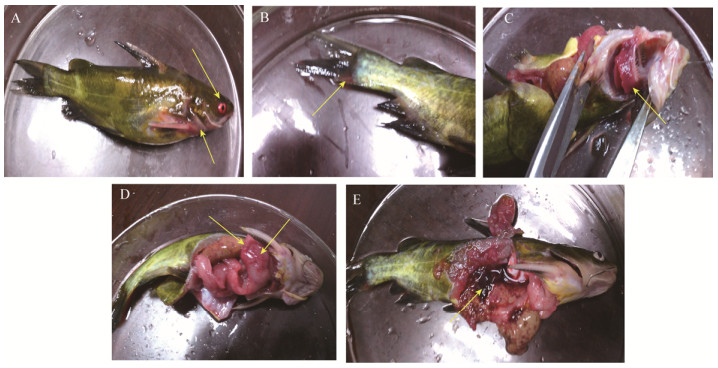
光学显微镜下观察到分离菌株HSY-2为G−两端钝圆的杆菌,长短不一,(0.4−0.5) μm×(1.0−2.0) μm,偶可见有长丝状菌体,散在排列(图 2A)。透射电镜下观察可见菌体呈杆状,两端钝圆且有鞭毛(图 2B)。分离菌株HSY-2的生化特性如表 4所示,发酵葡萄糖(产气)、D-蜜二糖和D-甘露醇;吲哚试验、硝酸盐还原试验、柠檬酸利用试验和V-P试验均阳性;氧化酶、赖氨酸脱羧酶和精氨酸双水解酶均阳性;不分解蔗糖、L-阿拉伯糖、鼠李糖、纤维二糖、D-山梨醇、肌醇、苦杏仁苷、七叶苷和水杨苷,不产生硫化氢,尿素酶试验和鸟氨酸脱羧酶试验均阴性。参照文献[24]报道的简达气单胞菌表型特征,初步认为分离菌株HSY-2为简达气单胞菌。进一步检测与分析分离菌株的16S rRNA基因序列,结果发现该基因长度为1 508 bp (MK743938),与GenBank中收录的简达气单胞菌参考株(Aeromonas jandaei strain LC208)的相似性高达99%,在构建的系统进化树中两者也聚为一分支(图 3)。
|
| 图 2 分离菌株HSY-2的光镜和透射电镜图 Figure 2 Light and transmission electron microscopic pictures of the strain HSY-2 isolated from diseased yellow catfish 注:A:光镜照片(1 000×);B:透射电镜照片(6 000×,白色箭头示鞭毛). Notes: A: Light microscopic picture of strain HSY-2 (1 000×); B: Transmission electron microscopic picture of strain HSY-2 (6 000×), white arrows show flagella. |
|
|
| 测定项目 Test items |
分离菌株 HSY-2 Isolated strain HSY-2 |
简达气单胞菌 ATCC49568T A. jandaei ATCC49568T |
||||
| 葡萄糖产气 Gas from Glucose |
+ | + | ||||
| 苦杏仁苷 Amygclalin |
- | - | ||||
| D-蜜二糖 D-Melibiose |
+ | + | ||||
| D-甘露醇D-Mannitol | + | + | ||||
| 蔗糖 Sucrose |
- | - | ||||
| D-山梨醇 D-Sorbitol |
- | - | ||||
| L-阿拉伯糖 L-Arabinose |
- | - | ||||
| 鼠李糖 Rhamnose |
- | - | ||||
| 七叶苷 Esculin |
- | - | ||||
| 纤维二糖 Cellobiose |
- | - | ||||
| 肌醇 Inositol |
- | - | ||||
| 硫化氢 H2S |
- | - | ||||
| 吲哚 Indol |
+ | + | ||||
| 尿素酶 Urease |
- | - | ||||
| 水杨苷 Salicin |
- | - | ||||
| 硝酸盐还原 Nitrate |
+ | + | ||||
| 柠檬酸盐利用 Citrate |
+ | + | ||||
| V-P试验 V-P test |
+ | + | ||||
| 氧化酶 Oxidase |
+ | + | ||||
| 赖氨酸脱羧酶 Lysine decarboxylase |
+ | + | ||||
| 鸟氨酸脱羧酶 Ornithine decarboxylase |
- | + | ||||
| 精氨酸双水解酶 Arginine dihydrolase |
+ | + | ||||
| 注:+:阳性;-:阴性. Notes: +: Positive; –: Negative. |
||||||

|
| 图 3 基于分离菌株HSY-2与相关参考株的16S rRNA基因序列构建的系统发育进化树 Figure 3 Phylogenetic tree was constructed based on 16S rRNA gene of the bacterial isolate in this study (HYS-2) and their related reference strains 注:括号中的序号表示代表菌株的16S rRNA基因GenBank登录号;分支点上的数字表示系统树1 000次计算,形成该节点的百分比;标尺0.000 5代表 0.05%的16S rRNA基因序列的进化差异. Note: The number in the bracket means the GenBank accession number of the strain's 16S rRNA gene; The number on branch means percentage bootstrap values were calculated from 1 000 replications; The scale bar 0.000 5 means 0.5% 16S rRNA gene sequence difference. |
|
|
综合分离菌株HSY-2的表型特性及其16S rRNA基因序列分析结果,可以确定其为简达气单胞菌。
2.3 分离菌株的生物膜形成特性对正交试验结果(表 5)进行极差分析,通过比较三因素的极差R值,发现影响分离菌株HSY-2生物膜形成的的主次关系是培养温度(A) > 培养时间(C) > 培养基种类(B)。各因素的组合以A2B3C3为最佳,即分离菌株生物膜形成的最佳条件是将细菌接种TSB培养基,30 ℃静置培养96 h。
| 实验组 Experimental groups |
因素 Factor |
OD492值 OD492 value |
||
| A | B | C | ||
| 1 | 1 | 1 | 1 | 0.099 |
| 2 | 1 | 2 | 2 | 0.101 |
| 3 | 1 | 3 | 3 | 0.133 |
| 4 | 2 | 1 | 2 | 0.126 |
| 5 | 2 | 2 | 3 | 0.214 |
| 6 | 2 | 3 | 1 | 0.225 |
| 7 | 3 | 1 | 3 | 0.101 |
| 8 | 3 | 2 | 1 | 0.083 |
| 9 | 3 | 3 | 2 | 0.081 |
| K1 | 0.111 | 0.109 | 0.135 | |
| K2 | 0.188 | 0.133 | 0.103 | |
| K3 | 0.088 | 0.146 | 0.149 | |
| R | 0.100 | 0.037 | 0.046 | |
| 注:K1、K2和K3分别表示每一列“1”、“2”和“3”水平所对应的试验指标平均值,R表示极差(K1、K2、K3中最大值减去最小值). Note: K1, K2 and K3 represent the average of the test index corresponding to “1”, “2” and “3” levels in each column, respectively. R means extreme difference (The maximum value in K1, K2 and K3 minus the minimum value). |
||||
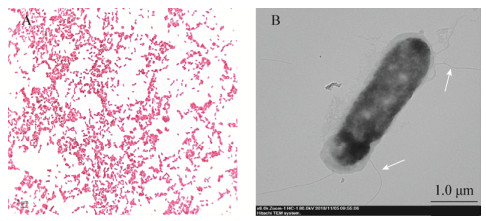
在最佳条件下同时应用结晶紫染色法和扫描电镜检测分离菌株HSY-2的生物膜形成能力。结果如图 4A、B所示,接种分离菌株的3个复孔经培养、结晶紫染色及清洗后,孔侧壁与底部均有紫色附着,而空白对照孔无染液附着,呈透明色。空白对照孔的OD492平均值为0.067±0.002,临界值ODC为0.073,试验孔OD492平均值为0.247±0.009,2ODC < 试验孔OD492≤4 ODC,说明分离菌株HSY-2形成生物膜能力中等。通过扫描电镜可以观察到分离菌株HSY-2在盖玻片表面生长的形态较为均一,有致密的膜样物形成。

|
| 图 4 结晶紫染色法与扫描电镜检测菌株HSY-2的生物膜 Figure 4 Detection of the strain HSY-2 biofilm by crystal violet dyeing and scanning electron microscope 注:A:结晶紫染色的分离菌株生物膜;B:培养基空白对照;C:扫描电镜观察的分离菌株生物膜(8 000×). Note: A: Biofilm of the isolated strain stained with crystal violet; B: Blank control of culture medium; C: Biofilm of the isolated strain observed by scanning electron microscope (8 000×). |
|
|
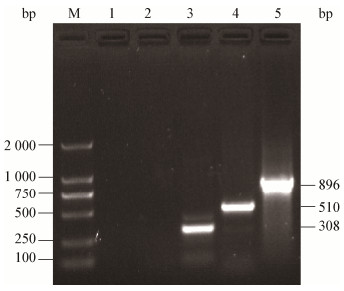
采用PCR方法检测简达气单胞菌分离株HSY-2携带4种生物膜形成相关基因情况,结果如图 5所示,在308、510和896 bp附近出现3条清晰的DNA条带,分别与预期的ahyI、glpD和luxS基因片段大小相符,而未扩增出mshQ基因片段。结果表明该菌株同时携带了编码LuxI家族蛋白同系物、甘油-3-磷酸脱氢酶D和S-核糖同型半胱氨酸裂解酶的3种生物膜形成相关基因,但未检测到甘露糖敏感型血凝素菌毛合成蛋白Q编码基因。
|
| 图 5 分离菌株HSY-2携带的生物膜形成相关基因的PCR检测 Figure 5 PCR detection of the biofilm formation related genes carried by the strain HSY-2 注:M:DNA分子质量标准;1:阴性对照;2:未扩增出mshQ基因;3:ahyI基因片段的PCR产物;4:glpD基因片段的PCR产物;5:luxS基因片段的PCR产物. Note: M: DNA Marker; 1: Negative control; 2: Unamplified mshQ gene; 3: PCR product of ahyI gene fragment; 4: PCR product of glpD gene fragment; 5: PCR product of luxS gene fragment. |
|
|
随着黄颡鱼养殖产业不断发展,养殖环境日益恶化,各种病害频发。其中,暴发性出血病是一种流行地域最广、流行季节最长、造成损失最大的急性传染病,并且该病的病原报道不一致。如,柏爱旭等[7]报道了由嗜水气单胞菌引起的黄颡鱼出血病;韩继卫等[25]报道黄颡鱼出血病的病原为温和气单胞菌;沈亚斌等[16]报道了一例由车轮虫引起的黄颡鱼暴发性出血病。本研究从患出血病的黄颡鱼体内分离得到一株优势菌株,通过回归感染试验证实其为此次黄颡鱼暴发性疾病的病原菌。根据形态特征、生化特性以及16S rRNA基因序列分析,确定该病原菌为简达气单胞菌。这些结果表明尽管患病黄颡鱼症状相似,但由于地域和养殖环境的差异,其病原不尽相同,甚至是多种病原微生物的混合感染。
近年来,已有文献陆续报道多种鱼源的简达气单胞菌,但对其生物膜的研究尚未见有报道。本试验首次研究简达气单胞菌的生物膜形成特性。由于不同细菌在相同条件下,以及同种细菌在不同条件下形成生物膜的能力各不相同,为了明确简达气单胞菌分离菌株HSY-2形成生物膜的最佳条件及其成膜能力,我们采用正交试验设计L9(33)方案,通过测定生物膜溶解液OD492值分析培养基种类、培养温度和培养时间对生物膜形成的影响。结果发现影响成膜因素的主次关系是培养温度 > 培养时间 > 培养基种类,最终确定生物膜形成的最佳条件是将分离菌株接种TSB培养基,30 ℃静置培养96 h,并且在该最佳条件下分离菌株表现为生物膜形成能力中等。这些结果为探究简达气单胞菌的生物膜形成机制和致病机理奠定了基础。
细菌生物膜形成是一个动态的过程,包括黏附、聚集及生长、成熟和脱落4个阶段。研究表明调控细菌生物膜形成的基因涉及细菌的黏附性、运动性、群体感应系统(Quorum sensing,QS)、代谢调控、细胞壁生成以及应激反应等多个方面[26]。Qin等[27]报道甘露糖敏感型血凝素菌毛合成蛋白Q (Mannose-sensitive hemagglutinin pili biogenesis protein Q)的编码基因mshQ是嗜水气单胞菌生物膜形成相关基因,该基因通过调控菌毛合成而影响生物膜的形成能力。张海月[28]研究发现甘油-3-磷酸脱氢酶D (Glycerol-3-phosphate dehydrogenase D)编码基因是维氏气单胞菌生物膜形成相关基因。GlpD是糖酵解途径中的关键酶,不仅参与膜转运与膜融合,分布在细胞膜上的GlpD还具有促进细菌黏附进而形成生物膜的作用。QS系统是指细菌细胞密度达到一定阈值后,能够感知自身分泌的自诱导信号分子来进行细胞间交流,从而控制细菌基因表达的相关机制。细菌形成生物膜过程中,通过QS系统调节,细菌裂解释放大量游离DNA构成细菌生物膜的骨架,维持生物膜的空间构象。Kozlova等[29]研究发现嗜水气单胞菌QS系统luxS基因突变株产生的生物膜较野生株厚;Lynch等[30]利用电镜观察到嗜水气单胞菌QS系统ahyⅠ基因(LuxI家族蛋白同系物编码基因)缺失株不能形成成熟形状的生物膜,说明luxS基因和ahyⅠ基因均是嗜水气单胞菌生物膜形成相关基因。本研究采用PCR方法检测了简达气单胞菌分离菌株HSY-2是否携带上述气单胞菌生物膜形成相关基因,结果显示该分离菌株同时携带glpD、luxS和ahyⅠ基因,但未检测到mshQ基因,这与透射电镜下未见到分离菌株菌毛的结果一致。近来,Ganesh等[31]研究发现红果榄仁果树(Terminalia bellerica)的甲醇提取物具有抗QS作用,进而抑制细菌生物膜形成。这一研究结果提示我们红果榄仁果树的甲醇提取物经过纯化或加工修饰后可作为抗菌制剂。此外,我们认为也可以通过研究上述3种生物膜形成相关基因编码蛋白的分子结构,寻找与其具有相似结构的竞争药物来进行竞争性抑制细菌生物膜的形成,从而达到抗菌目的。
综上所述,简达气单胞菌分离菌株HSY-2是引起安徽省当涂县养殖黄颡鱼暴发性出血病的主要病原菌,可形成中等强度的生物膜,且同时携带glpD、luxS和ahyⅠ三种生物膜形成相关基因。
| [1] |
Cao HP, Guo C, An J, et al. Stenotrophomonas maltophilia: an emerging pathogen of ascites disease in farmed yellow catfish Pelteobagrus fulvidraco[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2017, 69: 1445. |
| [2] |
Zhang X, Li YW, Mo ZQ, et al. Outbreak of a novel disease associated with Vibrio mimicus infection in fresh water cultured yellow catfish, Pelteobagrus fulvidraco[J]. Aquaculture, 2014, 432: 119-124. DOI:10.1016/j.aquaculture.2014.04.039 |
| [3] |
Yang YB, Guo C, Cao HP, et al. Shewanella putrefaciens: an emerging pathogen for farmed yellow catfish Pelteobagrus fulvidraco[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2017, 69: 1425. |
| [4] |
Zhang YL, Zhao LJ, Zhou WD, et al. Characterization and pathogenicity of a strain of Flavobacterium columnare isolated from Pelteobagrus fulvidraco[J]. Journal of Huazhong Agricultural University, 2016, 35(2): 83-89. (in Chinese) 张玉蕾, 赵丽娟, 周伟东, 等. 黄颡鱼源柱状黄杆菌的分离鉴定及其对翘嘴鳜的致病性[J]. 华中农业大学学报, 2016, 35(2): 83-89. |
| [5] |
Liu JY, Li AH, Zhou DR, et al. Isolation and characterization of Edwardsiella ictaluri strains as pathogens from diseased yellow catfish Pelteobagrus fulvidraco (Richardson) cultured in China[J]. Aquaculture Research, 2010, 41(12): 1835-1844. DOI:10.1111/j.1365-2109.2010.02571.x |
| [6] |
Gou XL, Wang L. Pathogenicity and detection of virulence genes of bacterium Yersinia enterocolitica isolated from yellow catfish (Pelteobagrus fulvidraco)[J]. Fisheries Science, 2013, 32(5): 293-296. (in Chinese) 苟小兰, 王利. 小肠结肠炎耶尔森氏菌对黄颡鱼的致病性及毒力基因检测[J]. 水产科学, 2013, 32(5): 293-296. DOI:10.3969/j.issn.1003-1111.2013.05.009 |
| [7] |
Bai AX, Zhang K, Zhang JY, et al. Identification and detection of pathogenic Aeromonas hydrophila isolated from yellow catfish (Pelteobagrus fulvidraco)[J]. Jiangsu Agricultural Sciences, 2018, 46(7): 175-178. (in Chinese) 柏爱旭, 张科, 张敬友, 等. 黄颡鱼病原嗜水气单胞菌分离鉴定及致病性研究[J]. 江苏农业科学, 2018, 46(7): 175-178. |
| [8] |
Carnahan A, Fanning GR, Joseph SW. Aeromonas jandaei (formerly genospecies DNA group 9 A. sobria), a new sucrose-negative species isolated from clinical specimens[J]. Journal of Clinical Microbiology, 1991, 29(3): 560-564. |
| [9] |
Dong HT, Techatanakitarnan C, Jindakittikul P, et al. Aeromonas jandaei and Aeromonas veronii caused disease and mortality in Nile tilapia, Oreochromis niloticus (L.)[J]. Journal of Fish Diseases, 2017, 40(10): 1395-1403. DOI:10.1111/jfd.12617 |
| [10] |
Sarma PS. Aeromonas jandaei cellulitis and bacteremia in a man with diabetes[J]. The American Journal of Medicine, 2002, 112(4): 325. DOI:10.1016/S0002-9343(01)01052-X |
| [11] |
Wang YX, Zhang WD, Zhang YG, et al. Identification of Aeromonas jandaei and Providencia rustigianii isolated from Buffalo[J]. Yunnan Journal of Animal Science and Veterinary Medicine, 2003(4): 1-3. (in Chinese) 王永贤, 张文东, 张应国, 等. 水牛简达气单胞菌和拉氏普罗威登斯菌的分离与鉴定[J]. 云南畜牧兽医, 2003(4): 1-3. DOI:10.3969/j.issn.1005-1341.2003.04.001 |
| [12] |
Jiang YL, Li LL. Research progress on Aeromonas hydrophila[J]. Heilongjiang Agricultural Sciences, 2015(2): 142-146. (in Chinese) 姜艳丽, 李丽丽. 嗜水气单胞菌的研究进展[J]. 黑龙江农业科学, 2015(2): 142-146. |
| [13] |
Wu H, Moser C, Wang HZ, et al. Strategies for combating bacterial biofilm infections[J]. International Journal of Oral Science, 2015, 7(1): 1-7. |
| [14] |
Zhang Q, Ma HN. Advances in research on Escherichia coli biofilm formation and antimicrobial resistance mechanisms[J]. Chinese Journal of Antibiotics, 2018, 43(5): 497-501. (in Chinese) 张青, 马慧娜. 大肠埃希菌生物膜形成与耐药机制的研究进展[J]. 中国抗生素杂志, 2018, 43(5): 497-501. DOI:10.3969/j.issn.1001-8689.2018.05.001 |
| [15] |
Jamal M, Ahmad W, Andleeb S, et al. Bacterial biofilm and associated infections[J]. Journal of the Chinese Medical Association, 2018, 81(1): 7-11. DOI:10.1016/j.jcma.2017.07.012 |
| [16] |
Shen YB, Zeng XK, Li GH, et al. Treatment and thinking of a case of fulminant hemorrhagic disease of yellow catfish (Pelteobagrus fulvidraco)[J]. Scientific Fish Farming, 2017(4): 71-72. (in Chinese) 沈亚斌, 曾宪凯, 李桂花, 等. 一例黄颡鱼暴发性出血病的治疗与思考[J]. 科学养鱼, 2017(4): 71-72. |
| [17] |
Xiao N, Kong LY, Zhou H, et al. Isolation and identification of Citrobacter freundii from diseased Procambarus clarkii and its antibiotics susceptibility and adhesion characteristics[J]. Journal of Fisheries of China, 2016, 40(6): 946-955. (in Chinese) 肖宁, 孔令严, 周昊, 等. 克氏原螯虾病原弗氏柠檬酸杆菌的分离鉴定及其药敏与黏附特性[J]. 水产学报, 2016, 40(6): 946-955. |
| [18] |
Toranzo AE, Barja JL, Potter SA, et al. Molecular factors associated with virulence of marine vibrios isolated from striped bass in Chesapeake Bay[J]. Infection and Immunity, 1983, 39(3): 1220-1227. |
| [19] |
Cao J, Ma L, Zhang WC, et al. Identification of Vibrio alginolyticus isolated from large yellow croaker (Pseudosciaena crocea) and generation of V. alginolyticus ghosts[J]. Microbiology China, 2018, 45(1): 129-137. (in Chinese) 曹际, 马林, 张文畅, 等. 大黄鱼源溶藻弧菌的鉴定及其菌蜕制备[J]. 微生物学通报, 2018, 45(1): 129-137. |
| [20] |
Weisburg WG, Barns SM, Pelletier DA, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 173(2): 697-703. DOI:10.1128/jb.173.2.697-703.1991 |
| [21] |
Pál Z, Urbán E, Dósa E, et al. Biofilm formation on intrauterine devices in relation to duration of use[J]. Journal of Medical Microbiology, 2005, 54(12): 1199-1203. DOI:10.1099/jmm.0.46197-0 |
| [22] |
Watnick PI, Kolter R. Steps in the development of a Vibrio cholerae El Tor biofilm[J]. Molecular Microbiology, 1999, 34(3): 586-595. DOI:10.1046/j.1365-2958.1999.01624.x |
| [23] |
Stepanović S, Vuković D, Dakić I, et al. A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J]. Journal of Microbiological Methods, 2000, 40(2): 175-179. DOI:10.1016/S0167-7012(00)00122-6 |
| [24] |
Joseph SW, Carnahan AM, Brayton PR, et al. Aeromonas jandaei and Aeromonas veronii dual infection of a human wound following aquatic exposure[J]. Journal of Clinical Microbiology, 1991, 29(3): 565-569. |
| [25] |
Han JW, Luo W, Zheng DH. Isolation, identification and drug sensitive tests of Aeromonas sobria from sick Pelteobagrus Fulvidraco[J]. Journal of Shaoxing University, 2011, 31(9): 19-21. (in Chinese) 韩继卫, 罗文, 郑大恒. 黄颡鱼温和气单胞菌的分离鉴定与药敏试验[J]. 绍兴文理学院学报, 2011, 31(9): 19-21. DOI:10.3969/j.issn.1008-293X.2011.09.006 |
| [26] |
Jefferson KK. What drives bacteria to produce a biofilm?[J]. FEMS Microbiology Letters, 2004, 236(2): 163-173. DOI:10.1111/j.1574-6968.2004.tb09643.x |
| [27] |
Qin YX, Yan QP, Mao XX, et al. Role of MshQ in MSHA pili biosynthesis and biofilm formation of Aeromonas hydrophila[J]. Genetics and Molecular Research, 2014, 13(4): 8982-8996. DOI:10.4238/2014.October.31.13 |
| [28] |
Zhang HY. Screening of differential proteins between biofilm and planktonic cells and construction of glpD gene mutant of Aeromonas veronii[D]. Changchun: Master's Thesis of Jilin Agricultural University, 2017 (in Chinese) 张海月.维氏气单胞菌浮游态和生物被膜态差异蛋白的筛选及ΔglpD的构建[D].长春: 吉林农业大学硕士学位论文, 2017 |
| [29] |
Kozlova EV, Popov VL, Sha J, et al. Mutation in the S-ribosylhomocysteinase (luxS) gene involved in quorum sensing affects biofilm formation and virulence in a clinical isolate of Aeromonas hydrophila[J]. Microbial Pathogenesis, 2008, 45(5/6): 343-354. |
| [30] |
Lynch MJ, Swift S, Kirke DF, et al. The regulation of biofilm development by quorum sensing in Aeromonas hydrophila[J]. Environmental Microbiology, 2002, 4(1): 18-28. |
| [31] |
Ganesh PS, Rai VR. Attenuation of quorum-sensing-dependent virulence factors and biofilm formation by medicinal plants against antibiotic resistant Pseudomonas aeruginosa[J]. Journal of Traditional and Complementary Medicine, 2018, 8(1): 170-177. DOI:10.1016/j.jtcme.2017.05.008 |
 2019, Vol. 46
2019, Vol. 46