扩展功能
文章信息
- 张玲, 张丽杰, 徐岩
- ZHANG Ling, ZHANG Li-Jie, XU Yan
- 耐高渗豆瓣酱内源易致腐败微生物鲁氏接合酵母的鉴定及控制策略
- Identification and effective control of velum-forming Zygosaccharomyces rouxii for preventing spoilage of soybean paste
- 微生物学通报, 2019, 46(12): 3312-3324
- Microbiology China, 2019, 46(12): 3312-3324
- DOI: 10.13344/j.microbiol.china.190113
-
文章历史
- 收稿日期: 2019-02-19
- 接受日期: 2019-04-29
- 网络首发日期: 2019-05-15
豆瓣酱是一种红褐色、带有油润光泽、粘稠适度的半固态调味品,因其浓郁的酱酯香及鲜亮的红润色泽,不仅成为各地菜式、小吃重要的调味佳品,更是大众消费者的家庭常见佐餐调料。中国国内传统酿造的豆瓣酱是由黄豆、面粉及盐为原料,经过长期发酵而成[1]。发酵过程主要分为两步:制曲和酱醪发酵。首先,将米曲霉接种到蒸熟的脱脂豆粕上并发酵40−48 h,制成曲料;然后将曲料与高浓度盐水混合,日晒夜露不少于3个月时间,经过适度高温杀菌后灌装,送上消费者餐桌[1]。
即使经过高温灭菌,部分上架豆瓣酱产品仍出现腐败迹象,即表面出现不同程度的白点(或白膜),且伴随有轻微不愉快气味,不仅降低了产品质量,给企业造成重大经济损失,也严重影响了消费者的食用安全。为避免出现腐败现象,酱类生产厂家除对发酵完毕的豆瓣酱进行瞬时或短时高温灭菌外,出厂前另添加化学防腐剂,如山梨酸钾、苯甲酸钠等以维持货架期菌群数量符合标准。随着人们生活水平的日益提高,消费者的食用需求也在发生变化,更倾向于食用既安全又无添加或少添加防腐剂的食品。生物基化学品是指利用可再生资源,如谷物、木质纤维素等为原料,经过微生物发酵产生的化合物,这类化合物因利用自然界原料,以生物方式产生,被认定为自然类似(Nature-identical)化合物[2]。因此,解析豆瓣酱腐败性白点微生物种属及来源,并开发针对性的生物基化合物添加控制办法具有重大的科学及应用价值。
鲁氏接合酵母(Zygosaccharomyces rouxii)一直被认为是酱类等高氮发酵产品发酵过程中重要的内源性产香菌种。有研究表明,在发酵过程中,鲁氏接合酵母可以积累HEMF[4-羟基-2(或5)乙基-5(或2)-甲基-3-(2氢)-呋喃酮]、HDMF [4-羟基-2, 5-二乙基-3-(2氢)-呋喃酮]等高氮发酵产品的重要风味化合物,且被证明与4-乙基愈创木酚、乙酸乙酯、α-酮异戊酸脂、α-酮异己酸酯等其他多种香气化合物的形成有关[3-5]。然而鲁氏接合酵母不同亚种及不同发酵条件之间的发酵特性并不相同,且发酵过程中的优势特性,如耐低pH、低水活度、高渗透压(高盐或高糖)、耐短时高温(鲁氏接合酵母可进行形成子囊孢子的有性生殖,其产孢性能又可赋予该菌种耐受短时高温的能力)可能会为发酵结束后的微生物控制增加难题。
鲁氏接合酵母分为产膜性鲁氏接合酵母及非产膜性鲁氏接合酵母。非产膜性鲁氏接合酵母在发酵过程中起到生香作用,而产膜性鲁氏接合酵母可在静止的酱醪表面形成白膜,产生轻微不良气味[6]。早在2006年已有研究表明,相对于非产膜性酵母,在基因水平上,产膜性酵母的FLO11基因启动子有111 nt的缺失(抑制因子区域);另外,外显子区域有多个编码疏水性FLO11蛋白基因的串联重复[7]。FLO11基因受高渗透压诱导表达,其表达产物是一种细胞表面糖蛋白[8],暴露在细胞膜外,增加细胞的疏水性。因此,产膜性酵母基因水平的两大突变导致细胞获得更大表面张力漂浮至液面,在气液界面形成白点或白膜[9-12]。事实上,FLO11基因的高效表达并非是酵母菌产白膜的充分条件,比如Zara等[13]研究表明,酵母菌的模式菌株酿酒酵母在无氧条件下,细胞不饱和脂肪酸及麦角甾醇相关基因无法表达,细胞膜不完整,因此细胞存活度大大降低,不会产生白膜。
在本研究中,针对豆瓣酱出现的腐败性白点问题,首先挑取白点进行微生物筛选,接着对筛选得到的微生物进行显微观察、分子生物学、生理生化鉴定及系统进化分析,发现豆瓣酱中白点污染微生物只有一种,即为鲁氏接合酵母。鲁氏接合酵母产生的孢子具有在短时高温情况下仍有存活能力且可耐受高渗透等特性,成为豆瓣酱内源性易致腐败微生物。结合文献查阅及实验验证,确定豆瓣酱白点物质实际为小面积白膜,由微生物产生的生物膜组成,并优化得到两种不添加非生物基防腐剂的可有效抑制豆瓣酱白点产生的方法,该方法以期为豆瓣酱等高氮发酵产品的储存和安全食用提供新的思路。
1 材料与方法 1.1 材料白点污染的豆瓣酱由国内某豆瓣厂提供;色谱级乙醇购自Sigma-Aldrich公司;分析纯乳酸、乙醇、2, 3-丁二醇等购自国药集团化学试剂有限公司;氮源基础培养基购于北京索莱宝科技有限公司;酵母总RNA快速抽提试剂盒、无RNA酶耗材、焦碳酸二乙酯(DEPC)等购自生工生物工程(上海)股份有限公司;qPCR试剂盒AceQⓇ qPCR SYBR Green Master Mix及反转录试剂盒HiScriptⓇ Ⅲ RT SuperMix购自Vazyme Biotech公司。
电泳凝胶定量分析系统购自ProteinSimple公司;冷场发射扫描电子显微镜HITACHI SV8220购自日立高新技术公司;电镜样品预处理中使用的离子溅射仪ACE-600及临界点干燥仪CPD-300购自LEICA公司;PCR仪、荧光定量PCR仪购自Bio-Rad公司。
YPD培养基(g/L):酵母提取物10.0,蛋白胨20.0,葡萄糖20.0。
1.2 豆瓣酱白点的显微观察用无菌接种环取出部分白点,溶解于适当体积的无菌生理盐水中,漩涡振荡,吸取白点溶解液滴加在无菌载玻片上并在显微镜下观察,物镜放大倍数为60倍。
1.3 微生物分离与纯化用无菌接种环取出部分豆瓣酱白点于10 mL无菌生理盐水中,漩涡振荡制成菌悬液,将菌悬液进行梯度稀释并涂布到含18% NaCl的YPD培养基上,30 ℃培养5 d,挑取单菌落并继续釆用平板划线法进行菌种纯化。
1.4 豆瓣酱腐败性白点微生物菌种鉴定 1.4.1 菌体培养特征、形态观察及生理生化特征测定将筛选菌种接种到含18% NaCl的YPD固体培养基和液体培养基上,于30 ℃静置培养4−5 d后观察固体菌落形态和液体培养特征,每组实验3个平行。为检测筛选菌种的碳源利用能力,接种腐败性白点微生物至500 mL生理盐水中制成菌悬液,并与氮源基础培养基混合后倒入培养皿中,将待测碳源化合物有规则地放置到培养皿的表面[14],于30 ℃培养,每隔2 d观察生长情况,持续20 d,观察碳源同化能力,每组实验3个平行。
1.4.2 分子生物学鉴定取1 mL菌液以4 000 r/min离心2 min得到细胞沉淀,去上清,用1 mL无菌水清洗菌体2次。苯酚氯仿抽提法提取酵母全基因组[15],以酵母全基因组为模板,以ITS1 (5′-GCATATCAATAAGCGGA GGAAAAG-3′)和ITS4 (5′-GGTCCGTGTTTCAAG ACGG-3′)为引物进行ITS序列扩增。PCR体系(50 μL):Taq Plus PCR Master Mix 25 μL,模板(50 ng/μL) 5 μL,正、反向引物(10 μmol/L)各1 μL,ddH2O 18 μL。PCR反应条件:98 ℃ 3 min;98 ℃ 30 s,55 ℃ 15 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。将克隆得到的ITS序列送基因测序公司(Vazyme Biotech)测序,测序结果进行NCBI BLAST比对。
1.4.3 FLO11、ACS2、BTN2基因的克隆以从豆瓣酱白点中筛选到的鲁氏接合酵母基因组为模板,分别以FLO11-F/FLO11-R、ACS2-F/A CS2-R、BTN2-F/BTN2-R为引物(序列见表 1)克隆FLO11、ACS2、BTN2基因。PCR体系同1.4.2。PCR反应条件:98 ℃ 3 min;98 ℃ 30 s,55 ℃ 15 s,72 ℃ 1−5 min,30个循环;72℃ 10 min。
| Primers name | Primers sequence (5′→3′) |
| FLO11-F | TTCCAGCTTGACAAACGCCT |
| FLO11-R | TGTTGAAGCGTAGAAGTTCGGT |
| ACS2-F | TAGTAGCTCGTCATGCACCTG |
| ACS2-R | AACAGCTGCAATGATACCTGGA |
| BTN2-F | CAAGCATGTTCATGGACCCC |
| BTN2-R | GAACCGGTTGACCTCTTCGT |
将克隆得到的FLO11、ACS2、BTN2基因送南京诺唯赞生物科技有限公司测序,将测序所得基因拼接序列翻译为蛋白序列,在NCBI上进行蛋白同源性比对分析,并下载相似性超过30%的蛋白序列。用ClustalX软件将下载得到的蛋白序列进行全序列比对,并利用MEGA 5.0软件的邻位连接法(Neighbor-Joining method)对选择的序列进行1 000次步长计算,构建系统发育树。
1.4.5 腐败性白点微生物的重新接种将筛选得到的菌种接种到含18% NaCl的YPD培养基中,于30 ℃、180 r/min振荡培养5 d。将培养后的菌种按0.1% (体积比)接种量接入新鲜的豆瓣酱中,并设置同体积空白YPD培养基接入作为对照,于室温下放置8−9 d,并观察豆瓣酱产膜情况。每组实验3个平行。
1.4.6 腐败性白点微生物的耐热性评价将微生物于YPD培养基中培养5 d,发酵结束后收菌,用生理盐水将菌体清洗2次,并制成105 CFU/mL的菌悬液。将菌悬液分别在60、70、80、90、100 ℃水浴中处理20 min,并将处理过的菌种按0.1% (体积比)接种量接种至高温(60–100 ℃)处理培养:将热处理后的菌液重新接入新鲜的含18% NaCl的YPD培养基中,以无菌培养基作为空白对照接入,于30℃振荡培养5 d,观察试管生长情况。
1.5 污染性白点的控制 1.5.1 隔绝氧气将市售的不添加防腐剂的豆瓣酱倒在培养皿中,接入80 ℃热处理20 min的产膜性鲁氏接合酵母D8,搅拌均匀后,将实验平板放在厌氧盒中,对照平板放在有氧条件下,于室温下静置培养30 d,每种处理3个平行。另外将热处理后的产膜性鲁氏接合酵母D8接种至无白点的豆瓣酱中,实验组充高纯氮气2 s,置于蓝盖瓶中;对照试验设置为充压缩空气2 s,于室温下静置培养30 d,每组试验3个平行,以研究模拟豆瓣酱出厂前处理以验证控氧处理的有效性。
1.5.2 添加生物基化合物将市售的不添加防腐剂的豆瓣酱倒在培养皿中,接入80 ℃热处理20 min的产膜鲁氏接合酵母D8,并添加不同浓度的乙醇(0.5%、1%、1.5%、2%)、0.5%甘油、0.5% 2, 3-丁二醇、0.5%乳酸,搅拌均匀后于室温下静置培养,每种处理3个平行。
1.6 电镜分析采用冷场发射扫描电子显微镜对豆瓣酱白点的结构进行进一步分析。首先将样品用5%戊二醛固定,然后用0.1 mol/L磷酸缓冲液漂洗数次,再用30%、50%、70%、90%、100%乙醇梯度脱水,在室温临界点干燥后,经过离子溅射用冷场发射扫描电镜观察。
1.7 FLO11、ACS2、BTN2转录水平的检测用生理盐水将D8稀释涂布于以下平板:A:含18% NaCl的YPD平板(无氧培养);B:含18% NaCl和2%生物基乙醇的YPD平板(有氧培养);C:含18% NaCl的YPD平板(有氧培养)。其中C组为对照组,每种处理3个平行,并保证接种量等其他条件相同。在30℃培养4−5 d后,用生理盐水将D8从平板上洗脱,4 000 r/min离心2 min收集菌体,根据酵母总RNA提取试剂盒提取RNA。RNA提取后检测浓度,逆转录反应时保证所有体系的RNA浓度相同。将逆转录产物cDNA以10倍梯度稀释,并以合适浓度添加到qPCR反应体系中,检测FLO11、ACS2、BTN2在不同条件下的转录水平。qPCR引物如表 2所示,其中18S rRNA基因为内参基因。qPCR反应体系(20 μL):SYBR Green Master Mix 10 μL,模板2 μL,正、反向引物(10 μmol/L)各0.5 μL,ddH2O 7 μL。qPCR反应条件:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。根据2−ΔΔCT方法分别对不同条件下FLO11、ACS2、BTN2转录水平进行相对定量。
| Primers name | Primers sequence (5′→3′) |
| FLO11-F (RT) | TGTGAAGAGACTTGTGGACAG |
| FLO11-R (RT) | GCGTAGAAGTTCGGTAAAGCG |
| BTN2-F (RT) | TGGTGTGGCGAAGGAATTTG |
| BTN2-R (RT) | CTCTGGAGCCTGTACATC |
| ACS2-F (RT) | GACGTGGAAGGTGTTTTGGC |
| ACS2-R (RT) | CTACCTGCACCATCACCTGT |
| 18S rRNA-F | TTTAAAGGCGTCTGTCCC |
| 18S rRNA-R | AGTTCGCTGCGTTCTTCATC |
取自然形成的豆瓣酱白点溶解于无菌生理盐水中,取微量已溶解豆瓣酱白点的生理盐水滴在无菌载玻片中,轻轻盖上盖玻片,置于普通光学显微镜下观察。如图 1所示,在60倍物镜放大的显微视野下,观察到数目众多、形态相似、可移动的圆形显微颗粒,根据颗粒物形态规则性及可移动性,推测这种可运动的圆形显微颗粒是一种微生物。结合已研究的豆瓣酱酿造微生物种类及颗粒大小,推测可能是酵母,即豆瓣酱白点可能是一种真菌污染。

|
| 图 1 豆瓣酱白点形态 Figure 1 White pellicle in soybean paste 注:A:豆瓣酱中白点形态;B:光学显微镜视野下白点的显微形态. Note: A: Morphology of white pellicle in soybean paste; B: Microscopic morphology of white pellicle under light microscope. |
|
|
取适量豆瓣酱白点溶解至无菌生理盐水中,将溶解液梯度稀释涂布至含18% NaCl的YPD培养基上,经过5 d培养后分离得到28株菌。如图 2A及2C所示,D1−D18在含18% NaCl的YPD平板上的菌落呈圆形,乳白色,表面干燥,且在含18% NaCl的YPD液体培养基培养时表面产生白膜;而A1−A10在18% NaCl的YPD培养基上菌落呈圆形,乳白色,表面较湿润,在18% NaCl的YPD培养基上表面未产生白膜(图 2B及2C)。

|
| 图 2 白点中微生物的分离与鉴定 Figure 2 Isolation and identification of microorganisms from the white pellicle 注:A:产白膜菌株的固体菌落形态(D1−D18);B:不产白膜菌株的固体菌落形态(A1−A10);C:筛选菌株的液体培养形态. Note: A: Colonial morphology of white-pellicle-selected strains D1−D18; B: Colonial morphology of white-pellicle-selected strains A1−A10; C: Liquid culture of white-pellicle-selected strains. |
|
|
将以上白点分离菌种D1−D18、A1−A10进行菌种培养及全基因组提取。分别以全基因组为模板,克隆各菌种ITS序列,将菌种的ITS测序结果进行BLAST序列比对,结果显示菌株D1−D18、A1−A10均为鲁氏接合酵母。随机挑选菌种D6、D8、D10、D13、A1及A2,构建基于ITS序列的系统发育进化树。如图 3所示,产膜菌株D6、D8、D10、D13与多株Zygosaccharomyces rouxii的ITS序列相似性高达100%,并与KY110253.1、FN431892.1、KY110261.1、KY110259.1、LN849112.1、AM943657.1序列的亲缘关系最近,位于系统发育树的同一分支;而非产膜菌株A1、A2与另一株Z. rouxii序列位于系统发育树的另一分支,更进一步表明白点污染性菌种可能均为鲁氏接合酵母,且产膜性的D菌种系列为产膜性鲁氏接合酵母,而非产膜性的A菌种系列为非产膜性鲁氏接合酵母。

|
| 图 3 基于筛选菌株的ITS序列构建系统发育进化树 Figure 3 Phylogenetic tree of partial selected strains based on ITS sequences 注:节点上的数字表示步长;括号中的数字表示序列号;1%比例尺表示序列分歧度. Note: Numbers at the nodes represented the bootstrap values and the numbers in parentheses represented the accession numbers of these sequences. The scale bar indicated 1% sequence divergence. |
|
|
为进一步确定污染菌种种属,随机挑选D8菌种为例进行碳源同化实验。如表 3所示,D8菌株能代谢麦芽糖、半乳糖、蔗糖、甘油、赤藓糖醇、阿拉伯糖多种碳源,可在含有60%葡萄糖的培养基上生长。综合《酵母菌的特征与鉴定手册》[14]中鲁氏接合酵母的生理生化描述,以及ITS序列比对和系统进化树分析,最终确定豆瓣酱白点污染菌种为鲁氏接合酵母。
| Carbon source | Assimilation |
| 60% Glucose | + |
| Lactose | − |
| Maltose | + |
| Galactose | + |
| Ribose | − |
| Ribitol | − |
| Erythritol | + |
| Arabinose | + |
| Xylose | − |
| Sorbose | − |
| Glycerinum | + |
| Raffinose | − |
| Saccharose | + |
| Cellose | − |
| Starch | − |
| Mycose | − |
| Note: +: Positive (growth or reaction); –: Negative (no growth or no reaction). | |
随机挑选筛选得到的鲁氏接合酵母D8接种至新鲜豆瓣酱,以无菌YPD培养基接种至同批豆瓣酱作为对照,室温下放置8−9 d后,发现接种鲁氏接合酵母的豆瓣酱表面生成严重白点(图 4),而接种无菌YPD培养基的豆瓣酱没有白点产生,因此确定豆瓣酱中污染性白点是由产膜性鲁氏接合酵母过度繁殖产生。

|
| 图 4 产膜性鲁氏接合酵母的接种导致豆瓣酱产生白点 Figure 4 Verification the source of white pellicle by inoculating Z. rouxii into soybean paste |
|
|
豆瓣酱出厂前会经过短时高温灭菌,但仍然有污染性白点产生,猜测可能是由产膜性鲁氏接合酵母的子囊孢子萌发形成[16]。如图 5所示,模拟豆瓣酱的企业短时高温灭菌程序,将处于对数生长期的产膜性鲁氏接合酵母D8分别经60−100 ℃高温处理20 min后,接种到新鲜的含18% NaCl的YPD培养基中,30 ℃振荡培养5 d,试管呈浑浊状态。暗示产膜性鲁氏接合酵母即使经过高温处理仍可存活。因此,短时高温并不能完全杀灭产膜性鲁氏接合酵母,在营养刺激下其子囊孢子仍能萌发繁殖,这可能是鲁氏接合酵母成为豆瓣酱内源性易致腐败微生物的重要原因。

|
| 图 5 产膜性鲁氏接合酵母经高温处理后生长 Figure 5 Z. rouxii can grow after high temperature treatment |
|
|
经短时高温处理后,子囊孢子形式的鲁氏接合酵母繁殖形成豆瓣酱污染性白点需要经过3个步骤:孢子萌发→菌株繁殖→生物膜形成。正确解析各步骤分子机制并形成针对性控制策略,可望在不添加或少添加防腐剂的情况下实现豆瓣酱发酵后的污染性菌种控制。
酿酒酵母作为酵母菌的模式菌种,相比鲁氏接合酵母,其孢子萌发→菌种繁殖→生物膜产生相关机制的研究更为深入。首先,有文献报道,在酵母菌中,子囊孢子萌发首先通过中性海藻糖酶降解孢子壁的海藻糖,然后代谢葡萄糖等营养物质以及蛋白质的折叠和转运来进行生物合成[17]。当孢子壁被局部降解后,子囊孢子开始受到一系列转录因子的调控,首先Hsf1和Sok2-Yap6-Phd1被诱导表达,紧接着核糖体基因(Fhl1、Sfp1、Rap1)和相关生物合成基因(Gcn4、Bas1、Leu3、Dal81等)持续表达,孢子囊得以萌发[18]。其次,萌发后的酵母菌开始繁殖,脂质是酵母菌繁殖过程中细胞膜形成的必要成分,ACS2参与酵母中脂质和麦角甾醇的合成,而氧气对于维持ACS2酶活性必不可少。当营养缺乏时(表现为低葡萄糖),繁殖后的酵母菌FLO11基因受渗透压诱导表达,在气液界面形成白膜[13]。因此,控制氧气含量可有效降低酵母菌繁殖,从而抑制腐败性白点产生。
若鲁氏接合酵母中的微生物繁殖与白膜产生机理与酿酒酵母相同或相似,控制灌装产品的氧气含量可能会抑制酵母生长,并进一步抑制白点产生。因此,本研究分别克隆鲁氏接合酵母中的FLO11与ACS2基因并测序,将测序结果进行蛋白序列BLAST比对,并将比对结果中蛋白相似性超过30%的序列构建进化树。如图 6所示,蛋白FLO11、ACS2与酿酒酵母中蛋白相似性分别约为64%、83%,且在进化树上与酿酒酵母处于同一分支,推测控制氧气含量可能会抑制白点产生。
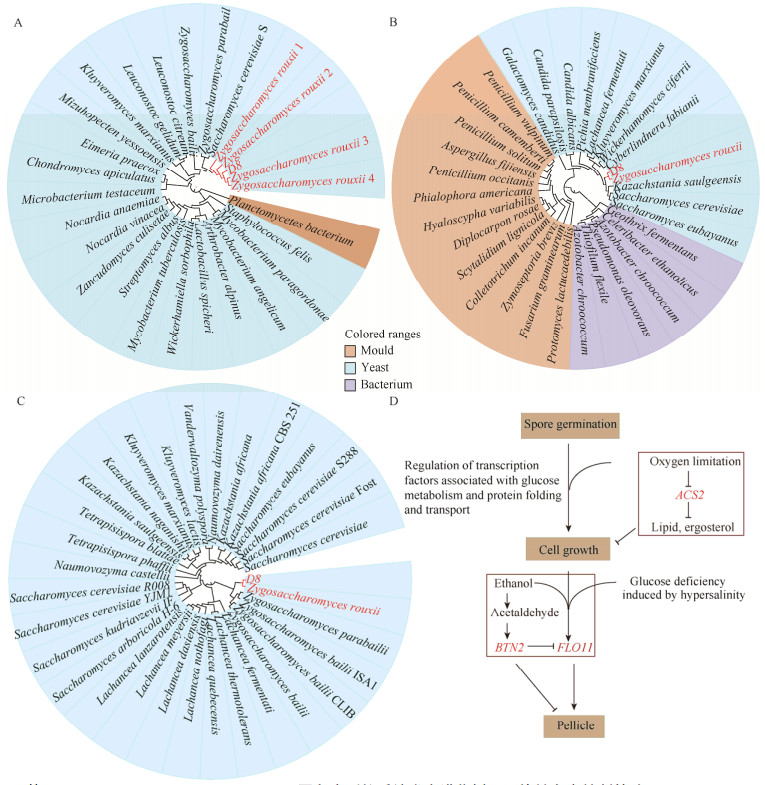
|
| 图 6 基于FLO11 (A)、ACS2 (B)、BTN2 (C)蛋白序列的系统发育进化树及污染性白点控制策略(D) Figure 6 Phylogenetic tree based on the FLO11 (A), ACS2 (B) and BTN2 (C) protein sequences and the control strategy of white pellicle (D) |
|
|
本研究首先验证氧气控制对豆瓣酱白点控制的影响。将热处理过(80℃处理20 min)的鲁氏接合酵母涂布到含18% NaCl的YPD培养基上,如图 7A所示,在有氧条件下培养5 d后,培养基布满白膜;而厌氧条件下培养30 d,仍没有白膜产生。光学显微镜下观察,鲁氏接合酵母的子囊孢子很快萌发、繁殖,但是在无氧条件下培养的鲁氏接合酵母数目明显较少,说明隔绝氧气可以大大降低甚至抑制产膜性鲁氏接合酵母的繁殖,与Abbas等研究一致[19]。另外,本研究模拟豆瓣酱出厂前处理以验证控氧处理的有效性,豆瓣酱常温下放置30 d后,发现未充氮气的蓝盖瓶中豆瓣酱生成白点严重,而充氮气的豆瓣酱中未产生白点(图 7B)。将有氧条件下产白点的豆瓣酱与无氧条件下未产白点的豆瓣酱置于电子显微镜下观察,发现产白点的豆瓣酱中富含酵母,且酵母表面有明显的膜状粘性物质(图 7C),而未产白点的豆瓣酱中酵母含量明显较低,且酵母表面光滑(图 7D)。因此表明通过限制氧气含量可以实现豆瓣酱中白点的有效控制。

|
| 图 7 限制氧气含量对污染性白点的控制 Figure 7 The control strategy of white pellicle in soybean paste by oxygen limitation 注:A:耗氧或厌氧状态下培养的豆瓣酱形态(0 d);B:耗氧或厌氧状态下的豆瓣酱形态(30 d);C:耗氧放置30 d后豆瓣酱的显微形态;D:厌氧放置30 d后豆瓣酱的显微形态;E、F:限制氧气时ACS2和FLO11的转录水平. Note: Morphology of soybean paste which was cultured at aerobic or anaerobic condition at 0 day (A) or at 30 days (B); C: Microscopic morphology of soybean paste which was cultured at aerobic condition at 30 days; D: Microscopic morphology of soybean paste which was cultured at anaerobic condition at 30 days; E and F: Transcriptional level of ACS2 and FLO11 of Z. rouxii cultured under anaerobic condition. |
|
|
为进一步验证其分子机制,对有氧及无氧条件下Z. rouxii中ACS2和FLO11的转录水平进行分析。图 7E为反转录后的cDNA,然后利用qPCR法,以18S rRNA为内参基因,根据2−ΔΔCT方法[20]计算不同条件下ACS2和FLO11的相对表达量。如图 7F所示,在无氧条件下,ACS2、FLO11的转录水平分别为有氧条件下的21.92%、1.96%,说明氧气含量限制可以明显抑制ACS2和FLO11表达。结合文献[13]的报道,暗示在鲁氏接合酵母培养过程中,限制氧气可能降低脂质合成,进而降低酵母繁殖速率,降低糖蛋白产生速率,从而实现豆瓣酱白点防控。
2.3.2 生物基乙醇的加入可抑制豆瓣酱白点产生无氧或低氧处理的豆瓣酱虽可实现货架期间白点的有效防控,可一旦消费者打开食用,就难以在生活条件下实现豆瓣酱包装罐内的氧气含量控制。因此,本工作继续研究豆瓣酱白点的其他控制方法。本研究探究自然类似化合物的添加对豆瓣酱白点是否有抑制作用。因实验用生物基化合物获取有难度,采用色谱纯或分析纯化学品替代加入。如图 8A所示,分别将0.5%乙醇、2, 3-丁二醇、甘油、乳酸添加入豆瓣酱中,经过10 d发酵,仅0.5%的乙醇对白点有明显抑制作用;当乙醇浓度提高至2%时,豆瓣酱白点被完全抑制(图 8B),暗示2%生物基乙醇对豆瓣酱白点可能有针对性控制作用。乙醇本身为豆瓣酱自然发酵产物,经2%乙醇处理过的豆瓣酱经品尝对豆瓣酱口感无影响,因此工业上2%生物基乙醇的添加有望作为豆瓣酱白膜的重要防控办法。

|
| 图 8 添加生物基乙醇对污染性白点的控制 Figure 8 The control strategy of white pellicle in soybean paste by adding ethanol 注:A:不同生物基化合物对白点的控制;B:不同生物基乙醇浓度对白点的控制;C、D:生物基乙醇对BTN2和FLO11转录的影响. Note: A: The control of bio-compounds on white pellicle; B: The control of bioethanol on white pellicle; C and D: Transcriptional level of BTN2 and FLO11 of Z. rouxii under the treatment of bioethanol. |
|
|
根据文献[21]报道,乙醇脱氢酶催化乙醇生成乙醛,而乙醛会促进蛋白转运调控因子编码基因BTN2的转录,后者进一步抑制FLO11转录。本研究中,在YPD培养基中加入2%乙醇后培养鲁氏接合酵母D8,提取RNA反转录为cDNA后,测定2%乙醇添加后的BTN2及FLO11转录量(以18S rRNA为内参基因) (图 8C)。如图 8D所示,发现加入乙醇后BTN2及FLO11的转录水平分别为对照组的406.83%及21.22%,说明添加乙醇可以促进BTN2转录并同时抑制FLO11转录。暗示在鲁氏接合酵母中,2%乙醇添加后可能降解为乙醛,乙醛促进BTN2的表达,后者抑制FLO11的表达,从而抑制酵母产膜。
3 讨论与结论早在2005−2008年,雷宏杰等就对豆瓣酱中白点物质(有时呈现白色片状)进行了分析:在显微镜下观察,白点物质呈现针状结晶体,对白点进行菌种培养及氨基酸分析,发现豆瓣酱中白点物质为大量酪氨酸和少量苯丙氨酸的结晶[22];耿予欢等分析白点物质产生原因,可能是原料面粉中一些蛋白质未被彻底分解而与酱油中部分游氨基酸混合而沾附在黄豆表面,在盐水浸泡下变成较硬的、难溶解的白点物质[23]。之后豆瓣酱行业对出现的豆瓣酱白点物质即为氨基酸结晶形成共识。本研究中出现的豆瓣酱白点呈现白色不规则较软形态,与之前报道明显不同。将白点溶解液放在显微镜下观察,发现白点是一种能运动的圆形物,而且形态相似、数目众多。经过微生物分离、分子生物学鉴定、生理生化鉴定以及系统进化分析,发现白点物质可能是一类可以产膜的鲁氏接合酵母。因此,对豆瓣酱中出现的白点物质,要结合白点具体形态及豆瓣酱制作流程具体分析。
因鲁氏接合酵母对温度、酸度、渗透压的高耐受性,不仅本研究中的豆瓣酱,已有报道发现它是其他高氮发酵食品如酱油、鱼酱等,以及高渗食品如蜜饯、果汁等的主要腐败微生物[24-25]。例如酱油在高温灭菌压榨灌装前短时存放时,经常会出现白膜,就有可能为产膜性鲁氏接合酵母孢子萌发及过度繁殖所致。以鲁氏接合酵母为代表的产膜酵母过度繁殖产膜,不仅会产生异味,为生产厂家造成重大经济损失,也不排除腐败酵母会产生有害物质从而危害食品安全的可能。除添加山梨酸钠等弱酸性食品添加剂,近些年有科学家研究报道如何控制产膜性酵母菌的腐败问题,如进一步提高食品酸度及糖浓度[25],添加含抑菌功能类黄酮的植物(Desmodium caudatum)提取物[26],添加酶合成的月桂酰葡萄糖[27]等,但因缺乏对酵母菌经巴氏灭菌后孢子萌发、繁殖、产膜等分子机制的深入解析,控制策略有效性并不确定,且仅限于研究水平。
酿酒酵母是酵母菌的模式菌种,近些年大部分关于酵母菌孢子萌发→繁殖→产膜相关机制研究均以酿酒酵母为研究对象。为了克服不利于生长的条件,产膜酿酒酵母常常表现出许多适应性反应,如丝状结构、侵入性生长、絮凝和生物膜形成[28]。FLO (絮凝)基因家族在这些适应性反应中起着关键作用,例如在酿酒酵母中有5个FLO基因:FLO1、FLO5、FLO9、FLO10和FLO11[29-32]。在营养缺乏的情况下,酿酒酵母的FLO11基因受高渗透压诱导表达,在液体表面生成白膜。另外,生物膜的形成是一种氧化代谢[33-34],氧气对于生物膜的形成[35]以及维持产膜性酿酒酵母的脂质合成是必不可少的,其中ACS2是乙酰辅酶合成酶2,参与酿酒酵母脂质和麦角甾醇的合成。本研究中发现的豆瓣酱污染菌种——产膜性鲁氏接合酵母,通过比对生物膜合成关键蛋白FLO11及ACS2,发现该菌种的FLO11及ACS2两种蛋白与酿酒酵母处于同一分支,因此细胞产膜及繁殖调控机制可能与酿酒酵母相同。通过转录水平的分析,当限制氧气含量时,ACS2和FLO11的转录水平分别只有对照组的21.92%及1.96%,暗示氧气含量限制可能会阻止酵母细胞中脂质和麦角甾醇的合成,减慢酵母细胞生长速度,从而能有效实现豆瓣酱白点生成防治。Espinazo-Romeu等[21]发现BTN2是酿酒酵母中蛋白质转运的关键调控因子,添加乙醛能促进酿酒酵母中BTN2的表达,当BTN2高效表达时,FLO11表达降低,但是当BTN2缺失时,FLO11的表达也会增加,促进酿酒酵母产膜。在本研究中,添加乙醇的实验组中BTN2的转录水平是对照组的406.83%,而FLO11的转录水平是对照组的21.22%,当在豆瓣酱中添加2%乙醇时会有效抑制白点生成。
针对短时高温灭菌未添加防腐剂的豆瓣酱上架后出现腐败性白点问题,本文首先通过显微镜观察、微生物筛选、鉴定及重新接种,确认豆瓣酱白膜实质为一种微生物——产膜性鲁氏接合酵母过度繁殖所致。通过分析产膜性酵母的孢子萌发、繁殖及产膜分子机制,制定了两种针对产膜酵母的非防腐剂添加的微生物防治方法,有效实现了豆瓣酱腐败性白点防控,同时也为其它高渗食品如蜜饯、果汁的防腐提供参考。
| [1] |
Zhu LJ, Fan ZH, Kuai H, et al. Batch-batch stable microbial community in the traditional fermentation process of huyumei broad bean pastes[J]. Letters in Applied Microbiology, 2017, 65(3): 226-233. DOI:10.1111/lam.12765 |
| [2] |
Jiang LL, Zhou JJ, Wang XD, et al. Progress in chemicals production by microbial consortia[J]. Chinese Journal of Biotechnology, 2016, 32(11): 1496-1506. (in Chinese) 姜莉莉, 周瑾洁, 王旭东, 等. 微生物菌群发酵生产化学品的研究进展[J]. 生物工程学报, 2016, 32(11): 1496-1506. |
| [3] |
van der Sluis C, Wolken WAM, Giuseppin MLF, et al. Effect of threonine, cystathionine, and the branched-chain amino acids on the metabolism of Zygosaccharomyces rouxii[J]. Enzyme and Microbial Technology, 2000, 26(2/4): 292-300. |
| [4] |
Cao XH, Hou LH, Lu MF, et al. Genome shuffling of Zygosaccharomyces rouxii to accelerate and enhance the flavour formation of soy sauce[J]. Journal of the Science of Food and Agriculture, 2010, 90(2): 281-285. DOI:10.1002/jsfa.3810 |
| [5] |
Uehara K, Watanabe J, Mogi Y, et al. Identification and characterization of an enzyme involved in the biosynthesis of the 4-hydroxy-2(or 5)-ethyl-5(or 2)-methyl-3(2H)-furanone in yeast[J]. Journal of Bioscience and Bioengineering, 2017, 123(3): 333-341. DOI:10.1016/j.jbiosc.2016.10.004 |
| [6] |
Wang HX, Hu ZQ, Long FY, et al. Early detection of Zygosaccharomyces rouxii—spawned spoilage in apple juice by electronic nose combined with chemometrics[J]. International Journal of Food Microbiology, 2016, 217: 68-78. DOI:10.1016/j.ijfoodmicro.2015.10.010 |
| [7] |
Fidalgo M, Barrales RR, Ibeas JI, et al. Adaptive evolution by mutations in the FLO11 gene[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(30): 11228-11233. DOI:10.1073/pnas.0601713103 |
| [8] |
Goossens KVY, Willaert RG. The N-terminal domain of the Flo11 protein from Saccharomyces cerevisiae is an adhesin without mannose-binding activity[J]. FEMS Yeast Research, 2012, 12(1): 78-87. DOI:10.1111/j.1567-1364.2011.00766.x |
| [9] |
Zara S, Bakalinsky AT, Zara G, et al. FLO11-based model for air-liquid interfacial biofilm formation by Saccharomyces cerevisiae[J]. Applied and Environmental Microbiology, 2005, 71(6): 2934-2939. DOI:10.1128/AEM.71.6.2934-2939.2005 |
| [10] |
Nakagawa Y, Toda Y, Yamamura H, et al. FLO11 is essential for pellicle formation by wild pellicle-forming yeasts isolated from contaminated wines[J]. Journal of Bioscience and Bioengineering, 2011, 111(1): 7-9. DOI:10.1016/j.jbiosc.2010.09.006 |
| [11] |
Kraushaar T, Brückner S, Veelders M, et al. Interactions by the fungal Flo11 adhesin depend on a fibronectin type Ⅲ-like adhesin domain girdled by aromatic bands[J]. Structure, 2015, 23(6): 1005-1017. DOI:10.1016/j.str.2015.03.021 |
| [12] |
Bou Zeidan M, Carmona L, Zara S, et al. FLO11 Gene is involved in the interaction of flor strains of Saccharomyces cerevisiae with a biofilm-promoting synthetic hexapeptide[J]. Applied and Environmental Microbiology, 2013, 79(19): 6023-6032. DOI:10.1128/AEM.01647-13 |
| [13] |
Zara G, Angelozzi D, Belviso S, et al. Oxygen is required to restore flor strain viability and lipid biosynthesis under fermentative conditions[J]. FEMS Yeast Research, 2009, 9(2): 217-225. DOI:10.1111/j.1567-1364.2008.00472.x |
| [14] |
Barnett JA. Yeasts: Characteristics and Identification[M]. Translated by Hu RQ. Qingdao: Qingdao Ocean University Press, 1991: 20-24 (in Chinese) 巴尼特JA.酵母菌的特征与鉴定手册[M].胡瑞卿, 译.青岛: 青岛海洋大学出版社, 1991: 20-24 |
| [15] |
Song ZW, Du H, Zhang Y, et al. Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J]. Frontiers in Microbiology, 2017, 8: 1294. DOI:10.3389/fmicb.2017.01294 |
| [16] |
Dijksterhuis J. The fungal spore and food spoilage[J]. Current Opinion in Food Science, 2017, 17: 68-74. DOI:10.1016/j.cofs.2017.10.006 |
| [17] |
D'Enfert C. Fungal spore germination: insights from the molecular genetics of Aspergillus nidulans and Neurospora crassa[J]. Fungal Genetics and Biology, 1997, 21(2): 163-172. DOI:10.1006/fgbi.1997.0975 |
| [18] |
Geijer C, Pirkov I, Vongsangnak W, et al. Time course gene expression profiling of yeast spore germination reveals a network of transcription factors orchestrating the global response[J]. BMC Genomics, 2012, 13(1): 554. DOI:10.1186/1471-2164-13-554 |
| [19] |
Abbas AA, Planchon S, Jobin M, et al. Absence of oxygen affects the capacity to sporulate and the spore properties of Bacillus cereus[J]. Food Microbiology, 2014, 42: 122-131. DOI:10.1016/j.fm.2014.03.004 |
| [20] |
Adnan M, Morton G, Hadi S. Analysis of rpoS and bolA gene expression under various stress-induced environments in planktonic and biofilm phase using 2–ΔΔCT method[J]. Molecular and Cellular Biochemistry, 2011, 357(1/2): 275-282. DOI:10.1007/s11010-011-0898-y |
| [21] |
Espinazo-Romeu M, Cantoral JM, Matallana E, et al. BTN2p is involved in ethanol tolerance and biofilm formation in flor yeast[J]. FEMS Yeast Research, 2008, 8(7): 1127-1136. DOI:10.1111/j.1567-1364.2008.00397.x |
| [22] |
Lei HJ, Liu JX, Jiang LS, et al. Study on white particles in fermented broad bean paste[J]. Journal of Food Science and Biotechnology, 2008, 27(5): 134-137. (in Chinese) 雷宏杰, 刘金霞, 蒋立胜, 等. 蚕豆酱中白点物质的分析[J]. 食品与生物技术学报, 2008, 27(5): 134-137. DOI:10.3321/j.issn:1673-1689.2008.05.026 |
| [23] |
Geng YH, Li GJ, Zhang BS. Study on white particles in fermented soybean paste[J]. China Brewing, 2005, 24(2): 12-14. (in Chinese) 耿予欢, 李国基, 张本山. 豆酱中白色物质的分析研究[J]. 中国酿造, 2005, 24(2): 12-14. DOI:10.3969/j.issn.0254-5071.2005.02.004 |
| [24] |
Martorell P, Stratford M, Steels H, et al. Physiological characterization of spoilage strains of Zygosaccharomyces bailii and Zygosaccharomyces rouxii isolated from high sugar environments[J]. International Journal of Food Microbiology, 2007, 114(2): 234-242. DOI:10.1016/j.ijfoodmicro.2006.09.014 |
| [25] |
Wang HX, Hu ZQ, Long FY, et al. Combined effect of sugar content and pH on the growth of a wild strain of Zygosaccharomyces rouxii and time for spoilage in concentrated apple juice[J]. Food Control, 2016, 59: 298-305. DOI:10.1016/j.foodcont.2015.05.040 |
| [26] |
Sasaki H, Shibata H, Imabayashi K, et al. Prenylated flavonoids from the stems and leaves of Desmodium caudatum and evaluation of their inhibitory activity against the film-forming growth of Zygosaccharomyces rouxii F51[J]. Journal of Agricultural and Food Chemistry, 2014, 62(27): 6345-6353. DOI:10.1021/jf5020439 |
| [27] |
Dusane DH, Rajput JK, Kumar AR, et al. Disruption of fungal and bacterial biofilms by lauroyl glucose[J]. Letters in Applied Microbiology, 2008, 47(5): 374-379. DOI:10.1111/j.1472-765X.2008.02440.x |
| [28] |
van Mulders SE, Ghequire M, Daenen L, et al. Flocculation gene variability in industrial brewer's yeast strains[J]. Applied Microbiology and Biotechnology, 2010, 88(6): 1321-1331. DOI:10.1007/s00253-010-2843-5 |
| [29] |
Govender P, Domingo JL, Bester MC, et al. Controlled expression of the dominant flocculation genes FLO1, FLO5, and FLO11 in Saccharomyces cerevisiae[J]. Applied and Environmental Microbiology, 2008, 74(19): 6041-6052. DOI:10.1128/AEM.00394-08 |
| [30] |
Nardi T, Remize F, Alexandre H. Adaptation of yeasts Saccharomyces cerevisiae and Brettanomyces bruxellensis to winemaking conditions: a comparative study of stress genes expression[J]. Applied Microbiology and Biotechnology, 2018, 88(4): 925-937. DOI:10.1007/s00253-010-2786-x |
| [31] |
Eldarov MA, Beletsky AV, Tanashchuk TN, et al. Whole-genome analysis of three yeast strains used for production of sherry-like wines revealed genetic traits specific to flor yeasts[J]. Frontiers in Microbiology, 2018, 9: 965. DOI:10.3389/fmicb.2018.00965 |
| [32] |
Chang Q, Yue F, Guo XN, et al. Regulatory effect of FLO1 tandem repeats on the flocculation characteristics and genetic stability in Saccharomyces cerevisiae[J]. Acta Microbiologica Sinica, 2012, 52(11): 1360-1368. (in Chinese) 常琦, 岳峰, 郭雪娜, 等. FLO1基因内重复序列对酿酒酵母絮凝能力及稳定性的影响[J]. 微生物学报, 2012, 52(11): 1360-1368. |
| [33] |
Moreno-García J, Mauricio JC, Moreno J, et al. Differential proteome analysis of a flor yeast strain under biofilm formation[J]. International Journal of Molecular Sciences, 2017, 18(4): 720. DOI:10.3390/ijms18040720 |
| [34] |
Legras JL, Moreno-Garcia J, Zara S, et al. Flor yeast: new perspectives beyond wine aging[J]. Frontiers in Microbiology, 2016, 7: 503. |
| [35] |
Sivadon P, Grimaud R. Assimilation of hydrocarbons and lipids by means of biofilm formation[A]//Krel T. Cellular Ecophysiology of Microbe[M]. Cham: Springer, 2018: 1-12
|
 2019, Vol. 46
2019, Vol. 46