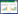扩展功能
文章信息
- 李华伟, 刘中华, 张鸿, 李国良, 林赵淼, 邱思鑫
- LI Hua-Wei, LIU Zhong-Hua, ZHANG Hong, LI Guo-Liang, LIN Zhao-Miao, QIU Si-Xin
- 福建甘薯病毒病病原鉴定及主要病毒多样性
- Identification and genetic diversity analysis of sweet potato virus in Fujian province
- 微生物学通报, 2019, 46(12): 3267-3277
- Microbiology China, 2019, 46(12): 3267-3277
- DOI: 10.13344/j.microbiol.china.190538
-
文章历史
- 收稿日期: 2019-06-20
- 接受日期: 2019-08-20
- 网络首发日期: 2019-10-17
甘薯[Ipomoea batatas (L.)Lam.]是世界第七大粮食作物,分布于世界100多个国家和地区。我国是世界上甘薯种植面积最大的国家,年总产量已达1亿t左右,占世界总产量的80%[1-2]。甘薯属无性繁殖作物,生产过程中甘薯一旦感染病毒就会造成病毒的积累并继代传染,造成严重的产量损失。据统计,世界上每年甘薯因病毒病造成的损失高达30%−50%,中国每年因甘薯病毒病造成的损失达40亿元[3-4]。
全世界已经鉴定出的能侵染甘薯的病毒有32种,分属于9个科[5]。最常见的RNA病毒主要有马铃薯Y病毒属的甘薯病毒有甘薯羽状斑驳病毒(Sweet potato feathery mottle virus,SPFMV)、甘薯轻型斑点病毒(Sweet potato mild speckling virus,SPMSV)、甘薯潜隐病毒(Sweet potato latent virus,SPLV)、甘薯G病毒(Sweet potato virus G,SPVG)、甘薯C病毒(Sweet potato virus C,SPVC) 5种[5]。毛形病毒属有甘薯褪绿矮化病毒(Sweet potato chlorotic stunt virus,SPCSV) 1种。黄瓜花叶病毒属的黃瓜花叶病毒(Cucumber mosaic virus,CMV)[6-7]。DNA病毒主要有菜豆金色黄花叶病毒属的甘薯卷叶病毒(Sweet potato leaf curl virus,SPLCV)、甘薯中国曲叶病毒(Sweet potato leaf curl China virus,SPLCCNV)和甘薯乔治亚曲叶病毒(Sweet potato leaf curl Geogia virus,SPLCGoV)3种[8-11]。据报道,我国甘薯至少存在15种甘薯病毒[12-14],在全国甘薯产区普遍存在,近几年报道最多的是SPFMV和SPCSV复合侵染引起的甘薯病毒病(SPVD)[15-16],当SPCSV和SPFMV复合侵染时,SPFMV的含量比SPFMV单独侵染时增加600倍[17],该病毒在我国被首次报道后在全国甘薯种植区开始蔓延,并和其他属的病毒以复合侵染的方式侵染甘薯,降低甘薯的品质和产量,同时甘薯双生病毒的频繁发生,严重影响甘薯产业的发展。
甘薯是福建省第二大粮食作物,常年种植面积在17万hm2,近几年调查发现,甘薯病毒病随着全国及全省甘薯产区的种苗及种质交换而频繁发生,导致了甘薯病毒病逐年加重并呈现蔓延式的发展,尤其是SPVD在福建甘薯产区的频发,已经严重威胁到福建省甘薯产业健康发展[18-19]。而近年来,有关福建甘薯病毒病鉴定、分布和流行报道较少,因此,为了明确福建甘薯病毒病的种类、分布及流行情况,本研究调查福建7个甘薯产区病毒病,采集病毒病样品,利用PCR/RT-PCR鉴定方法,对福建甘薯病毒病的病原物种类进行检测和鉴定,以期为今后甘薯病毒病的防控工作提供依据。
1 材料与方法 1.1 供试材料、主要试剂和仪器调查福建省甘薯种植区福州、莆田、泉州、龙岩、三明、宁德、漳州7个地区的大田和甘薯苗地甘薯病毒病发生情况。同时采集甘薯病毒病以及无症状(健康)的甘薯叶片样品,放入自封袋带回实验室液氮冷冻处理后进行病毒检测。
RNA提取试剂盒(EasyPure Plant RNA Kit)、DNA提取试剂盒、cDNA反转录试剂盒(EasyScript First-Strand cDNA Synthesis SuperMix)、PCR SuperMix、DNA产物纯化试剂盒、质粒纯化试剂盒均购自北京全式金生物技术有限公司。ABI梯度PCR仪,赛默飞世尔科技(中国)有限公司;凝胶成像系统,VILBER LOURMAT公司;水平电泳仪,北京六一生物科技有限公司。
1.2 甘薯病毒的检测 1.2.1 植物总RNA与总DNA的提取样品RNA提取采用北京全式金生物技术有限公司的植物总RNA提取试剂盒,按照其操作步骤提取甘薯样品叶片的总RNA。样品DNA提取采用植物总DNA提取试剂盒(EasyPure Plant Genomic DNA Kit),按照其操作步骤提取甘薯叶的总DNA。获得的总RNA和总DNA用1%琼脂糖凝胶电泳检测其质量,并于−80 ℃保存备用。
1.2.2 cDNA合成cDNA合成参照北京全式金生物技术有限公司反转录试剂盒合成第一链cDNA合成,cDNA模板用于后续的试验。
1.2.3 引物的设计根据已报道的侵染甘薯的不同病毒的检测引物序列合成部分引物,在NCBI上下载已登录的甘薯病毒基因组序列,根据其保守序列信息使用Primer Premier 5软件设计引物。引物由福州尚亚生物技术有限公司合成,引物序见表 1。
| 病毒 Virus |
引物序列 Forward reverse primer (5′→3′) |
基因 Gene |
片段 Fragment (bp) |
来源 Sources |
| 甘薯退绿矮化病毒 SPCSV |
CGGTCARATTGGAAGGTA TTCGCTATCAAAGAAGTRTC |
hsp70 | 304 | [19] |
| 甘薯羽状斑驳病毒 SPFMV |
TCCACCACCCACAATAAC ACGGTTTCGCATCTCTAT |
cp | 601 | [19] |
| 甘薯G病毒 SPVG |
ACAGGACCATTACCACCA AATCTTCCCTGACACCCTC |
cp | 433 | [19] |
| 甘薯2号病毒 SPV2 |
ACGTAGCCCAAGGCAAGTTA CCATTTCAGCATCAGACACCC |
cp | 275 | This study |
| 甘薯C病毒 SPVC |
AGGGCCGTATACAGCACCAGA CAGTWTGARGTTGCRAACACCCG |
cp | 526 | This study |
| 甘薯C-6病毒 SPV6 |
AAAAGCTTGTTGGCAATTTGTG TTGGCATTTCGATTGTCCC |
TGBp2 | 591 | This study |
| 甘薯潜隐病毒 SPLV |
CCAAATATCAATGGTGATTGGGT CCACGCATTCCAAGTAGTGTGTGT |
cp | 420 | [12] |
| 甘薯轻型斑点病毒 SPCFV |
CTATGCTGCTCACTCAAGC TTGATTGGCCACAAGCGAAG |
cp | 600 | [20] |
| 甘薯褪绿斑病毒 SPMMV |
ACAGAAGGCAAGGATAAGGG ACATTGGCATAACCAGCAGT |
cp | 954 | This study |
| 甘薯轻型斑驳病毒 SPMSV |
GCTAGTACTGGGGTAAATCAA GTTTTCCCAGTCACGAC |
cp | 1 100 | [12] |
| 黄瓜花叶病毒 CMV |
ATGGACAAATCTRAATCAACCAG TCARACTGGGAGCACYCCWGAYGT |
cp | 657 | [12] |
| 甘薯卷叶病毒 SPLCV |
GGAACAGGCATTAGTTAGGA TGCAACGCAGAGTCTGATAT |
cp | 161 | [21] |
| 甘薯无症状1号病毒 SPSMV-1 |
TTCTACCTGGGATGATGT GTATTTGGGAAGTTCTGG |
cp | 366 | This study |
| 甘薯杆状DNA病毒B SPBV-B |
CAACATCTCGGCAGTAAC TAGACCATCCCAGTCCAA |
cp | 307 | This study |
以甘薯总DNA为模板进行DNA病毒的PCR扩增。PCR反应体系(25μL):2×EasyTaqPCR SuperMix 12 μL,总DNA模板(50−100ng/μL)2μL,正、反向引物(10μmol/L)各0.5μL,灭菌水补足至25μL。PCR反应条件:94℃ 3 min;94℃ 30s,50℃ 30s,72℃ 1min,5次循环;94℃ 30s,54℃ 30s,72℃ 1min,25次循环;72℃ 10min,4℃保存。
以反转录cDNA为模板进行RNA病毒的RT-PCR扩增。单一反应体系(25 μL):2×EasyTaq PCR SuperMix 12 μL,DNA或cDNA模板(50− 100 ng/μL) 2 μL,上、下游引物(10 μmol/L)各0.5 μL,水补足至25 μL。三重反应体系(25 μL):2×EasyTaq PCR SuperMix 12 μL,DNA或cDNA模板(50−100 ng/μL) 2 μL,SPFMV上、下游引物(10 μmol/L)各0.3 μL,SPCSV上、下游引物(10 μmol/L)各0.8 μL,SPVG上、下游引物(10 μmol/L)各0.5 μL,水补足至25 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,52−60 ℃ 30 s (根据引物的退火温度决定52−60 ℃),72 ℃ 1 min,30个循环;72 ℃ 10 min,4 ℃保存。
取5 μL扩增产物在1%的琼脂糖凝胶上电泳(GenGreen染色),电泳缓冲液为0.5% TBE缓冲液,在120 V电压下电泳35 min,凝胶成像仪观察拍照。
1.2.5 PCR产物的克隆及序列分析经1%琼脂糖凝胶电泳检测后,切下特异性片段,利用北京全式金生物技术公司的通用型DNA纯化回收试剂盒进行纯化,纯化后连接到T载体上,转化大肠杆菌,经PCR验证后送福州尚亚生物技术有限公司测序。测序完成后将序列在NCBI库中进行BLAST比对,利用DNAMAN软件拼接后再利用MEGA 6.0软件进行同源性分析[22],采用邻接法(Neighbor-Joining method)自举值(Bootstrap) 1 000次构建系统进化图谱。
2 结果与分析 2.1 甘薯病毒病的田间症状及发生趋势对福建省7个甘薯产区的甘薯病毒病进行了调查,调查结果表明,甘薯侵染病毒后植株的症状类型主要表现为植株矮化、成簇生长,严重影响甘薯地上部生长。叶片上的症状主要表现为花叶、皱缩、明脉、黄脉、叶脉突起、卷曲、疱疹畸形等症状(图 1A−I),严重影响叶片的光合作用,导致产量严重损失。

|
| 图 1 甘薯病毒病症状 Figure 1 Symptoms of sweet potato virus diseases |
|
|
综合调查结果表明,7个甘薯产区的甘薯病毒病发病率5%−95%,其中以泉州地区发病率最高,发病率最高的地块达95%。莆田、龙岩、福州发病率次之,三明、宁德地区的发病率最低,发病率较高的地块达5%。
2.2 甘薯的病毒种类检测用SPCSV、SPFMV、SPVG、SPV2、SPVC、SPC-6、SPLV、SPCFV、SPMMV、SPMSV、CMV、SPLCV、SPSMV-1、SPBV-B 14种甘薯病毒的特异引物对采集的甘薯疑似染病的样品进行RT-PCR和PCR检测,共检测到12种甘薯病毒,包括9种RNA病毒(SPCSV、SPFMV、SPVG、SPV2、SPVC、SPLV、SPCFV、SPMSV、CMV)和3种DNA病毒(SPLCV、SPSMV-1、SPBV-B)。12种病毒的PCR扩增各获得了一条特异性目的条带,各条带大小符合目的片段大小,部分病毒的PCR扩增电泳图见图 2A−C。对获得的PCR片段进行回收、克隆、序列测定及BLAST分析,结果表明,PCR产物与相应病毒的核苷酸序列一致性均达97%以上,表明PCR可靠性。

|
| 图 2 单重PCR和三重PCR检测甘薯病毒病 Figure 2 Single and triple PCR detection of sweet potato virus diseases 注:A和B:单一PCR;C:多重PCR. Note:A and B: Single PCR; C: Triple PCR. |
|
|
对采集7个地区的甘薯样品179份进行RT-PCR和PCR检测,结果表明:179份甘薯样品中共有139份感染甘薯病毒病,阳性率为77.65%。其中SPFMV、SPCSV和SPVG检出率最高,分别为50.28%、41.90%、35.75%,检出率次之的依次是SPLCV、SPVC、SPLV、SPBV-B、SPV2、SPCFV、SPMSV、SPSMV-1,检出率分别为24.58%、24.58%、23.46%、21.23%、17.88%、16.20%、14.53%、10.61% (图 3)。CMV的检出率在所有检测病毒病的最低,只有5份样品检测为阳性,占2.79%,CMV主要检出区域为泉州、莆田和福州3个地区,在其他地区未检测到CMV。SPC-6和SPMMV在7个地区的检出率为0%。
|
| 图 3 不同甘薯病毒检出率 Figure 3 Detection rate of different sweet potato viruses |
|
|
根据各个地区的病毒检测结果分析,福建省甘薯病毒病主要分布于泉州、莆田、龙岩和福州等地区(图 4),且这4个地区的病毒类型多样,而三明、宁德、漳州的甘薯病毒病较为单一,以SPVD侵染为主。连续几年的甘薯病毒病调查结果表明,福建省甘薯病毒病的发生呈现以泉州为中心,向其他甘薯产区逐步扩散,呈现从南到北的侵染过程。由于全国(省)甘薯种苗交换的频繁发生,导致了福建省甘薯病毒病蔓延并呈逐年加重的趋势。

|
| 图 4 不同地区甘薯病毒病种类分布 Figure 4 Distribution of sweet potato virus diseases in different areas |
|
|
在139份检测出侵染甘薯病毒病样品中,1种病毒单独侵染的有20份,占14.39%,2种及以上病毒侵染的样品有119份,占85.61%,2种病毒侵染中RNA病毒多以SPFMV、SPCSV、SPVG、SPLV、SPVC、SPV2中的其中2种病毒复合侵染为主,其中以SPFMV和SPCSV复合侵染最为常见,占2种病毒复合侵染的68.75%。DNA病毒以SPLCV、SPBV-B复合侵染为主。3种病毒复合侵染的有51份,占36.69%,3种病毒主要以SPFMV、SPCSV、SPVG、SPVC、SPV2、SPCFV其中的3种侵染为主。4种病毒复合侵染的有26份,占18.71%,4种病毒主要以SPFMV、SPVG、SPVC、SPV2和SPFMV、SPV2、SPLV、SPVG侵染为主,其次是SPFMV、SPCSV、SPVG、SPVC。5种、6种病毒复合侵染的比例分别占5.76%、2.88%,没有检测到7种以上病毒复合侵染方式。
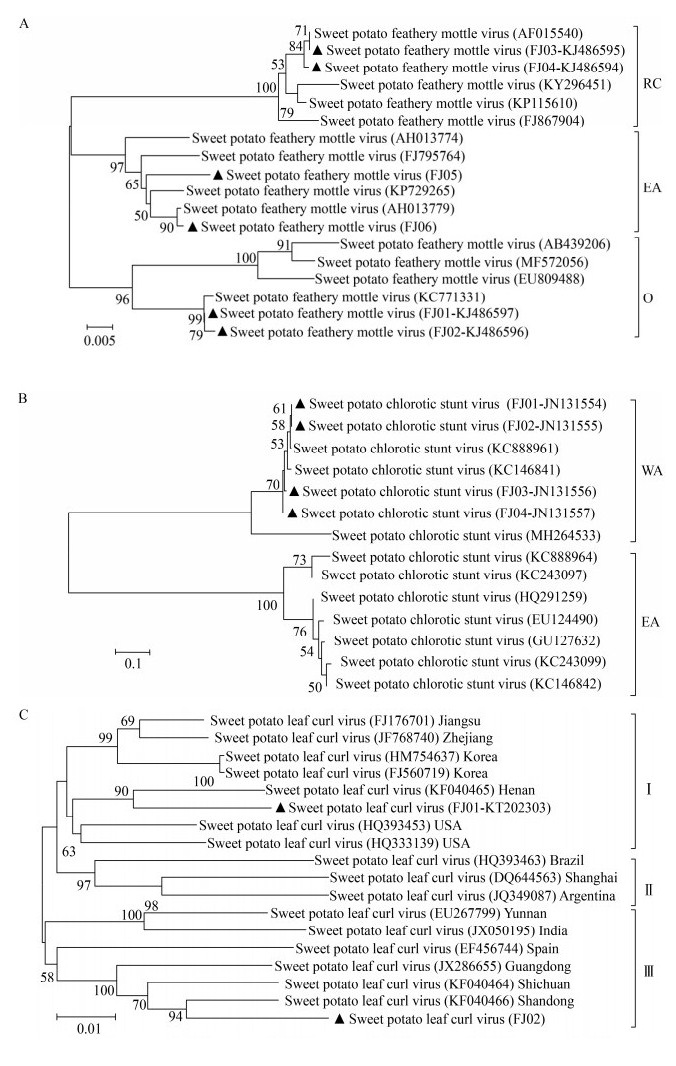
2.5 主要病毒遗传多样性分析根据SPFMV、SPLCV的cp基因和SPCSV的hsp70基因核苷酸的分子变异情况可划分为不同的株系类别,从NCBI中下载已报道的SPFMV、SPLCV的典型株系的cp和SPCSV的hsp70基因的保守核苷酸序列,比对下载的核苷酸序列和本研究分离的部分分离物核苷酸序列,用生物学软件MEGA 6.0构建不同分离物的系统发育树(图 5)。从聚类图可以看出,福建省6个SPFMV分离物分别聚类到RC株系(褐裂株系)、EA株系(东非株系)和O株系(普通株系) (图 5A),说明福建省存在SPFMV 3种株系类型,从分离物的比对结果分析,SPFMV以RC和O株系为主,分别占60%和35%,EA株系占15%。SPCSV分离物均聚类到WA株系(西非株系) (图 5B),表明福建省SPCSV仅存在WA株系,还未发现EA株系(东非株系)。系统发育树显示SPLCV福建分离物分属2个株系(图 5C),与已报道的山东省及河南省份的SPLCV分离物之间亲缘关系较近,说明福建省SPLCV存在遗传多样性。
|
| 图 5 Neighbor-Joining法构建的SPFMV、SPCSV、SPLCV不同分离物部分核苷酸序列的系统发育树 Figure 5 Neighbor-Joining phylogenetic dendrograms based on the partial nucleotide sequences of different SPFMV and SPCSV and SPLCV isolates 注:▲:本研究获得的分离物. A:SPFMV;B:SPCSV;C:SPLCV.括号内序号为序列的GenBank登录号.分支点上的数字表示1 000次重复后得到的置信值;标尺表示100个核苷酸中有1个被替换. Note: ▲: The isolates described in this study. A: SPFMV; B: SPCSV; C: SPLCV. Numbers in parentheses are GenBank accession numbers. Numbers at the branch points indicates bootstrap values obtained after 1 000 replicates; The scale bar corresponds to 0.01 substitutions per nucleotide position. |
|
|
本研究系统对福建7个甘薯产区的甘薯病毒病进行了调查及鉴定,调查结果表明,7个甘薯产区的甘薯病毒病危害程度不同,发病率在5%−95%,主要以泉州、莆田、龙岩、福州发生最严重,检出率最高,病毒种类最多,包含了检测出的12种病毒,这4个甘薯产区列为重点检疫地区,防止带病种苗向其他地区传播扩散。宁德、三明、漳州发病较轻,其中三明地区检测到7种病毒,宁德地区检测到4种病毒,而漳州地区的病毒种类较为单一,只检测到马铃薯Y病毒属的SPMFV、SPVG和SPLV 3种病毒,这3个甘薯产区应重点防控SPFMV和SPVG,同时防止其他病毒的传入。在采集的179个样品中,139个样品检测到12种甘薯病毒,RNA病毒9种,DNA病毒3种,病毒检出率为77.65%。本研究检出的病毒种类均多于乔奇等[12] (2012)报道福建检出甘薯病毒6种,Xie等[14] (2013)报道福建检出甘薯病毒有7种,邹为坤[18] (2016)报道福建检出甘薯病毒有11种,说明随着甘薯交换苗的频发,导致了福建甘薯病毒种类在逐年增加、流行加速、传播更快、危害更加严重。因此各地区在引种及种苗调运过程中要加强病毒的检测,防止带病种苗的传播。
由于甘薯为无性繁殖作物,容易感染病毒并造成病毒的积累,病毒传播方式主要有种子和薯块带毒、蚜虫持久性和非持久性、粉虱非持久性及机械摩擦传播,多种传播方式导致甘薯可以被多种病毒复合侵染[23]。本研究检出的12种病毒中SPFMV、SPCSV、SPVG、SPLCV、SPVC、SPLV的检出最高,这些病毒大部分属于马铃薯Y病毒属(SPFMV、SPVG、SPVC、SPV2、SPLV),而马铃薯Y病毒属能够依靠机械、蚜虫和粉虱传播[24],因此本研究检出的病样中主要有2种及2种以上病毒复合侵染,复合侵染率占85.61%,单独侵染的病样仅占14.39%。同时本研究通过对7个地区的甘薯病毒病进行了系统的鉴定,发现不同病毒流行和分布存在一定的差异,SPFMV和SPVG分布最广,在7个甘薯产区均能检测到SPFMV和SPVG存在,其次是SPCSV和SPLV,只有在漳州和宁德未检测到这2种病毒,其他地区均有检出,说明这4种病毒为福建省的流行病毒。而CMV只在泉州、莆田和福州有检出,其他地区未检出,说明不同地区的病毒存在局部侵染的情况,应加强流行病毒检疫,防止病毒的流出和流入,SPV-6和SPMMV在所有产区未检出,这和以往的报道中福建样品中未检测出SPV-6和SPMMV结果一致,而近几年SPV-6和SPMMV在我国的河北、四川、山东、河南均有报道[12, 14],因此福建省甘薯是否存在SPV-6和SPMMV及其他病毒还用待进一步研究。
甘薯病毒病(SPVD)是SPFMV和SPCSV协同侵染引起的,甘薯一旦感染SPVD会造成极大的影响,严重时可造成甘薯绝产,SPVD在世界甘薯产区均有发生,已成为甘薯生产最重要的病害之一[25-27]。我国自报道发生SPVD以后,SPVD在我国甘薯产区均有发生并逐年加重[28-32],福建省是我国最早发现SPVD侵染的甘薯产区之一,而本研究中SPVD在福建省甘薯产区中检出率最高,除漳州没有检测到SPVD的发生外,其他6个地区均检出SPVD,说明SPVD已经成为福建省最主要的流行病毒。因此今后要加大对SPVD特别是漳州产区的监测,防止SPVD流入和传播。
病毒的遗传变异主要通过基因突变、重组,基因突变和重组会导致病毒株系流行的改变,而病毒的复合侵染有利于其在寄主体内发生基因组重组而引起病毒变异,因此弄清病毒变异及流行株系有利于培育抗病品种。根据病毒株系的划分标准,SPFMV划分RC、EA和O 3个株系,SPCSV划分EA和WA 2个株系[33-36]。近年的报道表明,我国甘薯上SPFMV存在上述3种株系,SPCSV流行株系为WA。本研究鉴定的SPFMV分离物进化分析聚类到上述的3个株系,与邹为坤[18] (2016)报道福建分离物属EA株系更为复杂,说明福建省SPFMV遗传结构较为复杂。鉴定的SPCSV的分离物进化分析聚类到上述WA株系,未检测到EA株系。SPLCV分离物进化分析聚类到2个株系群,其中一类和广东、四川分离物的亲缘关系较近,另一类和河南、美国的分离物亲缘关系较近,说明福建省流行病毒的遗传结构复杂,病毒变异速率正在增加。因此有必要对福建省甘薯病毒进行实时监测、鉴定并研究其变异机制,制定科学的防治技术措施。
综上所述,由于福建省甘薯病毒病类型多样,多为复合侵染,病毒种类及流行株系已发生新的变化,遗传结构呈现多样,而病毒变异速率加快,增大甘薯病毒病防控难度。因此生产中应加强种苗质量监控,培育健康脱毒种苗,防止在种苗交换过程中病毒的传播。
| [1] |
Ma JF, Cheng JH, Wang J, et al. Development of sweet potato industry at home and abroad[J]. Jiangsu Agricultural Sciences, 2012, 40(12): 1-5. (in Chinese) 马剑凤, 程金花, 汪洁, 等. 国内外甘薯产业发展概况[J]. 江苏农业科学, 2012, 40(12): 1-5. DOI:10.3969/j.issn.1002-1302.2012.12.001 |
| [2] |
Ma DF, Li Q, Cao QH, et al. Development and prospect of sweet potato industry and its technologies in China[J]. Jiangsu Agricultural Sciences, 2012, 28(5): 969-973. (in Chinese) 马代夫, 李强, 曹清河, 等. 中国甘薯产业及产业技术的发展与展望[J]. 江苏农业科学, 2012, 28(5): 969-973. |
| [3] |
Zhang YQ, Guo HC. Research progress on the tip meristem culture of sweet potato[J]. Chinese Agricultural Science Bulletin, 2005, 21(3): 74-76, 106. (in Chinese) 张雅琼, 郭华春. 甘薯茎尖分生组织培养的研究进展[J]. 中国农学通报, 2005, 21(3): 74-76, 106. DOI:10.3969/j.issn.1000-6850.2005.03.021 |
| [4] |
Zhang ZC, Ma HQ, Zhang GL. Advances in virus diseases of sweet potato[J]. Journal of Henan Agricultural Sciences, 2000(9): 19-22. (in Chinese) 张振臣, 马淮琴, 张桂兰. 甘薯病毒病研究进展[J]. 河南农业科学, 2000(9): 19-22. DOI:10.3969/j.issn.1004-3268.2000.09.009 |
| [5] |
Clark CA, Davis JA, Abad JA, et al. Sweet potato viruses: 15 years of progress on understanding and managing complex diseases[J]. Plant Disease, 2012, 96(2): 168-185. DOI:10.1094/PDIS-07-11-0550 |
| [6] |
Yamasaki S, Sakai J, Fuji S, et al. Comparisons among isolates of sweet potato feathery mottle virus using complete genomic RNA sequences[J]. Archives of Virology, 2010, 155(5): 795-800. DOI:10.1007/s00705-010-0633-0 |
| [7] |
Untiveros M, Fuentes S, Salazar LF. Synergistic interaction of sweet potato chlorotic stunt virus (Crinivirus) with Carla-, Cucumo-, Ipomo-, and potyviruses infecting sweet potato[J]. Plant Disease, 2007, 91(6): 669-676. DOI:10.1094/PDIS-91-6-0669 |
| [8] |
Luan YS, Zhang J, An LJ. First report of sweet potato leaf curl virus in China[J]. Plant Disease, 2006, 90(8): 1111. |
| [9] |
Adams MJ, Lefkowitz EJ, King AMQ, et al. Ratification vote on taxonomic proposals to the international committee on taxonomy of viruses (2016)[J]. Archives of Virology, 2016, 161(10): 2921-2949. DOI:10.1007/s00705-016-2977-6 |
| [10] |
Luan YS, Zhang J, Liu DM, et al. Erratum to: molecular characterization of sweet potato leaf curl virus isolate from China (SPLCV-CN) and its phylogenetic relationship with other members of the Geminiviridae[J]. Virus Genes, 2007, 35(3): 879-880. DOI:10.1007/s11262-007-0117-9 |
| [11] |
Liu QL, Zhang JX, Li XC, et al. Advances in research of DNA virus infecting sweet potato[J]. Plant Protection, 2017, 43(3): 36-42. (in Chinese) 刘起丽, 张建新, 李学成, 等. 侵染甘薯的DNA病毒研究进展[J]. 植物保护, 2017, 43(3): 36-42. DOI:10.3969/j.issn.0529-1542.2017.03.006 |
| [12] |
Qiao Q, Zhang ZC, Zhang DS, et al. Serological and molecular detection of viruses infecting sweet potato in China[J]. Acta Phytopathologica Sinica, 2012, 42(1): 10-16. (in Chinese) 乔奇, 张振臣, 张德胜, 等. 中国甘薯病毒种类的血清学和分子检测[J]. 植物病理学报, 2012, 42(1): 10-16. DOI:10.3969/j.issn.0412-0914.2012.01.002 |
| [13] |
Wang QM, Zhang LM, Wang B, et al. Sweet potato viruses in China[J]. Crop Protection, 2010, 29(2): 110-114. DOI:10.1016/j.cropro.2009.11.002 |
| [14] |
Xie YP, Xing JY, Li XY, et al. Survey of sweet potato viruses in China[J]. Acta Virologica, 2013, 57(1): 81-84. DOI:10.4149/av_2013_01_81 |
| [15] |
Qin Y, Zhang Z, Qiao Z, et al. First report of sweet potato leaf curl Georgia virus on sweet potato in China[J]. Plant Disease, 2013, 97(10): 1388. |
| [16] |
Gutiérrez DL, Fuentes S, Salazar LF. Sweet potato virus disease (SPVD): Distribution, incidence, and effect on sweet potato yield in Peru[J]. Plant Disease, 2003, 87(3): 297-302. DOI:10.1094/PDIS.2003.87.3.297 |
| [17] |
Zhang ZC, Qiao Q, Qin YH, et al. First evidence for occurrence of sweet potato virus disease (SPVD) caused by dual infection of sweet potato feathery mottle virus and sweet potato chlorotic stunt virus in China[J]. Acta Phytopathologica Sinica, 2012, 42(3): 328-333. (in Chinese) 张振臣, 乔奇, 秦艳红, 等. 我国发现由甘薯褪绿矮化病毒和甘薯羽状斑驳病毒协生共侵染引起的甘薯病毒病害[J]. 植物病理学报, 2012, 42(3): 328-333. DOI:10.3969/j.issn.0412-0914.2012.03.016 |
| [18] |
Zou WK. Occurrence and control strategies of sweet potato virus disease in Fujian province[D]. Fuzhou: Master's Thesis of Fujian Agricultural and Forestry University, 2016 (in Chinese) 邹为坤.福建省甘薯病毒病发生与防治策略[D].福州: 福建农林大学硕士学位论文, 2016 |
| [19] |
Li HW, Xu YQ, Qiu SX, et al. Establishment and application of a multiplex RT-PCR detection method for SPCSV, SPVG and SPFMV infecting sweetpotato[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(8): 1464-1470. (in Chinese) 李华伟, 许泳清, 邱思鑫, 等. 侵染甘薯的SPCSV、SPVG、SPFMV多重RT-PCR检测方法的建立及应用[J]. 核农学报, 2015, 29(8): 1464-1470. |
| [20] |
Bao GL, Zuo RJ, Rao WL, et al. Detection of sweet potato viruses in Yunnan and genetic diversity analysis of the common viruses[J]. Microbiology China, 2013, 40(2): 236-248. (in Chinese) 包改丽, 左瑞娟, 饶维力, 等. 云南甘薯病毒的检测及主要病毒的多样性分析[J]. 微生物学通报, 2013, 40(2): 236-248. |
| [21] |
Li HW, Liu ZH, Zhang H, et al. Establishment and application of a LAMP method for the rapid detection of sweet potato leaf curl virus[J]. Journal of Agricultural Biotechnology, 2019, 27(6): 1133-1140. (in Chinese) 李华伟, 刘中华, 张鸿, 等. 甘薯卷叶病毒LAMP快速检测技术的建立及应用[J]. 农业生物技术学报, 2019, 27(6): 1133-1140. |
| [22] |
Tamura K, Stecher G, Peterson D, et al. MEGA6: molecular evolutionary genetics analysis version 6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 |
| [23] |
Wang QM, Wang YC, Wang JJ, et al. Advances in virus diseases of sweet potato[J]. Shandong Agricultural Sciences, 1994(4): 36-39. (in Chinese) 王庆美, 王荫墀, 王建军, 等. 甘薯病毒病研究进展[J]. 山东农业科学, 1994(4): 36-39. |
| [24] |
Karyeija RF, Kreuze JF, Gibson RW, et al. Synergistic interactions of a potyvirus and a phloem-limited crinivirus in sweet potato plants[J]. Virology, 2000, 269(1): 26-36. |
| [25] |
Xie H, Su ZX, Yan H, et al. Pesticides could alleviate the symptoms of sweet potato virus disease (SPVD)[J]. Agricultural Biotechnology, 2018, 7(5): 268-273. |
| [26] |
Qiao Q, Zhang ZC, Qin YH, et al. First report of sweet potato chlorotic stunt virus infecting sweet potato in China[J]. Plant Disease, 2011, 95(3): 356. |
| [27] |
Tairo F, Mukasa SB, Jones RAC, et al. Unravelling the genetic diversity of the three main viruses involved in sweet potato virus disease (SPVD), and its practical implications[J]. Molecular Plant Pathology, 2005, 6(2): 199-211. DOI:10.1111/j.1364-3703.2005.00267.x |
| [28] |
Pu ZG, Qu JP, Wang DY, et al. Investigation and serological detection of sweet potato viruses in Sichuan province[J]. Journal of China West Normal University(Natural Sciences), 2007, 28(4): 270-273. (in Chinese) 蒲志刚, 曲继鹏, 王大一, 等. 四川省甘薯病毒病调查及病原血清学鉴定[J]. 西华师范大学学报:自然科学版, 2007, 28(4): 270-273. DOI:10.3969/j.issn.1673-5072.2007.04.002 |
| [29] |
Jiang SS, Zhang M, Wu B, et al. Molecular identification on mixed infection of sweet potato viruses in Shandong province[J]. Shandong Agricultural Sciences, 2018, 50(9): 97-101. (in Chinese) 姜珊珊, 张眉, 吴斌, 等. 山东省甘薯病毒复合侵染的分子鉴定[J]. 山东农业科学, 2018, 50(9): 97-101. |
| [30] |
Huang LL, Binhdan P, He FL, et al. The pathogenic virus species detection of sweet potato viral diseases in Guangxi[J]. Genomics and Applied Biology, 2016, 35(5): 1213-1218. (in Chinese) 黄利利, Binhdan P, 何芳练, 等. 广西甘薯病毒病的病原病毒种类检测[J]. 基因组学与应用生物学, 2016, 35(5): 1213-1218. |
| [31] |
Zhang XX, Wang XF, Lin JC, et al. Sweet potato virus diseases (SPVD): research progress[J]. Chinese Agricultural Science Bulletin, 2019, 35(1): 118-126. (in Chinese) 张新新, 王旭芳, 林坚淳, 等. 甘薯毁灭性病毒病害(SPVD)的研究进展[J]. 中国农学通报, 2019, 35(1): 118-126. |
| [32] |
Peng XQ, Wang HR, Zhang J, et al. Detection and identification of sweet potato virus diseases in Hubei[J]. China Plant Protection, 2017, 37(8): 20-23. (in Chinese) 彭小琴, 王浩然, 张俊, 等. 湖北甘薯病毒病的检测与鉴定[J]. 中国植保导刊, 2017, 37(8): 20-23. DOI:10.3969/j.issn.1672-6820.2017.08.004 |
| [33] |
Huang GX, Meng LQ, Zhu JC, et al. Establishment of duplex RT-PCR detection method for SPFMV and SPCSV infecting sweet potato[J]. Journal of Shenyang Agricultural University, 2018, 49(6): 724-729. (in Chinese) 黄广学, 孟利前, 朱建晨, 等. 甘薯羽状斑驳病毒(SPFMV)和矮化退绿病毒(SPCSV)的双重RT-PCR检测技术体系构建[J]. 沈阳农业大学学报, 2018, 49(6): 724-729. |
| [34] |
Abad JA, Conkling MA, Moyer JW. Comparison of the capsid protein cistron from serologically distinct strains of sweet potato feathery mottle virus (SPFMV)[J]. Archives of Virology, 1992, 126(1/4): 147-157. |
| [35] |
Aritua V, Barg E, Adipala E, et al. Further evidence for limited genetic diversity among East African Isolates of sweet potato chlorotic stunt virus[J]. Journal of Phytopathology, 2008, 156(3): 181-189. DOI:10.1111/j.1439-0434.2007.01338.x |
| [36] |
Untiveros M, Quispe D, Kreuze J. Analysis of complete genomic sequences of isolates of the sweet potato feathery mottle virus strains C and EA: molecular evidence for two distinct potyvirus species and two P1 protein domains[J]. Archives of Virology, 2010, 155(12): 2059-2063. DOI:10.1007/s00705-010-0805-y |
 2019, Vol. 46
2019, Vol. 46