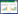扩展功能
文章信息
- 于冬梅, 朱峰, 邢志富, 范海燕, 朱晓峰, 段玉玺, 王媛媛, 刘晓宇, 陈立杰
- YU Dong-Mei, ZHU Feng, XING Zhi-Fu, FAN Hai-Yan, ZHU Xiao-Feng, DUAN Yu-Xi, WANG Yuan-Yuan, LIU Xiao-Yu, CHEN Li-Jie
- 碳代谢基因gabT调控生防菌Snea253的γ-氨基丁酸代谢途径影响杀线虫活性
- Carbon metabolism gene gabT regulates γ-aminobutyric acid metabolism of Streptomyces venezuelae Snea253 on nematicidal activity
- 微生物学通报, 2019, 46(12): 3257-3266
- Microbiology China, 2019, 46(12): 3257-3266
- DOI: 10.13344/j.microbiol.china.190037
-
文章历史
- 收稿日期: 2019-01-12
- 接受日期: 2019-05-28
- 网络首发日期: 2019-06-04
2. 吉林省农业科学院植物保护研究所 吉林 公主岭 130033;
3. 沈阳农业大学生物科学技术学院 辽宁 沈阳 110866;
4. 沈阳农业大学理学院 辽宁 沈阳 110866
2. Institute of Plant Protection, Jilin Academy of Agricultural Sciences, Gongzhuling, Jilin 130033, China;
3. College of Bioscience and Biotechnology, Shenyang Agricultural University, Shenyang, Liaoning 110866, China;
4. College of Science, Shenyang Agricultural University, Shenyang, Liaoning 110866, China
根结线虫是世界上最具破坏性的植物内寄生线虫,可寄生3 000多种植物[1],且分布范围极广。随着东北地区设施蔬菜种植面积逐年增加,适宜的生存环境和重茬连作的种植方式使当地根结线虫病害日趋严重,辽宁省保护地蔬菜以南方根结线虫为主要危害,其中以连作7年以上的黄瓜、番茄、苦瓜易感寄主为主的老菜棚的发病率达到100%,病情指数达到80以上[2]。采用化学方法防治蔬菜根结线虫病,不仅会降低蔬菜品质,还会破坏生态平衡[3],因此越来越多的研究者将目光转向生物防治。利用生防微生物代谢产物防治根结线虫是有效措施,其代谢产物中有多种有机酸具有较强的杀线虫活性,如亚油酸[4]、柠檬酸[5]、草酸等[6]。Morgunov等[7]研究发现,微生物合成的琥珀酸也具有较强的杀线虫活性,Kamzolova等[8]报道了微生物来源的琥珀酸对植物寄生线虫具有毒性,Botura等[9]的研究表明琥珀酸对山羊胃肠道线虫卵有明显的抑制作用。
γ-氨基丁酸(γ-Aminobutyric acid,GABA)是一种非蛋白质氨基酸,广泛存在于动物、植物和微生物中[10]。在植物中GABA有两条合成转化途径,即三羧酸循环旁路(GABA支路)和多胺降解途径[11-12]。微生物中GABA代谢成琥珀酸是通过GABA支路完成[13]。GABA由谷氨酸合成,在γ-氨基丁酸转氨酶(GABA-T)的作用下生成琥珀酸半醛,随后在琥珀酸半醛脱氢酶的作用下生成琥珀酸,参与生物的生理代谢[14]。研究发现,过量表达或沉默GABA-T基因会降低或提高GABA的含量。周露等[15]利用RNA干扰水稻GABA-T基因提高水稻中GABA的含量,Simpson等[16]在拟南芥中过表达了GABA-T基因,降低了GABA含量,Renault等[17-19]发现拟南芥中GABA-T功能的破坏会导致GABA含量升高而琥珀酸含量降低,然而GABA-T不直接作用于琥珀酸。在植物中关于GABA-T基因表达调控的研究很活跃,但在微生物中,尤其关于链霉菌中GABA-T基因表达调控还不清楚。
委内瑞拉链霉菌(Streptomyces venezuelae) Snea253是本实验室从土壤中分离获得的具有杀线虫活性的菌株[20]。田成丽等[21]经紫外诱变得到Snea253杀线虫活性不同的强毒株(Snea253-Q)和弱毒株(Snea253-R)。利用RNA-Seq进行转录组分析,筛选到碳代谢过程的重要基因——γ-氨基丁酸转氨酶基因gabT,gabT基因在强毒株中的相对表达量高于弱毒株。但是,gabT基因是否可以通过调控代谢影响Snea253杀线虫活性,以及不同碳源对gabT基因表达有何影响仍然未知。为探究gabT基因对Snea253的代谢调控,本研究通过在Snea253弱毒株中过表达gabT基因和改变菌株生长条件的碳源,检测gabT基因的表达对发酵液中GABA和琥珀酸合成及杀线虫活性的影响,从而为gabT基因或GABA支路调控生防菌Snea253碳代谢途径,以提高杀线虫效果提供一定的理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株、载体和根结线虫供试委内瑞拉链霉菌Snea253由沈阳农业大学北方线虫研究所提供;pGEM-T Easy载体购自Promega公司;质粒pIB139购自武汉淼灵生物科技有限公司;大肠杆菌DH5α感受态细胞购自天根生化科技有限公司。南方根结线虫(Meloidogyne incognita)由沈阳农业大学北方线虫研究所提供。
1.1.2 主要试剂和仪器试验所用PCR引物和实时荧光定量PCR引物由生工生物工程(上海)股份有限公司合成(表 1);氨苄霉素、安普霉素、PEG1000、LB培养基购自生工生物工程(上海)股份有限公司;植物基因组DNA提取试剂盒(Hi-DNAsecure Plant Kit)、DNA产物纯化试剂盒(TIANgel Midi Purification Kit)、质粒提取试剂盒(TIANprep Mini Plasmid Kit)、RNAprep Pure培养细胞/细菌总RNA提取试剂盒(RNAprep Pure Cell/Bacteria Kit)购自北京天根生化科技有限公司;限制性内切酶Xba Ⅰ、Nde Ⅰ购自宝生物工程有限公司;GABA检测试剂盒购自上海岚派生物有限公司。
| 引物名称Primers name | 引物序列Sequences (5′→3′) |
| RT-PCR -gabT-F1 | CGTTCTAGAATCCCCGGTCCGAAGTCGCAGGA |
| RT-PCR -gabT-R1 | CGTTCTAGAGTGACCCAGGACCTCTCCAAGA |
| qRT-PCR -gabT-F2 | TTGGCGGTGGTGATGAG |
| qRT-PCR -gabT-R2 | CAACGGCATCGTCTTCGT |
| 16S rRNA-F | GCAGGCTAGAGTTCGGTAG |
| 16S rRNA-R | CTCCTCAGCGTCAGTATCG |
电泳仪,北京六一生物科技有限公司;PCR仪,Bio-Rad公司;空气恒温摇床,北京北方同正生物技术发展公司;冷冻离心机,基因有限公司;恒温培养振荡器,上海智城分析仪器制造有限公司;超净工作台,苏州净化有限公司。
1.1.3 试验所用培养基和缓冲液高氏一号培养基(g/L):可溶性淀粉20.00,MgSO4·7H2O 0.50,KNO3 1.00,K2HPO4 0.50,NaCl 0.50,FeSO4 0.001 0,琼脂10.00。
优化高氏一号培养基:固定其他成分,再加入(NH4)2SO4 0.50 g/L,花生饼粉20.00 g/L。
SM培养基(g/L):葡萄糖10.00,蛋白胨4.00,酵母抽提物4.00,K2HPO4 4.00,KH2PO4 0.20,MgSO4 0.05。
R2YE培养基(g/L):蔗糖103.0,琼脂20.0,蛋白胨2.0,葡萄糖10.0,酵母抽提物1.0,MgCl2·6H2O 4.0,100.0 mL 2.78% CaCl2,2.0 mL微量元素溶液。
微量元素溶液(Trace element solution,g/L):ZnCl2 0.04,CuCl2·2H2O 0.01,FeCl3·6 H2O 0.20,MnCl2·4H2O 0.01,(NH4)6Mo7O4·4H2O 0.01,Na2B4O7·10H2O 0.01。
高渗溶液(PB,g/L):蔗糖103.00,K2SO4 0.25,MgCl2·6H2O 2.02,KH2PO4 0.05,2.00 mL微量元素溶液,0.25 mol/mL TES溶液100.00 mL,2.78% CaCl2溶液100.00 mL。
1.2 方法 1.2.1 杀线虫活性的检测Snea253杀线虫活性的检测:选取活跃的南方根结线虫二龄幼虫(J2)作为靶标线虫,在每个贝氏小皿中加入500 μL生防菌Snea253发酵滤液和约100条南方根结线虫J2,以500 μL液体培养基为对照,每个处理均重复3次,于24 h后观察J2的死亡情况,计算线虫死亡率和校正死亡率:

|

|
琥珀酸杀线虫活性检测:选取活跃的南方根结线虫J2作为靶标线虫,用琥珀酸溶液对J2进行杀线虫活性检测。在贝氏小皿中分别加入500 μL浓度为50、100、200、500、1 000、2 000 μg/mL的琥珀酸标准品和100条南方根结线虫J2,以500 μL ddH2O为对照,共7个处理,均重复3次,将其置于25 ℃温箱中,分别于24、48 h后观察线虫的死亡情况,并计算线虫死亡率和校正死亡率。
1.2.2 发酵液中GABA和琥珀酸含量的检测用高氏一号液体培养基摇瓶培养菌株5 d后,检测菌株发酵液中GABA和琥珀酸含量。GABA含量按照GABA试剂盒操作说明书进行。
用高效液相色谱法检测琥珀酸含量,色谱条件为:色谱柱为Kromasil C18色谱柱,柱温为30 ℃,流动相为100%甲醇:0.02 mol/L KH2PO4 (pH 2.5)为7:93,流速为0.5 mL/min,进样量为10 μL,检测波长为214 nm。标准品的制备:称取适量的琥珀酸标准品分别用流动相稀释到浓度为2 000、1 500、1 000、500、200、100 μg/mL的储备液。样品的处理:将500 mL发酵滤液旋蒸浓缩至5 mL,用等体积的乙酸乙酯萃取3次,回收乙酸乙酯液继续旋转蒸发浓缩至2 mL,微孔滤膜过滤,液相色谱检测。
1.2.3 表达载体pIB139-gabT的构建根据gabT基因的序列信息,设计含NdeⅠ和XbaⅠ位点的引物(表 1),以生防菌Snea253野生型的DNA为模板,用高保真酶进行PCR扩增。PCR反应体系:高保真酶Prime STAR HS DNA Polymerase 25 μL,gabT基因的上下游引物各2 μL (0.2 μmol/L),总DNA 4 μL (约50 ng/μL),ddH2O 17 μL。PCR反应条件:98 ℃ 2 min;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 55 s,35个循环;72 ℃ 2 min。使用PCR产物纯化试剂盒对PCR产物进行纯化后,用T4连接酶将基因片段和载体pGEM-T Easy室温连接3 h,通过热激法将连接产物转化到Escherichia coli DH5α感受态细胞中,经50 μg/mL氨苄霉素(Amp)抗性筛选,挑取白色单菌落进行菌落PCR,将阳性单菌落于含终浓度为50 μg/mL Amp的LB液体培养基中,37 ℃、180 r/min培养过夜,提取质粒pGEM-gabT,酶切鉴定。
经酶切验证成功后,用限制性内切酶NdeⅠ和XbaⅠ分别对重组质粒pGEM-gabT和载体pIB139进行双酶切,用T4连接酶连接载体与目的片段,采用热激法转化到E. coli DH5α感受态细胞中。经氨普霉素(50 μg/mL,Apr)抗性筛选,挑取白色单菌落进行菌落PCR,将阳性单菌落于含终浓度为50 μg/mL Apr的LB液体培养基中,37 ℃、200 r/min培养过夜,提取质粒pIB139-gabT,酶切鉴定。
1.2.4 生防菌Snea253原生质体的制备与转化孢子悬液和原生质体的制备方法如下:将100 μL生防菌Snea253弱毒株孢子悬液接入25 mL SM液体培养基中,30 ℃、200 r/min培养36 h后,取5 mL转接到含有0.5%甘氨酸的25 mL SM培养基中,30 ℃、200 r/min培养24 h。取5 mL分装到离心管中,8 000 r/min离心4 min,弃上清。先加入5 mL 10.3%蔗糖溶液,8 000 r/min离心4 min,重复此步骤一次。再加入5 mL PB溶液,操作与加入蔗糖溶液相同。加入5 mg/mL的溶菌酶2 mL,30 ℃消化3 h后再加入5 mL PB溶液,4 000 r/min离心10 min,弃上清。加入5 mL PB溶液,充分振荡,收集滤液,4 000 r/min离心10 min后重悬于l mL PB溶液中。
取制备完好的原生质体加入10 μL pIB139-gabT的质粒,迅速加入1 mL 33% PEG 1000,混匀后加入8 mL PB溶液。4 000 r/min离心10 min,去上清,将原生质体重悬在l mL PB溶液中。将转化的原生质体均匀涂布到R2YE培养基上,30 ℃培养12 h后加入l mL终浓度为150 μg/mL的Apr溶液,在恒温培养箱中30 ℃培养2−3 d。将转化子接到含有30 μg/mL Apr的链霉菌斜面孢子培养基连续培养3代,挑取菌落进行摇瓶培养,保存菌种。
1.2.5 gabT基因表达量的检测用细菌组织提取试剂盒提取过表达菌株的RNA,对其反转录得到cDNA。使用CFX96 Real-Time PCR System,按照SYBR Green PCR Master Mix说明书进行实时荧光定量PCR,16S rRNA基因作为看家基因,其引物序列见表 1。qPCR反应体系:SYBR Green PCR Master Mix 12.5 μL,上、下游引物各1 μL (0.2 μmol/L),cDNA 1.5 μL (100 ng/μL),ddH2O 9 μL。反应条件:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 30 s,采集一次荧光,40个循环;72 ℃ 5 min。
1.2.6 碳源的改变对Snea253的影响以高氏一号培养基的优化配方为基础,固定其他成分,分别加入8种不同的碳源:可溶性淀粉、玉米粉、玉米淀粉、马铃薯淀粉、蔗糖、乳糖、葡萄糖、D(+)麦芽糖,培养Snea253菌株,28 ℃培养5 d后检测生防菌Snea253菌体中gabT基因的相对表达量、发酵液的杀线虫活性及GABA和琥珀酸的含量。
2 结果与分析 2.1 gabT基因过表达结果 2.1.1 pIB139-gabT过表达载体的构建以野生型菌株DNA为模板,进行PCR反应后得到片段大小约为1 300 bp的单一条带(图 1A)。重组质粒pGEM-gabT经限制性内切酶Xba Ⅰ和Nde Ⅰ酶切后得到大小也为1 300 bp的目的条带(图 1B)。用限制性内切酶对pIB139-gabT质粒酶切鉴定,得到大小为1 300 bp的片段(图 1C),表明pIB139-gabT过表达载体构建成功。

|
| 图 1 pIB139-gabT的凝胶电泳分析 Figure 1 Electrophorestic analysis of pIB139-gabT 注:A:gabT基因PCR产物;M:DL2000 DNA marker;1:空对照;2:PCR产物. B:重组质粒pGEM-gabT双酶切鉴定;M:DL15000+2000 DNA marker;1:酶切产物;2:PCR产物. C:重组质粒pIB139-gabT双酶切鉴定;M:DL15000+2000 DNA marker;1:双酶切产物;2:PCR产物. Note: A: PCR products of gabT gene; M: DL2000 DNA marker; 1: Empty control; 2: PCR products. B: Verification of recombinant plasmid pGEM-gabT by double enzyme digestion; M: DL15000+2000 DNA marker; 1: Digest products; 2: PCR products. C: Verification of recombinant plasmid pIB139-gabT by double enzyme digestion; M: DL15000+2000 DNA marker; 1: Digest products; 2: PCR products. |
|
|
提取R-pIB139菌株的RNA,经RT-qPCR检测,过表达菌株R-pIB139中gabT基因的表达量是弱毒株Snea253-R的3.69倍(图 2)。
|
| 图 2 R-pIB139中gabT基因相对表达量 Figure 2 Relative quantity level of gabT gene in R-pIB139 注:*表示经t检验在P < 0.05水平差异显著. Note: * indicate significant different at P < 0.05 level by t test. |
|
|
经不同浓度的琥珀酸(SA)处理南方根结线虫J2,观察线虫死亡情况。如图 3所示,在接种线虫24 h时,琥珀酸的浓度在50−2 000 μg/mL时线虫校正死亡率由28.87%逐渐升高到84.30%;在接种线虫48 h时,琥珀酸的浓度在50−2 000 μg/mL线虫校正死亡率由48.23%逐渐升高到98.75%。试验结果表明琥珀酸对南方根结线虫J2有毒杀效果,其毒杀线虫的效果随着浓度的增大和处理时间的延长而增强。

|
| 图 3 琥珀酸处理南方根结线虫J2的线虫校正死亡率 Figure 3 The corrected mortality of Meloidogyne incognita treated with SA 注:不同浓度的琥珀酸处理南方根结线虫J2在24、48 h的线虫校正死亡率. Note: The corrected mortality of Meloidogyne incognita J2 treated with different concentrations of SA at 24 h and 48 h. |
|
|
利用GABA试剂盒检测菌株Snea253-R和R-pIB139发酵液中GABA含量,Snea253-R中GABA含量比过表达菌株pIB139-gabT中GABA含量高(图 4A)。用高效液相色谱法分别对菌株Snea253-R和R-pIB139中的琥珀酸含量进行检测,色谱图如4C、D。以进样浓度为横坐标,峰面积为纵坐标,得回归方程为Y=0.388 9X+0.671 4 (R2=0.999 8),琥珀酸标准品在浓度为100−2 000 μg/mL范围内与峰面积呈良好的线性关系。根据回归方程,得到Snea253-R和R-pIB139中琥珀酸含量(图 4B),Snea253-R中琥珀酸含量比R-pIB139中含量低。

|
| 图 4 菌株Snea253-R和R-pIB139中GABA和琥珀酸含量 Figure 4 The GABA and SA content of Snea253-R and R-pIB139 strains 注:A:菌株Snea253-R和R-pIB139中GABA的含量;B:菌株Snea253-R和R-pIB139中琥珀酸含量;C:标准品HPLC色谱图;D:试验样品HPLC色谱图. *:P < 0.05. Note: A: The GABA content of Snea253-R and R-pIB139; B: The SA content of Snea253-R and R-pIB139; C: HPLC chromatograms of standard; D: HPLC chromatograms of SA sample. *: P < 0.05. |
|
|
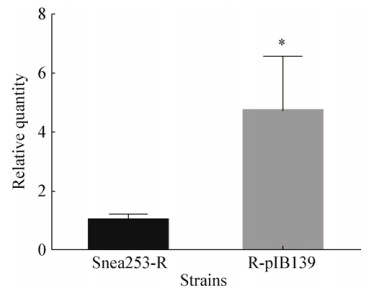
南方根结线虫J2经Snea253-R和R-pIB139发酵滤液处理24 h时,R-pIB139的线虫校正死亡率是66.26%,与线虫校正死亡率是27.47%的Snea253-R相比,线虫校正死亡率提高了39% (图 5)。结果表明,过表达gabT基因能提高Snea253的杀线虫效果。
|
| 图 5 Snea253-R和R-pIB139对南方根结线虫J2的毒力效果 Figure 5 Lethal effect of Snea253-R and R-pIB139 on J2 of Meloidogyne incognita 注:*表示经t检验在P < 0.05水平差异显著. Note: * Indicate significant different at P < 0.05 level by t test. |
|
|
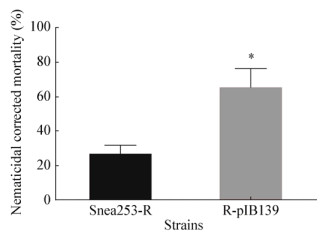
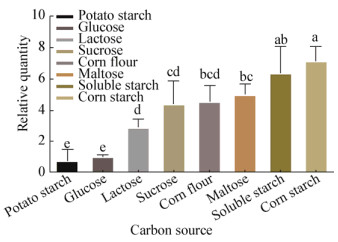
在优化高氏一号培养基中,分别用马铃薯淀粉、葡萄糖、乳糖、蔗糖、麦芽糖、玉米粉、玉米淀粉和可溶性淀粉作为碳源培养生防菌Snea253。如图 6所示,在可溶性淀粉和玉米淀粉作为培养基的碳源时,gabT基因的表达量最高,在马铃薯淀粉和葡萄糖作为培养基的碳源时gabT基因的表达量最低,蔗糖、麦芽糖、玉米粉作为培养基的碳源时gabT基因的表达量差别较小。
|
| 图 6 不同碳源对基因gabT相对表达量的影响 Figure 6 Effect on gene gabT relative quantity of different carbon source 注:不同字母表示经Duncan氏新复极差法检验在P < 0.05水平差异显著. Note: Different letters indicate significance at < 0.05 level by Duncan's new multiple range test. |
|
|
使用酶联免疫法对GABA含量进行检测,如图 7所示,碳源为马铃薯淀粉、葡萄糖时的发酵液中GABA含量较高,其浓度为8.70 ng/mL和9.37 ng/mL;碳源为玉米淀粉和可溶性淀粉时的发酵液中GABA的含量较低,其浓度为6.21 ng/mL和6.11 ng/mL。

|
| 图 7 不同碳源下Snea253中GABA的含量 Figure 7 GABA content of Snea253 in different carbon source 注:不同字母表示经Duncan氏新复极差法检验在P < 0.05水平差异显著. Note: Different letters indicate significance at P < 0.05 level by Duncan's new multiple range test. |
|
|
利用高效液相色谱法分别对不同碳源发酵液中的琥珀酸含量进行检测,以进样浓度为横坐标,峰面积为纵坐标,得回归方程为Y=0.388 9X+0.671 4 (R2=0.999 8),琥珀酸标准品在浓度为100−2 000 μg/mL范围内与峰面积呈良好的线性关系。琥珀酸标准品色谱图如图 4C所示,不同碳源发酵液的琥珀酸色谱图谱如图 8所示。可能是由于其他的代谢产物增多或者不同碳源培养基的发酵液颜色、pH值等存在差异,导致干扰了琥珀酸的检测,也可能由于琥珀酸含量过低,进行了2次试验均未检测出琥珀酸。

|
| 图 8 不同碳源发酵液中琥珀酸的HPLC色谱图 Figure 8 HPLC chromatograms of SA in different carbon source Note: A: Potato starch; B: Glucose; C: Lactose; D: Sucrose; E: Corn flour; F: Maltose; G: Soluble starch; H: Corn starch. |
|
|
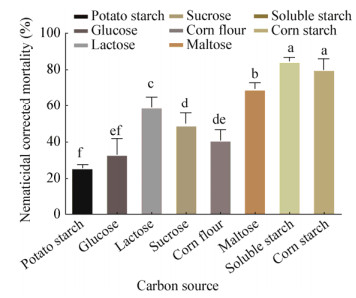
使用优化的高氏一号培养基培养菌株,不同碳源的发酵液中,碳源是可溶性淀粉和玉米淀粉培养的菌株发酵液杀线虫活性较高,线虫校正死亡率是84.8%和79.98%,碳源是马铃薯淀粉、葡萄糖的菌株发酵液杀线虫活性较低,线虫校正死亡率为25.97%和33.27% (图 9)。
|
| 图 9 不同碳源培养条件下Snea253对南方根结线虫J2毒力效果 Figure 9 Lethal effect of Snea253 on Meloidogyne incognita J2 in different carbon source 注:不同字母表示经Duncan氏新复极差法检验在P < 0.05水平差异显著. Note: Different letters indicate significance at < 0.05 level by Duncan's new multiple range test. |
|
|
γ-氨基丁酸转氨酶基因gabT是调控委内瑞拉链霉菌Snea253代谢GABA支路,从而提高杀线虫活性的关键基因之一,GABA支路下游代谢产物如琥珀酸等的合成影响了发酵液的杀线虫活性。同时,不同的碳源改变也影响gabT基因的表达和其他代谢产物的合成从而影响菌株的杀线虫活性。
GABA支路存在于动物、植物和微生物中,并发挥重要作用。该途径的另一个尚未充分研究的作用是将GABA代谢与其生物活性和功能联系起来,研究显示突变GABA-T基因降低了丁香假单胞菌的致病力[22]。在植物中,Bao等[23]在番茄中沉默GABA-T基因,导致番茄中GABA含量升高而琥珀酸含量下降,增强了番茄的耐盐性;Xiong等[24]在蓝藻中敲除GABA-T和琥珀半醛脱氢酶基因减少了琥珀酸的产生。
微生物中GABA支路碳氮代谢作用很多时候可作为TCA循环的替代途径提供琥珀酸[25]。Kamzolova等[8]发现微生物来源的琥珀酸对植物寄生线虫具有毒杀作用。本研究发现,gabT是存在于链霉菌中参与碳代谢的重要基因之一,利用过表达gabT基因调控GABA支路,代谢产物如琥珀酸的合成变化对Snea253杀线虫活性产生重要的影响:过表达菌株R-pIB139中GABA含量降低而琥珀酸含量升高,杀线虫活性也增强,说明GABA途径确实影响了链霉菌的生物活性。
GABA支路在微生物应对环境胁迫和致病性方面都产生着重要影响,如在耐酸性[26]、应激反应[27]和细菌毒力[28]等方面起作用。Renault等[17]研究显示GABA-T是拟南芥抗盐胁迫代谢调控GABA的关键节点。本试验也发现gabT基因的表达受到不同碳源的影响,杀线虫活性随之改变。
gabT基因调控GABA代谢支路影响了链霉菌Snea253杀线虫活性,其中的GABA和琥珀酸都对线虫有一定的作用,但委内瑞拉链霉菌的代谢产物比较复杂,需进一步研究其他碳氮代谢相关基因及其代谢产物,明确其杀线虫产物合成的机理,为我国农林业生产中根结线虫病害的防治提供新的植保技术支持。
| [1] |
Abad P, Favery B, Rosso MN, et al. Root-knot nematode parasitism and host response: molecular basis of a sophisticated interaction[J]. Molecular Plant Pathology, 2003, 4(4): 217-224. DOI:10.1046/j.1364-3703.2003.00170.x |
| [2] |
Zhao L, Duan YX, Bai CM, et al. Occurrence and control of vegetable root-knot nematodes under protected cultivation in Liaoning province[J]. Plant Protection, 2011, 37(1): 105-109. (in Chinese) 赵磊, 段玉玺, 白春明, 等. 辽宁省保护地蔬菜根结线虫发生规律及防治对策[J]. 植物保护, 2011, 37(1): 105-109. DOI:10.3969/j.issn.0529-1542.2011.01.023 |
| [3] |
Gong B, Zhang LL, Sui SL, et al. Effects of garlic straw application on controlling tomato root-knot nematode disease and rhizospheric microecology[J]. Scientia Agricultura Sinica, 2016, 49(5): 933-941. (in Chinese) 巩彪, 张丽丽, 隋申利, 等. 大蒜秸秆对番茄根结线虫病及根际微生态的影响[J]. 中国农业科学, 2016, 49(5): 933-941. |
| [4] |
Stadler M, Anke H, Sterner O. Linoleic acid——the nematicidal principle of several nematophagous fungi and its production in trap-forming submerged cultures[J]. Archives of Microbiology, 1993, 160(5): 401-405. |
| [5] |
Shemshura ON, Bekmakhanova NE, Mazunina MN, et al. Isolation and identification of nematode-antagonistic compounds from the fungus Aspergillus candidus[J]. FEMS Microbiology Letters, 2016, 363(5): 1-9. |
| [6] |
Zuckerman BM, Matheny M, Acosta N. Control of plant-parasitic nematodes by a nematicidal strain of Aspergillus niger[J]. Journal of Chemical Ecology, 1994, 20(1): 33-43. DOI:10.1007/BF02065989 |
| [7] |
Morgunov IG, Kamzolova SV, Dedyukhina EG, et al. Application of organic acids for plant protection against phytopathogens[J]. Applied Microbiology and Biotechnology, 2017, 101(3): 921-932. DOI:10.1007/s00253-016-8067-6 |
| [8] |
Kamzolova SV, Vinokurova NG, Shemshura ON, et al. The production of succinic acid by yeast Yarrowia lipolytica through a two-step process[J]. Applied Microbiology and Biotechnology, 2014, 98(18): 7959-7969. DOI:10.1007/s00253-014-5887-0 |
| [9] |
Botura MB, dos Santos JDG, da Silva GD, et al. In vitro ovicidal and larvicidal activity of Agave sisalana Perr. (Sisal) on gastrointestinal nematodes of goats[J]. Veterinary Parasitology, 2013, 192(1/3): 211-217. |
| [10] |
Dhakal R, Bajpai VK, Baek KH. Production of GABA (γ-Aminobutyric acid) by microorganisms: a review[J]. Brazilian Journal of Microbiology, 2012, 43(4): 1230-1241. DOI:10.1590/S1517-83822012000400001 |
| [11] |
Shelp BJ, Mullen RT, Waller JC. Compartmentation of GABA metabolism raises intriguing questions[J]. Trends in Plant Science, 2012, 17(2): 57-59. |
| [12] |
Shelp BJ, Bozzo GG, Trobacher CP, et al. Hypothesis/review: contribution of putrescine to 4-aminobutyrate (GABA) production in response to abiotic stress[J]. Plant Science, 2012, 193-194: 130-135. DOI:10.1016/j.plantsci.2012.06.001 |
| [13] |
Scott EM, Jakoby WB. Soluble γ-aminobutyric-glutamic transaminase from Pseudomonas fluorescens[J]. Journal of Biological Chemistry, 1959, 234(4): 932-936. |
| [14] |
Shelp BJ, Bown AW, McLean MD. Metabolism and functions of γ-aminobutyric acid[J]. Trends in Plant Science, 1999, 4(11): 446-452. DOI:10.1016/S1360-1385(99)01486-7 |
| [15] |
Zhou L, Shen BB, Bai SY, et al. RNA interference of OsGABA-T1 gene expression induced GABA accumulation in rice grain[J]. Acta Agronomica Sinica, 2015, 41(9): 1305-1312. (in Chinese) 周露, 沈贝贝, 白苏阳, 等. 以RNA干扰γ-氨基丁酸转氨酶1基因(OsGABA-T1)表达提高稻米γ-氨基丁酸(GABA)含量[J]. 作物学报, 2015, 41(9): 1305-1312. |
| [16] |
Simpson JP, Clark SM, Portt A, et al. γ-Aminobutyrate transaminase limits the catabolism of γ-aminobutyrate in cold-stressed Arabidopsis plants: insights from an overexpression mutant[J]. Botany, 2010, 88(5): 522-527. DOI:10.1139/B10-020 |
| [17] |
Renault H. Fiat lux!: phylogeny and bioinformatics shed light on GABA functions in plants[J]. Plant Signaling & Behavior, 2013, 8(6): e24274. |
| [18] |
Renault H, El Amrani A, Berger A, et al. γ-Aminobutyric acid transaminase deficiency impairs central carbon metabolism and leads to cell wall defects during salt stress in Arabidopsis roots[J]. Plant, Cell & Environment, 2013, 36(5): 1009-1018. |
| [19] |
Renault H, Roussel V, El Amrani A, et al. The Arabidopsis pop2-1 mutant reveals the involvement of GABA transaminase in salt stress tolerance[J]. BMC Plant Biology, 2010, 10: 20. DOI:10.1186/1471-2229-10-20 |
| [20] |
Chen LJ, Chen JS, Zheng YN, et al. Identification of actinomycetes strain Snea253 and its activity against soybean cyst nematode[J]. Chinese Journal of Biological Control, 2009, 25(1): 66-69. (in Chinese) 陈立杰, 陈井生, 郑雅楠, 等. 放线菌Snea253的鉴定及对大豆胞囊线虫的抑制作用[J]. 中国生物防治, 2009, 25(1): 66-69. DOI:10.3321/j.issn:1005-9261.2009.01.013 |
| [21] |
Tian CL, Zhu F, Chen JS, et al. Variance analysis of Streptomyces venezuelae Snea253 mutants against Meloidogyne incognita[J]. Journal of Nuclear Agricultural Sciences, 2014, 28(9): 1541-1548. (in Chinese) 田成丽, 朱峰, 陈井生, 等. 链霉菌Snea253菌株的变异分析及对根结线虫活性影响[J]. 核农学报, 2014, 28(9): 1541-1548. |
| [22] |
Tian J, Bryk R, Itoh M, et al. Variant tricarboxylic acid cycle in Mycobacterium tuberculosis: identification of α-ketoglutarate decarboxylase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(30): 10670-10675. DOI:10.1073/pnas.0501605102 |
| [23] |
Bao H, Chen XY, Lv SL, et al. Virus-induced gene silencing reveals control of reactive oxygen species accumulation and salt tolerance in tomato by γ-aminobutyric acid metabolic pathway[J]. Plant, Cell & Environment, 2015, 38(3): 600-613. |
| [24] |
Xiong W, Brune D, Vermaas WFJ. The γ-aminobutyric acid shunt contributes to closing the tricarboxylic acid cycle in Synechocystis sp. PCC 6803[J]. Molecular Microbiology, 2014, 93(4): 786-796. DOI:10.1111/mmi.12699 |
| [25] |
Feehily C, Karatzas KAG. Role of glutamate metabolism in bacterial responses towards acid and other stresses[J]. Journal of Applied Microbiology, 2013, 114(1): 11-24. DOI:10.1111/j.1365-2672.2012.05434.x |
| [26] |
Feehily C, O'Byrne CP, Karatzas KAG. Functional γ-aminobutyrate shunt in Listeria monocytogenes: role in acid tolerance and succinate biosynthesis[J]. Applied and Environmental Microbiology, 2013, 79(1): 74-80. DOI:10.1128/AEM.02184-12 |
| [27] |
Metzner M, Germer J, Hengge R. Multiple stress signal integration in the regulation of the complex σS-dependent csiD-ygaF-gabDTP operon in Escherichia coli[J]. Molecular Microbiology, 2004, 51(3): 799-811. |
| [28] |
Chevrot R, Rosen R, Haudecoeur E, et al. GABA controls the level of quorum-sensing signal in Agrobacterium tumefaciens[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(19): 7460-7464. DOI:10.1073/pnas.0600313103 |
 2019, Vol. 46
2019, Vol. 46