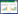扩展功能
文章信息
- 胡海艳, 杜少平, 夏枫耿, 黄魁英, 周世宁
- HU Hai-Yan, DU Shao-Ping, XIA Feng-Geng, HUANG Kui-Ying, ZHOU Shi-Ning
- 甲硫氨酸γ-裂解酶基因在大肠杆菌中的高效表达和活性
- High expression and activity of an L-methionine γ-lyase gene in Escherichia coli
- 微生物学通报, 2019, 46(12): 3225-3232
- Microbiology China, 2019, 46(12): 3225-3232
- DOI: 10.13344/j.microbiol.china.190106
-
文章历史
- 收稿日期: 2019-02-14
- 接受日期: 2019-05-13
- 网络首发日期: 2019-06-20
2. 中山大学生命科学学院 生物防治重点实验室 广东 广州 510275
2. State Key Laboratory for Biocontrol, School of Life Sciences, Sun Yat-sen University, Guangzhou, Guangdong 510275, China
海洋蕴藏着极其丰富的微生物资源和新颖的生物代谢方式,在陆地微生物新型活性物质资源日益枯竭的今天,海洋微生物及其代谢产物成为现今新型生物催化剂和药物开发的一个研究热点。迄今为止绝大部分深海微生物难以在实验室的条件下获得纯培养,成为研究和开发深海微生物资源的一大瓶颈。本研究采用不依赖培养的宏基因组技术,对深海微生物资源进行研究。
甲硫氨酸γ-裂解酶(L-methionine γ-lyase,MGL,又称METase,EC 4.4.1.11),是一种5′-磷酸吡哆醛(Pyridoxal 5′ phosphate,PLP)依赖型的多功能酶,属于γ-蛋白家族。它能催化L-甲硫氨酸及同型半胱氨酸的α, γ-裂解反应。通过MGL来消耗肿瘤组织的L-甲硫氨酸,使具有L-甲硫氨酸依赖性的癌细胞停止分裂,可达到肿瘤治疗的目的。同时,它可以作为同型半胱氨酸血症诊断的一种检测试剂。
在前期工作中,本实验室构建了一个约含39 600个克隆的中国南海深海沉积物Fosmid宏基因组文库,并对其中一个能产生黑色素的克隆子fss6进行了亚克隆,对其中一个片段大小为4 406 bp,含有4个ORF的亚克隆进行了深入研究[1]。在研究过程中,通过对该亚克隆所含ORF的氨基酸序列分析发现,所有ORF的最相近序列均来自Idiomarina属的细菌,该属是2001年由Ivanova等提出的一个新属[2]。在本研究中,对这个宏基因组文库克隆子进行了插入片段全长测序分析,并对其中一个预测的甲硫氨酸γ-裂解酶基因进行了生物信息学分析。
目前不少研究者已经从一些生物体内成功分离提取到MGL,并对其酶学性质进行了初步的研究,然而受产酶条件及产酶水平的影响,限制了天然来源的MGL在实验研究及商业化生产中的有效应用,因此MGL的异源表达成为研究热点。此研究使用本实验室构建好的深海宏基因组文库中的甲硫氨酸γ-裂解酶基因(mgl),克隆至大肠杆菌中并优化表达条件,以达到高效表达的目的。
1 材料与方法 1.1 菌种、质粒fss6为本实验室构建的南海深海沉积物宏基因组文库的一个克隆子,对其插入的片段进行了全长测序,本文克隆表达的基因mgl为其插入片段中的一个基因。
大肠杆菌DH5α、BL21(DE3)以及原核表达载体pET-28a(+)均由本实验室保存。
1.2 主要试剂和仪器Nde I、Xho I酶、蛋白质Marker SM0431,MBI Fermentas公司;质粒小量提取试剂盒(MiniBEST Plasmid Purification Kit)、DNA片段纯化试剂盒(DNA Fragment Purification Kit),宝生物工程(大连)有限公司;DNA回收试剂盒,天根生化科技(北京)有限公司。
SONICS超声波破碎仪,南京新辰生物科技有限公司;Biologic LP低压蛋白层析系统,Bio-Rad公司;TGRADIENT96温度梯度PCR仪,Biometra公司;DYY-6C型双稳定恒压恒流电泳仪,北京六一生物科技有限公司。
1.3 表达载体的构建与鉴定PCR扩增mgl基因,用1% (质量体积比)琼脂糖凝胶电泳检测,在紫外线下观察到目的片段后进行回收纯化,分别对回收纯化产物和载体pET-28a(+)进行Nde I和Xho I双酶切。酶切产物用1% (质量体积比)琼脂糖凝胶进行电泳分离,用DNA回收试剂盒回收目的基因。将纯化的目的mgl基因和线性化的pET-28a(+)用T4连接酶过夜连接,连接产物转化Escherichia coli DH5α感受态细菌。对在含有抗生素的LB平板上长出的单菌落用菌落PCR的方法进行鉴定,经初步鉴定为阳性的重组子,再次培养后进行测序,以确认克隆的基因是否与原序列一致。
1.4 重组载体pET-mgl转化E. coli BL21(DE3)及表达取鉴定正确的携带pET-mgl重组质粒的E. coli DH5α接种培养,提取质粒,转化感受态表达宿主菌E. coli BL21(DE3),转化后进行菌落PCR鉴定。选取鉴定过的克隆子命名为pET-mgl/BL21,作为基因mgl的大肠杆菌工程菌株。
挑选单菌落,接种于含50 μg/mL Kan的LB液体培养基中,37 ℃、200 r/min培养过夜。取培养菌液按1:100的比例进行放大培养,至菌体密度OD600达到0.6−0.8 (大致需要3 h),加入100 mmol/L IPTG至终浓度为1 mmol/L。仍在37 ℃、200 r/min振荡诱导培养9−10 h。收集诱导培养的菌体超声破碎,破碎液于4 ℃、22 000×g离心20 min,取上清液作为粗酶液,对重组蛋白(命名为rMGL,以区别其他文献报道的未经克隆重组表达的MGL)进行SDS-PAGE检测以及蛋白质含量和酶活测定。
1.5 重组蛋白表达条件的优化参照1.3方法,分别对诱导温度(37、30、25、20、15 ℃),诱导剂浓度(0、0.1、0.2、0.3、0.4、0.5、0.8、1.0 mmol/L),诱导时间(8、10、12、14、16、18 h)等表达条件进行优化,通过SDS-PAGE分析,同时测试各诱导培养时间的粗酶液的可溶性蛋白含量、酶活和比活。确定最佳表达条件。
1.6 重组蛋白提取条件的优化采用Ni2+-亲和层析的方法进行纯化。将层析柱固定在铁架台上,用0.2 mol/L的NiSO4溶液过柱后,用起始缓冲液(40 mmol/L磷酸钾缓冲液,0.1 mmol/L PMSF,pH 7.2)平衡层析柱。将制备的粗酶上清液以1.0 mL/min的流速加入预处理的层析柱,分别用含40、80、160、200、300、400 mmol/L咪唑的洗涤缓冲液进行洗脱,分部收集洗脱液,进行SDS-PAGE检测。
1.7 重组蛋白酶含量及活性测试可溶性蛋白含量用蛋白质定量试剂盒进行测定,按照说明书的步骤进行操作。酶活性测定按照Tanaka等的方法进行[3],pH 8.0、37 ℃反应条件下,每分钟催化L-甲硫氨酸生成1.0 μmol α-丁酮酸的酶量定义为1酶活单位(U),酶的比活(Specific activity,SA)定义为:每毫克蛋白所含的酶活单位,单位为U/mg。
2 结果与分析 2.1 基因mgl在BL21(DE3)宿主菌中的鉴定随机挑取抗性平板上的若干个菌落,采用菌落PCR扩增的方法,大部分克隆子获得与预期目标编码基因mgl大小相符的片段(约1 300 bp)。经测序证实所获得的PCR片段与mgl序列完全一致,说明mgl已经正确连接至pET-28a(+)载体,并成功转入E. coli DH5α中。菌落PCR鉴定结果如图 1所示。
|
| 图 1 部分pET-mgl-DH5α转化子的PCR鉴定 Figure 1 Colony PCR of random selected pET-mgl-DH5α transformants 注:M:DL2000;1−10:随机挑选的转化子PCR测试. Note: M: DL2000; 1−10: PCR products of random selected transformants. |
|
|
将测序证实的E. coli DH5α克隆子培养,提取质粒,转化BL21(DE3)表达宿主,随机挑取抗性平板上的若干个BL21(DE3)克隆子进行菌落PCR验证,菌落PCR鉴定如图 2所示,所有克隆子均有目标条带,这些阳性克隆子则为携带pET-mgl重组质粒的工程表达菌株(命名为pET-mgl/BL21(DE3))。

|
| 图 2 部分pET-mgl/BL21(DE3)转化子PCR鉴定 Figure 2 Colony PCR of random selected pET-mgl-BL21(DE3) transformants 注:M:DL2000;1−10:随机挑选的转化子PCR测试;11:阴性对照. Note: M: DL2000; 1−10: PCR products of random selected transformant; 11: Negative control. |
|
|
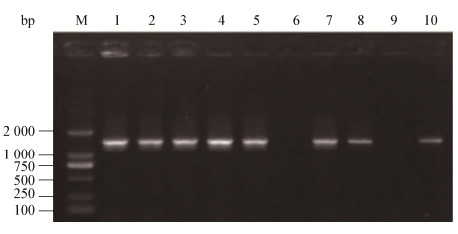
由pET-mgl/BL21表达的重组蛋白rMGL带有His-Tag,用Ni2+-亲和层析的方法进行纯化,通过咪唑浓度梯度洗脱回收,获得纯度较高的蛋白(图 3),可用于下一步的实验。
|
| 图 3 重组蛋白rMGL的纯化 Figure 3 The purification of rMGL protein 注:M:蛋白标记SM0431;1:Ni2+亲和提取纯化的rMGL;2:pET-mgl发酵后的可溶性蛋白.箭头指示部位为46 kD的rMGL. Note: M: Protein marker SM0431; 1: Purified rMGL protein by Ni2+-affinity column; 2: The soluble extract fractions of cells transformed with pET-mgl. The arrow points to the rMGL protein band of 46 kD. |
|
|
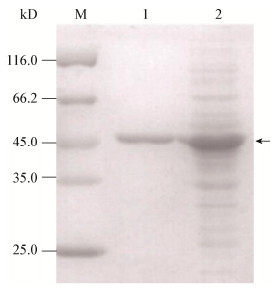
在酶液的SDS-PAGE、可溶性蛋白含量及酶活性测定中可知,在25−37 ℃温度范围内,随着诱导温度的降低,粗酶液中的可溶性蛋白含量、酶活及比活均有明显增加。而当诱导培养温度继续降低,由于菌体生长速度减缓,粗酶液中的可溶性蛋白含量、酶活及比活有所下降。综合菌体生长速度和蛋白表达量来考虑,选择25 ℃作为rMGL诱导表达的最适温度(图 4)。
|
| 图 4 rMGL蛋白诱导表达温度的优化 Figure 4 Optimization of induction temperature for rMGL overexpression 注:M:蛋白标记SM0431;1−5:pET-mgl/BL21在37、30、25、20、15 ℃分泌表达的粗酶液;6−10:pET-mgl/BL21在37、30、25、20、15 ℃菌体碎片上的蛋白.箭头所示部位为rMGL. Note: M: Protein marker SM0431; 1−5: The cells extraction of pET-mgl/BL21 incubated at 37, 30, 25, 20, 15 ℃; 6−10: The cells fragments of pET-mgl/BL21 incubating at 37, 30, 25, 20, 15 ℃. The arrow points to the position of rMGL. |
|
|
与不加IPTG的对照相比,加入终浓度为0.1 mmol/L的IPTG即可获得明显的诱导效果,重组子表达出大量可溶的rMGL蛋白,而在细胞破碎物沉淀中rMGL的含量较低。在IPTG终浓度在0.1−0.5 mmol/L的范围内,rMGL的表达量在SDS-PAGE中没有呈现出明显的变化;而当IPTG的终浓度达到0.8 mmol/L和1.0 mmol/L时,rMGL表达量略有下降。综合考虑,确定添加至培养物中IPTG的终浓度为0.2 mmol/L (图 5)。

|
| 图 5 rMGL表达IPTG诱导浓度的优化 Figure 5 Optimization of IPTG concentration for rMGL overexpression 注:经不同浓度IPTG诱导pET-mgl/BL21产生蛋白的SDS-PAGE图. 1−8分别表示0、0.1、0.2、0.3、0.4、0.5、0.8、1.0 mmol/L IPTG的浓度. M:蛋白标记SM0431;箭头所示部位为rMGL. Note: SDS-PAGE of the cells extraction of pET-mgl/BL21 induced by different concentration of IPTG. 1−8 represent the concentration of IPTG are 0, 0.1, 0.2, 0.3, 0.4, 0.5, 0.8, 1.0 mmol/L. M: Protein marker SM0431; The arrow points to the position of rMGL. |
|
|
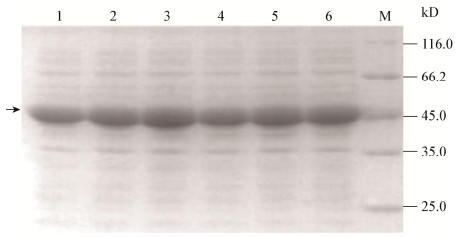
从粗酶液的SDS-PAGE和可溶性蛋白含量及酶活性测定来看,rMGL的表达量在8−12 h的诱导时间内随时间的延长而增加,到达12 h后表达量基本达到稳定。酶活性单位则随诱导时间延长而呈先提高后降低的趋势,在12 h时达到最大值:每100 mL培养物产酶623.9 U。根据实验数据,确定最佳诱导时间为12 h (图 6)。
|
| 图 6 rMGL表达最佳诱导时间的优化 Figure 6 Optimization of induction time for rMGL overexpression 注:M:蛋白标记SM0431;1−6分别表示pET-mgl/BL21经8、10、12、14、16、18 h诱导产生的蛋白图;箭头所示部位为rMGL. Note: M: Protein marker SM0431; 1−6 represent the cells extraction of pET-mgl/BL21 incubated for 8, 10, 12, 14, 16, 18 h. The arrow points to the position of rMGL. |
|
|
采用Ni2+-亲和层析的方法对重组蛋白进行纯化,重点对不同浓度咪唑缓冲液进行了洗脱的优化。从图 7可得出,40、80 mmol/L咪唑浓度洗脱液进行洗脱时,主要是去除杂蛋白;160、200、300、400 mmol/L均能洗脱目的蛋白,500 mmol/L咪唑浓度洗脱液在OD320已经检测不出数据,证明目的蛋白已被完全洗脱。所以最终洗脱条件为:起始缓冲液中加入40 mmol/L咪唑浓度,用80 mmol/L咪唑浓度洗脱杂蛋白,用400 mmol/L咪唑浓度梯度洗脱目的蛋白。

|
| 图 7 不同咪唑洗脱浓度洗脱rMGL的优化 Figure 7 Optimization of imidazole concentration for rMGL purification 注:1:粗酶液;2:40 mmol/L咪唑流穿液;3−8:40、80、160、200、300、400 mmol/L咪唑洗脱液. Note: 1: Crude enzymes; 2: 40 mmol/L imidazole washing fluid penetration; 3−8: 40, 80, 160, 200, 300, 400 mmol/L imidazole washing collection solution. |
|
|
以rMGL对L-甲硫氨酸的活性为100%,对DL-同型半胱氨酸、L-半胱氨酸及L-胱氨酸的相对活性如图 8所示。rMGL不仅能作用于L-甲硫氨酸,也能催化DL-同型半胱氨酸的γ-裂解,而且对DL-同型半胱氨酸的活性约为对L-甲硫氨酸活性的1.4倍;但几乎不能作用于L-半胱氨酸及L-胱氨酸(相对活性分别为3.59%和0.38%)。

|
| 图 8 rMGL对不同底物的相对活性 Figure 8 Relative activity of rMGL on different substrates |
|
|
对MGL的研究已经有30多年,主要来源是微生物,包括细菌和某些原生动物。此类酶最早于1951年在E. coli中发现,并将它最初命名为“甲硫氨酸酶” (Methionase,METase)[3]。随后几十年间又陆续报道了从细菌Pseudomonas putida (=ovalis)、Clostridium sporogenes、Aeromonas sp.、Citrobacter intermedius、Citrobacter freundii、Brevibacterium linens、Porphyromonas gingivalis等和原生动物Entamoeba histolytica和Trichomonas vaginalis中发现了该类酶[4-12],如今将其命名为甲硫氨酸γ-裂解酶。最近,在植物Arabidopsis thaliana中也发现了MGL的存在[13]。但是至今在酵母、高等哺乳动物和人中缺乏有生物活性的MGL的报道。之后的研究表明,虽然来源不同,但该酶几乎都是由4个相同亚基组成的四聚体。2个亚基单体聚合成有活性的二聚体,2个二聚体通过对称结合在一起形成全酶,四聚体的形成可以增加酶的稳定性,便于PLP的结合,并形成4个活性位点。
本文首次从深海宏基因组文库中筛选得到mgl基因。基于测序的宏基因组文库筛选方法,是一种开放式的筛选策略,它能最大限度获得宏基因组文库中的各种序列信息,在环境微生物多样性的研究、新基因和基因簇的发现以及未培养微生物基因组的重建方面发挥着重要作用。MGL最重要的应用在于它的抗肿瘤活性。关于其对多种肿瘤的抑制作用目前已经有不少报道[14-16]。
虽然目前已发现并纯化了多种MGL,但真正能够作为药物使用的为数并不多,这主要是因为作为药物使用的MGL需要具有高活性和高纯度,获得大量表达。国内马百坤等使用来源于人阴道毛滴虫的甲硫氨酸裂解酶基因在大肠杆菌DH5α表达,获得的产量难以进一步提高[17];孔晨虹等同样使用人阴道毛滴虫的甲硫氨酸裂解酶基因在大肠杆菌BL21(DE3)表达,但会形成蛋白包涵体,大大减少了产量[18]。在本实验中选择pET-28a(+)载体和大肠杆菌BL21(DE3)宿主表达MGL蛋白。pET系统的高表达水平容易导致表达蛋白在大量表达时发生错误折叠,形成没有活性的包涵体。在本研究中,通过优化诱导温度和诱导剂浓度及诱导时间,使目的蛋白在细胞内得到了大量表达,且以四聚体的可溶性活性蛋白形式存在,不需经过如孔晨虹等报道的蛋白酶需要复性处理,根据优化后的诱导培养条件进行诱导培养,通过SDS-PAGE的凝胶成像分析,重组蛋白rMGL约占可溶性总蛋白的53% (高于马百坤等[17]报道的34%),粗酶液在最终的优化条件下诱导表达的酶活值可达到近900 U/100 mL培养物,其产量高于国内外报道[3, 17-18],说明利用pET-28a(+)/BL21(DE3)表达rMGL的有效性。
在酶活研究中,rMGL能催化L-甲硫氨酸和DL-同型半胱氨酸的裂解,但几乎不作用于L-半胱氨酸和L-胱氨酸,其中对DL-同型半胱氨酸的催化效率比对L-甲硫氨酸的催化效率高,相对活性约为对L-甲硫氨酸催化效率的1.4倍。预示着该蛋白在高半胱氨酸血症的临床检测中同样具有十分重要的作用,极具药物开发的价值。
4 结论来自深海宏基因组文库中的mgl基因能够利用pET-28a(+)/BL21(DE3)高效表达。rMGL能催化L-甲硫氨酸和DL-同型半胱氨酸的裂解,但几乎不作用于L-半胱氨酸和L-胱氨酸,在抗肿瘤和心血管疾病诊断试剂盒方面具有较好的开发前景。
| [1] |
Huang YL, Lai XT, He XC, et al. Characterization of a deep-sea sediment metagenomic clone that produces water-soluble melanin in Escherichia coli[J]. Marine Biotechnology, 2009, 11(1): 124-131. |
| [2] |
Ivanova EP, Mikhailov VV. A new family, Alteromonadaceae fam. nov., including marine proteobacteria of the genera Alteromonas, Pseudoalteromonas, Idiomarina, and Colwellia[J]. Microbiology, 2001, 70(1): 10-17. |
| [3] |
Tanaka H, Esaki N, Soda K. Properties of L-methionine γ-lyase from Pseudomonas ovalis[J]. Biochemistry, 1997, 16(1): 100-106. |
| [4] |
Ohigashi K, Tsunetoshi A, Ichihara K. The role of pyrioxal in methylmercaptan formation, partial purification and resolution of methioninase[J]. Medical Journal of Osaka University, 1951, 2(2): 111-117. |
| [5] |
Kreis W, Hession C. Isolation and purification of L-methionine- α-deamino-γ-mercaptomethane-lyase (L-methioninase) from Clostridium sporogenes[J]. Cancer Research, 1973, 33(8): 1862-1865. |
| [6] |
Nakayama T, Esaki N, Sugie K, et al. Purification of bacterial L-methionine γ-lyase[J]. Analytical Biochemistry, 1984, 138(2): 421-424. DOI:10.1016/0003-2697(84)90832-7 |
| [7] |
Lockwood BC, Coombs BH. Purification and characterization of methionine γ-lyase from Trichomonas vaginalis[J]. The Biochemical Journal, 1991, 279: 675-682. DOI:10.1042/bj2790675 |
| [8] |
Faleev NG, Troitskaya MV, Paskonova EA, et al. L-Methionine-γ-lyase in Citrobacter intermedius cells: stereochemical requirements with respect to the thiol structure[J]. Enzyme and Microbial Technology, 1996, 19(8): 590-593. DOI:10.1016/S0141-0229(96)00071-3 |
| [9] |
Dias B, Weimer B. Purification and characterization of L-methionine γ-lyase from Brevibacterium linens BL2[J]. Applied and Environmental Microbiology, 1998, 64(9): 3327-3331. |
| [10] |
Yoshimura M, Nakano Y, Yamashita Y, et al. Formation of methyl mercaptan from L-methionine by Porphyromonas gingivalis[J]. Infection and Immunity, 2000, 68(12): 6912-6916. DOI:10.1128/IAI.68.12.6912-6916.2000 |
| [11] |
Tokoro M, Asai T, Kobayashi S, et al. Identification and characterization of two isoenzymes of methionine γ-lyase from Entamoeba histolytica: a key enzyme of sulfur-amino acid degradation in an anaerobic parasitic protist that lacks forward and reverse trans-sulfuration pathways[J]. The Journal of Biological Chemistry, 2003, 278(43): 42717-42727. DOI:10.1074/jbc.M212414200 |
| [12] |
Manukhov IV, Mamaeva DV, Rastorguev SM, et al. A gene encoding L-methionine γ-lyase is present in Enterobacteriaceae family genomes: identification and characterization of Citrobacter freundii L-methionine γ-lyase[J]. Journal of Bacteriology, 2005, 187(11): 3889-3893. DOI:10.1128/JB.187.11.3889-3893.2005 |
| [13] |
Rébeillé F, Jabrin S, Bligny R, et al. Methionine catabolism in Arabidopsis cells is initiated by a γ-cleavage process and leads to S-methylcysteine and isoleucine syntheses[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(42): 15687-15692. DOI:10.1073/pnas.0606195103 |
| [14] |
Miki K, Xu MX, An ZL, et al. Survival efficacy of the combination of the methioninase gene and methioninase in a lung cancer orthotopic model[J]. Cancer Gene Therapy, 2000, 7(2): 332-338. DOI:10.1038/sj.cgt.7700103 |
| [15] |
Kokkinakis DM. Methionine-stress: a pleiotropic approach in enhancing the efficacy of chemotherapy[J]. Cancer Letters, 2006, 233(2): 195-207. DOI:10.1016/j.canlet.2005.02.034 |
| [16] |
Peron K, Jones TN, Gauthier SA, et al. Targeting of a novel fusion protein containing methioninase to the urokinase receptor to inhibit breast cancer cell migration and proliferation[J]. Cancer Chemotherapy and Pharmacology, 2003, 52(4): 270-276. DOI:10.1007/s00280-003-0666-0 |
| [17] |
Ma BK, Wang HB. High expression of the L-methionine γ-lyase gene in E. coli[J]. Journal of Medical Postgraduates, 2008, 21(4): 353-355, 359. (in Chinese) 马百坤, 王红兵. 蛋氨酸裂解酶基因在大肠杆菌中的高效表达[J]. 医学研究生学报, 2008, 21(4): 353-355, 359. DOI:10.3969/j.issn.1008-8199.2008.04.005 |
| [18] |
Kong CH, Xia LL, Xu SL, et al. Expression, renaturation and activity of recombinant methionine γ-lyase expressed as inclusion body in E. coli[J]. Biotechnology Bulletin, 2010(4): 189-193. (in Chinese) 孔晨虹, 夏立亮, 徐顺利, 等. 重组蛋氨酸裂解酶的表达、复性及活性研究[J]. 生物技术通报, 2010(4): 189-193. |
 2019, Vol. 46
2019, Vol. 46