扩展功能
文章信息
- 杨燕, 郑珂, 潘梅, 唐蕾
- YANG Yan, ZHENG Ke, PAN Mei, TANG Lei
- 大肠杆菌rhtA缺失对血红素合成的影响
- The effect of rhtA deletion on heme synthesis in Escherichia coli
- 微生物学通报, 2019, 46(12): 3216-3224
- Microbiology China, 2019, 46(12): 3216-3224
- DOI: 10.13344/j.microbiol.china.190117
-
文章历史
- 收稿日期: 2019-02-20
- 接受日期: 2019-04-25
- 网络首发日期: 2019-05-31
2. 江南大学生物工程学院 江苏 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi, Jiangsu 214122, China
卟啉(Porphyrin)是自然界中普遍存在的一类色素辅因子,基于4个吡咯环(四吡咯)结构,用于各种生物过程,包括储存和运输氧分子(肌红蛋白和血红蛋白)、氧化磷酸化的电子传递(细胞色素b和c)和烃类氧化(细胞色素P450和细胞色素氧化酶)等[1]。血红素(Heme)也叫铁卟啉[2],其分子结构由一个PPⅨ和一个Fe2+或者Fe3+构成,是过氧化物酶等多种酶的辅因子,有载氧、贮氧、促进氧化还原、进行电子传递等重要生物学功能[3]。
卟啉应用广泛,可用作药物、保健品;同时也是半合成血卟啉(Haematoporphyrin,HP)及其衍生物(Hematoporphyrin derivatives,HPD)、原卟啉钠(Protoporphrin disodium)的原料[4]。因其化学合成存在一些困难且产率较低[5],所以生物合成卟啉意义重大。但由于卟啉本身具有较强的生理毒性[6],在生物体内的合成受到严格调控,所以利用生物法合成卟啉的关键在于了解不同生物体中卟啉的调控机制,而目前卟啉的调控机制尚不明确[7]。大肠杆菌作为基因工程的常用宿主,以C5途径合成各种卟啉物质[8](图 1),用于血红素生产或者用于表达血红素结合蛋白。如何大量合成所需的卟啉物质,一直存在很大困扰[9]。

|
| 图 1 大肠杆菌血红素代谢途径 Figure 1 The heme metabolism pathway in E. coli 注:GltX:谷氨酰t-RNA合成酶;HemA:谷氨酰t-RNA还原酶;HemL:ALA合成酶;HemB:ALA脱水酶;HemC:PBG脱氨酶;HemD:尿卟啉原Ⅲ合酶;HemE:尿卟啉原脱羧酶;HemF:粪卟啉原氧化脱羧酶;HemG:原卟啉原氧化酶;HemH:铁螯合酶;α-KG:α-酮戊二酸;GSA:谷氨酰-1-半醛;ALA:5-氨基乙酰丙酸;PBG:胆色素原;HMB:羟甲基胆色烷. Note: GltX: Glutamyl t-RNA synthetase; HemA: Glutamyl t-RNA reductase; HemL: ALA synthase; HemB: ALA dehydratase; HemC: PBG deaminase; HemD: Uroporphyrinogen Ⅲ synthase; HemE: Uroporphyrinogen decarboxylase; HemF: Coproporphyrinogen oxidative decarboxylase; HemG: Protoporphyrinogen oxidase; HemH: Iron chelatase; α-KG: Alpha-ketoglutaric acid; GSA: Glutamine-1-semialdehyde; ALA: 5-aminolevulinic acid; PBG: Choline pigment; HMB: Hydroxymethyl cholestane. |
|
|
RhtA (rhtA编码)是一类氨基酸二级转运蛋白,参与大肠杆菌中苏氨酸和高丝氨酸的外排[10],经鉴定RhtA也是大肠杆菌中5-氨基乙酰丙酸(5-Aminolevulinic,ALA)的外运蛋白[11]。ALA是一种天然存在的非蛋白质类氨基酸[12],是卟啉合成的重要前体物质[13]。hemA编码ALA合成的关键酶(谷氨酰t-RNA还原酶)[14],过表达hemA有利于ALA和卟啉含量的提高[15]。有研究表明过表达rhtA加速了ALA的外排并且使得ALA产量提高了45.9%[16],但大量ALA会被RhtA蛋白转运到胞外[17]。
本文采用Red同源重组,敲除E. coli BL21(DE3)中的rhtA,减少血红素代谢途径中前体物质ALA的外运,同时过表达hemA,检测C5途径中的各代谢产物以及基因表达水平,探讨敲除rhtA对卟啉合成的影响。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒与引物实验中所用到的菌株和质粒相关信息见表 1,本研究中所用引物由上海赛百盛基因技术有限公司合成,引物详细信息见表 2。
| 质粒/菌株 Plasmids/Strains |
特性 Characteristics |
来源/参考文献 Sources/References |
| Plasmids | ||
| pET-28a | Expression plasmid, T7 promoter, KanR | [15] |
| pET-22b | Expression plasmid, T7 promoter, AmpR | TaKaRa |
| pKD4, pKD46, pCP20 | Red homologous recombination knockout plasmids | [18] |
| pEUTD | pET-22b inserted with UrhtA, Kan2 and DrhtA | This study |
| pER | pET-28a inserted with rhtA | This study |
| pEA | pET-28a inserted with hemA | [15] |
| Strains | ||
| E. coli BL21(DE3) | F–ompT gal dcm lon hsdSB (rB–mB–; E. coli B strain), with DE3, a λ prophage carrying the T7 RNA pol gene | [15] |
| E. coli BL21(DE3)ΔrhtA | E. coli BL21(DE3) deleted rhtA | This study |
| E. coli BL21(DE3)ΔrhtA/pER | E. coli BL21(DE3)ΔrhtA transformed with plasmid pER | This study |
| E. coli BL21(DE3)/pEA | E. coli BL21(DE3) transformed with plasmid pEA | [15] |
| E. coli BL21(DE3)ΔrhtA/pEA | E. coli BL21(DE3)ΔrhtA transformed with plasmid pEA | This study |
| 引物 Primers |
引物序列 Primers sequence (5′→3′) |
大小 Sizes (bp) |
| UrhtAF | ggataacaattccccTCTAGACATCCAGCATTTCATGTACGGC | 43 |
| UrhtAR | cagctccagcctacacaatATTTACATTTCTGCATGGTTATGCA | 44 |
| DrhtAF | ttcccatgtcaCCTTTCTCCCACAAATATCTAGACTTAA | 39 |
| DrhtAR | gtggtggtggtggtgCTCGAGTCAGGTTGAAACCGCCCA | 39 |
| rkanF | tATTGTGTAGGCTGGAGCTGCTT | 23 |
| rkanR | ggagaaaggTGACATGGGAATTAGCCATGG | 30 |
| KrhtAF | CATCCAGCATTTCATGTACGGCAAT | 25 |
| KrhtAR | TCAGGTTGAAACCGCCCATTTTGT | 24 |
| QrhtAF | ATCCAGATGATCGATCAGTGCG | 22 |
| QrhtAR | GCTGTTGTCTTCTTCATAGCGG | 22 |
| rhtA1F | atgggtcgcggatccGAATTCTTAATTAATGTCTAATTCTTTTATTTTGCTC | 52 |
| rhtA1R | gtggtggtggtggtgCTCGAGATGCCTGGTTCATTACGTAAAATG | 45 |
| 注:表格中下划线标注为酶切位点序列,小写字母表示同源臂序列. Note: The sequences of restriction sites are underlined and the sequences of homologous arms are indicated with lowercase letters. |
||
限制性内切酶EcoR I、Hind Ⅲ、Xba I、Xho I和T4 DNA连接酶,质粒提取、纯化试剂盒,TaKaRa公司;ClonExpress®Ⅱ One Step Cloning Kit、ClonExpress® MultiS One Step Cloning Kit,南京诺唯赞生物科技有限公司;5-氨基乙酰丙酸盐酸盐标准品,氯高铁血红素(Hemin)及草酸,Sigma公司;尿卟啉Ⅲ盐酸盐(Uroporphyrin Ⅲ dihydrochloride,UⅢ)、粪卟啉Ⅲ盐酸盐(Coproporphyrin Ⅲ dihydrochloride,CⅢ)标准品,Frontier Scientific公司;原卟啉Ⅸ (Protoporphyrin Ⅸ,PPⅨ)标准品,源叶生物公司;异丙基-β-D-硫代吡喃半乳糖苷(Isopropyl-β-D-thiogalactopyranoside,IPTG)、硫酸卡那霉素(Kan)、氨苄青霉素(Amp)和氯霉素(Cm),生工生物工程(上海)股份有限公司。
荧光光度计,SHIMADZU公司;凝胶成像仪,Bio-Rad公司;酶标仪,Molecular Devices公司;高效液相色谱仪,Waters公司。
1.1.3 培养基LB液体培养基(固体培养基加入1.5%琼脂),抗性培养基为在LB培养基灭菌温度降至60 ℃后,加入相应比例Kan (终浓度为50 mg/L)、Amp (终浓度为50 mg/L)或Cm溶液(终浓度为25 mg/L)。
1.2 方法 1.2.1 质粒构建以NCBI上公布的E. coli BL21基因组序列(https://www.ncbi.nlm.nih.gov/nuccore/AM946981.2)为模板,设计引物rhtA1F和rhtA1R,通过PCR扩增得到rhtA目的片段(888 bp),用EcoR I和Hind Ⅲ双酶切pET-28a,纯化目的基因片段和线性化质粒,使用ClonExpress®Ⅱ One Step Cloning Kit,按照说明书上的操作步骤进行连接,将连接产物转化入E. coli JM109中,在Kan抗性平板上筛选阳性转化子,进行双酶切验证和基因测序(天霖生物科技无锡有限公司),将序列正确的质粒定名为pER。
1.2.2 大肠杆菌rhtA的敲除以NCBI上公布的E. coli BL21基因组序列(https://www.ncbi.nlm.nih.gov/nuccore/AM946981.2)为模板,设计敲除rhtA上下同源序列的引物。引物UrhtAF和UrhtAR扩增出rhtA上游约500 bp的同源序列基因UrhtA,引物DrhtAF和DrhtAR扩增rhtA下游约500 bp的同源序列基因DrhtA,以pKD4质粒为模板设计引物rkanF和rkanR,扩增Kan抗性及其两端FRT基因kan2,质粒pET-22b经Xba I和Xho I双酶切,使用ClonExpress® MultiS One Step Cloning Kit,按照说明书上的操作步骤进行,将扩增得到的3个基因片段与线性化质粒进行连接,将连接产物转化入E. coli JM109中,在Kan和Amp双抗平板上筛选阳性转化子进行验证,得到质粒pEURD。以pEURD为模板,利用引物KrhtAF和KrhtAR进行PCR扩增。PCR反应体系(50 μL):模板1 μL,PrimerSTAR Max DNA Polymerase 25 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 22 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,X ℃ 15 s,72 ℃ Y s,30个循环;72 ℃ 10 min (其中退火温度X根据不同基因片段的引物Tm值进行设置,延伸时间Y则根据片段长度按照每分钟扩增1 000个碱基的速度进行分配设置)。最终得到两端带有500 bp rhtA基因上下游同源序列、中间为含有FRT位点的Kan抗性基因Kan2的DNA打靶片段,用于敲除rhtA。
大肠杆菌rhtA的敲除参考巩元勇等[19],具体过程为:将2 503 bp左右的线性打靶片段电转入BL21(DE3)/pKD46后,迅速加入1 mL LB液体培养基,37 ℃、200 r/min振荡复苏12 h进行同源重组,之后均匀涂布在含有Kan抗性的LB培养基上,37 ℃筛选阳性重组菌。挑取阳性单菌落,以E. coli BL21(DE3)为对照,利用引物QrhtAF和QrhtAR进行菌落PCR扩增,验证条带大小正确后,再导入pCP20质粒,28 ℃振荡培养4 h后,涂布至Amp抗性平板上,28 ℃培养过夜,挑取阳性转化子,以E. coli BL21(DE3)为对照,利用引物QrhtAF和QrhtAR进行菌落PCR扩增,验证条带大小正确后,送至天霖生物科技无锡有限公司测序,经过测序验证正确后,再通过42 ℃培养,消除胞内质粒,得到没有任何抗性的E. coli BL21(DE3)ΔrhtA。
1.2.3 培养方法各菌株在50 mL LB液体培养基37 ℃、200 r/min活化12 h后,2%接种量至300 mL LB液体培养基中培养12 h,对应菌株中加入Kan抗生素,需要添加诱导剂的菌株,在培养2 h后加入终浓度0.2 mmol/L的IPTG诱导10 h。
1.2.4 ALA浓度检测参考陈丹园等[15]ALA检测方法,以5-氨基乙酰丙酸盐酸盐标准品作为标准样品,以水做空白参照,在554 nm处测定吸光度A554,根据绘制的标准曲线得出测定样品的ALA浓度。
1.2.5 血红素浓度检测利用荧光法检测血红素浓度,参考陈丹园等[15]大肠杆菌胞内血红素检测方法。
1.2.6 菌体量测定方法菌体密度采用浊度法间接测量,通过OD600来表示,并换算为菌体干重(Dry cell weight,DCW)。取不同浓度的E. coli BL21菌液,8 000×g离心10 min去上清,用去离子水洗涤3次,将菌体放于105 ℃烘箱至菌体恒重,将干燥后菌体干重(DCW)与对应的细胞密度绘制曲线,得到菌体干重(DCW)和OD600的关系:1 OD600=0.297 8 g/L DCW。
1.2.7 卟啉浓度检测通过高效液相荧光检测法检测卟啉[20],样品制备过程为:取3 mg干重大肠杆菌,加入1 mL Tris- EDTA (pH 7.2)缓冲液吸吹混匀,超声(200 W,超声5 s,间隔6 s)破碎5 min后,加入3 mL乙腈涡旋5 min,之后8 000×g离心5 min,将上清液制备装入液相小瓶中[21],一式三份,进行HPLC检测卟啉(为了验证胞内卟啉是否萃取完全,进行二次萃取,HPLC重复检测,将两次检测得到的卟啉数值相加)。
HPLC检测:色谱柱为Bischoff Prontoosil-120- 5-C18-ace-EPS (5 μm,125 mm×4 mm),流动相A (0.5 mol/L、pH 5.1的乙酸盐与乙腈的体积比为90:10),流动相B (甲醇与乙腈的体积比为90:10),流速1 mL/min,柱温25 ℃,荧光检测器激发波长400 nm,发射波长630 nm。
1.2.8 基因转录水平检测各菌株于37 ℃、200 r/min培养过夜后以1%体积分数的接种量转接新鲜LB培养基中,培养12 h后,4 ℃、12 000×g离心5 min收集菌体,用50 mg/mL的溶菌酶37 ℃破壁10 min。之后按照TaKaRa试剂盒说明书进行总RNA提取,提取的RNA浓度及纯度使用核酸定量仪测定,之后将RNA直接反转录成cDNA用于荧光定量实验。以上述cDNA为模板,荧光定量PCR引物见表 3,选择编码3-磷酸甘油醛脱氢酶的基因gapA作为内参基因,采用SYBR® Green I嵌合荧光法,反应体系参照TaKaRa试剂盒说明书。
| 引物 Primers |
引物序列 Primers sequence (5′→3′) |
大小 Sizes (bp) |
| gapAF | GCTACTACCGCTACTCAG | 18 |
| gapAR | TCAGGTCAACTACAGATACG | 20 |
| gltXF | CGAAGACCATATCAACAACAC | 21 |
| gltXR | GACGCACCAGATAGTTCA | 18 |
| hemAF | CTCTACGGTCACAGTGTT | 18 |
| hemAR | CGGTTGGCGATAATCATC | 18 |
| hemLF | AGGATTATTACGGTGTGGAA | 20 |
| hemLR | GCGACTTCATTCAGACAG | 18 |
| hemBF | TATTCGTTCCGTGATGACT | 19 |
| hemBR | TGACCGTGAGATGTGTATT | 19 |
| hemCF | ACTGGATAACGGCGAATA | 18 |
| hemCR | GAGTGCGAGAATCATCAAG | 19 |
| hemDF | TGAGCACTGGTTACTACAC | 19 |
| hemDR | CATCGTTGTCAGCGTTATC | 19 |
| hemEF | CGACTGGACAACGGATAT | 18 |
| hemER | CGCTACTTCTTCTTCAATGC | 20 |
| hemFF | CTACACCGACGCTTATTTAC | 20 |
| hemFR | GCATTGACATCAGGATAGAC | 20 |
| hemGF | GGTGCTTCTATTCGCTATG | 19 |
| hemGR | CTGTTGGTCTGTGGAGTA | 18 |
| hemHF | GAGACGCTGGAAGAGATT | 18 |
| hemHR | GCAACAAGATTAGCCATCAT | 20 |
以质粒pEURD为模板,利用引物KrhtAF和KrhtAR扩增得到长度为2 503 bp的打靶片段(图 2A)。将打靶片段电转进BL21(DE3)/pKD46后,利用引物QrhtAF和QrhtAR对获得的阳性重组菌株进行菌落PCR鉴定,同源重组成功后理论上可获得2 561 bp片段,而BL21(DE3)则为1 946 bp片段,结果表明挑取的菌落均可扩增出2 561 bp片段(图 2B),同源重组成功。转入pCP20质粒后,利用引物QrhtAF和QrhtAR对阳性菌进行菌落pCR鉴定,rhtA敲除成功的菌落理论上PCR结果为1 067 bp (保留一个FRT位点),而BL21(DE3) PCR结果为1 946 bp,结果表明挑取的菌落均可扩增出1 067 bp片段(图 2C),对验证正确的敲除菌测序,结果正确,表明rhtA被成功敲除,并将敲除菌命名为BL21(DE3)ΔrhtA。
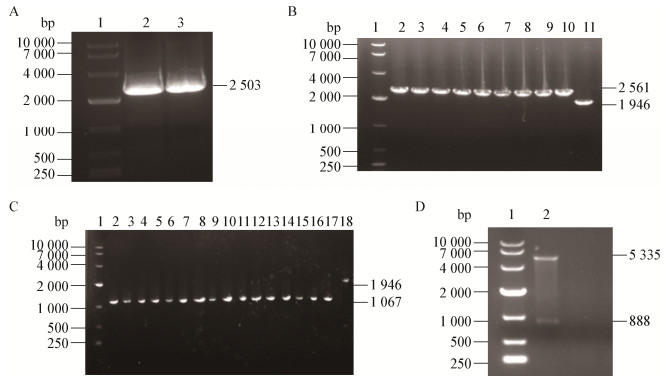
|
| 图 2 rhtA敲除与回补质粒pER的电泳验证 Figure 2 Electrophoretic verification of rhtA knockout and replenishing plasmid pER 注:1:Marker. A:打靶片段的PCR扩增;2−3:打靶片段. B:打靶片段导入后的菌落PCR验证;2−10:打靶片段重组成功的菌株;11:E. coli BL21(DE3)对照. C:Kan抗性基因消除后的PCR扩增;2−17:rhtA敲除菌株;18:E. coli BL21(DE3)对照. D:pER质粒的双酶切;2:pER. Note: 1: Marker. A: PCR amplification of target fragment; 2−3: Target fragment. B: Colony PCR verification after introduction of target fragments; 2−10: Strains with recombinant target fragments; 11: E. coli BL21(DE3) control. C: PCR amplification after elimination of Kan resistant gene; 2−17: Strains with rhtA knockout; 18: E. coli BL21(DE3) control. D: Double enzyme digestion of pER plasmid; 2: pER. |
|
|
通过EcoR I和Xho I双酶切鉴定pER质粒,rhtA长度为888 bp,pET-28a质粒双酶切后为5 335 bp,双酶切条带大小与理论一致(图 2D),对构建的质粒测序,结果正确,将pER转化入E. coli BL21(DE3) ΔrhtA中,得到回补菌株E. coli BL21(DE3)ΔrhtA/pER。
2.2 rhtA敲除对于大肠杆菌生长的影响以在LB培养基中各时刻所测定的菌体密度对培养时间作图得到各菌株生长曲线(图 3),结果表明在培养初期各菌体密度几乎一致,2−7 h内BL21(DE3)ΔrhtA的菌体密度稍高于BL21(DE3),7 h后BL21(DE3)菌体密度稍高于BL21(DE3)ΔrhtA,到达12 h BL21(DE3)ΔrhtA与BL21(DE3)菌体密度几乎一致。回补菌株BL21(DE3)ΔrhtA/pER与BL21(DE3)ΔrhtA/pET-28a在LB液体培养基中生长12 h的生长曲线几乎完全重合,菌株BL21(DE3)/pET-28a在12 h时的菌体密度与回补菌株BL21(DE3)ΔrhtA/pER、BL21(DE3)ΔrhtA/pET-28a相差不大,表明在LB液体培养基中,敲除大肠杆菌rhtA对菌株生长影响不大,与文献[22]报道一致。

|
| 图 3 各菌株生长曲线 Figure 3 Growth curve of each strain 注:BL21(DE3)ΔrhtA/pER培养2 h后添加终浓度0.2 mmol/L的IPTG诱导. Note: IPTG was added with a final concentration of 0.2 mmol/L at 2 h cultivation of BL21(DE3)ΔrhtA/pER. |
|
|
对摇瓶培养12 h后的不同菌进行代谢产物分析,结果表明BL21(DE3)ΔrhtA胞外ALA浓度为8.937 mg/L、胞内血红素浓度为11.700 μmol/L,BL21(DE3)胞外ALA浓度为11.627 mg/L、胞内血红素浓度为10.433 μmol/L (图 4A),BL21(DE3)ΔrhtA与BL21(DE3)相比,胞外ALA浓度减少了23%、胞内血红素浓度增加了12%,回补菌株BL21(DE3) ΔrhtA/pER胞外的ALA浓度为12.249 mg/L、胞内血红素浓度为6.065 μmol/L。敲除菌胞外ALA量减少,回补菌株胞外ALA基本提高到原菌株BL21(DE3)水平,表明RhtA参与胞内ALA外运,与文献[11]报道一致。减少ALA外运,胞内血红素含量得到相应提高。
大肠杆菌中hemA编码谷氨酰t-RNA还原酶,该酶改变了谷氨酰t-RNA的形成,用于蛋白质和ALA的合成[23]。BL21(DE3)ΔrhtA/pEA胞外ALA浓度为21.500 mg/L、血红素浓度为33.244 μmol/L,BL21(DE3)/pEA胞外ALA浓度为25.660 mg/L、血红素浓度为26.882 μmol/L (图 4B),BL21(DE3)ΔrhtA/ pEA与BL21(DE3)/pEA相比较,胞外ALA浓度减少了16%,表明RhtA确实参与大肠杆菌ALA的外运,血红素浓度增加了24%,与文献[24]报道的过表达hemA可提高血红素的含量相一致。

|
| 图 4 各菌株的胞外ALA与胞内血红素含量比较 Figure 4 Comparison of extracellular ALA and intracellular heme contents in each strain 注:A:菌株BL21(DE3)、BL21(DE3)ΔrhtA与BL21(DE3)ΔrhtA/ pEA;B:菌株BL21(DE3)/pEA与BL21(DE3)ΔrhtA/pEA. Note: A: Strain BL21(DE3), BL21(DE3)ΔrhtA and BL21(DE3) Δrh/pEA; B: Strain BL21(DE3)/pEA and BL21(DE3)ΔrhtA/pEA. |
|
|
通过高效液相检测血红素合成途径中其他产物的变化,结果表明BL21(DE3)ΔrhtA与BL21(DE3)相比较,胞内的UⅢ、CⅢ和PPⅨ量分别提高25%、15%和18%;BL21(DE3)ΔrhtA/pEA与BL21(DE3)/pEA相比较,除了胞内的UⅢ和CⅢ分别提高55%和64%外,PPⅨ量显著增加,约为BL21(DE3)/pEA的4.7倍(表 4),但是血红素的含量并没有显著提高,原因可能来自两方面:一是编码亚铁螯合酶的基因hemH转录水平较低,二是胞内游离铁离子的缺乏。
| 菌株 Strains |
尿卟啉Ⅲ浓度 Uroporphyrin Ⅲ concentration (nmol/g DCW) |
粪卟啉Ⅲ浓度 Coproporphyrin Ⅲ concentration (nmol/g DCW) |
原卟啉Ⅸ浓度 Protoporphyrin Ⅸ concentration (nmol/g DCW) |
| BL21(DE3) | 4.945±0.027 | 0.837±0.323 | 18.719±2.051 |
| BL21(DE3)ΔrhtA | 6.175±0.460 | 0.963±0.003 | 22.181±5.915 |
| BL21(DE3)/pEA | 3.368±0.120 | 0.700±0.027 | 23.606±0.002 |
| BL21(DE3)ΔrhtA/pEA | 5.234±0.232 | 1.148±0.021 | 134.213±1.537 |
为了探究关键基因表达对血红素及卟啉合成的影响,对途径中10个基因进行了qRT-PCR分析。结果表明敲除菌BL21(DE3)ΔrhtA除hemC转录水平略有下调,其余基因转录水平均有不同程度的上调(图 5)。hemC编码的PBG脱氨酶,使4分子PBG缩合成1分子HMB,hemC下调可能会导致环化形成卟啉的前体HMB量的不足;其中编码原卟啉原Ⅸ氧化酶HemG的hemG转录水平上调最为显著(图 5),HemG催化原卟啉原Ⅸ生成PPⅨ,促进胞内PPⅨ累积;gltX和hemA转录上调有利于ALA积累和进一步转化成卟啉;hemH转录水平上调并没有促成PPⅨ的进一步转化,与文献[5]报道一致。PPⅨ在BL21(DE3)ΔrhtA/pEA的累积可能是由于游离铁离子的缺乏所致。
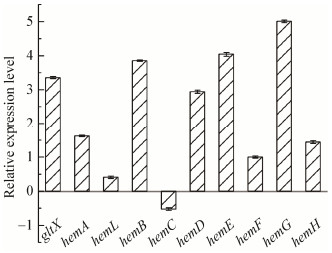
|
| 图 5 BL21(DE3)ΔrhtA菌株血红素合成途径中各基因的相对转录水平 Figure 5 Relative transcriptional level of each gene in the heme synthesis pathway of BL21(DE3)ΔrhtA |
|
|
卟啉物质的合成在微生物的生长与代谢中起着重要作用。以往的大肠杆菌血红素代谢研究偏重于血红素合成途径中相关基因之间的相互作用与调控。本文主要关注了转运蛋白RhtA对血红素合成途径的影响。敲除rhtA后,血红素合成途径中的前体物质ALA外运明显减少,同时过表达hemA,胞内的卟啉量得以增加,尤其PPⅨ累积明显,对于终产物血红素的形成有一定的促进作用。因此可以将控制ALA转运蛋白的水平作为一种新的策略应用于基因工程菌如E. coli BL21的改造,减少前体物质ALA的外排,提高卟啉与血红素的合成。
敲除rhtA后,胞外ALA量减少但并没有低至零点,表明RhtA蛋白并不是ALA唯一的外运蛋白。将rhtA敲除,胞内过量累积的ALA依旧可以通过其他外排转运蛋白运送出胞外,从而未对菌体生长造成显著影响。目前E. coli胞内卟啉及终产物血红素外运的研究还十分有限[25],虽有研究表明tolC编码的蛋白TolC可参与PPⅨ的转运[26],但在rhtA敲除菌中PPⅨ的积累和输送尚有待进一步研究。
| [1] |
Lee MJ, Kim HJ, Lee JY, et al. Effect of gene amplifications in porphyrin pathway on heme biosynthesis in a recombinant Escherichia coli[J]. Journal of Microbiology and Biotechnology, 2013, 23(5): 668-673. DOI:10.4014/jmb.1302.02022 |
| [2] |
Deng Y, Guo YX, Li C, et al. Research progress on the porphyrin compounds as a biological marker[J]. Central South Pharmacy, 2015, 13(5): 509-512. (in Chinese) 邓晔, 郭瑶雪, 李春, 等. 血红素合成中间体——卟啉类化合物作为生物标记物的研究进展[J]. 中南药学, 2015, 13(5): 509-512. |
| [3] |
Beale SI. Biosynthesis of hemes[J]. EcoSal Plus, 2007, 2(2). DOI:10.1128/ecosalplus.3.6.3.11 |
| [4] |
Pranawidjaja S, Choi S, Lay BW, et al. Analysis of heme biosynthetic pathways in a recombinant Escherichia coli[J]. Journal of Microbiology and Biotechnology, 2015, 25(6): 880-886. DOI:10.4014/jmb.1411.11050 |
| [5] |
Li HJ. Construction of expression system for 5-aminolevulinic acid and the optimization of fermentation technics[D]. Jinan: Master's Thesis of Jinan University, 2016 (in Chinese) 李慧杰. 5-氨基乙酰丙酸表达体系的构建及发酵工艺优化[D].济南: 济南大学硕士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10427-1016257837.htm |
| [6] |
Song YQ, Zhu RF, Chen P. Physiological distribution and regulation of heme[J]. Scientia Sinica Chimica, 2015, 45(11): 1194-1205. (in Chinese) 宋艳群, 祝融峰, 陈鹏. 血红素的生理分布与调控[J]. 中国科学:化学, 2015, 45(11): 1194-1205. |
| [7] |
Ge BS, Chen Y, Yu Q, et al. Regulation of the heme biosynthetic pathway for combinational biosynthesis of phycocyanobilin in Escherichia coli[J]. Process Biochemistry, 2018, 71: 23-30. DOI:10.1016/j.procbio.2018.05.011 |
| [8] |
Li T, Guo YY, Qiao GQ, et al. Microbial synthesis of 5-aminolevulinic acid and its coproduction with polyhydroxybutyrate[J]. ACS Synthetic Biology, 2016, 5(11): 1264-1274. DOI:10.1021/acssynbio.6b00105 |
| [9] |
Zhang JL, Kang Z, Qian SD, et al. Construction of recombinant Saccharomyces cerevisiae for production of 5-aminolevulinic acid[J]. Journal of Food Science and Biotechnology, 2018, 37(3): 232-239. (in Chinese) 张俊丽, 康振, 钱晟东, 等. 产5-氨基乙酰丙酸酿酒酵母工程菌株的构建[J]. 食品与生物技术学报, 2018, 37(3): 232-239. DOI:10.3969/j.issn.1673-1689.2018.03.002 |
| [10] |
Livshits VA, Zakataeva NP, Aleshin VV, et al. Identification and characterization of the new gene rhtA involved in threonine and homoserine efflux in Escherichia coli[J]. Research in Microbiology, 2003, 154(2): 123-135. DOI:10.1016/S0923-2508(03)00036-6 |
| [11] |
Zhang LC. Study on 5-aminolevulinic acid transporter in Escherichia coli[D]. Tianjin: Master's Thesis of Tianjin University of Science and Technology, 2016 (in Chinese) 张良程.大肠杆菌中5-氨基乙酰丙酸转运蛋白的研究[D].天津: 天津科技大学硕士学位论文, 2016 |
| [12] |
Meng QL, Zhang YF, Ju XZ, et al. Production of 5-aminolevulinic acid by cell free multi-enzyme catalysis[J]. Journal of Biotechnology, 2016, 226: 8-13. DOI:10.1016/j.jbiotec.2016.03.024 |
| [13] |
Li ZX, Zhao L, Liang YL, et al. Advance on biosynthesis of 5-aminolevulinic acid[J]. Bulletin of Fermentation Science and Technology, 2017, 46(3): 178-182. (in Chinese) 李智祥, 赵磊, 梁云龙, 等. 生物法合成5-氨基乙酰丙酸的研究进展[J]. 发酵科技通讯, 2017, 46(3): 178-182. |
| [14] |
Kang Z, Zhang JL, Yang S, et al. Advances in microbial production of 5-aminolevulinic acid[J]. Chinese Journal of Biotechnology, 2013, 29(9): 1214-1222. (in Chinese) 康振, 张俊丽, 杨森, 等. 微生物发酵生产5-氨基乙酰丙酸研究进展[J]. 生物工程学报, 2013, 29(9): 1214-1222. |
| [15] |
Chen DY, Shen YJ, Yang Y, et al. Regulation of heme synthesis in Escherichia coli by overexpression of genes for the key enzymes and environmental factors[J]. Food and Fermentation Industries, 2018, 44(11): 7-14. (in Chinese) 陈丹园, 沈云杰, 杨燕, 等. 关键酶基因的过表达与环境因素对大肠杆菌血红素合成的调控[J]. 食品与发酵工业, 2018, 44(11): 7-14. |
| [16] |
Kang Z, Wang Y, Gu PF, et al. Engineering Escherichia coli for efficient production of 5-aminolevulinic acid from glucose[J]. Metabolic Engineering, 2011, 13(5): 492-498. DOI:10.1016/j.ymben.2011.05.003 |
| [17] |
Kwon SJ, de Boer AL, Petri R, et al. High-level production of porphyrins in metabolically engineered Escherichia coli: systematic extension of a pathway assembled from overexpressed genes involved in heme biosynthesis[J]. Applied and Environmental Microbiology, 2003, 69(8): 4875-4883. DOI:10.1128/AEM.69.8.4875-4883.2003 |
| [18] |
Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12): 6640-6645. DOI:10.1073/pnas.120163297 |
| [19] |
Gong YY, Ni WC, Guo SQ, et al. Construction method of BL21(DE3)ΔaroA strain and its application: CN, 104099363A[P]. 2014-10-15 (in Chinese) 巩元勇, 倪万潮, 郭书巧.等.一种BL21(DE3)ΔaroA菌株的构建方法及其应用: 中国, 104099363A[P]. 2014-10-15 |
| [20] |
Fotinos N, Convert M, Piffaretti JC, et al. Effects on gram-negative and gram-positive bacteria mediated by 5-aminolevulinic acid and 5-aminolevulinic acid derivatives[J]. Antimicrobial Agents and Chemotherapy, 2008, 52(4): 1366-1373. DOI:10.1128/AAC.01372-07 |
| [21] |
Fyrestam J, Östman C. Determination of heme in microorganisms using HPLC-MS/MS and cobalt(Ⅲ) protoporphyrin Ⅸ inhibition of heme acquisition in Escherichia coli[J]. Analytical and Bioanalytical Chemistry, 2017, 409(30): 6999-7010. DOI:10.1007/s00216-017-0610-5 |
| [22] |
Liu HL. Producing strain construction and fermentation condition optimization of 2-aminobutyrate[D]. Tianjin: Master's Thesis of Tianjin University of Science & Technology, 2015 (in Chinese) 刘宏亮. 2-氨基丁酸生产菌株构建及发酵条件优化[D].天津: 天津科技大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10057-1016104070.htm |
| [23] |
Beale SI, Gough SP, Granick S. Biosynthesis of δ-aminolevulinic acid from the intact carbon skeleton of glutamic acid in greening barley[J]. Proceedings of the National Academy of Sciences of the United States of America, 1975, 72(7): 2719-2723. DOI:10.1073/pnas.72.7.2719 |
| [24] |
Verderber E, Lucast LJ, van Dehy JA, et al. Role of the hemA gene product and δ-aminolevulinic acid in regulation of Escherichia coli heme synthesis[J]. Journal of Bacteriology, 1997, 179(14): 4583-4590. |
| [25] |
Zhao XR, Choi KR, Lee SY. Metabolic engineering of Escherichia coli for secretory production of free haem[J]. Nature Catalysis, 2018, 1(9): 720-728. DOI:10.1038/s41929-018-0126-1 |
| [26] |
Turlin E, Heuck G, Brand o MIS, et al. Protoporphyrin (PPⅨ) efflux by the MacAB-TolC pump in Escherichia coli[J]. MicrobiologyOpen, 2014, 3(6): 849-859. DOI:10.1002/mbo3.203 |
 2019, Vol. 46
2019, Vol. 46