扩展功能
文章信息
- 程丽芬, 樊兰英, 张欣, 马学文, 杨斌, 郑军, 芦冬涛
- CHENG Li-Fen, FAN Lan-Ying, ZHANG Xin, MA Xue-Wen, YANG Bin, ZHENG Jun, LU Dong-Tao
- 山西左云县采煤区人工湿地冬季沉积物细菌群落多样性
- Diversity of microbial community in winter at constructed wetlands sediment around coal mining area at Zuoyun, Shanxi province
- 微生物学通报, 2019, 46(12): 3181-3192
- Microbiology China, 2019, 46(12): 3181-3192
- DOI: 10.13344/j.microbiol.china.190048
-
文章历史
- 收稿日期: 2019-01-16
- 接受日期: 2019-04-02
- 网络首发日期: 2019-04-19
2. 山西省农业科学院小麦研究所 山西 临汾 041000;
3. 山西大学环境科学研究所 山西 太原 030006
2. Wheat Research Institute, Shanxi Academy of Agricultural Sciences, Linfen, Shanxi 041000, China;
3. Institute of Environmental Science, Shanxi University, Taiyuan, Shanxi 030006, China
随着经济和社会的发展,大量天然气、石油和煤炭等自然资源被开采,开采过程产生的废水对生态系统产生了较大污染。人工湿地通过模拟自然湿地对废水进行自然净化,近年来应用逐渐广泛,已成为控制污水生态工程的有效方法[1-4]。人工湿地生态系统多由基质、生物和水体组成,其中湿地沉积物是人工湿地生态系统的重要部分,也是水中污染物质沉积的归宿地。沉积物中含有的大量微生物群落可以对污染物进行转化和降解,使水质净化,尤其是在有机氮迁移转化过程中作用重大[5-6]。大量研究表明,人工湿地中的氮素多是通过微生物硝化和反硝化作用去除,细菌数量和种类与水质净化能力显著相关[7-9]。此外,沉积物微生物群落还可以作为营养水平指示物,用于评价和监控湿地的系统生态和群落营建。因此,对人工湿地沉积物中细菌种类和功能进行深入研究,可以为构建高效人工湿地系统提供参考。
煤炭在国民经济的发展中具有十分重要的战略意义,在一次性能源生产和消费结构中占比超过60%,然而煤炭开采过程产生大量富含铁离子和悬浮物的酸性矿井水,在排放过程中腐蚀设备和管路,常引起河流湖泊的水质恶化、作物枯萎和土地板结等问题。赵峰华等[10]和Nordin等[11]对煤矿酸性矿井水及其沉淀物化学组成的发现,矿井水中硫酸根和金属离子含量最高,危害最大。酸性水中含有大量的Fe2+和Fe3+等离子,常导致周围生态系统金属含量超标[8]。人工湿地在采矿废水的处理领域中已有应用报道,废水经人工湿地净化和脱毒处理后,可作为灌溉和工业用水,极具应用前景。曹优明等[12]研究了菖蒲人工湿地对煤矿废水脱毒,发现镉的去除率高于86.23%。Kiiskila等[13]证明人工湿地系统能有效去除采矿废水中的硫酸盐和金属离子。此外,可渗透性反应墙强化垂直流人工湿地对氨氮、磷、化学需氧量(Chemical oxygen demand,CODCr)的去除率分别达到88.84%、96.08%和85.78%[14]。目前,人工湿地处理煤矿废水的相关研究主要集中在水处理的效果方面,关于其沉积物中细菌群落结构及功能的研究较少。本文以山西左云县某采煤区为例,研究了人工湿地对采煤区废水净化的作用,分析了采煤区人工湿地河流沉积物中的细菌群落结构和特征,以及细菌群落结构与环境因子的关系。
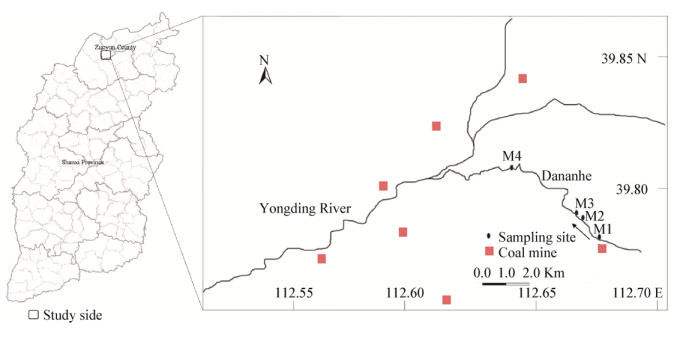
1 材料与方法 1.1 材料 1.1.1 样品采集采样地点为山西省左云县小京庄乡大南河人工湿地,2016年11月沿煤矿排水流经人工湿地上下游关系,依次设置4个采样点,编号为M1、M2、M3、M4 (图 1)。湿地表层沉积物样本(3 cm−5 cm)使用便携式柱状采泥器在采样点中心10 m范围内采集,每个采样点采集3−5次,沉积物样品用无菌袋封装,干冰运输,一部分样品−80 ℃冻存以备微生物群落结构分析;一部分样品干燥研磨后过200目筛,用于理化指标分析,使用自制便携式采水器采集上覆水样。
|
| 图 1 大南河人工湿地采样点地理位置示意图 Figure 1 The distribution of the sampling sites in Dananhe wetland Note: Geographical locations of the sampling stations: M1: 112°40′19.44″E, 39°46′39.87″N; M2: 112°39′56.1″E, 39°47′1.43″N; M3: 112°39′49.51″E, 39°47′8.4″N; M4: 112°38′8.81″E, 39°48′21.23″N. |
|
|
土壤DNA提取试剂盒,MOBIO Laboratories公司;DNA纯化回收试剂盒,Qiagen公司。便携式柱状采泥器,北京普雷德仪器设备有限公司;pH计、电导率仪,上海仪电科学仪器股份有限公司;双光束分光光度计,PerkinElmer公司;连续流动分析仪,Bran Luebbe公司;PCR仪,Bio-Rad公司;超微量蛋白质核酸分析仪,Thermo Fisher Scientific公司。
1.2 方法 1.2.1 沉积物理化性质测定沉积物理化性质测定:pH和电导率(Electrical conductivity,EC)使用pH计和电导率仪测定;化学需氧量(CODCr)采用重铬酸盐法测定(GB/T11914- 1989),总氮(Total nitrogen,TN)采用凯氏定氮法测定(GB/T11894-1989),总磷(Total phosphorus,TP)采用碱熔-钼锑抗分光光度法测定(GB/T11893-1989),铵态氮采用2 mol/L的KCl浸提后通过连续流动分析仪测定,操作步骤均参考文献[15]进行。
1.2.2 沉积物DNA提取沉积物DNA提取参照文献[16],称取0.5 g左右的沉积物,用土壤DNA试剂盒进行DNA提取,3次重复,使用超微量蛋白质核酸分析仪测定DNA浓度后−20 ℃中保存。
1.2.3 细菌多样性分析16S rRNA基因的V3−V4区测序参考Sun等[17]方法进行,正向引物:5′-ACTCCTACGGGAGGCAG CA-3′,反向引物:5′-GGACTACHVGGGTWTCTAA T-3′,PCR产物纯化后送至北京百迈克有限公司使用Illumina HiSeq2500平台进行高通量测序。
1.2.4 测序数据分析测序得到的原始数据中筛选有效数据进行OTU聚类和物种分类分析。根据OTU聚类结果,对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。对于代表性的序列使用基于RDP分类器算法的GreenGene数据库注释分类,基于QIIME计算样品Shannon指数、辛普森指数(Simpson)、文库覆盖率(Coverage)和系统发育距离,使用平均联动的非加权组平均法的聚类分析方法(UPGMA)来解释距离矩阵构建系统发育树,R语言程序(2.15.3版)绘制韦恩图。
1.2.5 统计学分析采用SPSS 20.0进行单因素方差分析(ANOVA),差异显著性水平通过最小显著差异法(Least significant difference,LSD)进行检验(α=0.05),不同优势菌属的相对丰度与理化性质间进行Pearson相关性分析。
2 结果与分析 2.1 人工湿地沉积物理化性质4个采样点的理化指标见表 1,各采样点沉积物的理化性质差异较大。整体上看,上游指标偏高,经过中游和下游,各项指标均下降。采煤区人工湿地沉积物呈现弱酸性,pH值为6.61−6.75,位点间无明显差异。总氮含量除M4外,总体偏高,其中M1最高,为6 051±0.7 mg/kg;M4最低,为1 259±0.6 mg/kg。总含磷量在中上游含量较高,M2处最高,为1.14±0.03 mg/kg;下游的M4最低,为0.73±0.01 mg/kg。EC、NO3−-N、NH4+-N的分布与总氮和总磷含量分布趋势相同,在上游、中游较高,在下游含量明显较低。在河流生态系统中,营养源和污染物与水体沉积物表层周期性交换有着主要的关系,人工湿地对于N、P等污染物的降解作用十分明显。
| Sample | pH | EC (μs/cm) | NO3--N (mg/kg) | NH4+-N (mg/kg) | TN (mg/kg) | TP (mg/kg) |
| M1 | 6.71±0.08a | 1 020±20.12ab | 0.69±0.01a | 24.7±0.13A | 6 051±0.7ab | 0.86±0.01a |
| M2 | 6.75±0.07a | 980±17.58ab | 0.56±0.01a | 20.4±0.11A | 5 488±0.3ab | 1.14±0.03a |
| M3 | 6.69±0.09a | 1 100±14.65Ab | 0.45±0.01A | 20.5±0.12A | 3 676±0.8AB | 0.96±0.02a |
| M4 | 6.68±0.07a | 930±21.23aB | 0.36±0.01A | 11.0±0.11B | 1 259±0.6AB | 0.73±0.01A |
| 注:小写字母表示P < 0.05,大写字母表示P < 0.01. Note: Different lowercase letters indicate significant differences at P < 0.05 and different capital letters indicate significant differences at P < 0.01 within each column. |
||||||
采煤区废水流经人工湿地后采样点水质明显改善,理化指标从上游至下游逐渐趋于正常(表 2)。通过湿地后生化需氧量(Biochemical oxygen demand,BOD5)、CODCr、TN、TP去除率分别达到76.2%、93.4%、73.4%和99.3%,悬浮物随着湿地水流流向逐渐减少,而挥发酚和硫化物在采样点间变化不大。
| Sample | BOD5 (mg/L) | CODCr (mg/L) | Sulfide (mg/L) | Volatile phenol (mg/L) | Suspended solid (mg/L) | TP (mg/L) | TN (mg/L) |
| M1 | 2.1 | 363.0 | 0.005 | 0.000 47 | 459 | 2.070 | 20.00 |
| M2 | 8.3 | 319.0 | 0.038 | 0.000 30 | 255 | 0.342 | 19.10 |
| M3 | 9.1 | 191.0 | 0.013 | 0.000 36 | 284 | 0.168 | 12.30 |
| M4 | 0.5 | 29.9 | < 0.005 | 0.000 51 | 42 | 0.014 | 5.32 |
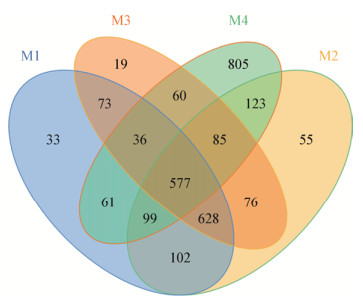
沉积物细菌多样性平台测序总共产生221 169条16S rRNA基因序列,平均读长422 bp;基于相似度大于97%的序列划分为一个分类操作单元OTU,从4个采样点的测序数据中共有2 832个OTU,共发现753个属的细菌,分布于51个门的150个纲。在4个取样点中,共同OTU为20.3%,前3个位点相同OTU数量为1 205,M1、M2和M3细菌群落相似性较强,其中M1与M2的相似性最高,为49.6%;M2与M3的OTU的相似性达到48%;与中、上游的3个位点相比,M4与M3的相似性较高(图 2)。不同位点沉积物细菌群落α多样性分析见表 3,测序文库的覆盖率均在99%以上,说明各个采样点的测序结果完全可以代表样本的真实情况。从OTU数量来看,M3的OTU数量最少,其次是M1,结合ACE指数、Shannon指数和Simpson指数来看M4的物种多样性程度最好,反映出人工湿地生态系统多样性得到恢复,对环境的耐受性增加。M1和M2的多样性指数低可能是因为煤矿废水流经人工湿地时,N、P等污染物含量较高导致。
|
| 图 2 人工湿地不同位点OTU韦恩图 Figure 2 Venn diagram representing the distribution of OTUs in different samples |
|
|
| Sample | OTUs | ACE index | Chao1 index | Simpson index | Shannon index | Coverage |
| M1 | 1 609 | 1 795.606 1 | 1 775.214 4 | 0.012 2 | 5.631 3 | 0.993 2 |
| M2 | 1 745 | 1 955.526 5 | 1 791.404 4 | 0.008 4 | 5.802 9 | 0.993 2 |
| M3 | 1 554 | 1 811.892 6 | 1 830.470 9 | 0.011 9 | 5.540 2 | 0.992 2 |
| M4 | 1 846 | 1 940.272 0 | 1 942.073 9 | 0.005 0 | 6.526 8 | 0.993 6 |
采用主成分分析法(Principal component analysis,PCA)研究了不同位点沉积物细菌群落结构差异(图 3)。2个主成分贡献率分别为56.51%和30.92%,从PC2轴上看,流经采样位点M1、M2位置位于PC2轴的正方向,M3位于PC2轴的负方向,随着废水流经人工湿地的距离,沉积物细菌群落结构逐渐产生差异,这与α多样性的结果一致。

|
| 图 3 人工湿地不同采样点PCA分析 Figure 3 PCA analysis of soil bacteria community under different samples |
|
|
依据分类学方法研究细菌群落结构变化表明,流经区域的细菌群落组成和结构具有显著性差异,采样点越接近,沉积物的细菌组成越相似。在门水平上(> 1%),M1优势门9个,变形菌门(Proteobacteria) (64.7%)、拟杆菌门(Bacteroidetes) (15.9%)、厚壁菌门(Firmicutes) (3.7%)、Parcubacteria (2.1%)、放线菌门(Actinobacteria) (1.9%)、蓝藻门(Cyanobacteria) (1.6%)、Spirochaetae (1.2%)、绿弯菌门(Chloroflexi) (1.2%)、迷踪菌门(Elusimicrobia) (1.0%)。M2优势门9个,变形菌门(57.2%)、拟杆菌门(19.6%)、厚壁菌门(5.7%)、Saccharibacteria (3.6%)、放线菌门(1.8%)、Spirochaetae (1.6%)、Gracilibacteria (1.5%)、Parcubacteria (1.3%)、梭杆菌门(Fusobacteria) (1.0%)。M3优势门7个,变形菌门(61.4%)、拟杆菌门(21.2%)、厚壁菌门(6.8%)、放线菌门(1.3%)、蓝藻门(1.2%)、Spirochaetae (1.0%)、梭杆菌门(1.0%)。M4优势门11个,变形菌门(49.6%)、拟杆菌门(16.0%)、酸杆菌门(Acidobacteria) (7.5%)、绿弯菌门(5.5%)、芽单胞菌门(Gemmatimonadetes) (2.4%)、厚壁菌门(2.4%)、Ignavibacteriae (2.0%)、放线菌门(1.8%)、硝化螺旋菌门(Nitrospirae) (1.7%)、疣微菌门(Verrucomicrobia) (1.2%)、Parcubacteria (1.1%)。4个采样点中变形菌门为绝对优势菌门,相对丰度为50%−64.7%,变形菌门的相对丰度依次是β-变形菌纲,γ-变形菌纲,δ-变形菌纲,ε-变形菌纲,α-变形菌纲。在M1、M2、M3中富含氨氮氧化细菌的β-变形菌纲和γ-变形菌纲丰度很高,β-变形菌纲达到27%以上,γ-变形菌纲也在10%−15%之间,而在M4中两种菌群的相对丰度只有13.5%和5%;δ-变形菌纲在M4丰度最高(15%),其他位点只有8%左右的相对丰度,ε-变形菌纲的相对丰度M1最少(2.3%),M3 (9.4%)与M4 (10%)较多,α-变形菌纲相差不大(图 4)。

|
| 图 4 不同采样点细菌的相对丰度(相对丰度 > 0.1%的门) Figure 4 Relative abundance of soil bacteria under different samples (Phyla relative abundance > 0.1%) |
|
|
4个采样点相对丰度 > 1%的属共有16个(表 4),主要是嗜氢菌属(Hydrogenophilus)、氢嗜胞菌属(Hydrogenophaga)、弓形菌属(Arcobacter)和丛毛单胞菌属(Comamonadaceae)、拟杆菌属(Bacteroides)、土杆菌属(Geobacter)等。不同采样点的细菌种类有一定的差异,采煤区废水流经人工湿地后,嗜氢菌属(Hydrogenophilus)丰度趋于减少,但在M4不足0.4%,氢嗜胞菌属(Hydrogenophaga)也呈现出相应的变化趋势,占比降到了0.2%;在中上游区Aquabacterium、Uncultured_bacterium_f_Chromatiaceae、Bacteroides、Uncultured Bacteroidetes bacterium、Flavobacterium、Azoarcus、Thauera和Perlucidibaca等8个属为特有菌属,而在下游中Sulfurimonas和Sulfuricurvum为特有菌属,说明废水中有机污染物与沉积物细菌群落结构紧密相关。
| Genus | M1 (%) | M2 (%) | M3 (%) | M4 (%) |
| Hydrogenophaga | 5.34 | 6.14 | 4.91 | 0.20 |
| Arcobacter | 1.93 | 3.87 | 8.47 | 1.12 |
| Uncultured_bacterium_f_Hydrogenophilaceae | 8.24 | 4.52 | 2.19 | 0.39 |
| Uncultured_bacterium_f_Comamonadaceae | 3.89 | 4.23 | 4.36 | 1.03 |
| Bacteroides | 1.15 | 2.15 | 4.14 | 0.11 |
| Uncultured_Bacteroidetes_bacterium | 2.31 | 0.86 | 2.93 | 0.11 |
| Geobacter | 0.76 | 2.57 | 0.95 | 1.83 |
| Flavobacterium | 1.72 | 1.87 | 1.87 | 0.59 |
| Azoarcus | 1.47 | 1.71 | 2.25 | 0.08 |
| Uncultured_bacterium_p_Saccharibacteria | 0.50 | 3.52 | 0.76 | 0.29 |
| Aquabacterium | 2.02 | 0.78 | 2.20 | 0.02 |
| Sulfurimonas | 0.07 | 0.31 | 0.28 | 4.25 |
| Sulfuricurvum | 0.15 | 0.43 | 0.23 | 3.69 |
| Perlucidibaca | 2.03 | 0.39 | 1.76 | 0.00 |
| Thauera | 1.53 | 1.57 | 0.97 | 0.09 |
| Uncultured_bacterium_f_Chromatiaceae | 2.25 | 1.63 | 0.20 | 0.00 |
构建的门水平丰度相似性热图可以直观地展示不同采样点的细菌群落构成差异(图 5)。M1处Miscellaneous_Euryarchaeotic_Group、Parcubacteria、WS6等,M2处Saccharibacteria与Gracilibacteria,M3处Cloacimonetes,M4差异性细菌门则最多,有疣微菌门、芽单胞菌门、Ignavibacteriae等菌门,充分说明M4的多样性最高,与α-多样性分析数据结果一致。在属水平上M1特有Dokdonella、Gelidibacter、Olsenella、Uncultured_ euryarchaeote、Aequorivita、Clostridium_sensu_stricto_3、Vulgatibacter和Uncultured_bacterium_c_Pla3_ lineage。此外,不同采样点还存在利于环境净化的特殊细菌,比如M1含有污水处理与生物修复方面具有重要应用价值的盐单胞菌属(Halomonas);M2中含有可利用多种有机化合物作碳源、可以降解芳香族化合物的Novosphingobium菌属;M3含有可降解有机物的Alkanindiges菌属;一些水生态系统特有的菌类,如可降解多环芳烃及六六六异构体的Sphingomonas菌属在M4中存在。

|
| 图 5 人工湿地不同位点细菌群落结构门水平聚类热图 Figure 5 The samples heat map and cluster analysis |
|
|
不同采样地点沉积物细菌种类和分布均有差异,环境是造成这种差异的原因所在,因此进一步研究了细菌群落与采样位点沉积物理化性质的相关性。结果表明沉积物的理化指标中pH、TN、TP、EC、NO3−-N和NH4+-N的分布均对细菌群落的构成有一定影响,效应值应是TN > EC > NO3−-N > NH4+-N > TP > pH (表 5)。其中Uncultured_bacterium_ f_Hydrogenophilaceae和Pseudarthrobacter菌属细菌的相对丰度与NO3−-N的含量极显著正相关;Uncultured_bacterium_f_Comamonadaceae、Azoarcus、Tolumonas、Sphingopyxis、Methyloversatilis、Algoriphagus、Bacteriovorax和Simplicispira菌属相对丰度与TN显著正相关,Uncultured_Bacteroidetes_bacterium、Zoogloea、Aeromonas、Acinetobacter、Bacteriovorax和Vogesella菌属细菌的相对丰度与EC的含量显著正相关;Sulfurimonas、Sulfuricurvum菌属相对丰度与NH4+-N的含量显著负相关,Thermomonas菌属细菌的相对丰度与NH4+-N的含量显著正相关,Rhodobacter菌属细菌的相对丰度与pH值显著正相关;Novosphingobium、Erysipelothrix菌属相对丰度与TP含量显著正相关。
| Dominant genus | pH | EC (μs/cm) | NO3--N (mg/kg) | NH4+-N (mg/kg) | TN (mg/kg) | TP (mg/kg) |
| Uncultured_bacterium_f_Hydrogenophilaceae (2.2%–8.2%) | 0.520 | 0.207 | 0.996** | 0.869 | 0.484 | 0.270 |
| Uncultured_bacterium_f_Comamonadaceae (1%–4.4%) | 0.579 | 0.753 | 0.635 | 0.889 | 0.955* | 0.785 |
| Uncultured_Bacteroidetes_bacterium (0.1%–2.9%) | -0.100 | 0.959* | 0.425 | 0.754 | 0.898 | 0.196 |
| Azoarcus (0.8%–2.3%) | 0.405 | 0.870 | 0.444 | 0.790 | 0.982* | 0.728 |
| Sulfurimonas (0.07%–0.31%) | -0.579 | -0.716 | -0.755 | -0.955* | -0.937 | -0.711 |
| Sulfuricurvum (0.15%–3.7%) | -0.546 | -0.744 | -0.739 | -0.953* | -0.950 | -0.695 |
| Tolumonas (0.006%–1%) | 0.317 | 0.913 | 0.409 | 0.774 | 0.988* | 0.663 |
| Sphingopyxis (0.05%–0.67%) | 0.366 | 0.872 | 0.326 | 0.702 | 0.959* | 0.737 |
| Zoogloea (0.003%–1%) | 0.004 | 0.994** | 0.252 | 0.662 | 0.941 | 0.411 |
| Novosphingobium (0.14%–0.82%) | 0.785 | 0.436 | 0.339 | 0.554 | 0.695 | 0.991** |
| Methyloversatilis (0.006%–0.8%) | 0.074 | 0.945 | 0.529 | 0.842 | 0.954* | 0.345 |
| Rhodobacter (0.12%–1%) | 0.984* | -0.034 | 0.463 | 0.438 | 0.346 | 0.921 |
| Algoriphagus (0.06%–0.78%) | 0.277 | 0.927 | 0.368 | 0.747 | 0.983* | 0.642 |
| Aeromonas (0.01%–0.4%) | 0.000 | 0.963* | 0.079 | 0.525 | 0.889 | 0.467 |
| Acinetobacter (0.003%–0.98%) | 0.000 | 0.971* | 0.107 | 0.549 | 0.900 | 0.459 |
| Bacteriovorax (0.23%–0.6%) | 0.010 | 0.992** | 0.348 | 0.729 | 0.953* | 0.374 |
| Simplicispira (0.003%–0.53%) | 0.287 | 0.888 | 0.632 | 0.915 | 0.984* | 0.516 |
| Pseudarthrobacter (0.03%–0.6%) | 0.651 | 0.297 | 0.991** | 0.927 | 0.608 | 0.473 |
| Erysipelothrix (0.14%–0.49%) | 0.858 | 0.186 | 0.245 | 0.376 | 0.479 | 0.987* |
| Thermomonas (0.06%–0.36%) | 0.664 | 0.584 | 0.855 | 0.973* | 0.857 | 0.697 |
| Vogesella (0.003%–0.32%) | -0.166 | 0.969* | 0.351 | 0.698 | 0.876 | 0.156 |
| 注:*:P < 0.05;**:P < 0.01. Note: *: Correlation is significant at P < 0.05 level;**: Correlation is significant at P < 0.01 level. |
||||||
山西省左云县作为国家优质动力煤基地之一,煤炭能源输出大,产生的采煤废水却给可持续发展带来挑战[18-19],在实际的运行案例中,采煤废水流经人工湿地后,BOD5、CODCr、TN、TP都得到了有效的控制(表 2)。深入研究山西省左云县人工湿地处理废水的效应和机制,有助于将人工湿地技术进一步推广应用。目前人工湿地相关研究主要集中在采矿废水的处理效果方面[20-21],关于不同类型采煤区人工湿地河流沉积物中细菌群落结构及其功能的研究较少。人工湿地水深较浅,促使沉积层物质与水体物质交换频繁,进而影响微生物的多样性。本研究结果表明,相邻取样点的细菌群落组成较为相似,人工湿地下游菌落组成的均匀度和丰富度最高;营养通量的改变可能导致生态系统发生变化,使得不同营养区的细菌群落组成各异;门水平来看(> 1%),变形菌门、拟杆菌门、厚壁菌门、放线菌门在4个采样点均属于优势菌门。Chen等发现城市污水人工湿地沉积物优势菌种以变形菌门、绿弯菌门和放线菌门为主,所占比例接近80%[22],Ma等研究了中国钢铁工业集团9个焦化废水人工湿地沉积物细菌多样性,发现变形菌门(平均76.14%)、拟杆菌门(平均6.79%)、酸杆菌门(平均4.32%)、厚壁菌门(平均2.4%)、放线菌门(平均2.35%)为优势分布菌门。在研究的山西太原钢铁集团的焦化废水人工湿地,尽管地理位置相近,但是其沉积物中变形菌门丰度占90.38%,该人工湿地流入CODCr达到4 000 mg/L,氨氮300 mg/L[23],远高于本研究中人工湿地的流入指标,因此出现了门水平种类丰度的偏差。根据Hooper等的生态系统功能假说,湿地沉积物细菌多样性越高,生态系统功能越强[24],本研究中沉积物门水平的多样性也反映出了人工湿地在处理采煤废水中的功能。变形菌门细菌代谢与碳、氮和硫循环密切相关[25],在硫酸盐和硝酸盐共还原过程中起着重要的功能作用[26]。放线菌门可利用难分解有机碳源,厚壁菌门在氮污染生物修复中可以将上覆水的氮转移到沉积物中[27]。迷踪菌门能将葡萄糖降解为乳酸、醋酸、氢和二氧化碳,并能固定氮和分泌固氮酶[28]。M1沉积物中的变形菌门、迷踪菌门丰度最高,厚壁菌门丰度较高,同时沉积物的TN含量最高,说明更多的氮可能参与了氮的生物地球化学循环。Ignavibacteriae细菌是氨氧化污泥反应器废水处理系统中的主要类群[29],硝化螺旋菌门是推动亚硝化反应的重要微生物,在多种厌氧氨氧化环境中被检测到[30],在M4沉积物中均发现这两类菌群,结合M4的上覆水以及沉积物TN,说明二者参与了M4处氮元素的转移。Saccharibacteria菌门在好氧、硝酸盐还原和厌氧条件下,对有机化合物和糖类化合物的降解有着重要的作用[31],Spirochaetae能促进碳水化合物和氨基酸发酵成醋酸盐、氢和二氧化碳[32]。疣微菌门是酸性土壤中参与碳循环固碳作用的菌类[33]。芽单胞菌门的某些纲具有分解有机碳的能力[34]。M2沉积物中发现Saccharibacteria、Spirochaetae菌门,上覆水CODCr在M2处下降12.1%,说明Saccharibacteria、Spirochaetae菌门参与了碳化合物的循环。而在M3沉积物中仅发现Spirochaetae,从上覆水的CODCr下降中来看,单一的Spirochaetae菌门更有利于CODCr的去除,M4中发现的疣微菌门、芽单胞菌门则参与了上覆水中碳固定,从而使得整体采煤废水的CODCr去除率达到93.4%。
本研究4个采样点中变形菌门属绝对优势菌门(49.6%−64.7%),此结果与Ansola等在城市污水人工湿地沉积物的研究相近,Ansola等发现构成变形菌门的主要纲除α-变形菌纲、β-变形菌纲、δ-变形菌纲、γ-变形菌纲、ɛ-变形菌纲外还存在少量的θ-变形菌纲[35],本研究中未发现有θ-变形菌纲,这可能是由于废水来源的差异,环境参数的不同而使得人工湿地沉积物细菌主要纲组成产生差异。在4个采样点中α-变形菌纲丰度差别不大,α-变形菌纲菌属具有适应其生境的生理特性,与整个人工湿地中上游的高营养度相关。在M1、M2、M3中β-变形菌纲丰度达到27%以上,β-变形菌纲菌属能够耐受高盐生境,可降解烃类芳香族类化合物,参与氮循环。在M4中δ-变形菌纲丰度最高(15%),δ-变形菌纲丰度与盐度相关,在化能自养的代谢过程中还原硫酸盐升高生境的pH值,M4中虽然其丰度高,但是其硫化物浓度低,相应的生境pH值差别也不显著(表 2)。丰度与盐度也存在相关性,只不过与δ-变形菌纲菌属生态功能却相反,在M1、M2、M3中γ-变形菌纲丰度在10%−15%之间,可以通过硫化物的代谢而降低生境的pH值。尽管利用高通量测序技术对不同采样点沉积物细菌16S rRNA基因测序存在过高估微生物多样性的可能[17],但实验结果能从整体上反映生态系统的结构和多样性。
特定的环境更适合特定的菌群生存,环境相似的条件下菌群结构也较为相似。有学者发现总碳含量[36]、沉积物的粒径[37]、溶解氧[38]以及温度被认为是表层沉积物中微生物群落结构的重要环境驱动者[39-41]。研究发现Sulfurimonas、Sulfuricurvum菌属细菌的相对丰度与NH4+-N含量存在显著的负相关关系,在M1、M2、M3的相对丰度较低,在M4处超过4%,两者是ɛ-变形菌纲中的细菌属,以还原硝酸盐并能将硫化物氧化为单质硫等无毒形式的硫,进而减少和缓解因硫化物引起的酸化及腐蚀。在氮素循环中,固氮菌属中的Azoarcus菌属广泛存在于受污染水中,参与污染物的降解。在M1、M2、M3的相对丰度都超过1.5%,其相对丰度与TN存在显著的正相关关系。人工湿地中细菌的组成及其功能性是湿地系统运行关键[42-43],从细菌群落结构的丰度来看,采煤区废水流经人工湿地时会对细菌的种群数量产生影响,但是随着人工湿地的细菌生态功能,其生物群落的多样性还可以重新建立。
4 结论(1) 采煤废水流经人工湿地后水质明显改善,BOD5、CODCr、TN、TP得到了有效的去除;悬浮物随着湿地水流流向逐渐减少,挥发酚和硫化物在采样点间变化不大。
(2) 在人工湿地沉积物分析中,不同采样点沉积物中细菌群落组成和多样性存在差异,相邻取样点的细菌群落组成较为相似,营养通量是不同营养区的细菌群落组成各异的主要原因。
| [1] |
Xia HP. Mechanisms and efficiencies on wastewater treatment with constructed wetlands: a review[J]. Chinese Journal of Ecology, 2002, 21(4): 52-59. (in Chinese) 夏汉平. 人工湿地处理污水的机理与效率[J]. 生态学杂志, 2002, 21(4): 52-59. DOI:10.3321/j.issn:1000-4890.2002.04.012 |
| [2] |
Ann Y, Reddy KR, Delfino JJ. Influence of chemical amendments on phosphorus immobilization in soils from a constructed wetland[J]. Ecological Engineering, 1999, 14(1/2): 157-167. |
| [3] |
Jesus JM, Cassoni AC, Danko AS, et al. Role of three different plants on simultaneous salt and nutrient reduction from saline synthetic wastewater in lab-scale constructed wetlands[J]. Science of the Total Environment, 2017, 579: 447-455. DOI:10.1016/j.scitotenv.2016.11.074 |
| [4] |
Luo P, Liu F, Liu XL, et al. Phosphorus removal from lagoon-pretreated swine wastewater by pilot-scale surface flow constructed wetlands planted with Myriophyllum aquaticum[J]. Science of the Total Environment, 2017, 576: 490-497. DOI:10.1016/j.scitotenv.2016.10.094 |
| [5] |
Vymazal J. Removal of nutrients in various types of constructed wetlands[J]. Science of the Total Environment, 2007, 380(1/3): 48-65. |
| [6] |
Zhang SB, He XJ, Wu HL, et al. Effects of environmental factors on the community structure of denitrification bacteria in sediment of constructed wetland[J]. Technology of Water Treatment, 2017, 43(4): 11-14, 18. (in Chinese) 张盛博, 何小娟, 吴海露, 等. 环境因子对人工湿地沉积物中反硝化微生物群落结构的影响[J]. 水处理技术, 2017, 43(4): 11-14, 18. |
| [7] |
Absalon D, Matysik M. Changes in water quality and runoff in the Upper Oder River Basin[J]. Geomorphology, 2007, 92(3/4): 106-118. |
| [8] |
Pahl-Wostl C, Hoff H, Meybeck M, et al. The role of global change research for aquatic sciences[J]. Aquatic Sciences, 2002, 64(4): iv-vi. DOI:10.1007/PL00012595 |
| [9] |
Kothandaraman V. Industrial water pollution control[J]. Journal of the American Water Resources Association, 1969, 5(2): 73-74. |
| [10] |
Zhao FH, Sun HF, Li WS. Migration of hazardous elements in acid coal mine drainage[J]. Journal of China Coal Society, 2007, 32(3): 261-266. (in Chinese) 赵峰华, 孙红福, 李文生. 煤矿酸性矿井水中有害元素的迁移特性[J]. 煤炭学报, 2007, 32(3): 261-266. DOI:10.3321/j.issn:0253-9993.2007.03.009 |
| [11] |
Nordin AP, da Silva J, de Souza CT, et al. In vitro genotoxic effect of secondary minerals crystallized in rocks from coal mine drainage[J]. Journal of Hazardous Materials, 2018, 346: 263-272. DOI:10.1016/j.jhazmat.2017.12.026 |
| [12] |
Cao YM, Dai T. Study on the treatment of cadmium-containing wastewater from coal mine in calamus artificial wetlands[J]. Industrial Water Treatment, 2012, 32(7): 43-45. (in Chinese) 曹优明, 戴涛. 菖蒲人工湿地对煤矿废水中镉的处理研究[J]. 工业水处理, 2012, 32(7): 43-45. DOI:10.3969/j.issn.1005-829X.2012.07.012 |
| [13] |
Kiiskila JD, Sarkar D, Feuerstein KA, et al. A preliminary study to design a floating treatment wetland for remediating acid mine drainage-impacted water using vetiver grass (Chrysopogon zizanioides)[J]. Environmental Science and Pollution Research, 2017, 24(36): 27985-27993. DOI:10.1007/s11356-017-0401-8 |
| [14] |
Di JZ, Jiang F, Ma L, et al. Treatment of coal mine wastewater with vertical flow constructed wetland system strengthened by PRB[J]. Chinese Journal of Environmental Engineering, 2013, 7(6): 2033-2037. (in Chinese) 狄军贞, 江富, 马龙, 等. PRB强化垂直流人工湿地系统处理煤矿废水[J]. 环境工程学报, 2013, 7(6): 2033-2037. |
| [15] |
Ma DS, Guo YH, Zhang QQ, et al. Influence of reclaimed water on the bacterial community structure of sediment from an urban river[J]. Acta Ecologica Sinica, 2015, 35(20): 6742-6749. (in Chinese) 马栋山, 郭羿宏, 张琼琼, 等. 再生水补水对河道底泥细菌群落结构的影响[J]. 生态学报, 2015, 35(20): 6742-6749. |
| [16] |
Wang CY, Zhou JW, Liu J, et al. Responses of soil N-fixing bacteria communities to invasive species over a gradient of simulated nitrogen deposition[J]. Ecological Engineering, 2017, 98: 32-39. DOI:10.1016/j.ecoleng.2016.10.073 |
| [17] |
Sun DL, Jiang X, Wu QL, et al. Intragenomic heterogeneity of 16S rRNA genes causes overestimation of prokaryotic diversity[J]. Applied and Environmental Microbiology, 2013, 79(19): 5962-5969. DOI:10.1128/AEM.01282-13 |
| [18] |
Li YJ, Zhang RR, Li SQ. Interspecific relationships of dominant species in naturally colonized plant communities on coal gob piles of Xinglonggou Mine in Zuoyun County of Shanxi Province, China[J]. Chinese Agricultural Science Bulletin, 2015, 31(1): 10-16. (in Chinese) 李钰洁, 张蓉蓉, 李素清. 山西左云县兴隆沟煤矿矸石山自然定居植物群落优势种种间关系研究[J]. 中国农学通报, 2015, 31(1): 10-16. |
| [19] |
Zhang L, Wu HM. Sustainable development of Shanxi's coal industry[J]. Reformation & Strategy, 2010, 26(1): 129-131. (in Chinese) 张磊, 吴红梅. 山西煤炭工业的可持续发展研究[J]. 改革与战略, 2010, 26(1): 129-131. DOI:10.3969/j.issn.1002-736X.2010.01.037 |
| [20] |
Fang JD, Zhang HX, Ju YW. Constructed wetland construction for coal-bed methane produced water and research on its treatment efficiency[J]. Environmental Engineering, 2017, 35(5): 20-24. (in Chinese) 房继德, 张洪勋, 琚宜文. 煤层气产出水的人工湿地构建与处理效果研究[J]. 环境工程, 2017, 35(5): 20-24. |
| [21] |
Saeed T, Afrin R, Al Muyeed A, et al. Treatment of tannery wastewater in a pilot-scale hybrid constructed wetland system in Bangladesh[J]. Chemosphere, 2012, 88(9): 1065-1073. DOI:10.1016/j.chemosphere.2012.04.055 |
| [22] |
Chen Y, Wen Y, Tang ZR, et al. Effects of plant biomass on bacterial community structure in constructed wetlands used for tertiary wastewater treatment[J]. Ecological Engineering, 2015, 84: 38-45. DOI:10.1016/j.ecoleng.2015.07.013 |
| [23] |
Ma Q, Qu YY, Shen WL, et al. Bacterial community compositions of coking wastewater treatment plants in steel industry revealed by Illumina high-throughput sequencing[J]. Bioresource Technology, 2015, 179: 436-443. DOI:10.1016/j.biortech.2014.12.041 |
| [24] |
Hooper DU, Chapin FS, Ewel JJ, et al. Effects of biodiversity on ecosystem functioning: a consensus of current knowledge[J]. Ecological Monographs, 2005, 75(1): 3-35. DOI:10.1890/04-0922 |
| [25] |
Kersters K, de Vos P, Gillis M, et al. Introduction to the Proteobacteria[A]//Dwarkin M, Falkow S, Rosenberg E, et al. The Prokaryotes[M]. New York: Springer, 2006: 3-37
|
| [26] |
Chen C, Xu XJ, Xie P, et al. Pyrosequencing reveals microbial community dynamics in integrated simultaneous desulfurization and denitrification process at different influent nitrate concentrations[J]. Chemosphere, 2017, 171: 294-301. DOI:10.1016/j.chemosphere.2016.11.159 |
| [27] |
He T, Guan W, Luan ZY, et al. Spatiotemporal variation of bacterial and archaeal communities in a pilot-scale constructed wetland for surface water treatment[J]. Applied Microbiology and Biotechnology, 2016, 100(3): 1479-1488. DOI:10.1007/s00253-015-7072-5 |
| [28] |
Zheng H, Dietrich C, Radek R, et al. Endomicrobium proavitum, the first isolate of Endomicrobia class. nov. (phylum Elusimicrobia)-an ultramicrobacterium with an unusual cell cycle that fixes nitrogen with a group Ⅳ nitrogenase[J]. Environmental Microbiology, 2016, 18(1): 191-204. DOI:10.1111/1462-2920.12960 |
| [29] |
Mardanov AV, Beletsky AV, Nikolaev Y, et al. Metagenome of the microbial community of anammox granules in a nitritation/anammox wastewater treatment system[J]. Genome Announcements, 2017, 5(42): e01115-17. |
| [30] |
Huang C, Shi YJ, El-Din MG, et al. Optimization of ozonation combined with integrated fixed-film activated sludge (IFAS) in the treatment of oil sands process-affected water (OSPW)[J]. International Biodeterioration & Biodegradation, 2016, 112: 31-41. |
| [31] |
Tang YQ, Li M, Xu DN, et al. Application potential of aerobic denitrifiers coupled with a biostimulant for nitrogen removal from urban river sediment[J]. Environmental Science and Pollution Research, 2018, 25(6): 5980-5993. DOI:10.1007/s11356-017-0903-4 |
| [32] |
Lee SH, Park JH, Kang HJ, et al. Distribution and abundance of Spirochaetes in full-scale anaerobic digesters[J]. Bioresource Technology, 2013, 145: 25-32. DOI:10.1016/j.biortech.2013.02.070 |
| [33] |
Zheng Y, Zheng YM, Zhang LM, et al. Advances in thermoacidophilic methanotrophs from extreme environments[J]. Acta Ecologica Sinica, 2009, 29(7): 3864-3871. (in Chinese) 郑勇, 郑袁明, 张丽梅, 等. 极端环境下嗜热酸甲烷营养细菌研究进展[J]. 生态学报, 2009, 29(7): 3864-3871. DOI:10.3321/j.issn:1000-0933.2009.07.049 |
| [34] |
Fawaz MN. Revealing the ecological role of Gemmatimonadetes through cultivation and molecular analysis of agricultural soils[D]. Knoxville: Master's Thesis of the University of Tennessee, 2013: 44-50
|
| [35] |
Ansola G, Arroyo P, Sáenz de Miera LE. Characterisation of the soil bacterial community structure and composition of natural and constructed wetlands[J]. Science of the Total Environment, 2013, 473-474: 63-71. |
| [36] |
Yang FL, Yang JS, Deng CP, et al. Bacterial communities and their hydrocarbon bioremediation potential in the Bohai Sea, China[J]. Marine Ecology Progress Series, 2015, 538: 117-130. DOI:10.3354/meps11489 |
| [37] |
Truu M, Juhanson J, Truu J. Microbial biomass, activity and community composition in constructed wetlands[J]. Science of the Total Environment, 2009, 407(13): 3958-3971. |
| [38] |
Zheng BH, Wang LP, Liu LS. Bacterial community structure and its regulating factors in the intertidal sediment along the Liaodong Bay of Bohai Sea, China[J]. Microbiological Research, 2014, 169(7/8): 585-592. |
| [39] |
Gao MH, Liu JW, Qiao YL, et al. Diversity and abundance of the denitrifying microbiota in the sediment of Eastern China Marginal Seas and the impact of environmental factors[J]. Microbial Ecology, 2017, 73(3): 602-615. DOI:10.1007/s00248-016-0906-6 |
| [40] |
Zhou JZ, Deng Y, Zhang P, et al. Stochasticity, succession, and environmental perturbations in a fluidic ecosystem[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(9): E836-E845. DOI:10.1073/pnas.1324044111 |
| [41] |
Li YX. Microbial diversity in sediments of Jiaozhou Bay and East Pacific seamounts (~13°N)[D]. Qingdao: Doctoral Dissertation of Institute of Oceanology, Chinese Academy of Sciences, 2008 (in Chinese) 李友训.胶州湾和东太平洋海隆(~13°N)沉积物微生物多样性研究[D].青岛: 中国科学院海洋研究所博士学位论文, 2008 |
| [42] |
Mao BQ, Ao CL, Jiao Y, et al. Evaluation of preference heterogeneity of ecosystem services in the Sanjiang Plain Wetlands based on choice experiments[J]. Acta Ecologica Sinica, 2017, 37(4): 1297-1308. (in Chinese) 毛碧琦, 敖长林, 焦扬, 等. 基于选择实验的三江平原湿地生态系统服务功能价值评价及偏好异质性研究[J]. 生态学报, 2017, 37(4): 1297-1308. |
| [43] |
Sun BD, Cui LJ, Li W, et al. Dominant ecosystem services of Shuangtai estuary wetland based on different beneficiaries[J]. Chinese Journal of Ecology, 2017, 36(1): 164-171. (in Chinese) 孙宝娣, 崔丽娟, 李伟, 等. 基于不同受益者的双台河口湿地生态系统主导服务功能[J]. 生态学杂志, 2017, 36(1): 164-171. |
 2019, Vol. 46
2019, Vol. 46