扩展功能
文章信息
- 赵葵, 郜熙阳, 邱立友
- ZHAO Kui, GAO Xi-Yang, QIU Li-You
- 真菌激素研究进展
- Research progress on fungal hormone
- 微生物学通报, 2019, 46(11): 3102-3109
- Microbiology China, 2019, 46(11): 3102-3109
- DOI: 10.13344/j.microbiol.china.190030
-
文章历史
- 收稿日期: 2019-01-10
- 接受日期: 2019-03-15
- 网络首发日期: 2019-05-15
真菌种类繁多,约有150万种,生活环境多样,与人类健康、工农业生产和生态系统物质循环的关系非常密切。约有8 000种真菌感染植物,影响全球1/3的粮食产量。约有3亿人遭受真菌感染侵袭,每年有160万人死于真菌感染,多于因疟疾死亡的人口,相似于肺结核死亡人口。植物和动物都有多种激素,许多真菌能够合成性激素和动、植物激素,这些激素能够被真菌感知,并对真菌有不同的生理作用,建立真菌激素学这一新学科指日可待。
1 植物和动物的激素目前已知的植物激素有十大类,即脱落酸(Abscisic acid,ABA)、生长素(Auxin,AUX)、油菜素甾醇醇类(Brassinosteroids,BRs)、细胞分裂素(Cytokinins,CKs)、乙烯(Ethylene,ET)、赤霉酸(Gibberellic acids,GAs)、茉莉酸(Jasmonic acid,JA)、一氧化氮(Nitric oxide,NO)、水杨酸(Salicylic acid,SA)和独脚金内酯(Strigolactones,SLs)[1]。动物激素与植物激素有所不同,动物激素往往由动物特定的分泌细胞或内分泌腺分泌,种类较多,可分为肽类和蛋白质、氨基酸衍生物和固醇类激素。
2 真菌合成的植物激素及其生理功能植物合成的激素在生物或非生物胁迫条件下调控自身的生长发育、抗病性和抗逆性。许多真菌与植物发生紧密的相互作用,有些是有益的,如菌根真菌;有些则是有害的,如病原真菌。菌根真菌和绝大多数病原真菌在侵入植物体内时往往产生多种植物激素,如AUX、CKs、GAs、ET、ABA、JA和SA等,以扰乱植物体内这些内源激素的水平,削弱植物的防御。同时,真菌和植物合成的植物激素也对真菌产生生理调节功能[2]。
2.1 生长素许多植物病原菌、外生菌根真菌和内生菌等合成吲哚乙酸(Indole-3-acetic acid,IAA)。植物合成IAA的途径主要是吲哚-3-丙酮酸和色胺途径,真菌中合成IAA的途径是吲哚-3-丙酮酸、色胺、吲哚-3-乙腈和吲哚-3-乙酰胺等途径[3-4]。
一些真菌的生长素产量与其生长速度呈负相关[5],而生长素则促进酿酒酵母(Saccharomyces cerevisiae)和葡萄酒酵母(S. ellipsoideus)细胞的伸长和孢子的形成,并可导致酿酒酵母和白色假丝酵母(Candida albicans)菌体形态的转变,引发其毒性菌丝的生长[6]。白色假丝酵母在全球每年引起40余万人的严重感染,死亡率高达46%-75%[7]。IAA可促进粗糙脉孢菌(Neurospora crassa)孢子的萌发,但却抑制番茄病原菌尖孢镰刀菌(Fusarium oxysporum f. sp. lycopersici)孢子的萌发。生长素对真菌菌丝生长的影响可能是剂量相关的,低浓度促进鹰嘴豆病原菌镰刀霉菌(F. delphinoides)的生长,高浓度则抑制其生长[8]。生长素还参与菌根真菌与植物的共生。一个过量合成生长素的外生菌根真菌粘花菇(Hebeloma cylindrosporum)其突变株入侵松根组织的能力显著增强[9]。生长素也参与真菌病原菌与植物的互作。小麦黑锈病病菌(Puccinia graminis f. sp. tritici)产生的生长素类似物促进其在小麦叶的定殖[10]。稻瘟病菌(Magnaporthe oryzae)的菌丝和分生孢子合成的IAA可能具有诱导植物生长、减弱植物防御的作用[11]。
2.2 细胞分裂素多种真菌可合成CK,包括腐生菌、致病菌或共生菌[12-13]。真菌合成CK的途径尚属未知。
细胞分裂素可促进菌根菌菌丝分枝和菌丝的生长,以及有性生殖,并改变菌丝细胞膜的粘度,从而影响菌丝对离子和水的运输,这些影响既与细胞分裂素的浓度有关,也与细胞分裂素的分子类型有关[14]。最近研究发现,稻瘟病菌合成的CK可影响水稻的防御、营养分布和对真菌侵染诱发的氧化胁迫的耐受性等,从而增强其致病性[15]。
2.3 赤霉酸许多植物病原菌、外生菌根真菌和内生菌等合成GA。植物和真菌合成GA的途径中几个主要步骤相似,但其基因和酶则有较大的差异[16]。赤霉酸可促进粗糙脉胞菌分生孢子的萌发和菌丝的生长。菌根菌侵染植物时,植物中的GA含量增加[17]。被侵染的植物细胞中GA含量增加可能起到信号作用,增强被侵染植物细胞的碳库活性,为侵染真菌提供营养[18]。水稻恶苗病原菌藤仓赤霉菌(Gibberella fujikuroi)合成的GA是否提高其致病性还尚未确定。
2.4 脱落酸多种植物病原真菌和腐生真菌,尤其是病原真菌合成脱落酸。植物和真菌生物合成ABA途径有较大差异,植物合成ABA仅有一条途径,而真菌中则存在另外4条不同的途径[3]。
外加ABA对甘薯黑斑病(Ceratocystis fimbriata)菌丝的生长有一定的促进作用,可促进稻瘟病菌附着胞的形成。丛枝菌根真菌球囊霉菌(Glomus sp.)合成ABA,形成菌根的植株木质部树液中ABA浓度高于未形成菌根的植株,但其究竟是来自植株还是真菌尚未确定[19]。稻瘟病菌的致病性与其ABA的合成有密切关系[2]。
2.5 乙烯 2.5.1 乙烯的合成乙烯是植物的重要激素,对植物的生长和发育有重大的调节作用,包括种子萌发、果实成熟、器官成熟和脱落以及胁迫响应等。许多真菌能合成乙烯,Ilag等调查了228种真菌,其中58种(25.6%)合成乙烯[20]。El-Sharouny从植物病根中分离的81种真菌中有31%产生乙烯[21]。目前已报道有88种酵母菌和霉菌可合成乙烯,酵母菌有酿酒酵母、裂殖酵母和白色隐球菌等,霉菌分布于真菌的所有门中,既有土壤中常见的真菌如曲霉、根霉,以及菌根真菌、大型食药用真菌、植物病原真菌、人和动物病原真菌,也有重要的工业真菌青霉素产生菌产黄青霉等[22]。
植物合成乙烯的途径是1-氨基环丙烷-1-羧酸(1-Aminocyclopropane-1-carboxylate,ACC)途径,在真菌中则有KMBA途径和ACC途径,ACC途径的关键酶有ACC合成酶(ACC synthetase,ACS)和ACC氧化酶(ACC oxidase,ACO)[23]。
2.5.2 乙烯的生理功能乙烯对真菌的生长发育、代谢以及与植物互作等多方面都有影响。
(1) 乙烯影响真菌的生长和发育
乙烯影响真菌的生长和发育表现为浓度依赖性。高浓度乙烯促进核盘菌(Sclerotinia sclerotiorum)菌丝的生长,促进烟草赤星病菌(Alternaria alternata)孢子的萌发和菌丝生长[24],但却抑制灰霉菌(Botrytis cinerea)菌丝的生长及双孢蘑菇菌丝的生长和子实体的形成[23]。而低浓度的乙烯则促进灰霉菌菌丝的生长、芽管的伸长和附着胞的形成。右旋糖酐酶产生菌圆弧青霉(Penicillium cyclopium)形成气生菌丝和分生孢子时伴随有乙烯的迅速合成。抑制乙烯的合成,圆弧青霉不能形成成熟的分生孢子,其萌发率降低90%[25]。
(2) 乙烯影响真菌和植物的相互作用
真菌和植物相互作用之初往往会引起乙烯浓度的增加,合成的乙烯是来自真菌还是植物尚不清楚。乙烯对有些病原真菌的致病性有促进作用,对另一些病原真菌的致病性则有抑制作用。植物合成的乙烯可提高灰霉菌致病基因的表达[26]和烟草赤星病菌致病性[24],诱导炭疽菌(Colletotrichum sp.)附着胞的形成及对果实的侵染[27]。外源乙烯可提高流胶病病原菌(Lasiodiplodia theobromae)的致病性[28]。而稻胡麻斑病菌(Cochliobolus miyabeanus)和灰霉菌合成的乙烯可增加宿主的乙烯水平,提高致病性[29]。对不同植物的乙烯不敏感突变株的研究表明,乙烯可减轻坏死或活体-坏死营养型真菌病害,相对地,乙烯往往促进非严重真菌病害的发展[30]。
乙烯同样影响共生真菌与植物共生关系的建立。外源乙烯或植物合成的乙烯抑制丛枝状内生菌根真菌的共生,但某些外生菌根真菌通过合成的乙烯诱导宿主根部畸变,从而成功形成共生结构[2]。
(3) 乙烯促进食用菌子实体的成熟和衰老
已发现多种食用菌如双孢蘑菇、草菇、香菇、金针菇等合成乙烯。采收的双孢蘑菇和草菇子实体有2个乙烯峰值,第一个峰值是采收切柄和菌盖机械损伤的应激反应时,后一个峰值是成熟担子释放时,表现为典型呼吸跃变型果蔬的乙烯特征,在极短时间内导致食用菌子实体开伞、褐变、软腐等衰老现象,货架期比其他新鲜果蔬短,仅能保存3-4 d,严重影响其鲜销及经济社会效益[31-32]。我们研究发现,用乙烯利处理后,双孢蘑菇子实体采后成熟衰老加快,易褐变、易开伞,硬度下降,与成熟衰老相关的多酚氧化酶、外切葡聚糖酶和自噬相关等的基因显著上调。用乙烯受体抑制剂1-甲基环丙烯(1-MCP)处理的结果与乙烯利则相反[33]。
(4) 乙烯抑制真菌次生代谢产物的合成
外源乙烯抑制曲霉(Aspergillus)合成黄曲霉毒素[34]。黄曲霉(A. flavus)侵染玉米种子可引起种子大量合成乙烯,霉菌在种子中大量繁殖,但不合成黄曲霉毒素[35]。宿主合成的乙烯可诱导交链孢菌(Alternaria alternata f. sp. Lycopersici)毒素的合成[36]。
2.6 SA和JA在香菇和金针菇中发现可合成JA、SA和茉莉酸甲酯等。一些植物病原真菌也合成JA和SA[37]。
SA对玉米枯萎头孢霉(Harpophora maydis)孢子的萌发和菌丝的生长有一定的抑制作用,降低尖孢镰刀菌孢子的萌发和菌丝的生长,显著抑制黄曲霉菌丝的生长[2]。稻瘟病菌能够合成JA衍生物和JA单加氧酶,从而改变宿主体内JA的平衡,抑制宿主的JA信号,削弱宿主的防御和抗性[38]。
真菌合成的植物激素对其自身的作用可用图 1加以概括。
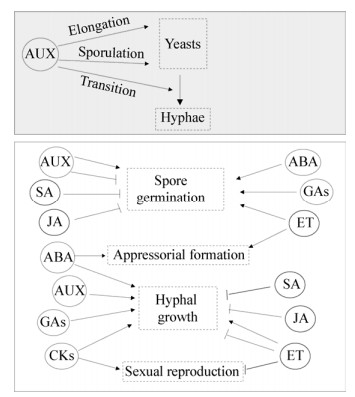
|
| 图 1 植物激素对酵母状真菌(亮灰色背景)和丝状真菌的生理作用示意图 Figure 1 Schematic representation of the effects of hormones on the physiology of yeast-like (light grey background) and filamentous fungi 注:箭头和T形线:分别表示正的和负的影响;ABA:脱落酸;AUX:生长素;ET:乙烯;CKs:细胞分裂素;GAs:赤霉酸;JA:茉莉酸;SA:水杨酸. Note: Arrows and 'T' bars: Represent positive and negative effects, respectively; ABA: Abscisic acid; AUX: Auxins; ET: Ethylene; CKs: Cytokinins; GAs: Gibberellic acids; JA: Jasmonic acid; SA: Salicylic acid. |
|
|
粗糙脉孢菌、酿酒酵母和烟曲霉菌经诱导可合成胰岛素原、胰岛素类似物[39]。酿酒酵母的交配型α-因子与哺乳动物中的十肽促性腺激素释放因子具有序列同源性和功能相似性[40]。一些二型态真菌如假丝酵母、巴西副球孢子菌(Paracoccidioides brasiliensis)和粗球孢子菌(Coccidioides immitis),以及某些病原真菌如小孢癣菌(Microsporum)和毛癣菌(Trychophyton)等、大型担子菌糙皮侧耳(Pleurotus ostreatus)可合成多种动物性激素,包括皮质酮、睾酮、雄烯二酮、黄体酮和雌二醇等[41-42]。这些真菌之间,以及真菌和动物之间,合成类固醇激素的途径有较大的差异。真菌合成动物激素并没有特定的细胞或组织。
内源或外源的动物激素对许多真菌发生作用。粗糙脉孢菌中发现有胰岛素信号响应转导系统[43],胰岛素促进二氧化碳、乙醇、丙氨酸和糖原的产生及葡萄糖的代谢,其引起糖原合成的增加是由于糖原合成酶从6-磷酸葡萄糖依赖型(D)转变为非依赖型(I)[44]。在白色假丝酵母中有皮质类固醇、黄体酮和雌激素的结合受体[45-46],黄体酮降低白色假丝酵母的定殖、侵染和生物膜的形成,从而减弱其致病性,雌激素则促进白色假丝酵母的增殖、芽管的形成,以及对热和药物的抗性[47]。巴西副球孢子菌对人类两性的感染机会是均等的,但在男性中的发病率是女性的48倍,原因是雌激素可抑制这种二型态真菌由菌丝型向酵母型转化,酵母型是该菌唯一的感染型[41]。在巴西副球孢子菌酵母型细胞和菌丝型细胞中均发现有17-β-雌二醇的特异性结合蛋白,17-β-雌二醇可改变该两种类型细胞的蛋白表达谱[48]。
然而,动物类固醇激素对真菌的作用模式不是激素,而是有害物质。在真菌中尚未发现高等真核细胞中存在的类固醇激素受体介导的信号转导。尽管动物类固醇激素可改变酵母和丝状真菌多种基因的表达,但主要是应激反应相关基因的表达[49]。酿酒酵母对动物类固醇激素的信号转导途径是细胞壁完整性途径和高渗透压甘油丝裂原活化蛋白激酶途径。真菌中存在多种类固醇防御机制,对类固醇进行转化脱毒或运输至胞外[50-51]。
4 真菌合成的性激素卵菌、壶菌和接合菌门真菌合成的甾醇类性激素有雌诱素(Sirenin)、精器形成诱素(Antheridiol)、成卵激素(Oogoniol)、三孢酸(Trisporic acid)等[52]。子囊菌和担子菌合成的性激素是一些肽和脂肽类信息素[53]。真菌合成性激素和动物激素的途径尚未见报道。
卵菌、壶菌和接合菌门真菌合成的性激素可诱导有性生殖结构的形成、雌雄配子的结合等。而子囊菌和担子菌的性信息素则启动不同交配型细胞的结合[53]。
5 展望一些植物激素能够影响真菌的发育、营养和繁殖,表明这些激素分子能够引发真菌中的某些信号。然而,真菌是如何感知这些植物激素、信号途径怎样以及如何诱导生理响应等方面还尚不明晰。根据经典的激素概念,激素需满足3个条件:(1)已知生物合成部位;(2)能够从合成部位转运至靶细胞;(3)通过改变在生物体内的含量来调控其生物响应。然而,Kumar在Plant Cell Reports撰文指出,该3个条件并不充分,因为尚未回答激素为什么具有多种多样的生物效应;在没有鉴定出激素特异性受体之前,不能令人信服地解释激素的作用机制[54]。真菌激素的种类已知的还很少。公认的真菌激素仅有调节真菌的性分化和交配的信息素,已鉴定出相应受体和信号转导途径[53]。在多种真菌中有动物激素的结合位点[41, 55],这些结合位点是否是激素受体尚未得到鉴定。因此,迫切需要开展真菌激素受体及信号转导途径的研究,尽快建立起真菌激素学这一新型学科。
研究人体病原微生物与激素关系的学科——微生物内分泌学(Microbial Endocrinology)始创于1993年[56],研究人体病原真菌与激素关系的学科——真菌内分泌学已于2010年由Clemons等提出[57]。随着真菌与动植物激素和自身合成激素相关知识的积累,以及真菌激素对健康医疗、工农业生产等的巨大影响,真菌激素学呼之欲出。根据Kulinskiĭ等对激素学的定义,激素学是研究所有激素的科学[58]。相应地,真菌激素学是研究真菌激素的科学,真菌激素包括能够被真菌感知、信号转导并发生生理响应的内外源激素。真菌激素学研究内容包括真菌激素的种类、结构、合成途径、生理功能、信号转导和应用等。相关应用领域包括:真菌激素对食药用菌菌丝生长、子实体形成、产质量及生物活性物质合成的影响,真菌激素对植物病原真菌和共生真菌侵染、致病性和共生性的影响,真菌激素对人病原真菌致病性及其防治策略,包括新型药物作用靶点的发掘,真菌激素对人体真菌组的影响等。
对真菌激素学的研究还有利于理清动植物激素合成及其信号转导途径的起源与进化。乙烯生物合成的ACC途径除普遍存在于陆生植物外,还被发现存在于蓝细菌、红藻、绿藻类绿藻、轮藻类绿藻和粘菌中[59],仅有我们发现在真菌的双孢蘑菇中具有该途径[23, 60-61],填补了该途径在生物进化历程中的关键一环。植物中的ACO可能起源于裸子植物和被子植物的共同祖先[62]。我们研究表明,担子菌的ACO起源可能早于植物[23]。
生物信息学分析表明,植物的乙烯受体起源于原核生物的双组分信号转导系统,许多种细菌含有假拟乙烯受体,在蓝藻的集胞藻(Synechocystis)中已鉴定有乙烯功能性受体[63]。植物乙烯信号转导途径起源于4.5亿年前淡水生的丝状绿藻草原水绵(Spirogyra pratensis L.)[64]。真菌起源于9亿年前,子囊菌和担子菌分化发生在5亿年前,最早的陆生真菌内囊霉(Endogone)在高等植物产生以前就与古老的陆生植物形成了类似于现在丛枝菌根的结构[65]。因此,植物的乙烯信号转导途径是否起源于真菌是一个非常有意义的研究课题。类似地,其他动植物激素的合成途径和信号转导途径的起源和进化与真菌的关系,同样值得深入研究。
动物生活史中变态的发生与动物激素有关。在一些真菌中也存在着类似于动物变态的现象,如从丝状菌丝转变为子实体,真菌的这种变态现象是否与真菌激素有关还属未知[66]。
真菌和人与动物的亲缘关系更近,因此很难开发出对病原真菌有效而对人体无害的抗真菌药物。双组分信号转导系统存在于微生物和植物中,在人和后生动物中没有,因此,双组分信号转导系统已成为新药开发的作用靶点[67]。同样地,在动物中不存在生长素的合成和信号转导系统,以酿酒酵母和白色假丝酵母中生长素的合成和信号转导系统为靶点,也很有可能开发出对机会病原酵母有效而对人没有毒副作用的新型药物。因此,系统研究真菌激素合成途径和信号转导途径,将可能为抗真菌新药的开发提供更多的作用靶点。
| [1] |
Santner A, Estelle M. Recent advances and emerging trends in plant hormone signalling[J]. Nature, 2009, 459(7250): 1071-1078. DOI:10.1038/nature08122 |
| [2] |
Chanclud E, Morel JB. Plant hormones: a fungal point of view[J]. Molecular Plant Pathology, 2016, 17(8): 1289-1297. DOI:10.1111/mpp.12393 |
| [3] |
Tudzynski B, Sharon A. Biosynthesis, biological role and application of fungal phytohormones[A]//Osiewacz HD. Industrial Applications[M]. Berlin, Heidelberg: Springer, 2002: 183-211
|
| [4] |
Luo K, Rocheleau H, Qi PF, et al. Indole-3-acetic acid in Fusarium graminearum: identification of biosynthetic pathways and characterization of physiological effects[J]. Fungal Biology, 2016, 120(9): 1135-1145. DOI:10.1016/j.funbio.2016.06.002 |
| [5] |
Gruen HE. Auxins and fungi[J]. Annual Review of Plant Physiology, 1959, 10: 405-440. DOI:10.1146/annurev.pp.10.060159.002201 |
| [6] |
Rao RP, Hunter A, Kashpur O, et al. Aberrant synthesis of indole-3-acetic acid in Saccharomyces cerevisiae triggers morphogenic transition, a virulence trait of pathogenic fungi[J]. Genetics, 2010, 185(1): 211-220. DOI:10.1534/genetics.109.112854 |
| [7] |
Brown GD, Denning DW, Gow NAR, et al. Hidden killers: human fungal infections[J]. Science Translational Medicine, 2012, 4(165): rv13. |
| [8] |
Kulkarni GB, Sanjeevkumar S, Kirankumar B, et al. Indole-3-acetic acid biosynthesis in Fusarium delphinoides strain GPK, a causal agent of wilt in chickpea[J]. Applied Biochemistry and Biotechnology, 2013, 169(4): 1292-1305. |
| [9] |
Laurans F, Pepin R, Gay G. Fungal auxin overproduction affects the anatomy of Hebeloma cylindrosporum-Pinus pinaster ectomycorrhizas[J]. Tree Physiology, 2001, 21(8): 533-540. DOI:10.1093/treephys/21.8.533 |
| [10] |
Yin CT, Park JJ, Gang DR, et al. Characterization of a tryptophan 2-monooxygenase gene from Puccinia graminis f. sp. tritici involved in auxin biosynthesis and rust pathogenicity[J]. Molecular Plant-Microbe Interactions, 2014, 27(3): 227-235. DOI:10.1094/MPMI-09-13-0289-FI |
| [11] |
Zhang SL, Deng YZ, Zhang LH. Phytohormones: the chemical language in Magnaporthe oryzae-rice pathosystem[J]. Mycology, 2018, 9(3): 233-237. DOI:10.1080/21501203.2018.1483441 |
| [12] |
Cooper SJ, Ashby AM. Comparison of cytokinin and cytokinin-O-glucoside cleaving β-glucosidase production in vitro by Venturia inaequalis and other phytopathogenic fungi with differing modes of nutrition in planta[J]. Physiological and Molecular Plant Pathology, 1998, 53(1): 61-72. |
| [13] |
Murphy AM, Pryce-Jones E, Johnstone K, et al. Comparison of cytokinin production in vitro by Pyrenopeziza brassicae with other plant pathogens[J]. Physiological and Molecular Plant Pathology, 1997, 50(1): 53-65. DOI:10.1006/pmpp.1996.0070 |
| [14] |
Gryndler M, Hršelová H, Chvátalová I, et al. The effect of selected plant hormones on in vitro proliferation of hyphae of Glomus fistulosum[J]. Biologia Plantarum, 1998, 41(2): 255-263. DOI:10.1023/A:1001874832669 |
| [15] |
Chanclud E, Kisiala A, Emery NRJ, et al. Cytokinin production by the rice blast fungus is a pivotal requirement for full virulence[J]. PLoS Pathogens, 2016, 12(2): e1005457. DOI:10.1371/journal.ppat.1005457 |
| [16] |
Tudzynski B, Hölter K. Gibberellin biosynthetic pathway in Gibberella fujikuroi: evidence for a gene cluster[J]. Fungal Genetics and Biology, 1998, 25(3): 157-170. DOI:10.1006/fgbi.1998.1095 |
| [17] |
Barker SJ, Tagu D. The roles of auxins and cytokinins in mycorrhizal symbioses[J]. Journal of Plant Growth Regulation, 2000, 19(2): 144-154. |
| [18] |
Blee KA, Anderson AJ. Regulation of arbuscule formation by carbon in the plant[J]. The Plant Journal, 1998, 16(5): 523-530. DOI:10.1046/j.1365-313x.1998.00315.x |
| [19] |
Esch H, Hundeshagen B, Schneider-Poetsch HJ, et al. Demonstration of abscisic acid in spores and hyphae of the arbuscular-mycorrhizal fungus Glomus and in the N2-fixing cyanobacterium Anabaena variabilis[J]. Plant Science, 1994, 99(1): 9-16. |
| [20] |
Ilag L, Curtis RW. Production of ethylene by fungi[J]. Science, 1968, 159(3821): 1357-1358. DOI:10.1126/science.159.3821.1357 |
| [21] |
El-Sharouny HM. Screening of ethylene-producing root-infecting fungi in Egyptian soil[J]. Mycopathologia, 1984, 85(1/2): 13-15. |
| [22] |
Arshad M, Frankenberger Jr WT. Ethylene: Agricultural Sources and Applications[M]. New York: Springer, 2012: 100-103.
|
| [23] |
Zhang CH, Huang T, Shen CH, et al. Downregulation of ethylene production increases mycelial growth and primordia formation in the button culinary-medicinal mushroom, Agaricus bisporus (Agaricomycetes)[J]. International Journal of Medicinal Mushrooms, 2016, 18(12): 1131-1140. DOI:10.1615/IntJMedMushrooms.v18.i12.80 |
| [24] |
Kępczyńska E. Involvement of ethylene in spore germination and mycelial growth of Alternaria alternata[J]. Mycological Research, 1994, 98(1): 118-120. DOI:10.1016/S0953-7562(09)80348-1 |
| [25] |
Pažout J, Pažoutová S, Vanĉura V. Effects of light, phosphate, and oxygen on ethylene formation and conidiation in surface cultures of Penicillium cyclopium westling[J]. Current Microbiology, 1982, 7(3): 133-136. DOI:10.1007/BF01568962 |
| [26] |
Chagué V, Danit LV, Siewers V, et al. Ethylene sensing and gene activation in Botrytis cinerea: a missing link in ethylene regulation of fungus-plant interactions?[J]. Molecular Plant-Microbe Interactions, 2006, 19(1): 33-42. DOI:10.1094/MPMI-19-0033 |
| [27] |
Flaishman MA, Kolattukudy PE. Timing of fungal invasion using host's ripening hormone as a signal[J]. Proceedings of the National Academy of Sciences of United States of America, 1994, 91(14): 6579-6583. DOI:10.1073/pnas.91.14.6579 |
| [28] |
Li Z, Zhu W, Fan YC, et al. Effects of pre- and post-treatment with ethephon on gum formation of peach gummosis caused by Lasiodiplodia theobromae[J]. Plant Pathology, 2014, 63(6): 1306-1315. DOI:10.1111/ppa.12214 |
| [29] |
van Bockhaven J, Spíchal L, Novák O, et al. Silicon induces resistance to the brown spot fungus Cochliobolus miyabeanus by preventing the pathogen from hijacking the rice ethylene pathway[J]. New Phytologist, 2015, 206(2): 761-773. DOI:10.1111/nph.13270 |
| [30] |
van Loon LC, Geraats BPJ, Linthorst HJM. Ethylene as a modulator of disease resistance in plants[J]. Trends in Plant Science, 2006, 11(4): 184-191. |
| [31] |
Meng DM, Shen L, Lu J, et al. Research progress in analysis of factors affecting sensory quality and preservation techniques for post-harvested Agaricus bisporus[J]. Food Science, 2010, 31(15): 283-287. (in Chinese) 孟德梅, 申琳, 陆军, 等. 双孢菇采后感官品质变化的因素分析与保鲜技术研究进展[J]. 食品科学, 2010, 31(15): 283-287. |
| [32] |
Chen BZ, Zhong YS, Chen XN, et al. Study on the effect of ethephon and 1-MCP on postharvest preservation process of Volvariella volvacea[J]. Edible and Medicinal Mushrooms, 2018, 26(1): 40-43, 45. (in Chinese) 陈炳智, 钟咏汕, 陈晓宁, 等. 乙烯利和1-MCP在草菇采后保鲜中的作用[J]. 食药用菌, 2018, 26(1): 40-43, 45. |
| [33] |
Zhang J. The molecular mechanism for the climacteric ripening regulation of the postharvest button mushroom[D]. Zhengzhou: Master's Thesis of Henan Agricultural University, 2019 (in Chinese) 张君.双孢蘑菇子实体呼吸跃变型成熟调控的分子机理[D].郑州: 河南农业大学硕士学位论文, 2019 |
| [34] |
Huang JQ, Jiang HF, Zhou YQ, et al. Ethylene inhibited aflatoxin biosynthesis is due to oxidative stress alleviation and related to glutathione redox state changes in Aspergillus flavus[J]. International Journal of Food Microbiology, 2009, 130(1): 17-21. |
| [35] |
Wang S, Park YS, Yang Y, et al. Seed-derived ethylene facilitates colonization but not aflatoxin production by Aspergillus flavus in maize[J]. Frontiers in Plant Science, 2017, 8: 415. |
| [36] |
Zhang LP, Jia CH, Liu LH, et al. The involvement of jasmonates and ethylene in Alternaria alternata f. sp. lycopersici toxin-induced tomato cell death[J]. Journal of Experimental Botany, 2011, 62(15): 5405-5418. DOI:10.1093/jxb/err217 |
| [37] |
Chaves FC, Gianfagna TJ. Necrotrophic phase of Moniliophthora perniciosa causes salicylic acid accumulation in infected stems of cacao[J]. Physiological and Molecular Plant Pathology, 2006, 69(1/3): 104-108. |
| [38] |
Patkar RN, Benke PI, Qu ZW, et al. A fungal monooxygenase- derived jasmonate attenuates host innate immunity[J]. Nature Chemical Biology, 2015, 11(9): 733-740. DOI:10.1038/nchembio.1885 |
| [39] |
Plotkin BJ. Contribution of host signaling and virome to the mycobiome[J]. Fungal Genomics & Biology, 2016, 6(1): 1000137. |
| [40] |
Loumaye E, Thorner J, Catt KJ. Yeast mating pheromone activates mammalian gonadotrophs: evolutionary conservation of a reproductive hormone?[J]. Science, 1982, 218(4579): 1323-1325. DOI:10.1126/science.6293058 |
| [41] |
Lenard J. Mammalian hormones in microbial cells[J]. Trends in Biochemical Sciences, 1992, 17(4): 147-150. DOI:10.1016/0968-0004(92)90323-2 |
| [42] |
Plemenitaš A, Kastelic-Suhadolc T, Žigon D, et al. Steroidogenesis in the fungus Pleurotus ostreatus[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1999, 123(2): 175-179. DOI:10.1016/S0305-0491(99)00053-X |
| [43] |
Kole HK, Muthukumar G, Lenard J. Purification and properties of a membrane-bound insulin binding protein, a putative receptor, from Neurospora crassa[J]. Biochemistry, 1991, 30(3): 682-688. DOI:10.1021/bi00217a014 |
| [44] |
Fawell SE, McKenzie MA, Greenfield NJ, et al. Stimulation by mammalian insulin of glycogen metabolism in a wall-less strain of Neurospora crassa[J]. Endocrinology, 1988, 122(2): 518-523. DOI:10.1210/endo-122-2-518 |
| [45] |
Powell BL, Frey CL, Drutz DJ. Identification of a17β-estradiol binding protein in Candida albicans and Candida (Torulopsis) glabrata[J]. Experimental Mycology, 1984, 8(4): 304-313. DOI:10.1016/0147-5975(84)90054-9 |
| [46] |
Loose DS, Feldman D. Characterization of a unique corticosterone-binding protein in Candida albicans[J]. Journal of Biological Chemistry, 1982, 257(9): 4925-4930. |
| [47] |
Sherrington SL, Kumwenda P, Kousser C, et al. Host sensing by pathogenic fungi[J]. Advances in Applied Microbiology, 2018, 102: 159-221. DOI:10.1016/bs.aambs.2017.10.004 |
| [48] |
San-Blas G, San-Blas F. Biochemistry of Paracoccidioides brasiliensis dimorphism[A]//Franco M, Lacaz CS, Restrepo-Moreno A, et al. Paracoccidioidomycosis[M]. Boca Raton: CRC Press, 2018: 49-66
|
| [49] |
Prasad R, Devaux F, Dhamgaye S, et al. Response of pathogenic and non-pathogenic yeasts to steroids[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2012, 129(1/2): 61-69. |
| [50] |
Cvelbar D, Žist V, Kobal K, et al. Steroid toxicity and detoxification in ascomycetous fungi[J]. Chemico-Biological Interactions, 2013, 202(1/3): 243-258. |
| [51] |
Baghel P, Rawal MK, Khan MF, et al. Multidrug ABC transporter Cdr1 of Candida albicans harbors specific and overlapping binding sites for human steroid hormones transport[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2017, 1859(10): 1778-1789. DOI:10.1016/j.bbamem.2017.05.011 |
| [52] |
Gooday GW. Hormones in mycelial fungi[A]//Wessels JGH, Meinhardt F. Growth, Differentiation and Sexuality[M]. Berlin, Heidelberg: Springer, 1994: 401-411
|
| [53] |
Duntze W, Betz R, Nientiedt M. Pheromones in yeasts[A]//Wessels JGH, Meinhardt F. Growth, Differentiation and Sexuality[M]. Berlin, Heidelberg: Springer, 1994: 381-399
|
| [54] |
Kumar PP. Plant hormones and their intricate signaling networks: unraveling the nexus[J]. Plant Cell Reports, 2013, 32(6): 731-732. DOI:10.1007/s00299-013-1435-0 |
| [55] |
Clemons KV, Shankar J, Stevens DA. Mycologic endocrinology[A]//Lyte M, Freestone PPE. Microbial Endocrinology: Interkingdom Signaling in Infectious Disease and Health[M]. New York: Springer, 2016: 337-363
|
| [56] |
Lyte M. The role of microbial endocrinology in infectious disease[J]. Journal of Endocrinology, 1993, 137(3): 343-345. DOI:10.1677/joe.0.1370343 |
| [57] |
Clemons KV, Shankar J, Stevens DA. Mycologic endocrinology[A]//Lyte M, Freestone PPE. Microbial Endocrinology: Interkingdom Signaling in Infectious Disease and Health[M]. New York: Springer, 2010: 269-290
|
| [58] |
Kulinskiĭ VI, Kolesnichenko LS. General hormonology[J]. Biomeditsinskaia Khimiia, 2004, 50(4): 344-366. |
| [59] |
Ju CL, Chang CR. Mechanistic insights in ethylene perception and signal transduction[J]. Plant Physiology, 2015, 169(1): 85-95. DOI:10.1104/pp.15.00845 |
| [60] |
Zhang DF, Qi YC, Gao YQ, et al. A primary analysis on the mechanism of casing soil triggering the sporophore formation of Agaricus bisporus[J]. Edible Fungi, 2010, 32(1): 9-11, 16. (in Chinese) 张大飞, 戚元成, 高玉千, 等. 双孢蘑菇覆土出菇机理初步探讨[J]. 食用菌, 2010, 32(1): 9-11, 16. DOI:10.3969/j.issn.1000-8357.2010.01.004 |
| [61] |
Chen SC, Qiu CW, Huang T, et al. Effect of 1-aminocyclopropane-1-carboxylic acid deaminase producing bacteria on the hyphal growth and primordium initiation of Agaricus bisporus[J]. Fungal Ecology, 2013, 6(1): 110-118. DOI:10.1016/j.funeco.2012.08.003 |
| [62] |
John P. Ethylene biosynthesis: the role of 1-aminocyclopropane- 1-carboxylate (ACC) oxidase, and its possible evolutionary origin[J]. Physiologia Plantarum, 1997, 100(3): 583-592. DOI:10.1111/j.1399-3054.1997.tb03064.x |
| [63] |
Lacey RF, Binder BM. Ethylene regulates the physiology of the cyanobacterium Synechocystis sp. PCC 6803 via an ethylene receptor[J]. Plant Physiology, 2016, 171(4): 2798-2809. |
| [64] |
Ju CL, van de Poel B, Cooper ED, et al. Conservation of ethylene as a plant hormone over 450 million years of evolution[J]. Nature Plants, 2015, 1(1): 14004. DOI:10.1038/nplants.2014.4 |
| [65] |
Simon L, Lévesque RC, Lalonde M. Identification of endomycorrhizal fungi colonizing roots by fluorescent single-strand conformation polymorphism-polymerase chain reaction[J]. Applied and Environmental Microbiology, 1993, 59(12): 4211-4215. |
| [66] |
Heyland A, Hodin J, Reitzel AM. Hormone signaling in evolution and development: a non‐model system approachs[J]. BioEssays, 2005, 27(1): 64-75. DOI:10.1002/bies.20136 |
| [67] |
Capra EJ, Laub MT. Evolution of two-component signal transduction systems[J]. Annual Review of Microbiology, 2012, 66: 325-347. DOI:10.1146/annurev-micro-092611-150039 |
 2019, Vol. 46
2019, Vol. 46