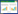扩展功能
文章信息
- 陈丹, 吴冰, 韩红操, 蔡俊鹏
- CHEN Dan, WU Bing, HAN Hong-Cao, CAI Jun-Peng
- 一株广盐性蛭弧菌的生物学特性
- Characterization of a euryhaline Bdellovibrio-and-like organism
- 微生物学通报, 2019, 46(11): 3030-3039
- Microbiology China, 2019, 46(11): 3030-3039
- DOI: 10.13344/j.microbiol.china.180988
-
文章历史
- 收稿日期: 2018-12-03
- 接受日期: 2019-01-31
- 网络首发日期: 2019-02-19
2. 华南理工大学分析测试中心 广东 广州 510640;
3. 华南理工大学生物科学与工程学院 广东 广州 510006
2. Analytical and Testing Center, South China University of Technology, Guangzhou, Guangdong 510640, China;
3. School of Biology and Biological Engineering, South China University of Technology, Guangzhou, Guangdong 510006, China
蛭弧菌类(Bdellovibrio-and-like organisms,BALOs)为一类极其好氧的寄生性革兰氏阴性菌,具有细菌的一般特征,它通过高速运动撞击并裂解其宿主来生存繁殖[1]。蛭弧菌的生活周期包括高耗能的具有鞭毛能运动、但不增殖的游泳体阶段和低耗能的脱去鞭毛、进入到宿主胞质空间、通过分解宿主细胞以营养增殖的蛭质体阶段;前者极易死亡,而后者的存活时间则相对较长[2-3]。
蛭弧菌的最新分类研究表明[4-6],除了隶属于Alpha-proteobacteria的Micavibrio属外,其余的均属于Delta-proteobacteria,包括蛭弧菌科(Bdellovibrionaceae),代表种为Bdellovibrio bacteriovorus和Bdellovibrio exovorus,多来源于土壤及淡水,盐度耐受能力不高;嗜盐噬菌蛭弧菌科(Halobacteriovoraceae),代表种为Halobacteriovorax marinus和Halobacteriovorax litoralis,多来自于海水和咸淡水,需要较高盐度才能生长繁殖;噬菌蛭弧菌科(Bacteriovoracaceae)及吞菌蛭弧菌科(Peredibacteraceae),代表种分别为Bacteriovorax stolpii和Peredibacter starrii,均来源于土壤,不耐受高盐度培养环境。
蛭弧菌在自然界分布广泛,可从土壤、水体、植物根瘤和动物肠道内分离。已有研究表明蛭弧菌不具有攻击真核细胞的能力,因此对动植物无毒害作用[7],且人肠道内蛭弧菌数量的降低会导致肠道微生态系统的失衡[8]。此外,蛭弧菌对引起水产养殖病害的致病菌清除效果显著。2004年,蛭弧菌HD100 (Bdellovibrio bacteriovorus HD100)全基因组测序工作的完成,证明了蛭弧菌基因组可有效预防自身基因组与其他细菌基因组发生基因重组及基因水平转移的可能[9],表明蛭弧菌在寄生、裂解有害菌的同时不会成为致病基因新的宿主,蛭弧菌的这一特性赋予了其作为“活抗生素”的可能。因此,蛭弧菌被认为在水产养殖、医学领域等方面有巨大的潜在应用价值。
然而,蛭弧菌在实际应用中存在许多限制因素。首先,蛭弧菌对生长条件的要求较为严格,不同来源的蛭弧菌有不同的生长条件适应范围,其中盐度为一主要限制条件。现有的报道[10]显示,从某一水域分离获得的蛭弧菌在高于或低于此水域盐度条件下,难以生存。因此,蛭弧菌产品若要达到应有的效果,必须考虑其盐度适应性。虽然可在海水、咸淡水、淡水等不同水体养殖中分别使用适应不同盐度范围的蛭弧菌菌株,但是此方法较为繁琐,实际应用中不便操作,目前也尚未发现有宽盐度适应范围的蛭弧菌菌株。其次,蛭弧菌产品的应用安全性也是必须考虑的问题。蛭弧菌的宿主多为革兰氏阴性菌,如大肠杆菌、沙门氏菌和弧菌类等[11-13],均为食品安全卫生中限量的类群,蛭弧菌的应用也因此受到限制。同时,蛭弧菌的生活周期包含游泳体阶段,在保存过程中易死亡,是导致产品活性低、保质期短的重要原因。
目前,市面上出现的各类蛭弧菌产品均存在应用活性低,无益生效果等问题。也正因此,农业部于2015年9月份发出公告,废止噬菌蛭弧菌微生态制剂(生物制菌王)的质量标准。但是蛭弧菌在生物防治、水产养殖等方面的应用潜力不可忽视。2017年,Dharani等[14]发现蛭弧菌可以捕食携带耐药基因的感染菌,能有效解决耐药基因的传播威胁及粘菌素等抗生素的滥用问题;韩民泳等[15]对刺参养殖环境中蛭弧菌多样性进行了研究,再次肯定了蛭弧菌在养殖病害防治上的价值,并提出需进一步分离更有效的蛭弧菌菌株以应用于生产。
因此,本文旨在针对蛭弧菌实际应用难题开展研究。以枯草芽孢杆菌为宿主,筛选获得适应多种水域环境的广盐性蛭弧菌菌株,保障应用安全高效;探究相关因素对提升蛭弧菌蛭质体密度的影响,为高质量蛭弧菌微生态制剂的生产提供新的手段。
1 材料与方法 1.1 菌株和培养基 1.1.1 实验菌株蛭弧菌分离所用海水样采集自广东一浅滩养殖水域。宿主菌为枯草芽孢杆菌(Bacillus subtilis GIM 1.136),购自广东省微生物研究所。30株受试菌中,27株受试菌分离自患病九孔鲍鲍苗及其养殖环境,王志等[16]采用API 20E对上述分离菌株进行了种类鉴定,通过对分离菌株进行致病毒力因子分析及溶血基因分析,发现它们均具有较强的分泌蛋白酶、明胶酶、脂肪酶以及溶血能力。另外3株受试菌是中国科学院南海海洋研究所提供的非O1/O139型霍乱弧菌,为潜在致病菌。
1.1.2 培养基所用的DNB (Dilute nutrient broth)固体培养基和液体培养基等均按照参考文献[1]配制。
1.2 主要试剂和仪器氯化钠、谷氨酸钠、氯化钙、氯化镁、吲哚均为分析纯,国药集团化学试剂有限公司;Ezup柱式细菌基因组DNA提取试剂盒,生工生物工程(上海)股份有限公司。
PCR仪和测序仪,Applied Biosystems公司;透射电子显微镜,JEOL公司。
1.3 实验方法 1.3.1 蛭弧菌的分离将宿主菌制成一定密度的菌悬液,取分离用海水样,采用DNB双层平板法进行蛭弧菌的分离筛选,具体方法同参考文献[1]。
1.3.2 蛭弧菌的初步鉴定观察DNB双层平板,根据长出噬菌斑的大小、形状及透明度等来鉴别,判断出现的噬菌斑是否符合蛭弧菌噬菌斑的一般特征。挑取DNB双层平板上的单个噬菌斑转移至DNB液体培养基中进行多次纯化培养,并取菌液负染,在透射电子显微镜下观察分离菌株的大小及形态特征,对其进行初步鉴定。
1.3.3 16S rRNA基因测序及分析挑取DNB双层平板上的单个噬菌斑转移至DNB液体培养基中摇床培养为蛭弧菌菌液,将菌液在4 ℃、6 000 r/min冷冻离心10 min,弃去沉淀,将上清液在4 ℃、20 000 r/min高速冷冻离心20 min,弃去上清液,用300 μL的1×TE溶液富集沉淀。送生工生物工程(上海)股份有限公司,采用SK8255 Ezup柱式细菌基因组DNA提取试剂盒提取蛭弧菌DNA,并对其进行PCR扩增和测序。根据文献[1, 17]报道,设计一对蛭弧菌特异性引物,上游引物(63F)序列为:5′-CAGGCCTAACACATGCA AGTC-3′;下游引物(Bdg842R)序列为:5′-CGWCAC TGAAGGGGTCAA-3′,其中,简并碱基W表示A/T。PCR反应体系(50 μL):Premix Taq酶25 μL,上、下游引物(10 μmol/L)各2 μL,DNA模板2 μL,灭菌蒸馏水19 μL。PCR反应条件[18]:95 ℃ 3 min;94 ℃ 1 min,56 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。
将获得的蛭弧菌的16S rRNA基因序列通过NCBI BLAST程序与GenBank数据库中已知的蛭弧菌序列进行同源性比对分析,调出相似性高且有效发表的典型蛭弧菌菌株序列,利用MEGA 7.0软件以ClustalW进行多重序列比对,以Kimura 2-parameter Model估算系统进化矩阵,采用邻接法(Neighbor-Joining)构建系统进化树,并自举1 000次分析评估进化树的拓扑稳定性。
1.3.4 蛭弧菌生物学特性研究为研究该株蛭弧菌对盐度、pH及温度的适应范围,设置培养蛭弧菌的盐度梯度为0.0%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%;pH梯度为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5;温度梯度为15、20、25、30、35、40 ℃。
取1.1.2中的DNB液体培养基,按上述条件的梯度分别调节盐度及pH值,分装至三角瓶,每瓶DNB液体培养基50 mL,高温灭菌后,再加入500 µL宿主菌悬液和500 µL蛭弧菌菌液,之后将三角瓶置于200 r/min恒温摇床中培养。在另两个培养条件相同情况下,分别检测不同盐度、pH及温度培养条件下蛭弧菌6 d内的生长浓度,比较该株蛭弧菌的生长繁殖能力。
1.3.5 蛭弧菌对30株受试菌的裂解能力为研究该株蛭弧菌的裂解性能,采用DNB双层平板法[1],即取500 µL蛭弧菌菌液分别与500 µL浓度约为106 CFU/mL的各受试菌混匀,倾倒于双层平板上,30 ℃静置培养5−7 d,根据DNB双层平板能否长出噬菌斑来探究该株蛭弧菌对30株受试菌的裂解能力。
1.3.6 3种提高蛭弧菌蛭质体密度的影响因素为研究谷氨酸钠、Ca2+和Mg2+及吲哚对该株蛭弧菌蛭质体密度的影响,取1.1.2中的DNB液体培养基,设置谷氨酸钠浓度为2.5、5、7.5、10 mmol/L,Ca2+和Mg2+浓度为10 mmol/L和5 mmol/L、20 mmol/L和10 mmol/L、30 mmol/L和15 mmol/L、40 mmol/L和20 mmol/L,吲哚浓度为0.5、1、1.5、2、3、4 mmol/L,同时制备空白对照;之后将已增殖的蛭弧菌菌液在4 ℃、6 000 r/min冷冻离心10 min,富集沉淀,即得到宿主与蛭质体混合液,通过DNB双层平板法观察蛭弧菌蛭质体的生长数目,检测蛭质体密度。
1.3.7 统计学分析采用Origin 8.0软件对不同培养条件下获得的蛭弧菌浓度数据做统计分析并制图;对蛭弧菌蛭质体密度的检测结果,采用单因素方差分析(ANOVA)统计显著性,并用Tukey B进行多重比较后制图,显著性水平0.05。
2 结果与分析 2.1 蛭弧菌的分离鉴定 2.1.1 广盐性蛭弧菌的分离以枯草芽孢杆菌为宿主,用DNB双层平板法于广东一浅滩养殖水域分离纯化出一株可以出现噬菌斑的菌株,命名为BDN-1。菌株BDN-1出现噬菌斑的时间约为2 d,噬菌斑呈圆形,深入凹陷且透明,噬菌斑表面湿润,边缘整齐(图 1),随着培养时间的延长,噬菌斑可有规则地不断扩大,直至覆盖整个平板。根据BDN-1的DNB双层平板噬菌斑特征可以初步确定分离纯化得到的这株菌为蛭弧菌。
|
| 图 1 BDN-1的DNB双层平板噬菌斑 Figure 1 The DNB double-plate plaque of BDN-1 |
|
|
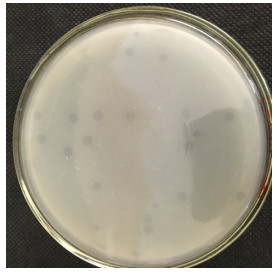
对BDN-1进行负染后,在透射电子显微镜下观察其形态和大小(图 2)。发现BDN-1为椭圆杆状,端生单根鞭毛,菌体大小为0.82 μm×0.43 μm,鞭毛长度约为4.1 μm。对照《伯杰氏细菌鉴定手册》[19]可以发现,BDN-1的大小和形态结构均符合蛭弧菌的典型特征,据此,进一步确定BDN-1为蛭弧菌。
|
| 图 2 BDN-1透射电镜观察图(17 000×) Figure 2 Transmission electron micrograph of BDN-1(17 000×) |
|
|
对BDN-1进行特异性PCR扩增,获得了长758 bp的16S rRNA基因产物,大小与预期相符。向NCBI数据库提交BDN-1的16S rRNA基因序列,获得登录号为MK159102。通过NCBI BLAST在GenBank数据库中进行同源比对分析鉴定,RDP classifier搜索分类为蛭弧菌,经分析发现BDN-1与Bdellovibrio sp. BDH12和Bdellovibrionales bacterium BDHSH06最高均具有99%的相似度,因此,BDN-1被鉴定为蛭弧菌(Bdellovibrio sp.),进一步通过MEGA 7.0软件构建出BDN-1的系统进化树(图 3)。
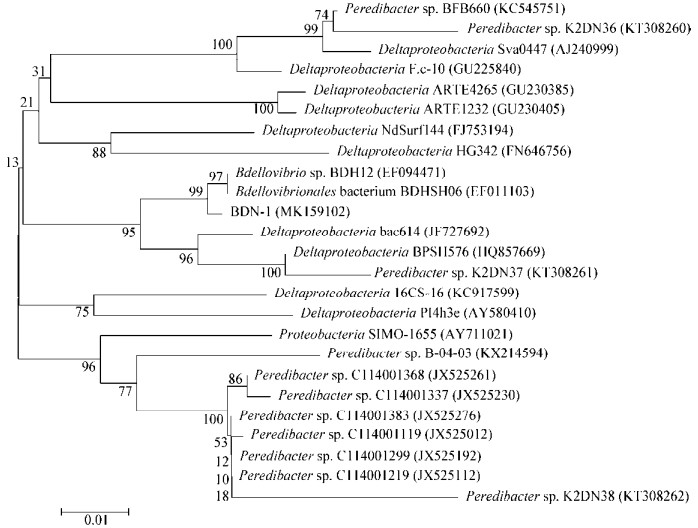
|
| 图 3 基于16S rRNA基因序列的BDN-1系统进化树 Figure 3 Phylogenetic tree of BDN-1 based on the 16S rRNA gene sequences 注:括号内为菌株序列的登录号;分支上各节点处数字为置信值;比例尺表示100个核苷酸中有1个替换. Note: GenBank accession numbers of the strain are provided in the parentheses; Bootstrap values are shown at branching points; The scale bar corresponds to 0.01 substitutions per nucleotide position. |
|
|
BDN-1生长的盐度适应范围为0.5%−3.0% (图 4),包括淡水、咸淡水及海水盐度范围。在1.0%−2.5%盐度范围内,BDN-1的生长繁殖能力最佳,培养2 d后BDN-1的生长浓度可达105 PFU/mL,较其他盐度高;当盐度为1.5%时,在培养3 d后,BDN-1可达到最高生长浓度9×105 PFU/mL。当盐度为0.5%、3.0%时,BDN-1可正常生长繁殖,增殖速度快,最高生长浓度也能达到105 PFU/mL;当盐度为0.0%、3.5%、4.0%时,BDN-1可进行生长繁殖,但受到抑制,生长浓度远低于其他盐度。上述结果说明BDN-1有较宽广的盐度适应范围,具有广盐性特征。
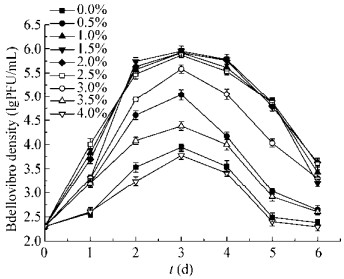
|
| 图 4 不同盐度下BDN-1的生长曲线 Figure 4 The growth curve of BDN-1 at different salinity |
|
|
BDN-1生长的pH适应范围为6.0−8.5 (图 5)。在此范围内,BDN-1的生长繁殖能力最佳,培养2 d后BDN-1的生长浓度达到105 PFU/mL,继续培养至3 d,BDN-1达到最高生长浓度5.12×105 PFU/mL。当pH为5.5时,BDN-1仍能实现增殖,但受到一定抑制;当pH持续降低至5.0时,BDN-1不再生长。
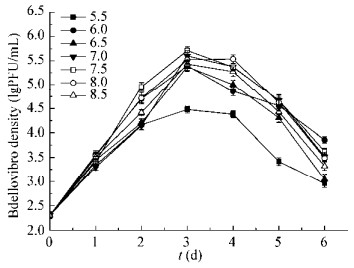
|
| 图 5 不同pH下BDN-1的生长曲线 Figure 5 The growth curve of BDN-1 at different pH |
|
|
BDN-1生长的温度适应范围为20−30 ℃ (图 6)。在此范围内,BDN-1的生长趋势与不同盐度、pH条件下的生长趋势保持一致,培养2 d后,BDN-1的生长浓度达到104 PFU/mL,继续培养至3 d能达到最高生长浓度4.12×105 PFU/mL;其他温度条件下,BDN-1的生长较缓慢,浓度均低于104 PFU/mL;当温度上升至40 ℃时,BDN-1不再生长。
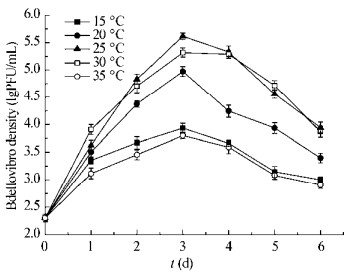
|
| 图 6 不同温度下BDN-1的生长曲线 Figure 6 The growth curve of BDN-1 at different temperatures |
|
|
蛭弧菌BDN-1的裂解谱如表 1所示。在30株受试菌中,有27株常见的水产类动物潜在致病菌,分别为16株弧菌、6株铜绿假单胞菌和5株腐败希瓦氏菌。BDN-1对不同属种的受试菌均具有明显的裂解作用,其中BDN-1对弧菌的裂解率为87.5%,不能裂解2号溶藻弧菌和3号溶藻弧菌;对铜绿假单胞菌的裂解率为83.3%,不能裂解29号铜绿假单胞菌;对腐败希瓦式菌的裂解率可达100%。
| 宿主菌株 Host strains |
来源 Sources |
裂解谱 Lysis |
| Vibrio alginolyticus 1 | A | + |
| Vibrio alginolyticus 2 | A | - |
| Vibrio alginolyticus 3 | A | - |
| Vibrio alginolyticus 4 | A | + |
| Vibrio alginolyticus 5 | A | + |
| Vibrio alginolyticus 10 | A | + |
| Vibrio alginolyticus 11 | A | + |
| Vibrio alginolyticus 16 | A | + |
| Vibrio alginolyticus 19 | A | + |
| Vibrio parahaemolyticus 8 | A | + |
| Vibrio parahaemolyticus 9 | A | + |
| Vibrio parahaemolyticus 25 | A | + |
| Vibrio cholerae 6 | A | + |
| Vibrio cholerae 10-211 | B | + |
| Vibrio cholerae 11-114 | B | + |
| Vibrio cholerae 11-201 | B | + |
| Shewanella putrafaciens 12 | A | + |
| Shewanella putrafaciens 24 | A | + |
| Shewanella putrafaciens 27 | A | + |
| Shewanella putrafaciens 28 | A | + |
| Shewanella putrafaciens 34 | A | + |
| Pseudomonas aeruginosa 17 | A | + |
| Pseudomonas aeruginosa 18 | A | + |
| Pseudomonas aeruginosa 22 | A | + |
| Pseudomonas aeruginosa 29 | A | - |
| Pseudomonas aeruginosa 32 | A | + |
| Pseudomonas aeruginosa 35 | A | + |
| Serratia ficaria 15 | A | - |
| Serratia ficaria 20 | A | + |
| Enterococcus agglometans 30 | A | + |
| 注:A:分离自患病九孔鲍鲍苗及其养殖环境,经API 20E鉴定[16],安瓿管冷冻干燥保藏于本实验室;B:由中国科学院南海海洋研究所提供. +:可裂解;−:不可裂解. Note: A: Isolated from whitened abalone postlarvae and farms in Shanwei, Guangdong, China. Identified by API 20E[16], ampoul freeze drying preserved in our laboratory; B: South China Institute of Oceanology, Chinese Academy of Sciences, Guangzhou, China. +: Can be cracked; −: Can not be cracked. |
||
总体上,BDN-1共能裂解26株受试菌,占总受试菌株的86.7%,说明BDN-1具有良好的裂解能力。此外,BDN-1除了能裂解弧菌,对铜绿假单胞菌及腐败希瓦氏菌也表现出较好的裂解作用,说明BDN-1为一株裂解谱较广的优良蛭弧菌菌株。
2.4 谷氨酸钠、Ca2+和Mg2+、吲哚对BDN-1蛭质体密度的影响鉴于蛭弧菌较特殊的生活周期,受宿主细胞壁保护的低耗能蛭质体存活能力会更强,其生长也可随时被打断,且对蛭弧菌的再增殖无影响。因此,提升蛭质体密度对蛭弧菌的保存有重要作用。
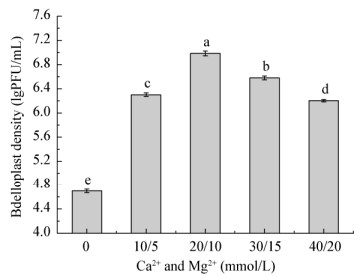
如图 7和8所示,谷氨酸钠与Ca2+和Mg2+对BDN-1蛭质体均有一定的促形成作用。在试验浓度范围内,蛭质体密度变化呈现先增后减的趋势,当谷氨酸钠浓度为5 mmol/L时,蛭质体密度达到最大5.61 lgPFU/mL,与对照组相比提高了0.91 lgPFU/mL;当Ca2+和Mg2+浓度为20 mmol/L和10 mmol/L时,蛭质体密度达到最大6.98 lgPFU/mL,与对照组相比增加了2.28 lgPFU/mL。由此可知,Ca2+和Mg2+对BDN-1蛭质体的形成有较显著的促进作用。此外,在受试浓度范围内,所有实验组蛭质体密度均高于对照组,由此说明只要控制谷氨酸钠或Ca2+和Mg2+浓度在一定范围内,即可起到促进蛭质体形成的作用。
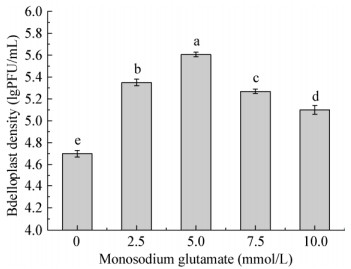
|
| 图 7 不同浓度谷氨酸钠对BDN-1蛭质体密度的影响 Figure 7 Effects of the concentration of monosodium glutamate on the density of the bdelloplast of BDN-1 注:不同字母代表BDN-1在不同浓度谷氨酸钠作用下其蛭质体密度差异显著(P < 0.05). Note: Different letters means significant difference between the bdelloplast density of BDN-1 under different concentrations of monosodium glutamate (P < 0.05). |
|
|
|
| 图 8 不同浓度Ca2+和Mg2+对BDN-1蛭质体密度的影响 Figure 8 Effects of the concentration of Ca2+ and Mg2+ on the density of the bdelloplast of BDN-1 注:不同字母代表BDN-1在不同浓度Ca2+和Mg2+作用下其蛭质体密度差异显著(P < 0.05). Note: Different letters means significant difference between the bdelloplast density of BDN-1 under different concentrations of Ca2+ and Mg2+ (P < 0.05). |
|
|
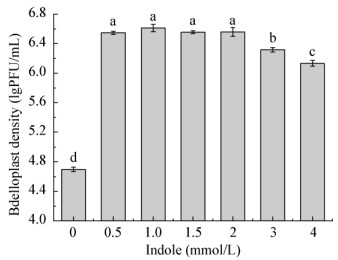
由图 9可知,吲哚也可提升蛭弧菌蛭质体密度。在0.5−2 mmol/L浓度范围内,BDN-1蛭质体密度变化无显著差异,蛭质体密度最大为6.61 lgPFU/mL,与对照组相比平均增加量为1.84 lgPFU/mL;当吲哚浓度高于2 mmol/L时,蛭质体密度开始下降。即在一定浓度范围内,吲哚对BDN-1蛭质体密度提升作用显著,不受浓度限制;超出此浓度范围,则对蛭质体密度提升有一定影响。
|
| 图 9 不同浓度吲哚对BDN-1蛭质体密度的影响 Figure 9 Effects of the concentration of indole on the density of the bdelloplast of BDN-1 注:不同字母代表BDN-1在不同浓度吲哚作用下其蛭质体密度差异显著(P < 0.05). Note: Different letters means significant difference between the bdelloplast density of BDN-1 under different concentrations of indole (P < 0.05). |
|
|
近年来的研究进一步揭示了蛭弧菌在生物防治、肠道菌群调节以及维持生态平衡等方面的重大作用。如McNeely等[20]发现蛭弧菌对于防治Burkholderia cepacia复合菌和植物病原性细菌有较好效果;Willis等[21]利用蛭弧菌与宿主免疫细胞的联合作用,治疗斑马鱼幼虫志贺氏菌的感染;Shatzkes等[22]提出蛭弧菌现已成为抗生素后时代一种新的治疗手段;Mosca等[23]的研究表明一个健康的微生态系统需要蛭弧菌在其中维持动态平衡。
然而,在实际应用中蛭弧菌产品存在质量差、应用活性低、效果不佳等问题,主要原因在于产品中蛭弧菌的生长条件与应用环境不相符、有效菌含量低,无法达到应有的益生效果。因此,扩宽蛭弧菌对生长环境的适应范围,提升蛭弧菌产品应用活性在蛭弧菌产品应用中显得尤为重要。
一般说来,蛭弧菌类群的盐度适应范围较窄,自一定盐度环境分离的蛭弧菌在该盐度之外无法生长。本研究分离获得了一株具有广盐性特征的蛭弧菌BDN-1。在接近淡水(0.5%)及海水(3.0%)的盐度中BDN-1仍具较强的生长繁殖能力,优于目前所报道的菌株,如宋志萍等[24]于盐度3.0%的海水中分离得到4株蛭弧菌,其中2株蛭弧菌在1.5%及以下盐度不能存活,另外2株蛭弧菌的生长繁殖则受到极大抑制,浓度仅为102 PFU/mL;郭庆东[25]分离的5株淡水蛭弧菌在盐度为0.0%时,生长繁殖能力最佳;在盐度为0.5%时,4株蛭弧菌的生长繁殖能力明显下降;当盐度达到1.0%时,停止生长;另一株蛭弧菌受极端环境胁迫,盐度耐受范围为0.0%−1.5%。薛明等[26]于盐度为3.2%的虾苗池中分离出的43株蛭弧菌,可培养盐度范围仅为2.0%−3.0%。
同样,蛭弧菌BDN-1对pH的适应范围也较宽。在pH 6.0−8.5范围内,BDN-1生长繁殖旺盛;当pH为5.5时,蛭弧菌BDN-1生长虽受到抑制,但仍能实现增殖,比一般蛭弧菌的pH适应范围宽。如Li等[27]的蛭弧菌,在pH 6.1−8.1时可生长繁殖,但在pH 5.6和8.6条件下不能存活。
此外,广盐性蛭弧菌BDN-1对常见水产类动物潜在致病菌也表现出良好的清除效果。Lu等[28]以鼠伤寒沙门氏菌(Salmonella typhimurium)为宿主分离获得4株淡水蛭弧菌,对试验弧菌的裂解率分别为46.7%、60.0%、53.3%、63.6%;同样的结果在Cai等[18]的研究中被证实,4株以副溶血弧菌(Vibrio parahaemolyticus)为宿主的海洋蛭弧菌对试验弧菌的裂解率分别为36.6%、39.0%、65.8%、63.4%。与上述蛭弧菌菌株相比,BDN-1对30株受试菌中弧菌的裂解率为87.5%,且对霍乱弧菌、副溶血弧菌的裂解率可达100%,对溶藻弧菌的裂解率为77.8%,显示出其优良的裂解性能。同时,广盐型蛭弧菌BDN-1以枯草芽孢杆菌为宿主,有效解决了蛭弧菌产品应用中限量菌株浓度超标而引起的潜在食品安全卫生问题。
蛭弧菌应用效果差的另一因素为蛭弧菌产品活性低。为此,本研究探讨了提高蛭弧菌蛭质体密度的影响因子的作用,发现谷氨酸钠、Ca2+和Mg2+、吲哚均能提升蛭质体的密度。马兰等[29]的研究证实,谷氨酸钠可影响蛭弧菌的增殖能力;Bell等[30]研究发现在培养基中添加二价阳离子可增强蛭弧菌对宿主的吸附率。这两种影响因子作用机制均表现为促进蛭弧菌生长增殖,进而获得蛭质体密度提升的效果。Dwidar等[31]研究表明吲哚有延缓蛭弧菌蛭质体发育和子代游泳体释放的作用,阐明了吲哚是通过使蛭弧菌的生长繁殖停留在蛭质体阶段,从而实现蛭质体密度的提升。但这种影响为可逆的,一旦吲哚从培养基中除去或其浓度达不到抑制水平,蛭弧菌则可恢复到正常的生长繁殖状态。因此,本研究结果有望提高蛭弧菌产品活性。
蛭弧菌分布于各种各样的环境中,蛭弧菌及其可裂解菌株种群之间的相互作用似乎已成为某些生态系统中菌群更替的最重要因素[32],而蛭弧菌的应用将加速这种更替的进程,提高物种多样性。本研究中广盐性蛭弧菌BDN-1的获得,为蛭弧菌的安全高效利用提供了可能,将有助于多种水域水产养殖致病菌的控制,促进水产养殖业的健康发展和壮大。
| [1] |
Jurkevitch E, Minz D, Ramati B, et al. Prey range characterization, ribotyping, and diversity of soil and rhizosphere Bdellovibrio spp. isolated on phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 2000, 66(6): 2365-2371. DOI:10.1128/AEM.66.6.2365-2371.2000 |
| [2] |
Lambert C, Evans KJ, Till R, et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus[J]. Molecular Microbiology, 2006, 60(2): 274-286. DOI:10.1111/j.1365-2958.2006.05081.x |
| [3] |
Dwidar M, Im H, Seo JK, et al. Attack-phase Bdellovibrio bacteriovorus responses to extracellular nutrients are analogous to those seen during late intraperiplasmic growth[J]. Microbial Ecology, 2017, 74(4): 937-946. DOI:10.1007/s00248-017-1003-1 |
| [4] |
Jurkevitch E. Predatory Prokaryotes——Biology, Ecology and Evolution[M]. Berlin: Springer, 2007.
|
| [5] |
Koval SF, Williams HN, Stine OC. Reclassification of Bacteriovorax marinus as Halobacteriovorax marinus gen. nov., comb. nov. and Bacteriovorax litoralis as Halobacteriovorax litoralis comb. nov.; description of Halobacteriovoraceae fam. nov. in the class deltaproteobacteria[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65: 593-597. DOI:10.1099/ijs.0.070201-0 |
| [6] |
Rotem O, Pasternak Z, Jurkevitch E. Bdellovibrio and like organisms[A]//Rosenberg E, DeLong EF, Lory S, et al. The Prokaryotes[M]. Berlin, Heidelberg: Springer, 2014: 3-17
|
| [7] |
Lenz RW, Hespell RB. Attempts to grow bdellovibrios micurgically-injected into animal cells[J]. Archives of Microbiology, 1978, 119(3): 245-248. DOI:10.1007/BF00405402 |
| [8] |
Iebba V, Santangelo F, Totino V, et al. Higher prevalence and abundance of Bdellovibrio bacteriovorus in the human gut of healthy subjects[J]. PLoS One, 2013, 8(7): e61608. |
| [9] |
Rendulic S, Jagtap P, Rosinus A, et al. A predator unmasked: life cycle of Bdellovibrio bacteriovorus from a genomic perspective[J]. Science, 2004, 303(5658): 689-692. DOI:10.1126/science.1093027 |
| [10] |
Li MJ, Guo YB, Wu B, et al. Research status and advances in Bdellovibrios: a review[J]. Fisheries Science, 2017, 36(3): 377-382. (in Chinese) 李敏佳, 郭衍彪, 吴冰, 等. 蛭弧菌(类群)研究现状及最新进展[J]. 水产科学, 2017, 36(3): 377-382. |
| [11] |
Jiang XP, Cai JP. Effect of BDYJAL on controlling Escherichia coli DH5α on grass carp fillets[J]. Journal of Anhui Agricultural Sciences, 2011, 39(16): 9740-9742. (in Chinese) 蒋小平, 蔡俊鹏. 蛭弧菌对草鱼片大肠杆菌生长的控制研究[J]. 安徽农业科学, 2011, 39(16): 9740-9742. DOI:10.3969/j.issn.0517-6611.2011.16.108 |
| [12] |
Xiao XL, Cai JP. Control of Salmonella typhimurium on fresh-cut muskmelon slices[J]. Modern Food Science and Technology, 2011, 27(11): 1414-1418. (in Chinese) 肖小丽, 蔡俊鹏. 鲜切香瓜片上鼠伤寒沙门氏菌的控制方法[J]. 现代食品科技, 2011, 27(11): 1414-1418. |
| [13] |
Wang Z, Cai JP, Wen QB. Isolation and characterization of Vibrio alginolyticus and its pathogenic effects on postlarvae of abalone Haliotis diversicolor supertexta[J]. Modern Food Science and Technology, 2011, 27(9): 1169-1174, 1061. |
| [14] |
Dharani S, Kim DH, Shanks RMQ, et al. Susceptibility of colistin-resistant pathogens to predatory bacteria[J]. Research in Microbiology, 2018, 169(1): 52-55. DOI:10.1016/j.resmic.2017.09.001 |
| [15] |
Han MY, Chen HX, Si H, et al. ARDRA analysis of diversity of Bdellovibrio-and-like organisms in mariculture environment of Apostichopus japonicus[J]. Microbiology China, 2016, 43(2): 254-261. (in Chinese) 韩民泳, 陈慧黠, 斯晗, 等. ARDRA分型测定刺参养殖环境中蛭弧菌多样性[J]. 微生物学通报, 2016, 43(2): 254-261. |
| [16] |
Wang Z, Cai JP, Xu L, et al. Studies on extracellular virulent factors produced by potential pathogenic bacteria isolated from Abalone postlarvae and biofilms[J]. Acta Microbiologica Sinica, 2005, 45(4): 634-637. (in Chinese) 王志, 蔡俊鹏, 徐丽, 等. 南方九孔鲍培苗过程中潜在致病菌胞外产物的分析[J]. 微生物学报, 2005, 45(4): 634-637. DOI:10.3321/j.issn:0001-6209.2005.04.033 |
| [17] |
Marchesi JR, Sato T, Weightman AJ, et al. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA[J]. Applied and Environmental Microbiology, 1998, 64(2): 795-799. |
| [18] |
Cai JP, Zhao J, Wang Z, et al. Lysis of Vibrios by Bdellovibrio-and-like organisms (BALOs) isolated from marine environment[J]. Journal of Food Safety, 2008, 28(2): 220-235. DOI:10.1111/j.1745-4565.2008.00116.x |
| [19] |
Buchanan RE, Gibbons NE. Bergey's Manual of Determinative Bacteriology[M]. Institute of Microbiology, Chinese Academy of Sciences, trans. 8th ed. Beijing: Science Press, 1984 (in Chinese) 布坎南RE, 吉本斯NE.伯杰细菌鉴定手册[M].中国科学院微生物研究所, 译. 8版.北京: 科学出版社, 1984 |
| [20] |
McNeely D, Chanyi RM, Dooley JS, et al. Biocontrol of Burkholderia cepacia complex bacteria and bacterial phytopathogens by Bdellovibrio bacteriovorus[J]. Canadian Journal of Microbiology, 2017, 63(4): 350-358. DOI:10.1139/cjm-2016-0612 |
| [21] |
Willis AR, Moore C, Mazon-Moya M, et al. Injections of predatory bacteria work alongside host immune cells to treat Shigella infection in zebrafish larvae[J]. Current Biology, 2016, 26(24): 3343-3351. DOI:10.1016/j.cub.2016.09.067 |
| [22] |
Shatzkes K, Connell ND, Kadouri DE. Predatory bacteria: a new therapeutic approach for a post-antibiotic era[J]. Future Microbiology, 2017, 12(6): 469-472. DOI:10.2217/fmb-2017-0021 |
| [23] |
Mosca A, Leclerc M, Hugot JP. Gut microbiota diversity and human diseases: should we reintroduce key predators in our ecosystem?[J]. Frontiers in Microbiology, 2016, 7: 455. |
| [24] |
Song ZP, Cai JP, Wang Z, et al. Study of bacteria-lysis abilities and growth conditions of 4 Bdellovibrio[J]. Acta Microbiologica Sinica, 2005, 45(4): 571-575. (in Chinese) 宋志萍, 蔡俊鹏, 王志, 等. 蛭弧菌的分离及其生长条件和裂解能力的研究[J]. 微生物学报, 2005, 45(4): 571-575. DOI:10.3321/j.issn:0001-6209.2005.04.018 |
| [25] |
Guo QD. Isolation and biological characteristics of a Bdellovibrio sp. from fresh water of Fujian and Tianjin[D]. Guangzhou: Master's Thesis of South China University of Technology, 2009 (in Chinese) 郭庆东.福建、天津淡水蛭弧菌的分离及生物学特性研究[D].广州: 华南理工大学硕士学位论文, 2009 |
| [26] |
Xue M, Guan ML, Wang FY, et al. Comparison of two media for isolation and diversity analysis of marine Bdellovibrio-and-like organisms in shrimp hatchery system[J]. Microbiology China, 2014, 41(9): 1723-1732. (in Chinese) 薛明, 关敏丽, 王飞燕, 等. 两种培养基对对虾苗池海洋蛭弧菌的分离及其多样性分析[J]. 微生物学通报, 2014, 41(9): 1723-1732. |
| [27] |
Li HH, Liu CJ, Chen LY, et al. Biological characterization of two marine Bdellovibrio-and-like organisms isolated from Daya bay of Shenzhen, China and their application in the elimination of Vibrio parahaemolyticus in oyster[J]. International Journal of Food Microbiology, 2011, 151(1): 36-43. |
| [28] |
Lu F, Cai J. The protective effect of Bdellovibrio-and-like organisms (BALO) on tilapia fish fillets against Salmonella enterica ssp. enterica serovar Typhimurium[J]. Letters in Applied Microbiology, 2010, 51(6): 625-631. DOI:10.1111/j.1472-765X.2010.02943.x |
| [29] |
Ma L, Zhao BH, Tan TY, et al. Study of Bdellovibrio on the lysis of pandrug-resistant Gram-negative bacterias and culture conditions[J]. Journal of Sichuan University (Natural Science Edition), 2015, 52(4): 895-900. (in Chinese) 马兰, 赵博涵, 谭天宇, 等. 蛭弧菌裂解泛耐药革兰氏阴性菌及培养条件研究[J]. 四川大学学报:自然科学版, 2015, 52(4): 895-900. |
| [30] |
Bell RG, Latham DJ. Influence of NaCl, Ca2+ and Mg2+ on the growth of a marine Bdellovibrio sp.[J]. Estuarine and Coastal Marine Science, 1975, 3(3): 381-384. DOI:10.1016/0302-3524(75)90036-5 |
| [31] |
Dwidar M, Nam D, Mitchell RJ. Indole negatively impacts predation by Bdellovibrio bacteriovorus and its release from the bdelloplast[J]. Environmental Microbiology, 2015, 17(4): 1009-1022. DOI:10.1111/1462-2920.12463 |
| [32] |
Pérez J, Moraleda-Muoz A, Marcos-Torres FJ, et al. Bacterial predation: 75 years and counting![J]. Environmental Microbiology, 2016, 18(3): 766-779. DOI:10.1111/1462-2920.13171 |
 2019, Vol. 46
2019, Vol. 46