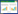扩展功能
文章信息
- 孙倩, 吴宏亮, 陈阜, 康建宏
- SUN Qian, WU Hong-Liang, CHEN Fu, KANG Jian-Hong
- 宁夏中部干旱带不同作物根际土壤真菌群落多样性及群落结构
- Fungal community diversity and structure in rhizosphere soil of different crops in the arid zone of central Ningxia
- 微生物学通报, 2019, 46(11): 2963-2972
- Microbiology China, 2019, 46(11): 2963-2972
- DOI: 10.13344/j.microbiol.china.181049
-
文章历史
- 收稿日期: 2018-12-22
- 接受日期: 2019-03-22
- 网络首发日期: 2019-04-22
2. 中国农业大学农学院 农业部农作制度重点实验室 北京 100193
2. College of Agriculture, Key Laboratory of Farming System of Ministry of Agriculture, China Agricultural University, Beijing 100193, China
真菌作为微生物区系的主要成员,具有分解有机质,为植物提供养分的功能,是土壤生态系统是否健康的指示物[1-2]。前人研究发现,真菌多样性受到各种因素的影响,如土壤pH值[3]、土地利用方式[4]、土壤养分状况[5]、耕作措施[6]、植被类型[7-8]等,但土壤本身的特性和作物根系分泌物等对真菌群落结构及多样性的影响更大[9-10]。近年来,对土壤真菌群落结构和功能的研究受到了研究者们的高度关注。Maestre等[11]研究发现随着干旱程度的增加,土壤中微生物的多样性和丰富度均呈降低趋势;在干旱条件下,子囊菌门为最优势真菌菌门,其次为担子菌门和壶菌门。张美庆等[12]对我国东南沿海七省的15种土类60科植物根区的土样进行研究,发现球囊菌属为共有优势属,且在北方地区的出现率高于南方地区。此外,还有研究发现,真菌群落结构及多样性同样受到季节变化的影响[13-14]。
宁夏中部干旱带地处宁夏回族自治区中部,主要包括盐池县、同心县、海原县、红寺堡开发区、固原原州区北部等地区。宁夏中部干旱带东靠毛乌素沙漠,南靠黄土高原,西接腾格里沙漠,是全国土地沙漠化严重的地区之一。该区常年缺水,植被稀疏,土地沙漠化严重,生态环境十分脆弱。土地沙漠化不仅导致土地生产力下降、促使土地沙漠化扩大,还制约着该区农业的发展,因此,改善宁夏中部干旱带农田生态环境具有重要意义。近年来,由于人们不能合理利用土地资源,导致土壤质量下降,但种植哪种作物更有利于干旱区农田土壤生态系统的稳定呢?目前,已有的关于宁夏中部干旱带农田土壤的研究大多集中在土壤物理、化学性状的变化上,而在土壤微生物群落结构、功能多样性上的研究较少。基于此,本研究选取适宜在干旱区种植的、具有耐旱耐瘠薄和培肥土壤的作物藜麦、谷子和大豆作为研究对象,利用高通量测序技术对它们的根际土壤进行分析,为探明不同作物根际土壤理化性质、真菌多样性和真菌群落结构的变化及真菌功能多样性和群落结构对土壤理化性质的响应,以期为该区土地资源的合理利用开发及干旱区土壤真菌多样性的深入研究提供基础数据和理论依据。
1 材料与方法 1.1 主要试剂和仪器Q5® High-Fidelity DNA Polymerase,NEB公司;Quant-iT PicoGreen dsDNA Assay Kit、Agarose和TAE,Invitrogen公司;Marker,TaKaRa公司。PCR扩增仪,ABI公司;酶标仪,BioTek公司;电泳仪,北京六一生物科技有限公司;凝胶成像系统,北京百晶生物技术有限公司。
1.2 试验区概况试验于2017年5月至10月在宁夏同心县王团镇旱作节水高效农业科技园区进行。该园区位于宁夏中部干旱带,地理位置为105°59'27"E,36°51'42"N,地势呈南高北低,该区土壤类型为砂壤土,属温带干旱、半干旱大陆性气候,海拔约1 370 m,干旱少雨,年降水量150 mm-300 mm,年际变率大,降水主要集中在7-9月,年蒸发量在2 325 mm左右,年平均气温8.6 ℃,≥10 ℃的积温约3 000 ℃,无霜期120-218 d。试验地前茬为玉米,基础理化性质为:全氮0.44 g/kg、有机质8.2 g/kg、碱解氮18.60 mg/kg、速效钾198.0 mg/kg、速效磷1.38 mg/kg、pH 9.04。2017年5-9月份的气温和降雨量见图 1。
|
| 图 1 同心县2017年5-9月份的气温和降雨量 Figure 1 Temperature and rainfall in Tongxin County from May to September in 2017 |
|
|
试验采用单因素随机区组试验设计,共设5个处理,分别为休耕地(翻耕后不种植任何作物,C)、大豆(品种为‘宁黑1号’,H)、藜麦(品种为‘静藜1号’,L)、谷子(品种为‘豫谷18号’,Y和‘张杂谷5号’,Z),各处理3次重复,共计15个小区,小区面积8 m×3.2 m=25.6 m2,每小区内种植8行作物,小区之间间隔为0.4 m,试验地四周设保护行,行宽1 m,试验面积共计563.04 m2。各供试作物分别于2017年5月1日至5月3日播种,2017年10月1日收获。藜麦等行距种植,行距40 cm,株距40 cm左右,播深3 cm-5 cm,种植密度4 200株/666.7 m2;大豆等行距种植,行距为40 cm,株距15 cm-20 cm,播深3 cm-5 cm,种植密度8 300株/666.7 m2;谷子等行距种植,行距为40 cm,株距4 cm-5 cm,种植密度30 000株/666.7 m2。播种前对试验地进行旋耕、粑耱,每666.7 m2施牛粪2 m3、复合肥50 kg (总养分大于等于45%,N:P:K为15%:15%:15%)。整个生育期共滴水2-3次,并随水施尿素10 kg/666.7 m2。为尽量减少土壤扰动对微生物群落的影响,本试验共进行两次中耕,且均在作物生长前期进行,后期尽量不扰动土壤;第一次浅锄、细锄,达到灭草不埋苗;第二次深锄、细锄,灭净杂草,并向作物根部培土。
1.4 样品采集根际土壤样品的采集采用抖根法。于2017年10月1日作物成熟收获时进行土壤取样,每小区选取5个样点,每一样点选择3株,将这3株的根际土混匀,作为该样点的土壤,共取得25份土壤样品。取样步骤:首先去除地表约5 cm厚的土壤,用铁锹挖取作物的完整根部,先轻轻抖落不含根系的大块土壤,然后用刷子刷下附着在根毛上的土壤,即为根际土。将取得的根际土装入无菌自封袋内,于冰盒内保存带回实验室,迅速过2 mm的网筛,除去根系、作物凋落物等杂物,一部分保存于-80 ℃,用于高通量测序,另一部分自然风干,用于土壤理化性质的测定。
1.5 土壤微生物总DNA的提取和测序将采集的土壤样品送到上海派森诺生物科技股份有限公司进行Illumina MiSeq高通量测序。利用前向引物ITS5F (5′-GGAAGTAAGTCGTAACAA GG-3′)和反向引物ITS1R (5′-GCTGCGTTCTTCTC GATGC-3′)对真菌ITS1区进行了PCR扩增。PCR反应体系:5×Reaction buffer 5 μL,5×GC buffer 5 μL,dNTPs (2.5 mmol/L) 2 μL,Forward primer (10 μmol/L) 1 μL,Reverse primer (10 μmol/L) 1 μL,DNA template 2 μL,ddH2O 8.75 μL,Q5 DNA polymerase (2 U/μL) 0.25 μL。PCR反应条件:98 ℃ 2 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃ 30 s,25-30个循环;72 ℃ 5 min。扩增结果进行2%琼脂糖凝胶电泳,切取目的片段然后用Axygen凝胶回收试剂盒回收目的片段。
1.6 序列分析高通量测序过程中,可能产生一系列错误或有疑问的序列,为了保证分析结果的可靠和准确,必须对所获得的有效序列的质量作进一步的评估,从而获得可用于后续分析的序列。首先运用QIIME软件[15](Quantitative insights into microbial ecology,V1.8.0)识别疑问序列,然后对其进行过滤、检查并剔除嵌合体序列。剔除标准为:序列长度 < 150 bp,且含有模糊碱基的序列;5′端引物错配碱基数 > 1的序列;含有连续相同碱基数 > 8的序列。经嵌合体检测后,其余的高质量序列以97%的序列相似度聚集成操作分类单元(OTU)。
1.7 土壤理化性质的测定将风干的25份土样分别过1 mm和0.25 mm的网筛用于土壤理化性质的测定。测定方法如下:pH测定的土水比为1:5;有机质(Soil organic matter,SOM)采用重铬酸钾容量法——外加热法;速效钾(Available kalium,AK)采用NH4OAc浸提-火焰光度法;速效磷(Available phosphorus,AP)采用NaHCO3-钼锑抗比色法;全氮(Total nitrogen,TN)采用凯氏定氮法;碱解氮(Alkali-hydrolyzable nitrogen,AN)采用半微量扩散法[16]。
1.8 数据处理利用Microsoft Excel 2010、DPS对试验数值进行计算、分析及作图;α多样性指数的计算参照Chao[17-18]、Shannon[19-20]以及Simpson[21]等提出的计算方法。利用QIIME软件获取各组样本在门和属分类水平上的细菌群落组成和丰度分布,并用R语言工具将其绘制成柱状图。使用Canoco 4.5软件对在属水平上的土壤真菌群落进行主成分分析(Principal component analysis,PCA)及土壤理化性质和真菌群落多样性进行对应分析(Correspondence analysis,DCA)。
2 结果与分析 2.1 不同作物根际土壤理化性质对取得的25份土壤样品进行理化性质的测定。结果显示,不同作物根际土壤理化性质间有差异,但差异不大,且不同指标间的差异有所不同(表 1)。与播前相比,种植作物提高了土壤全氮、有机质、碱解氮、速效钾和速效磷含量,降低了土壤pH值。就土壤pH值而言,C > L > H > Y > Z,且C、L处理与H、Y、Z处理之间差异显著;与C处理相比,L、H、Y、Z处理分别降低了0.12%、2.34%、2.47%和3.08%。土壤全氮含量表现为C > L > H > Y > Z,且C处理与L、H、Y、Z处理间均存在差异,其中与Z处理的差异最为显著;与C处理相比,L、H、Y、Z处理分别降低了11.67%、15.00%、23.33%和30.00%。土壤有机质含量表现为L > C > H > Y > Z,且C、L处理与H、Y、Z处理之间存在差异,其中与Z处理的差异最显著;与L处理相比,C、H、Y、Z处理分别降低了2.79%、14.66%、18.00%和24.68%。土壤碱解氮含量表现为L > H > C > Y > Z,且各处理间存在差异,其中以L处理和Z处理的差异显著;与L处理相比,H、C、Y、Z处理分别降低了9.51%、16.04%、24.34%和27.90%。土壤速效钾含量表现为L > Z > Y > C > H,各处理间有差异,但以L处理与C、H处理间的差异最显著;与L处理相比,Z、Y、C、H处理分别降低了8.44%、14.00%、52.84%和62.15%。土壤速效磷含量则表现为Z > L > Y > H > C,且Z处理与其余4种处理间差异显著;与Z处理相比,L、Y、H、C处理分别降低了23.27%、41.00%、41.27%和45.15%。参试作物中藜麦根际土壤的有机质、碱解氮和速效钾的含量最高,谷子根际速效磷含量最高,休耕处理的全氮含量最高。
| 处理 Treat |
pH | 全氮 TN (g/kg) |
有机质 SOM (g/kg) |
碱解氮 AN (mg/kg) |
速效钾 AK (mg/kg) |
速效磷 AP (mg/kg) |
| C | 8.11±0.05a | 0.60±0.03a | 14.26±0.29a | 33.01±3.85ab | 268.33±10.09c | 1.98±0.61b |
| H | 7.92±0.01b | 0.51±0.06bc | 12.52±0.54b | 35.58±8.35ab | 215.33±13.27c | 2.12±0.47b |
| L | 8.10±0.02a | 0.53±0.01b | 14.67±0.05a | 39.32±0.81a | 568.93±0.03a | 2.77±0.28b |
| Y | 7.91±0.08b | 0.46±0.01cd | 12.03±0.28b | 29.75±7.89ab | 489.33±64.14b | 2.13±0.31b |
| Z | 7.86±0.01b | 0.42±0.01d | 11.05±0.30c | 28.35±0.70b | 520.90±33.95ab | 3.61±0.49a |
| 注:数据表示形式均为平均值±标准误,表中小写字母表示根际土壤理化性质在不同作物间的差异显著(P < 0.05). C:休耕;H:大豆;L:藜麦;Y、Z:谷子.下同. Note: The data representations are mean ± standard error. The small letters in the table indicate that the physical and chemical properties of rhizosphere soil are significantly different among different crops (P < 0.05). C: Fallow; H: Soybean; L: Quinoa; Y, Z: Millet. The same as below. | ||||||
通过Illumina MiSeq高通量测序,共得到968 506条序列,按97%相似度归并后共获得1 848条不同的ITS1区OTU。5组处理真菌群落多样性分析结果见表 2,从表 2中可以得知,不同处理下根际土壤真菌群落丰富度指数(Chao1指数和ACE指数)均表现为Z > C > H > L > Y,多样性指数则表现为Z > C > H > Y > L,由此可知,C处理下真菌多样性指数和丰富度指数均不是最低,相反,较H、L、Y处理还有所上升,这说明休耕不仅不会降低真菌群落多样性,反而对维持真菌群落结构和提高真菌多样性有利。方差分析结果表明,不同处理间根际土壤真菌丰富度指数间均无显著性差异,但Z处理下Simpson指数与L处理差异显著,Shannon指数与其他4种处理均达显著水平。可见,土壤真菌多样性会因作物的变化而发生改变。
| 处理 Treat |
操作分类单元 OTUs |
丰富度指数 Richness index |
多样性指数 Diversity index |
|||
| Chao1 index | ACE index | Simpson index | Shannon index | |||
| C | 1 104 | 535.86±102.99a | 541.09±101.94a | 0.95±0.02ab | 6.06±0.71ab | |
| H | 1 015 | 506.51±37.16a | 517.40±51.54a | 0.94±0.03ab | 5.78±0.40b | |
| L | 975 | 505.24±39.64a | 516.66±40.61a | 0.92±0.02b | 5.24±0.30b | |
| Y | 948 | 491.63±50.80a | 501.31±44.58a | 0.94±0.03ab | 5.68±0.51b | |
| Z | 1 088 | 568.75±84.07a | 575.23±79.61a | 0.97±0.01a | 6.92±0.10a | |
| 注:表中不同小写字母代表不同处理间差异在0.05水平上显著. Note: Different small letters in the table represent significant differences between treatments at 0.05 level. | ||||||
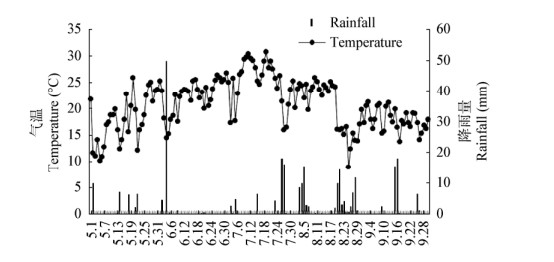
本研究共获得分属9门19纲58目89科145属的信号。在门分类水平上属于9个类群(图 2A),主要包括:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)、丝足虫类(Cercozoa)、纤毛亚门(Ciliophora)、Rozellomycota、球囊菌门(Glomeromycota)和未知菌属(Others)。其中,子囊菌门在5组土样中的相对丰度为73.00%-89.14%,是最优势菌门,远远大于次优势菌门——担子菌门(相对丰度为3.9%-16.5%);其次,休耕地(C)、藜麦(L)和谷子(Y)的根际土壤中子囊菌门的相对丰度显著大于大豆(H)和谷子(Z),而担子菌门的丰度则小于大豆(H)和谷子(Z)。另外,球囊菌门在谷子(Y)的根际土壤中不存在。
|
| 图 2 真菌群落组成及相对丰度 Figure 2 Composition and relative abundance of fungal communities 注:A:真菌门;B:优势真菌属. Note: A: Fungal phylum; B: Dominant fungal genera. |
|
|
在属分类水平上,5组土壤样品中相对丰度大于1%的优势真菌属共8个(图 2B),分别为支顶孢属(Acremonium)、Pyrenochaetopsis、裂壳菌属(Schizothecium)、足孢子菌属(Podospora)、被孢霉属(Mortierella)、光黑壳属(Preussia)、短梗霉属(Aureobasidium)和曲霉属(Aspergillus)。从图 2B中可知,各处理的优势属不同,休耕地(C)中Pyrenochaetopsis为最优势属,相对丰度为4.36%;次优势属为被孢霉属,相对丰度为3.78%。大豆(H)中足孢子菌属为最优势属,相对丰度为10.40%;次优势属为曲霉属,相对丰度为3.02%。藜麦(L)中支顶孢属为最优势属,相对丰度为8.96%;次优势属为光黑壳属,相对丰度为1.58%。谷子(Y)中裂壳菌属为最优势属,相对丰度为4.38%;次优势属为Pyrenochaetopsis和短梗霉属,相对丰度分别为3.68%和3.64%。谷子(Z)中被孢霉属为最优势属,相对丰度为4.30%;次优势属为裂壳菌属,相对丰度为3.94%。另外,支顶孢属和裂壳菌属为5组土样共有的优势菌属,曲霉属为大豆(H)特有的。由此可见,种植不同的作物能够改变其根际土壤真菌群落结构,各作物根际优势属及其丰度发生了变化。
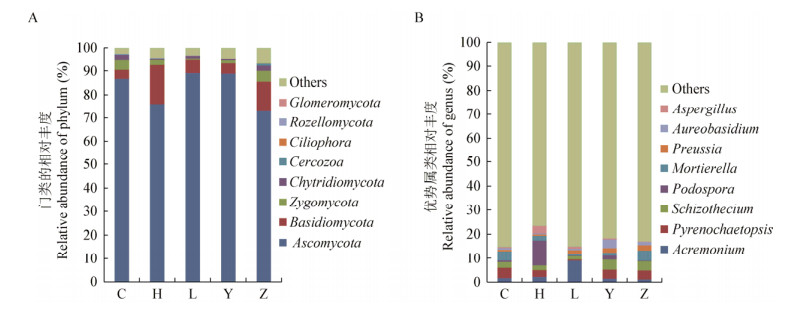
在属水平上对土壤真菌群落进行PCA分析,结果显示(图 3),5个处理的样点均位于第1象限,且各处理所代表的点之间有一定的距离,说明不同处理的真菌群落组成具有差异性;其次,从图 3还可以得知,休耕(C)、谷子(Z)和谷子(Y)处理的样点空间分布较为集中,说明这3种作物的根际土壤真菌群落结构组成较为相似。

|
| 图 3 土壤真菌群落主成分分析(PCA) Figure 3 Principal component analysis (PCA) of soil fungal community |
|
|
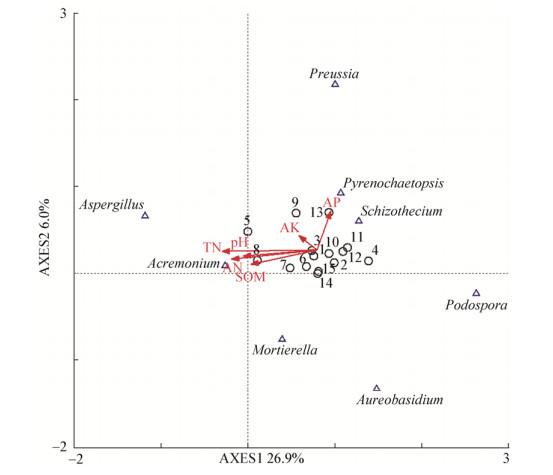
为进一步分析土壤理化性质对土壤真菌群落结构的影响,对5组土壤样品中的优势真菌属和土壤理化性质进行DCA分析(图 4),结果显示第1轴和第2轴累计解释变量达到32.9%,且土壤理化性质对真菌群落结构的影响较大,其中,速效磷作用最大,它与大部分真菌属呈正相关。由图 4可知,Acremonium与土壤pH、全氮、有机质、碱解氮和速效钾均呈正相关,其中,与pH和有机质呈显著性正相关(P < 0.05);Schizothecium和Preussia与速效钾和速效磷呈正相关,与土壤pH、全氮、有机质和碱解氮呈负相关,其中,Schizothecium与碱解氮呈极显著性负相关(P < 0.01);Pyrenochaetopsis和Podospora与速效磷呈正相关,与土壤pH、全氮、有机质、碱解氮和速效钾呈负相关;Mortierella与全氮呈正相关,与其余因子呈负相关;Aureobasidium与速效磷和速效钾呈正相关,与其余因子呈负相关;Aspergillus与全氮呈正相关,与其余因子呈负相关。
|
| 图 4 不同作物根际土壤真菌群落组成与土壤理化性质之间的对应分析(DCA) Figure 4 Correspondence analysis between fungal community composition and soil physical and chemical properties of rhizosphere soil of different crops (DCA) |
|
|
对不同作物根际土壤真菌群落多样性与土壤理化性质进行相关性分析,结果表明(表 3),土壤pH、全氮、有机质和碱解氮均与根际土壤真菌群落丰富度指数(Chao1指数和ACE指数)和多样性指数(Simpson指数和Shannon指数)呈负相关,这说明土壤pH值、全氮、有机质和碱解氮含量的高低会抑制根际土壤真菌丰富度和多样性;其次,多样性指数(Simpson指数和Shannon指数)与碱解氮的相关性达显著水平(P < 0.05),这说明土壤碱解氮含量过高会降低根际土壤真菌多样性。此外,根际土壤真菌群落丰富度指数(Chao1指数和ACE指数)和多样性指数(Shannon指数)与速效钾和速效磷均呈正相关,这说明土壤中速效养分的含量也是影响根际土壤真菌多样性的主要驱动因子。
| 相关性 Relevance |
pH | 有机质 SOM (g/kg) |
全氮 TN (g/kg) |
碱解氮 AN (mg/kg) |
速效钾 AK (mg/kg) |
速效磷 AP (mg/kg) |
| Chao1 index | -0.183 | -0.338 | -0.210 | -0.487 | 0.078 | 0.683 |
| ACE index | -0.135 | -0.300 | -0.232 | -0.488 | 0.219 | 0.731 |
| Simpson index | -0.556 | -0.699 | -0.416 | -0.838* | -0.114 | 0.450 |
| Shannon index | -0.578 | -0.725 | -0.488 | -0.867* | 0.003 | 0.519 |
| 注:*相关性在0.05水平上显著. Note: *Significant correlation at 0.05 level. | ||||||
土壤真菌数量巨大,种类繁多,可作为检测土壤质量变化的重要指标,在评价土壤生态系统等功能方面有着重要作用[22]。微生物多样性指数是评价土壤微生物群落多样性的有效方法,多样性指数高表明微生物群落多样性较高[23]。本研究发现,谷子(Z)的根际土壤真菌多样性指数最高,藜麦(L)的最低,说明谷子(Z)的根际土壤真菌多样性较高,藜麦(L)的根际土壤真菌多样性较低,这可能是不同作物的根际分泌物不同,从而影响了其根际真菌群落结构,进而导致其真菌功能多样性发生变化。此外,还发现休耕地土壤真菌多样性指数也还处于较高水平,这与van der Wal等[24]和毕明丽等[25]的研究结果相似,说明种植作物和休耕均会不同程度地促进或抑制真菌的生长,均有利于改善农田土壤微生物群落结构,改变微生物的多样性。
土壤真菌群落结构组成对生态系统均可产生深远的影响,对生态系统的平衡也起着重要的作用。子囊菌门大多为腐生菌,是土壤中重要的分解者[26],可以分解难降解的有机质,在养分循环方面起着重要作用[27],本研究分析出的8个真菌群落中子囊菌门相对丰度最大,在5个处理中的占比达73.00%-89.14%,为最优势真菌门(图 2A),这说明本研究的5种处理均有利于改善农田土壤真菌群落结构,使得有益真菌比例增加。被孢霉属是土壤习居菌,是一种具有较强分解纤维素能力的真菌。前人研究发现,只有接合菌门的被孢霉属被确定为对土壤有益的微生物[28],本研究中的被孢霉属均来自接合菌门。此外,研究发现土壤真菌群落组成与根腐病的发生存在一定的联系,被孢霉属在健康植株的根际土壤中相对丰度显著高于发病植株根际土壤[29],在本研究中,被孢霉属在谷子(Z)的根际土壤中占比较大,因此可以推测‘张杂谷5号’谷子植株根际抵抗根腐病的能力较强。其次,高玉峰等[30]研究表明土壤微生物群落结构越丰富、多样性越高时,抵抗病原菌的能力也就越强。在本研究中,‘张杂谷5号’谷子的根际土壤中真菌多样性和丰富度较其他处理而言最高,推测其抗病能力最强。
土壤理化性质与真菌群落结构和多样性有着密切联系,为探究影响根际土壤真菌群落结构及多样性的主要影响因子,绘制对应分析图(图 3)和相关性表(表 3),研究结果表明,速效磷对根际土壤真菌群落结构的影响最大,且与根际土壤丰富度指数和多样性指数均呈正相关,这与大多施磷肥会提高土壤真菌多样性的研究结果相一致[31-32],这可能是由于磷是微生物细胞结构的重要组成元素,从而导致微生物表现出对磷养分的依赖。但与Šmilauer[33]认为土壤磷与真菌群落结构或多样性并没有显著相关性是相互矛盾的,可能与试验地土壤条件和管理等因素有关,具体为何种因素有待进一步探究。Hazard等[34]研究显示,土壤环境因子(如:有机质等)对土壤真菌群落结构也会产生重要影响,与本试验结果不一致,这还需要进一步探究。土壤pH也是影响真菌群落结构组成的重要环境因子,对土壤真菌的生长繁殖具有显著影响[35];其次,真菌比较喜欢在偏酸性土壤中生存[36]。本研究的5组土样的pH值在7.86-8.11之间,呈弱碱性,与根际土壤真菌多样性指数与丰富度指数均呈负相关关系,这也说明真菌喜欢在偏酸性的环境中生长。此外,高玉峰等[30]指出土壤碱解氮含量的高低会影响土壤真菌的种类和数量,且随着土壤碱解氮的增多,真菌数量会下降。可见,土壤碱解氮也是导致土壤真菌群落功能多样性发生变化的一个重要因子,这与本研究结果有一致的地方。因此,作为植物与土壤的沟通桥梁,真菌群落结构必然会受到植物和土壤环境因子的直接或间接的影响,就本研究而言,土壤有效磷含量和碱解氮含量是导致土壤真菌群落结构和多样性变化的重要驱动因素。
4 结论在宁夏中部干旱带不同作物根际土壤真菌多样性与群落结构间存在差异,其中以‘张杂谷5号’谷子品种的丰富度指数和多样性指数最高。子囊菌门为各作物根际土壤中的最优势菌门,担子菌门为次优势菌门;支顶孢属和裂壳菌属为不同作物根际土壤共有的优势菌属类群;此外,曲霉属为大豆根际中新发现的真菌属。相关性分析表明土壤真菌群落结构和功能多样性受土壤有效磷和碱解氮的影响较大。
| [1] |
Sharma SK, Ramesh A, Sharma MP, et al. Microbial community structure and diversity as indicators for evaluating soil quality[A]//Lichtfouse E. Biodiversity, Biofuels, Agroforestry and Conservation Agriculture[M]. Dordrecht: Springer, 2010: 317-358
|
| [2] |
Zhang J, Zhang HW, Li XY, et al. Research advances in soil fungal diversity and molecular ecology[J]. Chinese Journal of Applied Ecology, 2004, 15(10): 1958-1962. (in Chinese) 张晶, 张惠文, 李新宇, 等. 土壤真菌多样性及分子生态学研究进展[J]. 应用生态学报, 2004, 15(10): 1958-1962. DOI:10.3321/j.issn:1001-9332.2004.10.051 |
| [3] |
Tripathi BM, Kim M, Singh D, et al. Tropical soil bacterial communities in Malaysia: pH dominates in the equatorial tropics too[J]. Microbial Ecology, 2012, 64(2): 474-484. DOI:10.1007/s00248-012-0028-8 |
| [4] |
Qin H, Li CX, Ren QS. Effects of different land use patterns on soil bacterial and fungal biodiversity in the hydro-fluctuation zone of the Three Gorges Reservoir region[J]. Acta Ecologica Sinica, 2017, 37(10): 3494-3504. (in Chinese) 秦红, 李昌晓, 任庆水. 不同土地利用方式对三峡库区消落带土壤细菌和真菌多样性的影响[J]. 生态学报, 2017, 37(10): 3494-3504. |
| [5] |
Ma LN, Huang WW, Guo CY, et al. Soil microbial properties and plant growth responses to carbon and water addition in a temperate steppe: the importance of nutrient availability[J]. PLoS One, 2012, 7(4): e35165. DOI:10.1371/journal.pone.0035165 |
| [6] |
Deng CC, Li LL, Xie JH, et al. Effects of tillage on soil bacterial community in the dryland farming area of central Gansu[J]. Acta Pedologica Sinica, 2019, 56(1): 209-219. (in Chinese) 邓超超, 李玲玲, 谢军红, 等. 耕作措施对陇中旱农区土壤细菌群落的影响[J]. 土壤学报, 2019, 56(1): 209-219. |
| [7] |
Han SZ, Gao R, Ma HL, et al. Soil fungal diversities of two types of forests in Jian'ou Wanmulin Nature Reserve[J]. Chinese Journal of Ecology, 2015, 34(9): 2613-2620. (in Chinese) 韩世忠, 高人, 马红亮, 等. 建瓯万木林自然保护区两种森林类型土壤真菌多样性[J]. 生态学杂志, 2015, 34(9): 2613-2620. |
| [8] |
Sun YJ, He CX, Xu GP, et al. Soil microbial properties under different vegetation types in Shiwan Mountain, Guangxi Province[J]. Chinese Journal of Ecology, 2015, 34(2): 352-359. (in Chinese) 孙英杰, 何成新, 徐广平, 等. 广西十万大山地区不同植被类型土壤微生物特征[J]. 生态学杂志, 2015, 34(2): 352-359. |
| [9] |
Wang GH, Jin J, Xu MN, et al. Effects of plant, soil and soil management on soil microbial community diversity[J]. Chinese Journal of Ecology, 2006, 25(5): 550-556. (in Chinese) 王光华, 金剑, 徐美娜, 等. 植物、土壤及土壤管理对土壤微生物群落结构的影响[J]. 生态学杂志, 2006, 25(5): 550-556. DOI:10.3321/j.issn:1000-4890.2006.05.017 |
| [10] |
Liu SX, Zhou P, Zhao LP, et al. Diversity of soil fungi in black soil planted with corn in Jilin Province[J]. Journal of Northeast Forestry University, 2008, 36(7): 42-46. (in Chinese) 刘淑霞, 周平, 赵兰坡, 等. 吉林黑土区玉米田土壤真菌的多样性[J]. 东北林业大学学报, 2008, 36(7): 42-46. DOI:10.3969/j.issn.1000-5382.2008.07.017 |
| [11] |
Maestre FT, Delgado-Baquerizo M, Jeffries TC, et al. Increasing aridity reduces soil microbial diversity and abundance in global drylands[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(51): 15684-15689. |
| [12] |
Zhang MQ, Wang YS, Xing LJ. The regional distribution of AM fungi in the East and South Coast of China[J]. Mycosystema, 1999, 18(2): 145-148. (in Chinese) 张美庆, 王幼珊, 邢礼军. AM真菌在我国东、南沿海各土壤气候带的分布[J]. 菌物系统, 1999, 18(2): 145-148. |
| [13] |
Lazzaro A, Hilfiker D, Zeyer J. Structures of microbial communities in alpine soils: seasonal and elevational effects[J]. Frontiers in Microbiology, 2015, 6: 1330. |
| [14] |
Santalahti M, Sun H, Jumpponen A, et al. Vertical and seasonal dynamics of fungal communities in boreal Scots pine forest soil[J]. FEMS Microbiology Ecology, 2016, 92(11): fiw170. DOI:10.1093/femsec/fiw170 |
| [15] |
Caporaso JG, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [16] |
Bao SD. Soil and Agricultural Chemistry Analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2000: 34. (in Chinese) 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000: 34. |
| [17] |
Chao A. Nonparametric estimation of the number of classes in a population[J]. Scandinavian Journal of Statistics, 1984, 11(4): 265-270. |
| [18] |
Chao A, Yang MCK. Stopping rules and estimation for recapture debugging with unequal failure rates[J]. Biometrika, 1993, 80(1): 193-201. DOI:10.1093/biomet/80.1.193 |
| [19] |
Shannon CE. A mathematical theory of communication[J]. Bell System Technical Journal, 1948, 27(3): 379-423. DOI:10.1002/j.1538-7305.1948.tb01338.x |
| [20] |
Shannon CE. A mathematical theory of communication[J]. Bell System Technical Journal, 1948, 27(4): 623-656. DOI:10.1002/j.1538-7305.1948.tb00917.x |
| [21] |
Simpson EH. Measurement of diversity[J]. Nature, 1949, 163(4148): 688. DOI:10.1038/163688a0 |
| [22] |
Ren YL, Fan FX, Peng SX, et al. Relationship between soil fungal community structure and physical and chemical properties of different seasons swamp meadow in Napahai Wetland[J]. Chinese Agricultural Science Bulletin, 2018, 34(29): 69-75. (in Chinese) 任玉连, 范方喜, 彭淑娴, 等. 纳帕海沼泽化草甸不同季节土壤真菌群落结构与理化性质的关系[J]. 中国农学通报, 2018, 34(29): 69-75. |
| [23] |
Xu XX, Wang D, Qin SH, et al. Diversity analysis of fungal communities in potato continuous cropping soil under different patterns of ridge-furrow film mulching[J]. Journal of Soil and Water Conservation, 2015, 29(6): 301-306, 310. (in Chinese) 徐雪雪, 王东, 秦舒浩, 等. 沟垄覆膜连作马铃薯根际土壤真菌多样性分析[J]. 水土保持学报, 2015, 29(6): 301-306, 310. |
| [24] |
van der Wal A, van Veen JA, Smant W, et al. Fungal biomass development in a chronosequence of land abandonment[J]. Soil Biology and Biochemistry, 2006, 38(1): 51-60. DOI:10.1016/j.soilbio.2005.04.017 |
| [25] |
Bi ML, Yu WT, Jiang ZS, et al. Study on the effects of different land use patterns on microbial community structure in aquic brown soil by utilizing PLFA method[J]. Scientia Agricultura Sinica, 2010, 43(9): 1834-1842. (in Chinese) 毕明丽, 宇万太, 姜子绍, 等. 利用PLFA方法研究不同土地利用方式对潮棕壤微生物群落结构的影响[J]. 中国农业科学, 2010, 43(9): 1834-1842. DOI:10.3864/j.issn.0578-1752.2010.09.009 |
| [26] |
Yelle DJ, Ralph J, Lu FC, et al. Evidence for cleavage of lignin by a brown rot basidiomycete[J]. Environmental Microbiology, 2008, 10(7): 1844-1849. DOI:10.1111/j.1462-2920.2008.01605.x |
| [27] |
Beimforde C, Feldberg K, Nylinder S, et al. Estimating the phanerozoic history of the Ascomycota lineages: combining fossil and molecular data[J]. Molecular Phylogenetics and Evolution, 2014, 78: 386-398. DOI:10.1016/j.ympev.2014.04.024 |
| [28] |
Goto BT, Maia LC. Glomerospores: a new denomination for the spores of Glomeromycota, a group molecularly distinct from the Zygomycota[J]. Mycotaxon, 2006, 96: 129-132. |
| [29] |
Wu ZX, Hao ZP, Chen YL, et al. Characterization of fungal community composition and carbon source utilization in the rhizosphere soil of Panax notoginseng suffering from root-rot disease[J]. Mycosystema, 2015, 34(1): 65-74. (in Chinese) 吴照祥, 郝志鹏, 陈永亮, 等. 三七根腐病株根际土壤真菌群落组成与碳源利用特征研究[J]. 菌物学报, 2015, 34(1): 65-74. |
| [30] |
Gao YF, He ZD. Study on soils effect factors to fungi diversity in Hebei Province[J]. Chinese Agricultural Science Bulletin, 2010, 26(10): 177-181. (in Chinese) 高玉峰, 贺字典. 影响土壤真菌多样性的土壤因素[J]. 中国农学通报, 2010, 26(10): 177-181. |
| [31] |
Liu ZF, Fu BJ, Zheng XX, et al. Plant biomass, soil water content and soil N:P ratio regulating soil microbial functional diversity in a temperate steppe: a regional scale study[J]. Soil Biology and Biochemistry, 2010, 42(3): 445-450. DOI:10.1016/j.soilbio.2009.11.027 |
| [32] |
Jansa J, Oberholzer HR, Egli S. Environmental determinants of the arbuscular mycorrhizal fungal infectivity of Swiss agricultural soils[J]. European Journal of Soil Biology, 2009, 45(5/6): 400-408. |
| [33] |
Šmilauer P. Communities of arbuscular mycorrhizal fungi in grassland: seasonal variability and effects of environment and host plants[J]. Folia Geobotanica, 2001, 36(3): 243-263. DOI:10.1007/BF02803179 |
| [34] |
Hazard C, Gosling P, van der Gast CJ, et al. The role of local environment and geographical distance in determining community composition of arbuscular mycorrhizal fungi at the landscape scale[J]. The ISME Journal, 2013, 7(3): 498-508. DOI:10.1038/ismej.2012.127 |
| [35] |
Han SZ, Gao R, Li AP, et al. Soil microbial community structure of two types of forests in the mid-subtropics of China[J]. Chinese Journal of Applied Ecology, 2015, 26(7): 2151-2158. (in Chinese) 韩世忠, 高人, 李爱萍, 等. 中亚热带地区两种森林植被类型土壤微生物群落结构[J]. 应用生态学报, 2015, 26(7): 2151-2158. |
| [36] |
Ju TZ, Chen Y, Chang CH, et al. The diversity of soil fungi and its relations with fertility factors in Taxus chinensis (Pilg.) Rehd community of Xiaolongshan of Tianshui city[J]. Research of Environmental Sciences, 2008, 21(1): 128-132. (in Chinese) 巨天珍, 陈源, 常成虎, 等. 天水小陇山红豆杉(Taxus chinensis (Pilg.) Rehd)林土壤真菌多样性及其与生态因子的相关性[J]. 环境科学研究, 2008, 21(1): 128-132. |
 2019, Vol. 46
2019, Vol. 46