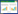扩展功能
文章信息
- 张宝, 王志航, 储卫华
- ZHANG Bao, WANG Zhi-Hang, CHU Wei-Hua
- 群体感应淬灭酶克隆表达及其对铜绿假单胞菌的影响
- Cloning and expression of quorum quenching enzyme affecting Pseudomonas aeruginosa
- 微生物学通报, 2019, 46(11): 2927-2932
- Microbiology China, 2019, 46(11): 2927-2932
- DOI: 10.13344/j.microbiol.china.180977
-
文章历史
- 收稿日期: 2018-11-30
- 接受日期: 2019-02-03
- 网络首发日期: 2019-02-18
2. 中国药科大学药学院 江苏 南京 210009
2. School of Pharmacy, China Pharmaceutical University, Nanjing, Jiangsu 210009, China
由于抗生素的过量使用,导致细菌耐药性越来越强,甚至产生超级细菌,严重危害人类和动物的健康。1994年Fuqua等[1]发现细菌间存在一种信息交流方式,即群体感应(Quorum sensing,QS),而细菌毒力因子和生物膜的产生依赖于群体感应系统[2]。研究发现通过抑制致病菌群体感应可有效抑制其致病能力,所以群体感应成为一种新型抑菌靶标[3]。可以通过两种方式对群体感应进行干预:竞争性抑制和降解信号分子。竞争性抑制可以通过抑制信号分子合成和降低或抑制受体蛋白活性两种方式来实现。降解群体感应信号分子使其不能达到激活致病基因表达的临界浓度,从而影响毒力基因的表达。降解信号分子可通过生物和化学的方法实现:生物分解——群体感应淬灭酶,如内酯酶和酰化酶;化学降解——一些化学物质能降解信号分子,如氧化卤素。N-酰基高丝氨酸内酯酶存在于多种微生物中,可以水解酰基高丝氨酸内酯类(Acyl-homoserine lactones,AHLs)信号分子,阻断细菌间群体感应,从而降低毒力因子和生物膜水平。铜绿假单胞菌(Pseudomonas aeruginosa,PA)是引起临床感染的常见条件致病菌。在连续7年中国国家重症监护病房细菌耐药监测统计的数据来看,从中国的ICU分离出的致病菌中,铜绿假单胞菌数量占第一位,而且临床上使用的抗生素的敏感率都在80%以下[4]。对于耐药PA,临床上有效药物较少,给治疗带来严峻挑战。铜绿假单胞菌通过分泌毒力因子,包括鼠李糖脂、绿脓菌素、弹性蛋白酶等引起致病,并通过形成生物被膜,阻碍药物的渗入,抵御抗生素的破坏。这些致病因子及生物膜的产生和群体感应密切相关,所以抑制群体感应成为一种有效的抗铜绿假单胞菌感染的手段。本研究通过克隆表达出N-酰基高丝氨酸内酯酶,研究其对铜绿假单胞菌致病性的影响,为治疗临床该细菌感染防治提供理论依据。
1 材料与方法 1.1 实验菌株铜绿假单胞菌PAO1,产群体感应淬灭酶芽孢杆菌QSI-1,大肠杆菌OP50,紫色杆菌CV12472为中国药科大学微生物实验室保存。实验前用无菌牙签蘸取菌株于LB固体平板上划线,37 ℃培养过夜,再用无菌牙签挑取菌落于LB固体培养基(g/L:胰化蛋白胨10.0,酵母提取物5.0,NaCl 5.0,琼脂粉15.0,pH 7.4)上三区划线,待培养过夜长出单菌落后,用无菌牙签挑取单菌落接种到5 mL LB液体培养基中,37 ℃、220 r/min培养18-24 h。秀丽隐杆线虫N2为本校微生物实验室储藏。线虫培养在涂有OP50的NGM培养基(g/L:胰蛋白胨2.5,NaCl 3.0,琼脂粉17.0,另外添加过滤除菌的1 mol/L氯化钙1 mL,1 mol/L硫酸镁1 mL,5 mg/L胆固醇1 mL,1 mol/L偏磷酸钾缓冲液22 mL)上生长。
1.2 群体感应淬灭酶的克隆表达及活性测定设计aiiA基因引物,Primer-F (5′-ATCGGATCCATGACAGTAAAGAAGCTTTATTTCG-3′)和Primer-R (5′-GTCGAATTCCTCAACAA GATACTCCTAATGATGT-3′),分别在上、下游引物两端引入BamH I和EcoR I酶切位点,引物由生工生物工程(上海)股份有限公司合成。分别以芽孢杆菌QSI-1基因组DNA为模板,PCR扩增aiiA基因片段,PCR反应体系:Taq DNA聚合酶25 μL,Primer-F (10 pmol/μL) 1 μL,Primer-R (10 pmol/μL) 1 μL,模板(0.5 μg/μL) 2 μL,ddH2O补至50 μL。PCR反应条件:95 ℃ 2 min;94 ℃ 30 s,50 ℃ 45 s,72 ℃ 2 min,30个循环;72 ℃ 2 min;4 ℃ 1 h。将扩增产物酶切连接于同样酶切的质粒载体pET30a,转化E. coli BL21(DE3),将转化的菌液涂于含有Amp的LB固体培养基上筛选阳性转化。挑取单菌落接种于5 mL LB液体培养基中,37 ℃、220 r/min培养过夜,次日按2%的接种量接种到50 mL LB液体培养基,当OD600为0.6-0.8之间时,加入终浓度为1 mmol/L IPTG进行诱导。收集IPTG诱导4 h后的菌体,0.9%的生理盐水洗涤1次,超声波破碎,将16 000 r/min离心20 min后收集的上清液按照使用说明过镍柱纯化蛋白,Bradford法测定蛋白浓度[5]。
1.3 群体感应淬灭酶对铜绿假单胞菌毒力因子及生物膜的影响在5 mL铜绿假单胞菌培养液中加入终浓度为0、15、30、60 μg/mL的淬灭酶,37 ℃、220 r/min培养过夜,5 000 r/min离心5 min,取上清用于毒力因子的测定。
总蛋白酶检测:采用脱脂奶平板法测定蛋白酶活性。在脱脂奶平板用无菌吸管均匀打孔,孔中加入培养上清液。37 ℃孵育24 h。测量蛋白溶解圈的直径。
鼠李糖脂检测[6]:用1 mL乙醚提取300 μL上清,涡旋30 s,取乙醚层,挥干,加入0.5 mL无菌水,再加入4.5 mL含0.19%地衣酚(53%硫酸)的溶液。将试管80 ℃水浴30 min,室温静置15 min,测OD421。
绿脓菌素检测[7]:取一定量上清,加入2/3体积的氯仿,涡旋30 s,充分静置,取下层,加入等体积0.2 mol/L HCl,涡旋30 s,静置分层,取上层液体测OD520。
生物被膜检测[8]:将培养体系缩小至2 mL,37 ℃静置培养48 h。倒去菌液后用ddH2O洗残留浮菌3次,每支试管加入1 mL 0.2%结晶,染色30 min后倒去结晶紫,用缓水流冲洗试管3次,烘干,每管加入2 mL 95%乙醇脱色10 min,测OD590。
1.4 群体感应淬灭酶对铜绿假单胞菌感染的秀丽隐杆线虫存活率的影响参照文献[9]对野生型线虫N2进行同步化处理得到虫卵。将虫卵转移到涂布有大肠杆菌OP50的NGM平板上,16 ℃孵化过夜得到L1期幼虫。将L1期线虫转接到涂有OP50的NGM平板上,20 ℃培养48-52 h到L4期,用M9缓冲液将线虫从平板上洗出,1 200 r/min离心2 min,重悬、清洗、收集虫体。分别向3个实验组培养基中加入终浓度为3.25、7.5、15 μg/mL的淬灭酶,空白对照组和感染模型组加入相同体积的无菌水。在实验组和感染模型组中加入100 μL过夜培养的铜绿假单胞菌菌悬液,对照组加入同体积OP50菌悬液,涂布均匀,37 ℃培养过夜。向每个平板上转接10条L4期线虫,20 ℃培养,每隔1 d统计一次线虫存活数,计算成活率[10]。
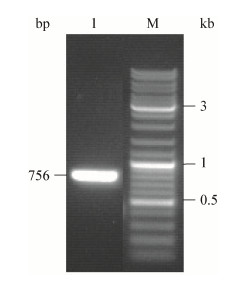
2 结果与分析 2.1 群体感应淬灭酶克隆表达及活性测定PCR扩增产物经1%琼脂糖电泳结果见图 1,其大小跟预期结果一致,大小为756 bp。重组菌经IPTG诱导表达,表达产物经镍柱纯化后进行SDS-PAGE,电泳结果表明E. coli BL21(DE3)-pET30a-aiiA成功表达出群体感应淬灭酶,在31 kD处有明显条带即为淬灭酶条带(图 2)。经Bradford法测定,所纯化的蛋白浓度为1.5 mg/mL。将纯化后的淬灭酶作用于紫色杆菌CV12472,发现表达的高丝氨酸内酯酶能有效抑制紫色杆菌CV12472产生紫色色素(图 3),说明该酶能抑制紫色杆菌的信号分子活性。
|
| 图 1 PCR产物电泳 Figure 1 PCR products of aiiA gene |
|
|

|
| 图 2 表达的AiiA蛋白SDS-PAGE图 Figure 2 SDS-PAGE analysis of AiiA protein |
|
|
|
| 图 3 AiiA群体感应淬灭活性测定 Figure 3 Characterization of the quorum quenching activity of AiiA |
|
|
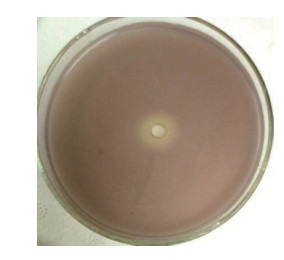
实验结果表明表达的淬灭酶对铜绿假单胞菌毒力因子的产生有明显的抑制作用。淬灭酶对绿脓菌素有着较强的抑制作用,当淬灭酶为30 μg/mL时抑制作用最强,抑制率达到58.83%,在60 μg/mL时稍有减弱,仍达到42.40%,如图 4A所示。淬灭酶对鼠李糖脂也有显著的抑制作用,实验组产生鼠李糖脂的水平降到对照组的40%以下,如图 4B所示。为了更好地检测总蛋白酶生成的变化,采用脱脂奶平板法,实验组溶蛋白圈大小明显小于对照组,说明淬灭酶抑制了铜绿假单胞菌蛋白酶的产生,如图 4C所示。
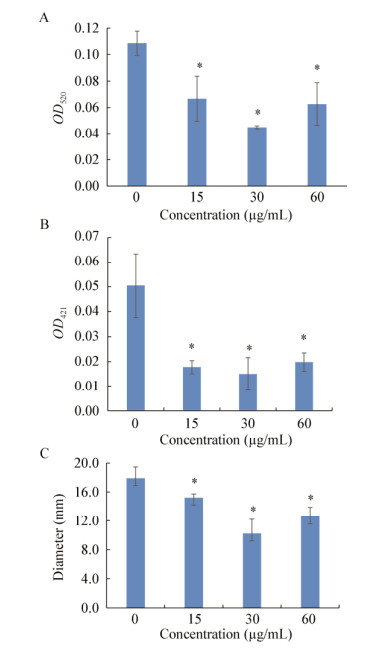
|
| 图 4 群体感应淬灭酶对铜绿假单胞菌毒力因子产生的影响 Figure 4 Effects of AiiA on virulence factors production of Pseudomonas aeruginosa 注:A:绿脓菌素;B:鼠李糖脂;C:蛋白酶. *:P < 0.05. Note: A: Pyocyanin; B: Rhamnolipid; C: Protease. *: P < 0.05. |
|
|
采用结晶紫染色法测定淬灭酶对PA生物膜形成的影响,结果如图 5所示。由图 5可见淬灭酶明显抑制了PA生物膜的形成,且随着浓度增加其抑制程度逐渐增强,在30 μg/mL时抑制率达到58.83%,但浓度为60 μg/mL时抑制率有所减弱,达到42.40%,但实验组间无差异性。
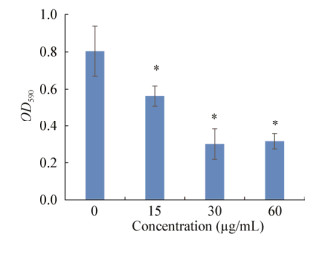
|
| 图 5 群体感应淬灭酶对铜绿假单胞菌生物膜产生的影响 Figure 5 Effect of AiiA on biofilm formation of Pseudomonas aeruginosa Note: *: P < 0.05. |
|
|
培养基中加入不同剂量的淬灭酶后,铜绿假单胞菌感染的线虫存活率较感染模型组高,但实验组间无明显差距。前3天模型组和实验组存活率差距拉大,淬灭酶浓度较高,相应的线虫存活率也稍高,之后存活率差距逐渐缩小,如图 6所示。
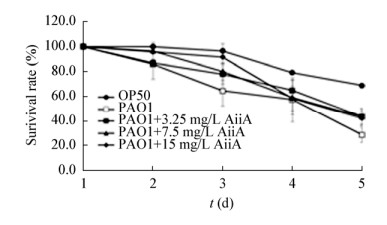
|
| 图 6 群体感应淬灭酶对铜绿假单胞菌感染线虫的存活率的影响 Figure 6 Effects of AiiA on the survival rate of Pseudomonas aeruginosa infected nematodes |
|
|
细菌耐药性问题日益严重,其主要原因是由于抗生素的广泛使用。传统抗生素类药物主要通过抑制致病菌生长或者杀死致病菌为目的,使细菌生存压力增大,从而导致菌株的耐药性突变。细菌在生长过程中,会自发产生和分泌一些小分子物质,其中就包含可以调控自身特定基因表达的群体感应信号分子。细菌通过感知环境中信号分子的浓度变化来改变自身群体行为,产生细胞毒素、毒力因子、生物被膜等一系列细菌特征性表型。铜绿假单胞菌致病基因的表达受群体感应系统调节,促使其产生致病性和耐药性。因此,可以通过抑制细菌群体感应系统来抑制其致病性和耐药性的产生,群体感应作为一种高效的新型抗细菌感染制剂具有非常广阔的前景[11]。
本研究通过克隆表达出群体感应淬灭酶,通过体外抗铜绿假单胞菌毒力因子产生及生物膜形成实验以及线虫感染模型,研究了不同浓度的群体感应淬灭酶对铜绿假单胞菌致病性的影响。以产群体感应淬灭酶的芽孢杆菌QSI-1基因组为模板,克隆并表达了高丝氨酸内酯酶,该酶能抑制紫色色杆菌产生紫色素,说明其能对信号分子产生淬灭作用。同时群体感应淬灭酶能显著抑制铜绿假单胞菌毒力因子产生和生物膜的形成;动物模型表明该酶能降低铜绿假单胞菌对线虫感染的死亡,显著提高了感染线虫的存活率。已有文献报道将微生物产生的群体感应淬灭酶克隆表达[12]。Cai等[13]克隆表达了海洋来源的Ruegeria mobilis YJ3菌的淬灭酶RmmL,发现该酶能抑制铜绿假单胞菌绿脓菌素以及鳗弧菌蛋白酶的产生,这些结果与本研究结果一致。从本研究结果说明,群体感应淬灭酶能够抑制细菌间群体感应信号,可以有效抑制细菌毒力因子的产生以及生物膜的形成,并能降低细菌对动物的感染。本研究为群体感应淬灭酶用于开发抗细菌性感染药物提供了理论基础,为抗细菌性感染提供了新的途径。
| [1] |
Fuqua WC, Winans SC, Greenberg EP. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators[J]. Journal of Bacteriology, 1994, 176(2): 269-275. DOI:10.1128/jb.176.2.269-275.1994 |
| [2] |
Rutherford ST, Bassler BL. Bacterial quorum sensing: its role in virulence and possibilities for its control[J]. Cold Spring Harbor Perspectives in Medicine, 2012, 2(11): a012427. |
| [3] |
LaSarre B, Federle MJ. Exploiting quorum sensing to confuse bacterial pathogens[J]. Microbiology and Molecular Biology Reviews, 2013, 77(1): 73-111. |
| [4] |
Bian W, Zhao W, Sun Y, et al. Etiological characteristics and related factors for nosocomial infections in critically ill patients of emergency department[J]. Chinese Journal of Nosocomiology, 2018, 28(6): 872-875. (in Chinese) 卞雯, 赵微, 孙燕, 等. 急诊科重症患者医院感染的病原学特点及相关因素研究[J]. 中华医院感染学杂志, 2018, 28(6): 872-875. |
| [5] |
Kruger NJ. The Bradford method for protein quantitation[A]//Walker JM. The Protein Protocols Handbook[M]. 2nd ed. Totowa: Humana Press, 2002: 15-21
|
| [6] |
Laabei M, Jamieson WD, Lewis SE, et al. A new assay for rhamnolipid detection—important virulence factors of Pseudomonas aeruginosa[J]. Applied Microbiology and Biotechnology, 2014, 98(16): 7199-7209. DOI:10.1007/s00253-014-5904-3 |
| [7] |
Essar DW, Eberly L, Hadero A, et al. Identification and characterization of genes for a second anthranilate synthase in Pseudomonas aeruginosa: interchangeability of the two anthranilate synthases and evolutionary implications[J]. Journal of Bacteriology, 1990, 172(2): 884-900. DOI:10.1128/jb.172.2.884-900.1990 |
| [8] |
Patel B, Kumari S, Banerjee R, et al. Disruption of the quorum sensing regulated pathogenic traits of the biofilm-forming fish pathogen Aeromonas hydrophila by tannic acid, a potent quorum quencher[J]. Biofouling: The Journal of Bioadhesion and Biofilm Research, 2017, 33(7): 580-590. DOI:10.1080/08927014.2017.1336619 |
| [9] |
Zhou YM, Chen DJ, Li JA, et al. Establishment of an infection model using Caenorhabditis elegans-multidrug resistance P. aeruginosa[J]. Journal of Antibiotics, 2011, 36(7): 511-514, 565. (in Chinese) 周雨朦, 陈代杰, 李继安, 等. 秀丽隐杆线虫-耐药铜绿假单胞菌感染模型的建立[J]. 中国抗生素杂志, 2011, 36(7): 511-514, 565. |
| [10] |
Adonizio A, Kong KF, Mathee K. Inhibition of quorum sensing-controlled virulence factor production in Pseudomonas aeruginosa by South Florida plant extracts[J]. Antimicrobial Agents and Chemotherapy, 2008, 52(1): 198-203. DOI:10.1128/AAC.00612-07 |
| [11] |
Wu H, Moser C, Wang HZ, et al. Strategies for combating bacterial biofilm infections[J]. International Journal of Oral Science, 2015, 7(1): 1-7. DOI:10.1038/ijos.2014.65 |
| [12] |
Chen F, Gao YX, Chen XY, et al. Quorum quenching enzymes and their application in degrading signal molecules to block quorum sensing-dependent infection[J]. International Journal of Molecular Sciences, 2013, 14(9): 17477-17500. DOI:10.3390/ijms140917477 |
| [13] |
Cai XL, Yu M, Shan H, et al. Characterization of a novel N-acylhomoserine lactonase RmmL from Ruegeria mobilis YJ3[J]. Marine Drugs, 2018, 16(10): 370. DOI:10.3390/md16100370 |
 2019, Vol. 46
2019, Vol. 46