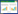扩展功能
文章信息
- 杨妍, 龙云川, 蒋娟, 景兆鹏, 周少奇
- YANG Yan, LONG Yun-Chuan, JIANG Juan, JING Zhao-Peng, ZHOU Shao-Qi
- 西双版纳保护区植物根际细菌的筛选及其促生能力研究
- Screening of plant-growth promoting rhizosphere actinomycetes in Xishuangbanna Reserve
- 微生物学通报, 2019, 46(11): 2877-2885
- Microbiology China, 2019, 46(11): 2877-2885
- DOI: 10.13344/j.microbiol.china.180967
-
文章历史
- 收稿日期: 2018-11-28
- 接受日期: 2019-05-27
- 网络首发日期: 2019-05-31
2. 贵州科学院贵州省生物研究所 贵州 贵阳 550009;
3. 中国科学院西双版纳热带植物园 云南 昆明 650223;
4. 华南理工大学环境与能源学院 广东 广州 510006
2. Guizhou Institute of Biology, Guizhou Academy of Sciences, Guiyang, Guizhou 550009, China;
3. Chinese Academy of Sciences Xishuangbanna Tropical Botanical Garden, Kunming, Yunnan 650223, China;
4. School of Environment and Energy, South China University of Technology, Guangzhou, Guangdong 510006, China
西双版纳热带季雨林自然保护区处于云南省南部,保护区因其独特的地理与气候条件特征,为此地的土壤、植物和微生物的丰富性提供了良好的条件。细菌作为生态系统中重要的组成部分,与物质循环、能量传递等都密不可分,与土壤和植物之间也存在复杂的关系网。放线菌作为细菌的一部分,广泛分布于大自然中,土壤则是放线菌及其生物活性物质的一个重要来源。植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)是自由存在于土壤或植物体内,可通过分泌吲哚乙酸(Indole-3-acetic acid,IAA)、解磷、产铁载体、产纤维素酶等能力来促进植物生长的一类有益微生物。
植物根际土壤中的放线菌能够帮助植物的根部不被病原菌感染,且其中部分根际放线菌还具有促进植物生长的能力[1]。如产吲哚乙酸菌能分泌生长素(IAA),一种植物生长激素,能够促进植物生长;产铁载体菌分泌铁载体到土壤中与难溶性铁结合改变铁的形态使之被植物吸收[2];解磷菌能将固定态植物难吸收的磷转化为可以直接利用的形式,提高磷的利用率;产纤维素酶菌通过产纤维素酶来催化降解纤维素,用于食品、造纸、或资源再利用领域等。在现有的报道中,细菌具有较好的促生长能力且研究较为普遍,而放线菌在此方面的研究尚不够完善。
目前,国外的学者对植物根际放线菌的功能性,如产IAA、产铁载体、纤维素酶等方面做了相应研究且取得一定的成果[3-5];国内的学者对土壤中放线菌对植物的促生作用也做出了一定的探索研究[6-9]。但是对于西双版纳保护区植物根际土壤中细菌特别是放线菌的筛选及其促生作用的研究极少,仅对西双版纳热带雨林土样中放线菌的多样性及其活性做了相应的鉴定[10]。
本研究从西双版纳保护区植物根际土壤中分离筛选植物促生菌,运用微生物学经典方法分离筛选得到14株菌株纯培养物,用16S rDNA序列分析进行分类学鉴定,并对菌株产IAA、铁载体、纤维素酶、淀粉酶以及是否有解磷的能力进行了测定,以期为西双版纳保护区植物根际微生物的开发利用提供菌株资源。
1 材料与方法 1.1 材料 1.1.1 样品采集植物根际土壤样品采自云南西双版纳保护区(99°56′E-101°50′E,21°08′N-22°36′N)利用五点法在保护区边缘、保护区实验区以及保护区缓冲区范围内生长良好的植物根部土壤区,去除表面的杂物以及表层约5 cm的土壤,用灭菌铲采集5 cm-10 cm深度的根际土壤15份,分别编号装于无菌自封袋中,封口带回实验室,自然风干后,于4 ℃下保存,以备后续植物根际促生菌的筛选。
1.1.2 培养基ZSSE培养基[11],海藻糖-脯氨酸培养基[12],高氏一号培养基[13],几丁质琼脂培养基[14],淀粉酪素培养基[12]。
1.1.3 主要试剂和仪器3, 5-二硝基水杨酸溶液(DNS),CMC-Na溶液,硫酸钼锑贮备液,钼锑抗显色剂,Salkowski试剂,CAS检测液等。
电热恒温培养箱,上海-恒科学仪器有限公司;紫外可见分光光度计,上海仪电分析仪器有限公司。
1.2 方法 1.2.1 土壤样品的处理将风干后的土样充分混匀称取10 g,放于90 mL带玻璃珠的灭菌蒸馏水中,振荡30 min使之混合均匀,吸取1 mL悬浮液于9 mL灭菌水中,制成浓度为10-1的土壤悬浮液,再用灭菌水依次进行浓度梯度稀释,取不同浓度梯度的悬浮液适量分别涂布平板,每个处理3次重复,倒置存放于28 ℃恒温培养7 d。
1.2.2 菌株的分离纯化与保存在筛选培养基中分别挑取优势菌株,进行纯化和多次传代,每个菌株设置3个平行,在不同的纯化培养基于28 ℃恒温培养箱中倒置培养7 d后,选取纯化后的菌株在不同的活性检测培养液中于30 ℃、120 r/min振荡培养7-14 d,取适量的纯菌液与已灭菌的20%甘油混合于保藏管中-20 ℃保藏,剩下的一部分用于鉴定,一部分做活性检测实验。
1.2.3 菌株鉴定对挑选出的菌株进行16S rRNA基因测序,PCR采用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)。PCR反应体系30 μL:2×Taq Master Mix 15 μL,10 mmol/L MgCl2,0.2 μmol/L dNTPs,正反向引物(10 μmol/L)各1 μL,DNA模板1 μL,Taq DNA聚合酶(5 U/μL) 0.2 μL,无菌水补足30 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。产物经1%琼脂糖电泳检测后,交昆明硕擎生物科技有限公司测序,所得测序序列提交到NCBI作BLAST分析,用MEGA 5.2软件中Neighbor-Joining方法来构建系统发育树,分析其亲缘关系。
1.2.4 菌株的活性检测(1) 产吲哚乙酸(IAA)的测定
标准曲线的制定,分别测定各浓度(0、0.5、1.0、5.0、10.0、15.0、20.0、25.0 μg/mL)吲哚乙酸标准液OD530的值,绘制IAA标准曲线。用Salkowski比色法测定产吲哚乙酸(IAA)的量[15]。将菌株接种于含有L-色氨酸的LB培养液中,28 ℃、150 r/min培养48 h,吸取50 μL菌悬液与等体积的Salkowski比色液混匀,室温避光放置30 min后观察,颜色变红者为能够分泌IAA的阳性菌株。将初步筛选到的阳性菌株培养液于11 000 r/min离心15 min,取1 mL上清液加1 mL纯水和4 mL Salkowski试剂,35 ℃避光静置30 min,测定OD530值。代入标准曲线计算出IAA含量。
(2) 产铁载体能力的测定
取菌株培养液11 000 r/min离心15 min,取1 mL上清液和1 mL高氏一号液体培养液作空白,然后各加2 mL CAS检测液混合均匀,室温条件下静置反应60 min,测定OD630,测试管记为A,空白管记为Ar。计算A/Ar的比值与铁载体活性单位(Siderophore unites,Su)的值表示菌株产铁载体能力,Su=[(Ar-A)/Ar]×100%。
(3) 解磷能力的测定
标准曲线的制定,分别测定各浓度(0、0.1、0.2、0.3、0.4、0.5、0.6 μg/mL)磷酸标准液OD730的值,绘制磷酸标准曲线。采用钼锑抗显色法测定解磷的能力[16]。取菌株培养液于11 000 r/min离心15 min,取1.25 mL上清液加入2.5 mL钼锑抗显色剂,慢慢摇动试管并加水定容至25 mL,室温静置30 min,测定OD730值。以不接菌的培养基作为对照,通过磷酸标准曲线计算出磷酸量。
(4) 产纤维素酶活性测量
葡萄糖标准曲线的制定,分别测定不同量(0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL)葡萄糖标准液OD520的值,绘制葡萄糖标准曲线。取菌株培养液在11 000 r/min离心15 min。取0.5 mL上清液加入1.5 mL 0.5%的CMC-Na缓冲液和DNS试剂2.0 mL,沸水煮沸2 min,取出冷却后用蒸馏水补足到25 mL,测定OD520,作为空白对照组。另取2支带有25 mL刻度的试管作平行样品管。每支样品管中加0.5 mL酶溶液,置于50 ℃水浴锅中预热30 min,然后在2支试管中分别加入1.5 mL已预热至50 ℃的CMC-Na溶液和DNS试剂2.0 mL,煮沸2 min,取出冷却后用蒸馏水补足到25 mL,测定OD520。计算出葡萄糖数,再代入公式:酶活力(U/mL)=A×1/0.5×n×2,其中A为吸光度在标准曲线上查得的还原糖量,mg;1/0.5换算成酶液1 mL;2为时间换算系数。
(5) 淀粉水解酶活性的测定
麦芽糖标准曲线的制定,分别取不同量(0、0.5、1.0、1.5、2.0 mL)的麦芽糖标准液OD540的值,绘制麦芽糖标准曲线。取2支试管,一支对照一支测定,各加菌液0.5 mL,70 ℃准确加热15 min,取出冷却后,向对照管加2 mL 0.4 mol/L NaOH,终止酶活;测定管和对照管于40 ℃水浴15 min,均加入1 mL 40 ℃预热的淀粉,立即40 ℃水浴保温15 min,取出后迅速向测定管中加入2 mL 0.4 mol/L NaOH;取出对照管和测定管中溶液各2 mL,分别加入到刻度试管中,各加2 mL 3, 5-二硝基水杨酸,沸水浴5 min,冷却后稀释至25 mL,混匀,测定OD540,代入标准曲线计算。
1.2.5 数据处理利用Microsoft Excel 2013和Origin 7.0软件进行数据分析及图表制作。
2 结果与分析 2.1 菌株的筛选与鉴定为获得更多不同种类菌株,特别是稀有放线菌菌株,采用5种不同培养基分离西双版纳保护区根际土壤样品,得到菌株120株;经过菌株形态排除重复及酶活性初步检测,得到14株菌株。对分离筛选得到的14株菌株的16S rRNA基因序列通过NCBI数据库完成分子生物学鉴定,其结果如表 1所示。
| 菌株 Strains |
属 Genus |
登录号 Accession No. |
相似菌株 Similar strains |
相似菌株登录号 Accession No. of similar strains |
相似度 Similarity (%) |
| B351 | Azospirillum | MK301162 | Azospirillum brasilense | AB480699 | 99 |
| B442 | Bacillus | MK301165 | Bacillus aryabhattai | MH671857 | 100 |
| B453 | Bacillus | MK301165 | Bacillus aryabhattai | MH553938 | 100 |
| B541 | Bacillus | MK301165 | Bacillus aryabhattai | MH553938 | 100 |
| B642 | Ensifer | MK301170 | Ensifer adhaerens | KY820821 | 100 |
| B545 | Mesorhizobium | MK301166 | Mesorhizobium amorphae | KF150349 | 99 |
| B542 | Mesorhizobium | MK301166 | Mesorhizobium amorphae | LN890033 | 99 |
| B546 | Mesorhizobium | MK301169 | Mesorhizobium amorphae | LN890033 | 99 |
| B543 | Nocardi | MK301167 | Nocardia asteroides | MH241035 | 99 |
| B547 | Streptomyces | MK301168 | Streptomyces gardneri | KF317978 | 100 |
| B412 | Streptomyces | MK301163 | Streptomyces lucensis | FJ547130 | 100 |
| B221 | Streptomyces | MK301161 | Streptomyces chromofuscus | FJ486284 | 100 |
| B433 | Streptomyces | MK301164 | Streptomyces graminisoli | KY649414 | 99 |
| B641 | Stenotrophomonas | MK301171 | Stenotrophomonas maltophilia | CP028899 | 99 |
从表 1中的结果可以看到,分离得到的14株菌株与其相似菌的相似度为99%或100%,分别归属于链霉菌属(Streptomyces)、诺卡菌属(Nocardia)、杆菌属(Bacillus)、中华根瘤菌属(Ensifer)、中慢生根瘤菌属(Mesorhizobium)、固氮螺菌属(Azospirillum)和狭单胞菌属(Stenotrophomonas)。用MEGA 5.2软件构建菌株的系统进化树如图 1所示,菌株B412与B433,B542与B546在同一分支上,且相似性较高,前者同属链霉菌,后者同属根瘤菌。
|
| 图 1 基于菌株16S rRNA基因构建的系统发育树 Figure 1 Phylogenetic tree based on 16S rRNA gene 注:发育树节点的数值表示Bootstrap值;括号内数值为GenBank数据库的登录号. Note: Numbers at nodes in the tree denote bootstrap percentages; Those in parentheses are GenBank accession numbers. |
|
|
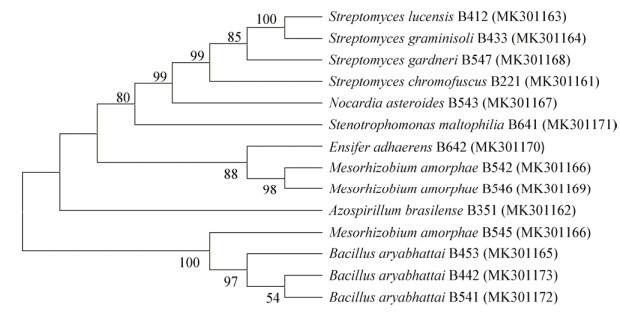
定量检测初步筛选出的14株植物根际促生菌的产IAA能力(图 2),菌株B433分泌的IAA最多,且随培养时间的增加其分泌IAA的量随之增加,在培养12 d时达到峰值9.23 mg/L。这些菌株分泌IAA的量的范围在0.29-9.23 mg/L,且随时间的变化和分泌的量差异较大,可能是菌株在不同培养基中表现出的优势有所不同。
|
| 图 2 不同菌株产IAA的能力 Figure 2 Estimation of IAA producting abilities of different strains |
|
|
定量检测初步筛选到的14株植物根际促生菌,其能力检测结果见表 2。菌株B546、B453、B351这3株细菌产铁载体的能力较强,其Su最高可达86.67%,强度为+++++;菌株B433、B442、B542、B545这4株细菌产铁载体的能力次之,Su值在60%-80%之间,强度为++++;其余菌株的产铁载体能力相对较弱,Su < 60%。影响此能力的原因可能是菌株自身特性差异或是不同培养基对菌株的影响,导致菌株分泌铁载体的量不同;也可说明菌株在复杂多变的自然环境中也能分泌一定的铁载体,确保菌株功能运行。植物根际土壤中具有良好产铁载体能力的菌株,不仅能促进植物旺盛生长,还能通过竞争铁营养达到生物防治的作用[17]。
| 菌株 Strains |
A/Ar | Su (%) | 产铁载体能力 Siderophore capacity |
| B221 | 0.515 3 | 48.47 | +++ |
| B412 | 0.550 3 | 44.97 | +++ |
| B433 | 0.365 3 | 63.47 | ++++ |
| B541 | 0.413 9 | 58.61 | +++ |
| B351 | 0.133 3 | 86.67 | +++++ |
| B442 | 0.243 1 | 75.69 | ++++ |
| B542 | 0.275 0 | 72.50 | ++++ |
| B545 | 0.250 0 | 75.00 | ++++ |
| B547 | 0.542 8 | 45.72 | +++ |
| B546 | 0.195 8 | 80.42 | +++++ |
| B641 | 0.415 3 | 58.47 | +++ |
| B453 | 0.198 6 | 80.14 | +++++ |
| B543 | 0.628 4 | 37.16 | ++ |
| B642 | 0.637 7 | 36.23 | ++ |
| 注:Su (%)的值表示产铁载体能力,0-20:+;20-40:++;40-60:+++;60-80:++++;80-100:+++++. Note: The value of Su (%) indicates the capacity of siderophore production, 0-20: +; 20-40: ++; 40-60: +++; 60-80: ++++; 80-100: +++++. |
|||
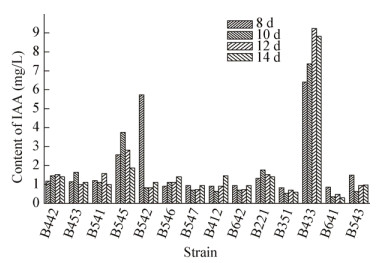
对初筛的14株菌株解磷能力进行定量检测(图 3),其中菌株B541的解磷能力最强,磷酸根的浓度达到9.79 mg/L,解磷菌可将植物难以吸收的磷转化为可吸收的磷的形态,提高植物对磷的吸收量和根系活力,且可增加土壤肥力[18]。
|
| 图 3 14株细菌解磷能力检测 Figure 3 Detection of phosphorus removal ability of 14 strains of bacteria |
|
|
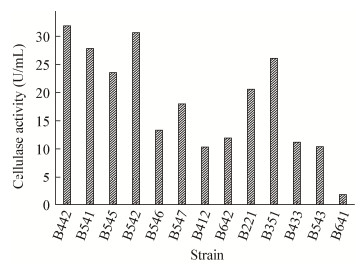
综合分析14株菌中具有产纤维素酶能力的有13株,由图 4可知,各菌株均有产纤维素酶能力。菌株B442综合产纤维素酶能力最强,其酶活力最高达到31.86 U/mL,菌株B542次之30.62 U/mL。
|
| 图 4 菌株的纤维素酶活测定 Figure 4 Determination of cellulase activity of different strains |
|
|
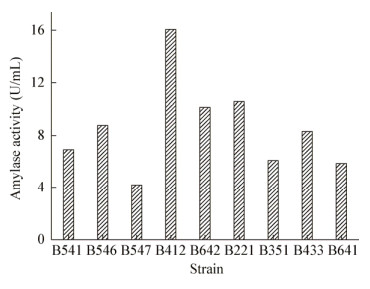
初筛的14株中有9株具有产淀粉酶的能力,其酶活力如图 5所示,菌株B412淀粉酶活力最高为16.07 U/mL;菌株B547酶活力最低为4.19 U/mL。目前在工业方面大多用微生物发酵法生产淀粉酶制剂。因此将土壤中产淀粉酶的菌株分离出来用于工业,能大大提高效率与经济。
|
| 图 5 菌株的淀粉酶活力 Figure 5 Amylase activities of different strains |
|
|
从植物根际土壤筛选得到的细菌能够分泌促进植物生长的激素,其能力大小与菌株自身特性或生长环境紧密相关。本研究采用纯培养的方式,筛选到的菌株经分析鉴定后发现,在筛选放线菌的同时得到了部分细菌,且生长状况及其促生能力较好,说明某些细菌也可在筛选放线菌的培养基上生长。受培养条件及其他因素的影响,不可培养菌还有一定的占比,此纯培养的结果不能完全表示本试验样本中微生物的情况,今后可采用宏基因或其它更先进的技术来完善。
从试验研究结果看来(表 3),菌株在分泌生长激素(IAA)的方面,最高可分泌IAA的量为9.23 mg/L,与Haiyambo等[3]从纳米比亚东部卡万戈地区的草根际分离与筛选出的菌株分泌IAA的最高值为8.98±0.46 mg/L的量几乎相符合,说明西双版纳保护区植物根际的放线菌在分泌生长激素促进植物生长方面有较大的开发价值。在具有产铁载体能力的菌株中,其Su值多数在60%以上,能较好地分泌铁载体给自身提供可利用的铁源,同时也可形成铁浓度相对高的小生境,有利于其它同铁源的植物利用[19],但总体上放线菌的产铁载体能力相对于细菌较低。能溶磷菌株的有效磷含量在2.97-9.79 mg/L,郭英等[20]从野大豆根际分离得到N4 (Bacillus aryabhattai)有效磷含量为32.53 mg/L。与之相比,本试验的综合解磷能力远远小于其它解磷菌的解磷能力,这可能与菌株的产磷能力、培养基的营养差异、优化条件等有关,若改善实验的相关条件,菌株的溶磷能力可能会更高。产纤维素酶的菌株中酶活最高可达31.86 U/mL,在已有的研究中,任大明等[21]筛选出1株链霉菌,其产纤维素酶的酶活为30.06 U/mL。由此可见,西双版纳保护区的菌有较好的产纤维素酶能力,开发研究更高效酶活性的纤维素酶在医药、食品﹑棉纺﹑环保及可再生资源利用领域的酶制剂方面都具有重要的意义。在产淀粉酶方面,所得菌株淀粉酶酶活力在4.19-16.07 U/mL,而张志强等[22]筛选得到高产淀粉酶活性为365.12 U/mL的菌株,与本试验结果相差较大,很大可能是培养基以及培养条件的差异;苏雪莹[23]分离土壤中的产淀粉酶菌株的最高产酶量为4.95 U/mL,与之相差的原因可能是菌株生长条件以及自身特性不同而导致的差异。相对而言本试验分离的产淀粉酶的酶活力较为一般,后续可以优化培养条件看是否有所改善。
| 菌株 Strains |
产吲哚乙酸 Content of IAA (mg/L) |
产铁载体 Siderophore capacity |
解磷 Phosphorus content (mg/L) |
产纤维素酶 Cellulase activity (U/mL) |
产淀粉酶 Amylase activity (U/mL) |
| B221 | 1.75 | +++ | 2.97 | 20.60 | 10.56 |
| B351 | 0.82 | +++++ | 8.55 | 26.08 | 6.08 |
| B412 | 1.46 | +++ | 6.01 | 10.33 | 16.07 |
| B433 | 9.23 | ++++ | 4.90 | 11.19 | 8.29 |
| B442 | 1.52 | ++++ | 4.18 | 31.86 | - |
| B453 | 1.64 | +++++ | 4.84 | - | - |
| B541 | 1.58 | +++ | 9.79 | 27.80 | 6.91 |
| B545 | 3.74 | ++++ | 3.97 | 23.53 | - |
| B542 | 5.73 | ++++ | 5.00 | 30.62 | - |
| B543 | 3.74 | ++ | 6.75 | 10.38 | - |
| B546 | 1.40 | +++++ | 3.72 | 13.30 | 8.76 |
| B547 | 1.32 | +++ | 6.79 | 17.98 | 4.19 |
| B642 | 0.94 | ++ | 6.18 | 11.94 | 10.13 |
| B641 | 0.85 | +++ | 8.55 | 1.74 | 5.84 |
| 注:-:未检测出菌种的促生能力. Note: -: No growth promoting ability of the strain has been detected. |
|||||
本研究从西双版纳保护区根际土壤中筛选出14株促生菌,其中菌株B542紫穗槐中间根瘤菌(Mesorhizobium amorphae)具有较好的产吲哚乙酸(IAA),同时还具有较好的产铁载体和产纤维素酶的能力;菌株B433禾谷链霉菌(S. graminisoli)、B545紫穗槐中间根瘤菌(Mesorhizobium amorphae)、B221色褐链霉菌(S. chromofuscus)等菌株均有2种及以上的较好产酶能力。综上所述,西双版纳保护区植物根际土壤中存在具有促生作用的菌株,且同一种菌具有不同的促生功能。因此,开发研究西双版纳保护区植物根际细菌及其促生能力具有重要的研究价值和意义。
| [1] |
Himaman W, Thamchaipenet A, Pathom-Aree W, et al. Actinomycetes from Eucalyptus and their biological activities for controlling Eucalyptus leaf and shoot blight[J]. Microbiological Research, 2016, 188-189: 42-52. DOI:10.1016/j.micres.2016.04.011 |
| [2] |
Sreevidya M, Gopalakrishnan S, Kudapa H, et al. Exploring plant growth-promotion actinomycetes from vermicompost and rhizosphere soil for yield enhancement in chickpea[J]. Brazilian Journal of Microbiology, 2016, 47(1): 85-95. DOI:10.1016/j.bjm.2015.11.030 |
| [3] |
Haiyambo DH, Chimwamurombe PM, Reinhold-Hurek B. Isolation and screening of rhizosphere bacteria from grasses in East Kavango Region of Namibia for plant growth promoting characteristics[J]. Current Microbiology, 2015, 71(5): 566-571. DOI:10.1007/s00284-015-0886-7 |
| [4] |
Pandey BR, Ghimire S, Bhattarai S, et al. Isolation, growth, enzyme assay and identification via 16S rRNA full sequencing of cellulolytic microbes from Nepal for biofuel production[J]. Renewable Energy, 2019, 132: 515-526. DOI:10.1016/j.renene.2018.07.120 |
| [5] |
Mukhtar S, Mehnaz S, Mirza MS, et al. Isolation and characterization of bacteria associated with the rhizosphere of halophytes (Salsola stocksii and Atriplex amnicola) for production of hydrolytic enzymes[J]. Brazilian Journal of Microbiology, 2019, 50(1): 85-97. DOI:10.1007/s42770-019-00044-y |
| [6] |
Huang CK, Zuo XM, Wang HL, et al. Isolation, identification and characterization of a cellulase-producing strain[J]. Microbiology China, 2015, 42(4): 646-653. (in Chinese) 黄春凯, 左小明, 王红蕾, 等. 一株产纤维素酶菌株的分离、鉴定及产酶特性[J]. 微生物学通报, 2015, 42(4): 646-653. |
| [7] |
Wang JL, Li MY, Song BJ, et al. Screening, identification of a high-producing cold-active amylase strain and its amylase characterization[J]. Journal of Agricultural Biotechnology, 2016, 24(3): 426-434. (in Chinese) 王继莲, 李明源, 宋保健, 等. 产低温淀粉酶菌株的筛选、鉴定及酶学性质初步研究[J]. 农业生物技术学报, 2016, 24(3): 426-434. |
| [8] |
Zheng WB, Shen F, Yan XM, et al. Isolation and identification of the IAA-producing and phosphate-dissolving bacteria and its promoting effects on red soil[J]. Soils, 2015, 47(2): 361-368. (in Chinese) 郑文波, 申飞, 闫小梅, 等. 红壤中产吲哚乙酸并具解磷作用的促生菌筛选鉴定及促生效果研究[J]. 土壤, 2015, 47(2): 361-368. |
| [9] |
Wang X, Shen PP, Zhou YL, et al. The producing strain isolation and enzymatic properties of a cold-active amylase[J]. Journal of Hubei University (Natural Science Edition), 2018, 40(5): 448-451, 456. (in Chinese) 王翔, 沈盼盼, 周玉玲, 等. 低温淀粉酶菌株分离及其酶学性质研究[J]. 湖北大学学报:自然科学版, 2018, 40(5): 448-451, 456. |
| [10] |
Zhang XF, Wang HL, Zheng JM, et al. Isolation and activity identification of actinomycetes in Xishuangbanna soil[A]// Proceedings of the 4th national microbial resources academic and national microbial resources platform operation service seminar[C]. Chengdu: China Society for Microbiology, 2012: 2 (in Chinese) 张雪芳, 王海龙, 郑计梅, 等.西双版纳土壤放线菌分离与活性鉴定[A]//第四届全国微生物资源学术暨国家微生物资源平台运行服务研讨会论文集[C].成都: 中国微生物学会, 2012: 2 |
| [11] |
Long YC, Zhou J, Zhou SQ, et al. Diversity and mercury-resistance of actinomycetes in Tongren, Guizhou[J]. Fujian Journal of Agricultural Sciences, 2017, 32(2): 212-216. (in Chinese) 龙云川, 周娟, 周少奇, 等. 贵州矿区放线菌多样性及对汞的抗性[J]. 福建农业学报, 2017, 32(2): 212-216. |
| [12] |
Li YM, Buheliqihan·Baikeli, Bao J, et al. Bioprospecting and bioactivity screening of culturable actinobacteria from color desert in Dengpa, Tibet[J]. Microbiology China, 2018, 45(8): 1651-1660. (in Chinese) 李亚美, 布合力其汗·白克力, 鲍洁, 等. 西藏仲巴五彩沙漠放线菌资源勘探及生物活性筛选[J]. 微生物学通报, 2018, 45(8): 1651-1660. |
| [13] |
Huang J, Zeng Y, Cai CP, et al. Screening and primary identification of an endophytic antagonistic actinomycetes from pepper[J]. Hunan Agricultural Sciences, 2018(9): 6-8, 12. (in Chinese) 黄军, 曾艳, 蔡长平, 等. 一株辣椒内生拮抗放线菌的筛选及初步鉴定[J]. 湖南农业科学, 2018(9): 6-8, 12. |
| [14] |
Zhao YH, Zhang SL, Wu JF, et al. Screening the diversity and activity of culturable bacteria isolated from mangrove rhizosphere soil at Shankou[J]. Acta Oceanologica Sinica, 2018, 40(8): 138-151. (in Chinese) 赵雅慧, 张舒琳, 吴家法, 等. 山口红树林根际土壤可培养细菌多样性及其活性筛选[J]. 海洋学报, 2018, 40(8): 138-151. DOI:10.3969/j.issn.0253-4193.2018.08.014 |
| [15] |
Gao C, Huang SF, Hu L, et al. Diversity and plant growth promotion of endophytic bacteria isolated from Oryza nivara[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(1): 33-38. (in Chinese) 郜晨, 黄淑芬, 胡莉, 等. 尼瓦拉野生稻内生菌多样性和促生作用[J]. 应用与环境生物学报, 2018, 24(1): 33-38. |
| [16] |
Hu J. Rapid test of available nitrogen, phosphorus and potassium in soil[J]. Biological Chemical Engineering, 2018, 4(4): 30-36. (in Chinese) 胡俊. 土壤中有效氮磷钾的快速检验[J]. 生物化工, 2018, 4(4): 30-36. DOI:10.3969/j.issn.2096-0387.2018.04.009 |
| [17] |
Wei BJ, Zeng XX, Liu ZC, et al. Isolation, identification and study on cadmium-mobilization ability of sidorophores-producing bacteria[J]. Environmental Science & Technology, 2014, 37(11): 26-31. (in Chinese) 魏本杰, 曾晓希, 刘志成, 等. 产铁载体菌的筛选鉴定及活化镉的性能探究[J]. 环境科学与技术, 2014, 37(11): 26-31. |
| [18] |
Xing FF, Gao MF, Zhuo YY, et al. Screening and identification of phosphate solubilizing bacteria in Hordeum vulgare rhizosphere and its growth promoting effect[J]. Acta Agriculturae Boreali-Sinica, 2016, 31(S1): 252-257. (in Chinese) 邢芳芳, 高明夫, 禚优优, 等. 大麦根际高效溶磷菌的筛选、鉴定及促生效果研究[J]. 华北农学报, 2016, 31(S1): 252-257. DOI:10.7668/hbnxb.2016.S1.042 |
| [19] |
Zhao X, Chen SX, Xie ZX, et al. Isolation, identification and over- siderophores production of Pseudomonas fluorescens sp-f[J]. Acta Microbiologica Sinica, 2006, 46(5): 691-695. (in Chinese) 赵翔, 陈绍兴, 谢志雄, 等. 高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f的筛选鉴定及其铁载体特性研究[J]. 微生物学报, 2006, 46(5): 691-695. DOI:10.3321/j.issn:0001-6209.2006.05.002 |
| [20] |
Guo Y, Yang P, Zhang DY, et al. Screening, identification and growth-promoting effect of multi-function rhizosphere growth-promoting strain of wild soybean[J]. Biotechnology Bulletin, 2018, 34(10): 108-115. (in Chinese) 郭英, 杨萍, 张丹雨, 等. 野大豆多功能根际促生菌的筛选鉴定和促生效果研究[J]. 生物技术通报, 2018, 34(10): 108-115. |
| [21] |
Ren DM, Zhao Y, Bai WQ, et al. Isolation, identification and enzymatic properties of a cellulose-producing Actinomyces[J]. Journal of Shenyang Agricultural University, 2016, 47(6): 667-672. (in Chinese) 任大明, 赵钰, 白炜琪, 等. 一株产纤维素酶放线菌的分离鉴定及酶学性质研究[J]. 沈阳农业大学学报, 2016, 47(6): 667-672. |
| [22] |
Zhang ZQ, Li SS, Li H, et al. Screening of high amylase-producing strains and optimization of their culture conditions[J]. Jiangsu Agricultural Sciences, 2017, 45(10): 221-223. (in Chinese) 张志强, 李思思, 李辉, 等. 高产淀粉酶菌株的筛选及其培养条件的优化[J]. 江苏农业科学, 2017, 45(10): 221-223. |
| [23] |
Su XY. Study on the isolation and purification of amylase-producing microorganisms in soil[J]. Science and Technology, 2016, 26(6): 55. (in Chinese) 苏雪莹. 土壤中产淀粉酶微生物分离纯化的研究[J]. 科技展望, 2016, 26(6): 55. DOI:10.3969/j.issn.1672-8289.2016.06.049 |
 2019, Vol. 46
2019, Vol. 46