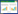扩展功能
文章信息
- 马建鹏, 马安周, 王愉琬, 王锋, 庄国强
- MA Jian-Peng, MA An-Zhou, WANG Yu-Wan, WANG Feng, ZHUANG Guo-Qiang
- 纳米零价铁耦合假单胞菌协同高效降解五氯苯
- Integrated zero-valent iron nanoparticles and Pseudomonas sp. strains system enhance degradation of pentachlorobenzene
- 微生物学通报, 2019, 46(11): 2857-2864
- Microbiology China, 2019, 46(11): 2857-2864
- DOI: 10.13344/j.microbiol.china.190400
-
文章历史
- 收稿日期: 2019-05-07
- 接受日期: 2019-05-16
- 网络首发日期: 2019-07-18
2. 中国科学院大学 北京 100049;
3. 江苏大学食品与生物工程学院 江苏 镇江 202013
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of Food and Biological Engineering, Jiangsu University, Zhenjiang, Jiangsu 202013, China
氯苯类化合物(Chlorinated benzenes,CBs)是苯环上只有氯原子和氢原子的一组取代苯类化合物,其化学性质较为稳定,能在环境中持久存在,这主要是因为氯原子有较高的电负性,强烈吸引苯环上的电子,使苯环成为一个疏电子环,因而很难发生亲电反应,对氧化、水解、脱氯等降解反应具有较强的耐受性[1]。CBs广泛用于制备溶剂、杀虫剂和许多其他工业上重要的化合物,由于在化学工业中的广泛应用以及对含有CBs的废物缺乏适当的回收利用,不可避免地导致它们作为自然生态系统中的污染物而广泛积累[2],在南极大气中,六氯苯的平均浓度也达到了12 600 fg/m3[3]。CBs属于有毒化合物,具有长期残留性、生物蓄积性和高毒性的特点,严重威胁人类健康和生态环境[4-6],因而被作为持久性有机污染物列入《关于持久性有机污染物的斯德哥尔摩公约》,并严格规定了这些物质在环境中存在的质量标准。
目前,针对此类污染物的工业废弃物处理技术迅速发展[7-8],其目标是将CBs转化为毒性较低的化合物,其中微生物修复技术在好氧和厌氧条件下均具有热力学可行性[9],具有低能耗、环境友好性等优势,在降解CBs方面的前景广阔。微生物降解CBs的关键是氯代基的去除。在好氧条件下,微生物降解CBs主要是通过加氧酶进行反应,氧气在降解CBs的过程中作为末端电子受体,促使CBs发生脱氯和开环[10-11]。厌氧降解主要是通过还原脱氯,CBs得到电子的同时去掉1个氯取代基并且释放出1个氯阴离子,生成C–H键和HCl[12]。但是目前的研究表明,微生物有效矿化CBs的能力仅限于有4个或更少氯取代基的氯苯类化合物[13-15]。其中,假单胞菌在好氧条件下展现出对低氯苯优秀的降解能力,如Pseudomonas sp. WR1306[16]、Pseudomonas sp. JS100[17]、Pseudomonas sp. JS6[18]、Pseudomonas aeruginosa RH01[11]、Pseudomonas sp. PS14[19]等。而五氯苯(Pentachlorobenzene,PeCB)和六氯苯等高氯苯的微生物降解局限于厌氧脱氯[20-21],这是因为在好氧条件下,氯原子强烈的吸电子性使苯环上电子云密度降低,氧化酶很难从苯环上获取电子,氯原子的取代个数越多,可生化性就越低[22],限制了高氯苯污染修复中好氧微生物降解方法的应用。
纳米零价铁(Nanoscale zero-valent iron,NZVI)在好氧条件下展现出强大的降解能力,其巨大的比表面积和极强的反应活性有利于污染物的降解,因此已被用于多种难降解污染物的降解,如硝基苯[23]、苯酚[24]和多溴联苯醚[25]等。但NZVI容易发生聚集而导致反应活性下降,对有机卤代物污染的环境进行修复时,NZVI也会吸附其他有机质,致使活性位点被消耗,反应效率降低,并且其降解效果受投加量和环境因素的影响较大,单独使用容易造成过量投加或中间产物累积[26]。Chen等[27]采用NZVI复合材料对六氯苯进行降解去除,120 h后仅副产物中的二氯苯和氯苯就占污染物总量的40%。这些低氯苯中间产物在好氧条件可被微生物代谢利用,这为利用微生物好氧情况下降解高氯苯提供了可能。
将NZVI的脱卤作用与微生物的分解代谢有效结合,能够使微生物减小卤化持久性有机污染物的空间效应,加速微生物的分解代谢,并且易于把降解产物引入分解代谢系统,使其完全转化为生物质和二氧化碳。He等[28]发现,2, 2′, 4, 5, 5′-五氯联苯对好氧细菌的分解代谢作用具有抗性,而NZVI能迅速将其转化为2, 2′, 4-三氯联苯,从而使其被好氧细菌利用。本研究将NZVI与假单胞菌(Pseudomonas sp. JS100)耦合构建合成体系,使其在好氧条件下协同降解五氯苯,一方面克服微生物无法独自好氧降解PeCB的困难,同时,利用微生物快速去除NZVI催化脱氯副产物,实现对PeCB的高效去除和无害化降解。
1 材料与方法 1.1 主要试剂和仪器七水合硫酸亚铁(FeSO4·7H2O),国药控股(上海)化学试剂有限公司;五氯苯和硼氢化钾(KBH4),中国上海阿拉丁生化科技有限公司;正己烷(99.9%),赛默飞世尔科技(中国)有限公司;正己烷为色谱纯,其余所有化学试剂均为分析纯,实验用水为去离子水。
场发射扫描电子显微镜,株式会社日立制作所;全温振荡培养箱,太仓市强乐实验设备有限公司;紫外分光光度计,贝克曼库尔特有限公司;正置荧光显微镜,卡尔·蔡司股份公司;气相质谱联用仪,岛津公司,配有HP-5弹性石英毛细管色谱柱(30 m×0. 32 mm×0.25 μm,含5%苯基,95%二甲基聚硅氧烷固定相),安捷伦科技有限公司。
Pseudomonas sp. JS100 [ATCC 700442]购自ATCC。培养基Tryptic Soy Broth [BD 211825]购自BD公司,用于菌种复苏。
1.2 纳米零价铁的制备将0.483 g FeCl3·6H2O与50 mL去离子水和45 mL乙醇在三颈烧瓶中混匀,机械搅拌速率为600 r/min。然后将0.3 g KBH4溶于25 mL去离子水中,通过分液漏斗以2滴/min的速率加入三颈烧瓶中。制备全程通氮气保护,在此条件下,30 min后停止搅拌,然后用磁铁将纳米零价铁吸至烧瓶底部,缓慢倒掉上清溶液,用乙醇洗涤3次,再用去离子水洗涤3次,在真空干燥箱中干燥12 h后,可获得0.1 g纳米零价铁。
1.3 降解实验采用60 mL血清瓶在25 ℃下进行PeCB降解实验。每个血清瓶中加入10 mL液体无碳矿物盐培养基(每1 L去离子水含有:0.7 g KH2PO4,0.7 g K2HPO4,0.7 g MgSO4·7H2O,1.0 g NH4NO3,0.005 g NaCl,0.002 g FeSO4·7H2O,0.002 g ZnSO4·7H2O和0.001 g MnSO4·H2O)和50 μL浓度为10 g/L的PeCB,使溶液中PeCB的浓度为50 mg/L,再加入100 μL菌液(细菌处于对数中期)或0.01 g NZVI或100 μL菌液(细菌处于对数中期)+0.01 g NZVI。以只含有PeCB的去离子水为对照,每个处理设置3个平行实验。将血清瓶放入转速为150 r/min的振荡培养箱中,按给定的时间间隔取样(2、4、6、8、10、12、16、20、24、30、36 h),用正己烷进行萃取获取PeCB及其降解产物。
1.4 分析方法浓度测定:通过气相质谱联用仪测定PeCB及其降解产物的浓度,条件:载气和补充气为高纯氦气(99.999%),总流量为25.0 mL/min,柱流量为2.0 mL/min,吹扫流量为3 mL/min;进样口温度、离子源温度和接口温度均为250 ℃;程序升温模式为:柱箱的初始温度为100 ℃,保持1 min,再以25 ℃/min升温至250 ℃,并保持0.5 min。分流进样,分流比为10:1,进样量1 μL,采用峰面积外标法定量。
细菌形态和生长状况观测:通过场发射扫描电子显微镜观察附着于NZVI的细菌的形态;采用血球板计数法估算细菌数量。
2 结果与分析 2.1 不同处理对PeCB的降解效果通过批次实验测试了假单胞菌JS100 (JS100)、纳米零价铁(NZVI)和纳米零价铁耦合假单胞菌JS100 (NZVI-JS100) 3组处理对PeCB的降解效果。结果如图 1所示,JS100在0-36 h内对PeCB的降解率始终低于5%,说明该菌不能将PeCB作为碳源用于生命活动;NZVI和NZVI-JS100在反应初期的降解率几乎相同,仅有20%左右;在16 h后NZVI的降解速度减慢,36 h时的降解率达到33.9%,表明NZVI对PeCB的降解能力有限;而NZVI-JS100在16 h后表现出较高的降解速率,36 h时的降解率可达55.4%,说明细菌参与了降解反应,减小了NZVI的降解压力,NZVI与细菌的协同降解提高了该合成体系的降解效率。
|
| 图 1 不同处理对五氯苯的去除率 Figure 1 Removal efficiency of pentachlorobenzene in different treatments |
|
|
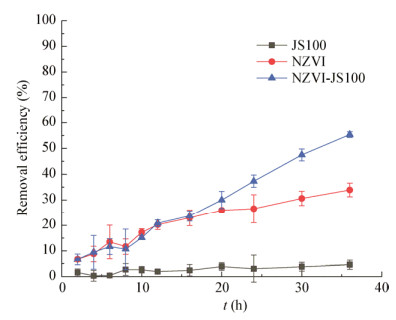
对NZVI和NZVI-JS100的反应过程进行动力学模型拟合。结果如图 2所示,NZVI-JS100对PeCB的降解速率明显高于NZVI,并且NZVI和NZVI- JS100的反应过程均遵循伪一级反应动力学[29]:
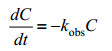
|
(1) |
|
| 图 2 五氯苯降解动力学模型 Figure 2 Degradation dynamics models of pentachlorobenzene |
|
|
式中:C是t(h)时刻溶液中PeCB的浓度(mg/L),kobs是实验得到的伪一级速率常数(h-1)。将实验数据拟合到方程(1)中确定伪一级速率常数。NZVI和NZVI-JS100反应过程的伪一级速率常数分别为0.013 30 h-1和0.020 48 h-1,表明在NZVI的添加量相同的情况下,NZVI-JS100较NZVI显示出更强的降解PeCB的反应性能。伪一级动力学模型的相关系数R2分别为0.961 77和0.987 79,说明ln(C/C0)与t具有良好的线性关系。
2.3 PeCB的脱氯产物分析NZVI和NZVI-JS100反应体系中PeCB及其脱氯产物的浓度变化分别如图 3所示。检测到的主要脱氯产物为1, 2, 4-三氯苯,其他脱氯产物还包括1, 2, 4, 5-四氯苯、1, 2, 3, 5-四氯苯、1, 2, 3-三氯苯、1, 3, 5-三氯苯、邻二氯苯、间二氯苯和氯苯等低氯苯类化合物。从图 3A中可以看出,NZVI降解PeCB的反应初期产生了较多脱氯产物,其中1, 2, 4-三氯苯的浓度明显高于其他脱氯产物。随着反应的进行,脱氯产物逐渐减少,说明NZVI不仅能够降解PeCB,还能进一步与低氯苯类的脱氯产物反应,将其转化为非氯苯类的物质。图 3B的结果表明,NZVI-JS100降解PeCB的反应初期也产生了较多以1, 2, 4-三氯苯为主的脱氯产物,浓度与NZVI反应体系相近。反应后期,NZVI-JS100反应体系中的PeCB浓度更低,而脱氯产物的浓度没有增加,说明NZVI-JS100中的细菌起到了去除脱氯产物的作用,减少了低氯苯类的脱氯产物对NZVI的消耗,在保证较低浓度脱氯产物的基础上,提高了反应体系对PeCB的降解效率。
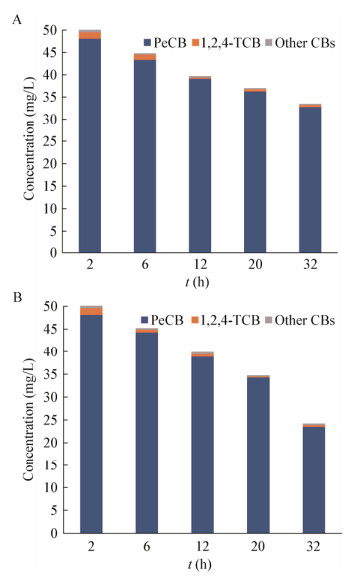
|
| 图 3 NZVI (A)和NZVI-JS100 (B)反应体系中五氯苯及其脱氯产物的浓度变化 Figure 3 Change of PeCB and its dechlorination by-products vs. time with NZVI (A) or NZVI-JS100 (B) 注:PeCB:五氯苯;1, 2, 4-TCB:1, 2, 4-三氯苯;Other CBs:1, 2, 4, 5-四氯苯、1, 2, 3, 5-四氯苯、1, 2, 3-三氯苯、1, 3, 5-三氯苯、邻二氯苯、间二氯苯和氯苯. Note: PeCB: Pentachlorobenzene; 1, 2, 4-TCB: 1, 2, 4-Trichlorobenzene; Other CBs: 1, 2, 4, 5-Tetrachlorobenzene, 1, 2, 3, 5-tetrachlorobenzene, 1, 2, 3-trichlorobenzene, 1, 3, 5-trichlorobenzene, 1, 2-dichlorobenzene, 1, 3-dichlorobenzene and monochlorobenzene. |
|
|
图 4为NZVI-JS100反应2 h和36 h时细菌的扫描电镜图。从图 4A中可以看出,反应初期,NZVI颗粒附着在细菌表面,呈现出明显的球形形态,具有较好的分散性,少部分被氧化成块状物质,说明此时仅有少量NZVI参与反应。从图 4B中可以看出,经过36 h的反应过程,大部分细菌表面的NZVI已经反应成块状物质,呈现团聚状态将细菌包裹,少量NZVI还具有颗粒形态,而细菌周围的块状物质较少,说明反应主要发生在细菌表面。

|
| 图 4 NZVI-JS100的扫描电镜照片 Figure 4 Scanning electron micrograph for NZVI-JS100 注:A:35 100×获得的2 h时的细菌形态;B:45 000×获得的36 h时的细菌形态. Note: A: The obtained bacteria morphology at 2 h at 35 100×; B: The obtained bacteria morphology at 36 h at 45 000×. |
|
|
JS100和NZVI-JS100反应体系中细菌的生长状况如图 5所示,JS100中的细菌数量始终保持在较低水平,说明在PeCB作为唯一碳源的反应体系中,细菌无法以PeCB为营养物质进行生命活动,这与该菌对PeCB的降解率几乎为零的结果相匹配,所以,细菌数量在整个反应过程中没有明显变化。而NZVI-JS100中的细菌数量有明显上升,32 h可达到初始浓度的2倍,说明在NZVI的催化作用下,PeCB反应生成了可生化性较高的低氯苯类化合物,成为细菌可用于自身生命活动和生长繁殖的有机物质。
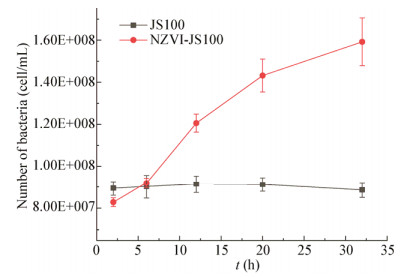
|
| 图 5 细菌的数量变化 Figure 5 Changes in the number of the bacteria |
|
|
本研究中的NZVI-JS100反应体系对PeCB具有良好的降解效果,36 h可降解55.4%,伪一级速率常数为0.020 48 h–1,均显著高于NZVI反应体系。NZVI在水中容易发生聚集,使得其有效的活性位点减少,导致降解性能降低。李杰等[30]采用纳米钯化铁进行PeCB的降解实验,20 h的降解率仅为20%,动力学模拟的伪一级速率常数为0. 014 40 h–1,反应速率明显低于本研究中的NZVI-JS100反应体系。而在利用细菌进行厌氧脱氯的实验中,无论是Jayachandran等[31]分离出的以PeCB为碳源的Dehalococcoides sp. strain CBDB1,还是Wu等[32]富集培养的多氯联苯(PCB)脱氯菌DF-1,降解PeCB的反应过程都耗时较长,降解效率大大低于本研究中的NZVI-JS100反应体系。因此,NZVI-JS100反应体系的降解效果相对于纳米铁和脱氯菌的单一反应体系具有明显提高。
已有研究表明[33-34],NZVI会与水中的O2发生类芬顿反应,溶解氧被NZVI连续激活,将Fe0氧化为Fe2+,并在NZVI表面生成H2O2,H2O2会继续与Fe0反应生成Fe2+,或与Fe2+反应产生羟基自由基。羟基自由基作为一种极具反应性的活性氧化剂[35],降解高氯苯的过程主要是通过改变电子云密度,提高苯环活性,攻击C-Cl键引起Cl-的脱除或取代,产生低氯苯类化合物。这些中间产物在羟基自由基的持续作用下容易形成多羟基苯,多羟基苯不稳定并倾向于进行开环反应以产生较小的有机酸,从而进一步被矿化为H2O和CO2。
通过研究NZVI-JS100反应体系中PeCB的脱氯产物和细菌生长状况发现,反应初期,细菌处于适应期时,脱氯产物的浓度相对较高,随着反应的进行,脱氯产物的浓度逐渐降低,细菌数量逐渐增多,表明细菌通过摄取利用低氯苯类的脱氯产物进行生长繁殖,发挥了与NZVI的协同降解作用。
由此推测,NZVI-JS100的反应初期主要由NZVI起降解作用,产生羟基自由基对PeCB进行攻击,进而产生可生化性较高的低氯苯类化合物。被脱除的氯离子或低氯产物可能会聚集于NZVI表面,影响电子的传递,细菌的加入减弱了这种反馈抑制,强化了NZVI与细菌的物质传递。并且细菌将这些脱氯产物作为营养物质用于自身的生命活动和生长繁殖,减少了脱氯产物对NZVI的消耗,增加了NZVI对PeCB的作用机会,促进了PeCB的降解。同时,细菌为NZVI提供附着位点,使其能够保持颗粒形态,这有利于减少NZVI自身的聚集,提高反应的活性。
本研究构建的NZVI耦合假单胞菌的合成体系对PeCB具有较好的降解性能,为含有高氯代苯类等有机污染物的复杂环境的修复提供了参考。
| [1] |
Gan P, Zhu TT, Fan YB, et al. Biodegradation of chlorobenzenes (CBS)——a review[J]. Techniques and Equipment for Environmental Pollution Control, 2000, 1(4): 1-12. (in Chinese) 甘平, 朱婷婷, 樊耀波, 等. 氯苯类化合物的生物降解[J]. 环境污染治理技术与设备, 2000, 1(4): 1-12. |
| [2] |
Oliver BG, Nicol KD. Rebuttal to correspondence on: chlorobenzenes in sediments, water and selected fish from Lakes Superior, Huron, Erie and Ontario[J]. Environmental Science & Technology, 1983, 17(8): 505. |
| [3] |
Bengtson Nash SM, Wild SJ, Hawker DW, et al. Persistent organic pollutants in the east Antarctic atmosphere: inter-annual observations from 2010 to 2015 using high-flow-through passive sampling[J]. Environmental Science & Technology, 2017, 51(23): 13929-13937. |
| [4] |
Robinson PE, Mack GA, Remmers J, et al. Trends of PCB, hexachlorobenzene, and β-benzene hexachloride levels in the adipose tissue of the U.S. population[J]. Environmental Research, 1990, 53(2): 175-192. DOI:10.1016/S0013-9351(05)80118-5 |
| [5] |
Gregoraszczuk EL, Ptak A, Karpeta A, et al. Hexachlorobenzene and pentachlorobenzene accumulation, metabolism and effect on steroid secretion and on CYP11A1 and CYP19 expression in cultured human placental tissue[J]. Reproductive Toxicology, 2014, 43: 102-110. DOI:10.1016/j.reprotox.2013.12.004 |
| [6] |
Meijer SN, Ockenden WA, Sweetman A, et al. Global distribution and budget of PCBs and HCB in background surface soils: implications for sources and environmental processes[J]. Environmental Science & Technology, 2003, 37(4): 667-672. |
| [7] |
Mochizuki S. Photochemical dechlorination of PCBs[J]. Chemical Engineering Science, 1977, 32(10): 1205-1210. DOI:10.1016/0009-2509(77)80053-5 |
| [8] |
de Bont JA, Vorage MJ, Hartmans S, et al. Microbial degradation of 1, 3-dichlorobenzene[J]. Applied and Environmental Microbiology, 1986, 52(4): 677-680. |
| [9] |
Dolfing J, Harrison BK. Gibbs free energy of formation of halogenated aromatic compounds and their potential role as electron acceptors in anaerobic environments[J]. Environmental Science & Technology, 1992, 26(11): 2213-2218. |
| [10] |
Potrawfke T, Timmis KN, Wittich RM. Degradation of 1, 2, 3, 4-tetrachlorobenzene by Pseudomonas chlororaphis RW71[J]. Applied and Environmental Microbiology, 1998, 64(10): 3798-3806. |
| [11] |
Spain JC, Nishino SF. Degradation of 1, 4-dichlorobenzene by a Pseudomonas sp.[J]. Applied and Environmental Microbiology, 1987, 53(5): 1010-1019. |
| [12] |
Wang YF, Zhang ZM, Hu XM, et al. The research progress of treating chlorobenzenes in wastewater by microorganisms[J]. Microbiology China, 2008, 35(6): 949-954. (in Chinese) 王玉芬, 张肇铭, 胡筱敏, 等. 微生物法去除水中氯苯类化合物的研究进展[J]. 微生物学通报, 2008, 35(6): 949-954. DOI:10.3969/j.issn.0253-2654.2008.06.022 |
| [13] |
Oldenhuis R, Kuijk L, Lammers A, et al. Degradation of chlorinated and non-chlorinated aromatic solvents in soil suspensions by pure bacterial cultures[J]. Applied Microbiology and Biotechnology, 1989, 30(2): 211-217. |
| [14] |
Winn LM. Homologous recombination initiated by benzene metabolites: a potential role of oxidative stress[J]. Toxicological Sciences, 2003, 72(1): 143-149. DOI:10.1093/toxsci/kfg008 |
| [15] |
Field JA, Sierra-Alvarez R. Microbial degradation of chlorinated benzenes[J]. Biodegradation, 2008, 19(4): 463-480. DOI:10.1007/s10532-007-9155-1 |
| [16] |
Reineke W, Knackmuss HJ. Microbial metabolism of haloaromatics: isolation and properties of a chlorobenzene-degrading bacterium[J]. Applied and Environmental Microbiology, 1984, 47(2): 395-402. |
| [17] |
Haigler BE, Nishino SF, Spain JC. Degradation of 1, 2-dichlorobenzene by a Pseudomonas sp.[J]. Applied and Environmental Microbiology, 1988, 54(2): 294-301. |
| [18] |
Brunsbach RF, Reineke W. Degradation of chlorobenzenes in soil slurry by a specialized organism[J]. Applied Microbiology and Biotechnology, 1994, 42(2/3): 415-420. |
| [19] |
Sander P, Wittich RM, Fortnagel P, et al. Degradation of 1, 2, 4-trichloro- and 1, 2, 4, 5-tetrachlorobenzene by Pseudomonas strains[J]. Applied and Environmental Microbiology, 1991, 57(5): 1430-1440. |
| [20] |
Chau ATT, Lee M, Adrian L, et al. Syntrophic partners enhance growth and respiratory dehalogenation of hexachlorobenzene by Dehalococcoides mccartyi strain CBDB1[J]. Frontiers in Microbiology, 2018, 9: 1927. DOI:10.3389/fmicb.2018.01927 |
| [21] |
Neilson AH. An environmental perspective on the biodegradation of organochlorine xenobiotics[J]. International Biodeterioration & Biodegradation, 1996, 37(1/2): 3-21. |
| [22] |
Montánchez I, Kaberdina AC, Sevillano E, et al. Isolation of Pseudomonas fluorescens species highly resistant to pentachlorobenzene[J]. Folia Microbiologica, 2017, 62(4): 325-334. DOI:10.1007/s12223-017-0501-3 |
| [23] |
Li BZ, Zhu J. Removal of p-chloronitrobenzene from groundwater: effectiveness and degradation mechanism of a heterogeneous nanoparticulate zero-valent iron (NZVI)-induced Fenton process[J]. Chemical Engineering Journal, 2014, 255: 225-232. DOI:10.1016/j.cej.2014.06.013 |
| [24] |
Shimizu A, Tokumura M, Nakajima K, et al. Phenol removal using zero-valent iron powder in the presence of dissolved oxygen: roles of decomposition by the Fenton reaction and adsorption/precipitation[J]. Journal of Hazardous Materials, 2012, 201-202: 60-67. DOI:10.1016/j.jhazmat.2011.11.009 |
| [25] |
Lv YC, Zhang Z, Chen YC, et al. A novel three-stage hybrid nano bimetallic reduction/oxidation/biodegradation treatment for remediation of 2, 2'4, 4'-tetrabromodiphenyl ether[J]. Chemical Engineering Journal, 2016, 289: 382-390. DOI:10.1016/j.cej.2015.12.097 |
| [26] |
Crane RA, Scott TB. Nanoscale zero-valent iron: future prospects for an emerging water treatment technology[J]. Journal of Hazardous Materials, 2012, 211-212: 112-125. DOI:10.1016/j.jhazmat.2011.11.073 |
| [27] |
Chen WF, Pan L, Chen LF, et al. Dechlorination of hexachlorobenzene by nano zero-valent iron/activated carbon composite: iron loading, kinetics and pathway[J]. RSC Advances, 2014, 4(87): 46689-46696. DOI:10.1039/C4RA06760F |
| [28] |
He N, Li PJ, Zhou YC, et al. Degradation of pentachlorobiphenyl by a sequential treatment using Pd coated iron and an aerobic bacterium (H1)[J]. Chemosphere, 2009, 76(11): 1491-1497. DOI:10.1016/j.chemosphere.2009.06.046 |
| [29] |
Cao J, Xu RF, Tang H, et al. Synthesis of monodispersed CMC-stabilized Fe–Cu bimetal nanoparticles for in situ reductive dechlorination of 1, 2, 4-trichlorobenzene[J]. Science of the Total Environment, 2011, 409(11): 2336-2341. DOI:10.1016/j.scitotenv.2011.02.045 |
| [30] |
Li J, Wang F, Yang XL, et al. Degradation of highly-chlorinated benzenes by nanoscale iron and palladized iron in aqueous system[J]. Environmental Science, 2011, 32(3): 692-698. (in Chinese) 李杰, 王芳, 杨兴伦, 等. 纳米铁和钯化铁对水体中高氯苯的降解特性[J]. 环境科学, 2011, 32(3): 692-698. |
| [31] |
Jayachandran G, Görisch H, Adrian L. Dehalorespiration with hexachlorobenzene and pentachlorobenzene by Dehalococcoides sp. strain CBDB1[J]. Archives of Microbiology, 2003, 180(6): 411-416. DOI:10.1007/s00203-003-0607-7 |
| [32] |
Wu QZ, Milliken CE, Meier GP, et al. Dechlorination of chlorobenzenes by a culture containing bacterium DF-1, a PCB dechlorinating microorganism[J]. Environmental Science & Technology, 2002, 36(15): 3290-3294. |
| [33] |
Joo SH, Feitz AJ, Sedlak DL, et al. Quantification of the oxidizing capacity of nanoparticulate zero-valent iron[J]. Environmental Science & Technology, 2005, 39(5): 1263-1268. |
| [34] |
Oonnittan A, Isosaari P, Sillanpää M. Oxidant availability in soil and its effect on HCB removal during electrokinetic Fenton process[J]. Separation and Purification Technology, 2010, 76(2): 146-150. DOI:10.1016/j.seppur.2010.09.034 |
| [35] |
Xia SJ, Shao MM, Zhou XB, et al. Ti/ZnO-MxOy composites (M = Al, Cr, Fe, Ce): synthesis, characterization and application as highly efficient photocatalysts for hexachlorobenzene degradation[J]. Physical Chemistry Chemical Physics, 2015, 17(40): 26690-26702. DOI:10.1039/C5CP04125B |
 2019, Vol. 46
2019, Vol. 46