扩展功能
文章信息
- 钱忠英, 李杨, 蔡海莺, 冯凤琴
- QIAN Zhong-Ying, LI Yang, CAI Hai-Ying, FENG Feng-Qin
- 疏棉状嗜热丝孢菌脂肪酶基因在毕赤酵母工程菌中的遗传稳定性
- Hereditary stability of Thermomyces lanuginosus lipase gene in recombinant Pichia pastoris strain
- 微生物学通报, 2019, 46(11): 2821-2829
- Microbiology China, 2019, 46(11): 2821-2829
- DOI: 10.13344/j.microbiol.china.190004
-
文章历史
- 收稿日期: 2019-01-02
- 接受日期: 2019-03-08
- 网络首发日期: 2019-04-23
2. 浙江科技学院生物与化学工程学院 浙江 杭州 310023
2. School of Biological and Chemical Engineering, Zhejiang University of Science & Technology, Hangzhou, Zhejiang 310023, China
脂肪酶是一种既可催化水解反应又可催化合成反应的高效生物催化剂,可广泛应用于烘焙、造纸、洗涤、皮革、饲料、油脂等各行各业。脂肪酶制剂由于主要依赖进口且价格昂贵,应用规模受到诸多限制。自然界的微生物是一个巨大的资源宝库,其产生的胞外脂肪酶更是具有开发和商业利用价值。毕赤酵母(Pichia pastoris)蛋白表达系统是20世纪80年代发展起来的真核表达系统[1],因具有强启动子、蛋白翻译后加工修饰、自身分泌蛋白少、易于高密度发酵等一系列独特优势而被广泛应用于实验室研究和工业生产中,如今已有400多种外源蛋白在该系统中得到有效表达,是仅次于大肠杆菌的最常用蛋白表达系统[2-3]。随着基因工程技术的发展,将经改造修饰后的脂肪酶基因转入毕赤酵母中以实现外源脂肪酶的高效表达,能降低脂肪酶的生产成本和使用成本,为其工业化生产创造了前提条件。
疏棉状嗜热丝孢菌脂肪酶(Thermomyces lanuginosus lipase,TLL)是一种嗜碱的、具有高活性和高稳定性及sn-1, 3位置专一性的酶,能在两相介质(水-有机溶剂)和无溶剂体系中发挥作用。最新研究表明,其位置特异性还可通过界面吸附在特定疏水载体(如Purolite C-18等)而改变,固定化后的TLL能够在一定条件下随机水解甘油三酯的酯键而产生约100%乙酯[4]。长期以来,TLL得到了广泛的关注与研究,TLL在多领域,尤其是油脂改性、生物柴油生产、外消旋体拆分等方面具有鲜明优势[4-5]。诺维信公司已将其开发为可溶性(Lipozyme TL 100 L)和固定化(Lipozyme TL IM)两种商品酶形式。
本实验根据蔡海莺[6]的方法优化改造了tll基因,并将表达载体以同源重组的方式整合到毕赤酵母原始宿主菌GS115基因组中,筛选并纯化得到一株高拷贝转化子。工业上通过高密度发酵的手段可显著提高重组毕赤酵母表达目的蛋白[7-8]。值得注意的是,在高密度发酵过程中重组菌生长繁殖迅速且经历多次传代,往往伴随着遗传不稳定性现象的出现。重组菌的传代稳定性是高效稳定表达异源基因和大规模发酵的重要前提,同时也是食品药品监督管理局评审基因工程产物的重要内容之一[9]。因此,实际生产中要求工程菌必须在一定代次之内遗传稳定。传代稳定性取决于宿主菌、外源基因、载体类型、拷贝数等多种因素[10],毕赤酵母一般在10-15代保持稳定可满足工业化生产要求[11-13]。本研究将工程菌PTL连续培养15代,多方面考察了其遗传稳定性,评价指标包括菌落及菌体形态、水解酶活、目的基因片段及序列、外源基因拷贝数等,以期为其工业化大规模生产奠定基础。
1 材料与方法 1.1 菌株毕赤酵母原始宿主菌Pichia pastoris GS115,Invitrogen公司;大肠杆菌Escherichia coli,苏州金唯智公司。
1.2 主要试剂和仪器Ezup柱式酵母基因组DNA抽提试剂盒、SanTaq Plus PCR Mix预混液、30%聚丙烯酰胺贮液、10%过硫酸氨、10% SDS、TEMED,生工生物工程(上海)股份有限公司;pEASY-T5 Zero Cloning Kit、EasyPure Plasmid MiniPrep Kit、EasyPure PCR Purification Kit、氨苄青霉素,北京全式金生物技术有限公司;对硝基苯酚棕榈酸酯(4-Nitrophenyl palmitate,pNPP)、对硝基苯酚(p-Nitrophenol,pNP),Sigma公司;SYBR荧光定量PCR试剂盒,南京诺唯赞生物科技有限公司;表达载体pPIC9K,Invitrogen公司;限制性内切酶、DNA聚合酶等工具酶,赛默飞世尔科技有限公司。
酶标仪,Tecan公司;实时荧光定量PCR仪、梯度PCR仪,赛默飞世尔科技有限公司;荧光化学发光成像仪,上海勤翔科学仪器有限公司;迷你垂直电泳仪、迷你水平电泳仪,北京百晶生物技术有限公司。
1.3 培养基配制YPD、BMGY、BMMY培养基按Invitrogen公司多克隆毕赤酵母表达手册配制;BMMY- Rhodamine B-橄榄油培养基(g/L):酵母提取物10.0,蛋白胨20.0,甲醇10.0,YNB 13.4,聚乙烯醇乳化橄榄油10.0,Rhodamine B 0.1,pH 6.0磷酸钾溶液0.10 mol/L,生物素0.016 μmol/L。
1.4 方法 1.4.1 载体构建和酵母转化目的基因tll是由前导肽序列(SPIRR-)和现有的疏棉状嗜热丝孢菌脂肪酶编码基因序列(GenBank登录号AF054513.1)组成,根据蔡海莺[6]的方法进行优化和改良。所得优化基因用EcoR I/Not I双酶切连接至表达载体pPIC9K的多克隆位点中,后导入毕赤酵母GS115中与宿主基因整合。经G418遗传霉素YPD平板筛选并纯化后得到高拷贝的重组菌PTL。
1.4.2 菌株传代方法以得到的重组菌PTL作为初代,划线接种于YPD固体培养基上,置于30 ℃下培养。每隔48 h挑取生长良好的单菌落转接到新的YPD固体培养基中,并算作传代一次,按上述方法连续传代15代,选择第1、5、10、15代为受检代次。
1.4.3 菌落和菌体形态观察观察并比较各受检代次菌株在YPD固体培养基上生长48 h后的菌落形态,制成涂片后于光学显微镜下观察并比较各代重组菌的菌体形态。
1.4.4 重组菌功能鉴定从受检代菌株的YPD培养基上挑取生长良好的单菌落点种到BMMY-Rhodamine B-橄榄油酶活平板上,30 ℃下培养48 h。根据菌落周围的水解圈大小,初步判断传代过程中脂肪酶的表达情况[14]。
1.4.5 重组工程菌的诱导表达参照蔡海莺的优化表达方案[6]对各受检代菌株进行诱导表达,4 ℃、5 000×g离心5 min收集第168 h的上清液即为待测粗酶液。
1.4.6 酶活测定及蛋白检测脂肪酶水解酶活以pNPP为底物,采用分光光度法进行测定[15]。0.3 mg/mL pNPP溶于异丙醇中,与20 mmol/L Tris-HCl缓冲液(pH 8.0,0.11%阿拉伯胶)按1:9的体积比混匀作为底物溶液使用。1.5 mL离心管中加入600 μL底物溶液,再加入适当稀释后的粗酶液25 μL,以灭活酶液作为空白对照,40 ℃下温育15 min后,加入500 μL 95%乙醇溶液终止反应,并于410 nm下测定吸光值。脂肪酶酶活定义为:1 min内催化水解底物对pNPP产生1 μmol pNP所需的酶量。粗酶液中的蛋白浓度采用Bradford法测定,蛋白分子量由SDS-PAGE检测。
1.4.7 引物设计根据NCBI数据库中公布的毕赤酵母gapdh基因序列(GenBank登录号U62648.1)以及工程菌PTL完整序列,分别设计PCR和RT-PCR反应所用引物,如表 1所示,由上海睿迪生物科技有限公司合成。
| 引物 Primers |
引物序列 Primers sequence (5′→3′) |
产物长度 Product length (bp) |
| GP-F | TACGTTGCGGGTAAAACGGA | 1 463 |
| GP-R | GAAAGAGCCAGTCCTCCGAC | |
| GQP-F | TTGTCGGTGTCAACGAGGAG | 137 |
| GQP-R | GGTGGTCATCAAACCGGACT | |
| TP-F | CTGGAATTCTCTCCTATCAGAA GAGAAGTTTCACAAGACCTG | 857 |
| TP-R | AGGAACAGTCATGTCTAAGG | |
| TQP-F | ACCTCTTCCTGGAGATCCGT | 241 |
| TQP-R | ACAGAGTACCACCGGTCTGA |
提取第1、5、10、15代工程菌基因组DNA,阴性对照用等量的ddH2O替代DNA模板,以TP-F、TP-R为上、下游引物进行PCR扩增。PCR反应体系根据SanTaq Plus PCR预混液试剂盒加样,PCR反应体系(50 μL):ddH2O 20 μL,2×PCR Master 25 μL,DNA模板1 μL,上、下游引物(10 μmol/L)各2 μL。PCR反应条件:95 ℃ 1 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s,35个循环;72 ℃ 7 min。1%琼脂糖凝胶电泳检测扩增产物,使用化学发光成像仪分析。
1.4.9 构建标准质粒以重组菌PTL的基因组为模板,用GP-F、GP-R及TP-F、TP-R为上、下游引物分别PCR扩增参照基因gapdh和目的基因tll,切胶回收即得相应的基因片段。按照pEASY-T5 Zero Cloning Kit,将基因片段分别连接到pEASY-T5 Zero载体后导入大肠杆菌Trans1-T1 Phage Resistant感受态细胞中,筛选在含氨苄青霉素的固体培养基上生长的大肠杆菌为阳性克隆子。阳性克隆子由上海睿迪生物科技有限公司测序鉴定,将测序正确的质粒命名为pGAP1和pTLL1,作为RT-PCR的标准质粒[16]。
1.4.10 RT-PCR法测定工程菌中的拷贝数采用双标准曲线法测定重组菌中目的基因的整合拷贝数[17]。将已计算拷贝数的标准质粒pGAP1和pTLL1梯度稀释,以GQP-F、GQP-R和TQP-F、TQP-R为引物分别进行RT-PCR扩增,以测得的Ct值为纵坐标,以起始模板中质粒拷贝数的对数为横坐标,建立标准曲线。受检代工程菌基因组同样用上述2对引物分别进行RT-PCR反应,得到相应的Ct值代入两条标准曲线计算tll基因和gapdh基因的起始拷贝数。作为管家基因,gapdh基因在毕赤酵母中始终以单拷贝形式存在[18],因此tll基因与gapdh基因拷贝数的比值即为整合拷贝数。拷贝数计算公式:
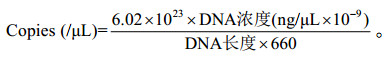
|
实验数据均以3次重复实验的平均值±标准差(x±SD)表示。使用SPSS 17.0软件进行单因素方差分析及Tukey多重比较法检验显著性,P < 0.05判断为有显著性差异;Origin 9.0软件用于数据处理和绘图。
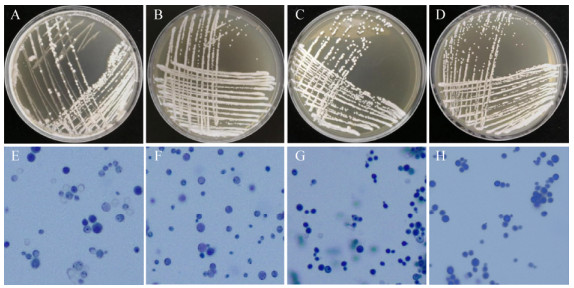
2 结果与分析 2.1 菌落和菌体形态观察重组菌的菌落和菌体形态如图 1所示,各代重组菌的菌落形态一致,呈乳白色不透明状,边缘整齐、中间凸起、表面湿润光滑,有酒香味,符合典型的巴斯德毕赤酵母菌落特征[19],平板中无杂菌生长。挑取各代单菌落进行镜检,观察到重组菌在连续传代的不同时期细胞形态一致,都为卵圆形且视野中无其他杂菌。
|
| 图 1 各代重组菌菌落特征及菌体特征(400×) Figure 1 Colony morphology and cell morphology of different generations of recombinant strains (400×) 注:A-D:第1、5、10、15代重组菌的菌落特征;E-H:第1、5、10、15代重组菌的菌体形态. Note: A-D: Colony morphology of the 1st, 5th, 10th and 15th generation of recombinant strains; E-H: Cell morphology of the 1st, 5th, 10th and 15th generation of recombinant strains. |
|
|
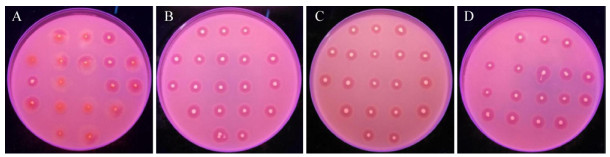
在紫外灯照射下,BMMY-Rhodamine B-橄榄油平板上各代工程菌的单菌落周围均有明显的水解圈(图 2),与蔡海莺的研究结果[6]一致,说明在连续传代的过程中未出现目的基因完全丢失的情况,即外源基因在各代工程菌中均有表达,但仍需通过RT-PCR定量测定工程菌中目的基因的整合拷贝数。
|
| 图 2 第1、5、10、15代重组菌水解圈 Figure 2 The fluorescence of different generations of recombinant strains on Rhodamine B agar plates 注:A-D:第1、5、10、15代重组菌. Note: A-D: The 1st, 5th, 10th and 15th generation of recombinant strains. |
|
|
以最高酶活和最高蛋白浓度为100%换算得到相对酶活和相对蛋白含量。由图 3可见,第5、10、15代工程菌发酵所得粗酶液的酶活显著高于第1代(P < 0.05),均在90%以上,各代工程菌的粗酶液中蛋白含量的高低与酶活的变化具有一致性。粗酶液中蛋白经SDS-PAGE检测,几乎没有杂蛋白,只显示为一条清晰的蛋白质特征条带,约为36 kD。理论上TLL蛋白大小为30.54 kD,推测是外源脂肪酶在分泌的过程中被毕赤酵母表达系统进行了糖基化等翻译后加工与修饰[20]。结合酶活与蛋白分析,外源基因的插入能在连续传代15代的过程中稳定遗传并表达出目的蛋白,毕赤酵母自身分泌的背景蛋白非常少,十分有利于目的蛋白分离纯化。但不可忽视的是,第1代重组菌的脂肪酶表达能力较差,有必要从基因层面探讨其原因,深入分析基因剂量与蛋白表达之间的关系。
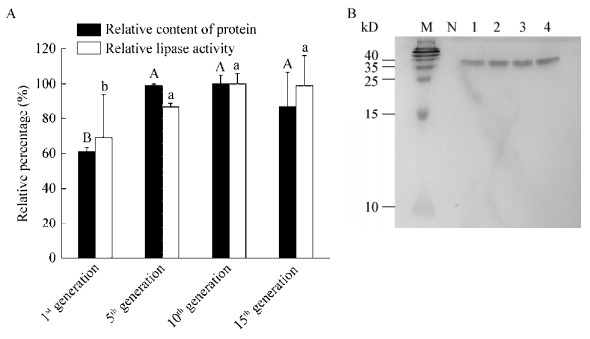
|
| 图 3 第1、5、10、15代工程菌粗酶液中脂肪酶水解酶活和蛋白含量(A)及蛋白SDS-PAGE检测图谱(B) Figure 3 Hydrolytic activity of lipase and protein content (A) and SDS-PAGE pattern (B) in crude lipase from different generations of recombinant strains 注:M:蛋白分子量标准;N:阴性对照;1-4:第1、5、10、15代重组菌发酵粗酶液. Note: M: Marker; N: Negative control; 1-4: Crude lipase respectively from the 1st, 5th, 10th and 15th generation of recombinant strains. |
|
|
针对第1、5、10、15代工程菌基因组中目的基因进行PCR扩增,琼脂糖凝胶电泳图(图 4)显示所得扩增产物在750-1 000 bp区间均存在明显条带,与本实验设计的目的基因大小857 bp相符。将第15代工程菌的外源基因序列与本实验所设计的基因序列进行BLAST比对,两者一致性高达100%。
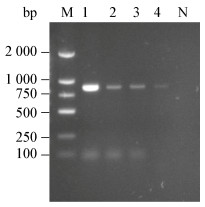
|
| 图 4 第1、5、10、15代工程菌目的基因PCR产物鉴定 Figure 4 Identification of target DNA segment in various generations by PCR analysis 注:M:DNA分子量标准;1-4:第1、5、10、15代重组菌基因组PCR产物;N:阴性对照. Note: M: DNA marker; 1-4: PCR products of the 1st, 5th, 10th, 15th generation of recombinant strains respectively; N: No template control. |
|
|
如图 5所示,标准质粒pGAP1和pTLL1的溶解曲线图中只存在单一的熔融峰,说明无特异性扩增,引物特异性高,定量结果准确可靠。

|
| 图 5 标准质粒的扩增曲线、标准曲线及熔解曲线 Figure 5 Amplification plots, standard curves and melt curves of the standard plasmids 注:A:标准质粒pGAP1;B:标准质粒pTLL1. Note: A: Standard plasmids pGAP1; B: Standard plasmids pTLL1. |
|
|
将标准质粒pGAP1、pTLL1分别按103、104、105、106、107、108梯度稀释后进行荧光定量PCR扩增,每个浓度梯度设置3次重复,得到一系列Ct值,扩增曲线见图 5。标准质粒pGAP1和pTLL1的标准曲线分别为:y=-3.423 1x+79.879 (R2=0.999 8);y=-3.383 4x+79.279 (R2=0.999 6),两者的扩增效率相近,分别为95.9%和97.5%。在同一反应条件下,以第1、5、10、15代工程菌基因组DNA为模板进行RT-PCR检测,计算得到每隔5代重组菌的拷贝数,见表 2。第1代拷贝数为64.99,传代至第5代拷贝数为17.80,发生了近70%的丢失;第10代和第15代拷贝数为7.00左右,仅保留了第1代10%拷贝数,但此时重组菌中的拷贝数已处于稳定状态。
| 传代数 Generation |
Ct | 整合拷贝数 Copy number |
基因丢失率 Deletion rate (%) |
|
| gapdh | tll | |||
| 1 | 19.71±0.08 | 13.67±0.01 | 64.99 | 0.0 |
| 5 | 19.29±0.02 | 15.17±0.07 | 17.80 | 72.6 |
| 10 | 19.11±0.10 | 16.30±0.00 | 7.29 | 88.8 |
| 15 | 19.14±0.05 | 16.21±0.04 | 7.87 | 87.9 |
在毕赤酵母表达系统中,表达载体通过同源重组的方式整合到宿主的基因组上具有相对较高的稳定性。本实验对重组工程菌PTL连续传代至15代,选取第1、5、10、15代作为受检代次,综合分析了各项检测指标以评价其遗传稳定性。研究结果显示,受检代工程菌的菌落和菌体形态一致,为毕赤酵母特征形态,说明重组菌的生长不受多拷贝基因的影响;经BMMY-Rhodamine B-橄榄油平板鉴定,传代过程中工程菌分泌外源脂肪酶的能力没有丢失;受检代工程菌的目的基因PCR扩增产物大小为857 bp,与所设计的基因序列大小相吻合;传至第15代,工程菌的基因序列与原始的优化序列的一致性为100%。
脂肪酶的产量是将该工程菌应用于工业化生产所关注的重要指标。然而,基因工程获得的克隆子往往具有不可预测的生产特性[21-22]。本实验中,第5代、第10代工程菌粗酶液的酶活均在99%以上,第15代酶活虽略有下降,仍保持在90%以上,表明第5代至第15代工程菌发酵产脂肪酶已达到了稳定,而第1代工程菌发酵液的酶活和蛋白含量都显著低于第5、10、15代,推测脂肪酶表达量的变化情况可能与目的基因在毕赤酵母中的遗传稳定性有关。因此,实验进一步监测了传代过程中工程菌基因拷贝数的变化,以期发现基因剂量与蛋白表达量之间的关系。
由RT-PCR结果发现,工程菌PTL在传至第5代时目的基因的整合拷贝数发生了大量损失,由64.99降为17.80,随后整合拷贝数损失量减少并保持稳定,第10、15代工程菌分别为7.29、7.86。由生产能力和基因剂量两个指标,我们发现拷贝数出现骤降的代次正是脂肪酶酶活发生变化的代次。目前对于高拷贝子的研究报道较少,高拷贝的重组菌在传代过程中目的基因易发生丢失,Zhu等通过HIS和AOX同源重组得到了拷贝数为29的毕赤酵母转化子,诱导培养96 h后拷贝数骤减至15[23]。大多数情况下,高基因剂量更有利于充分发挥毕赤酵母的表达潜力[24]。Vassileva等构建了HBsAg基因拷贝数最大量为8的毕赤酵母重组菌,发现拷贝数的增加与蛋白总水平的相应升高密切相关[25]。Wang等将BmK AngM1基因导入毕赤酵母Muts菌株,结果显示含有4个基因拷贝的菌株表达量约为单拷贝菌株的4倍[26]。
然而,本实验传代过程中基因拷贝数下降,工程菌脂肪酶表达量反而提高,其原因可能是目的基因并非细胞本身所携带,表达高拷贝的外源基因意味着细胞需要消耗更多额外的能量,加重了其生长代谢的负荷[12, 27]。宿主中mRNA的翻译效率或蛋白质的折叠效率受到限制,甚至对于分泌效率较低的蛋白,盲目增加基因剂量还会引起对分泌途径的负反馈抑制[3, 24]。这种高拷贝低表达的现象在他人的研究中也有发现。Sha等研究华根霉CCTCCM201021脂肪酶在毕赤酵母中表达时,发现基因拷贝数从5增加到6时,脂肪酶酶活从12 500 U/mL降至约2 000 U/mL[28]。Camara等在毕赤酵母中导入了不同剂量的米根霉脂肪酶(Rhizopus oryzae lipase,ROL)基因,拷贝数分别为1、2、4、8、15,结果发现拷贝数为2的蛋白产量最高[29]。Zhu等研究了更广泛的基因剂量,拷贝数分别为0、1、3、6、12、18、29、52,拷贝子为12时蛋白表达量最高,高拷贝子(拷贝数 > 12)的生长速率和甲醇利用率显著降低,得出了基因剂量和蛋白产量的关系曲线呈“钟形”的结论[30]。
此外,还有学者提出较为新颖的见解。Schwarzhans等认为基因拷贝数与外源蛋白的表达水平之间并无明显相关性,他们对845个毕赤酵母转化子进行分析测定,利用了全基因组测序手段,并将所获结果与菌株相应的生产特性共同讨论,发现如果多拷贝菌株中表达盒以头-头或尾-尾的方式串联,会对重组菌的蛋白生产能力产生显著的负面影响[21],该发现也可能解释了在一些未知表达盒串联方式的研究中,出现的表达量与qPCR所测拷贝数判断的理论表达水平不符的现象。
综上所述,重组菌的生产能力与外源基因本身的性质及表达水平、拷贝数、宿主、载体、细胞生理状态等多种因素均有关系[21, 31-33]。
总之,工程菌PTL经连续传代培养至第15代,目的基因拷贝数维持稳定,脂肪酶的表达量处于较高水平,适量的整合拷贝数更利于重组菌PTL的生产能力,并且综合菌落特征、菌体形态、蛋白分子大小及目的基因序列等多方面共同说明了菌株未发生退化,具备良好的遗传稳定性,可用于工业化生产。
| [1] |
Hu SJ, Luo SL, Zhang JZ, et al. Pichia pastoris expression system and strategies for high-level expression[J]. Biotechnology, 2007, 17(6): 78-83. (in Chinese) 胡世界, 罗素兰, 张吉贞, 等. 巴斯德毕赤酵母表达系统及其高水平表达策略[J]. 生物技术, 2007, 17(6): 78-83. DOI:10.3969/j.issn.1004-311X.2007.06.030 |
| [2] |
Zhu TC, Li Y. Recent development of Pichia pastoris system: current status and future perspective[J]. Chinese Journal of Biotechnology, 2015, 31(6): 929-938. (in Chinese) 朱泰承, 李寅. 毕赤酵母表达系统发展概况及趋势[J]. 生物工程学报, 2015, 31(6): 929-938. |
| [3] |
Li Y, Cai HY, Zhao MJ. Research progress in heterologous expression of lipase genes in Pichia pastoris[J]. Science and Technology of Food Industry, 2015, 36(7): 377-381. (in Chinese) 李杨, 蔡海莺, 赵敏洁, 等. 巴斯德毕赤酵母(Pichia pastoris)高效异源表达脂肪酶研究进展[J]. 食品工业科技, 2015, 36(7): 377-381. |
| [4] |
Silveira EA, Moreno-Perez S, Basso A, et al. Biocatalyst engineering of Thermomyces lanuginosus lipase adsorbed on hydrophobic supports: modulation of enzyme properties for ethanolysis of oil in solvent-free systems[J]. Journal of Biotechnology, 2019, 289: 126-134. DOI:10.1016/j.jbiotec.2018.11.014 |
| [5] |
Fernandez-Lafuente R. Lipase from Thermomyces lanuginosus: uses and prospects as an industrial biocatalyst[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 62(3/4): 197-212. |
| [6] |
Cai HY. Screening, recombinant expression and molecular modification of sn-1, 3 specific lipase[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2016 (in Chinese) 蔡海莺. sn-1, 3专一性脂肪酶的筛选、重组表达和分子改造研究[D].杭州: 浙江大学博士学位论文, 2016 |
| [7] |
Li HM, Wang HN, Xu QK. Advance of Pichia pastoris on high-density fermentation[J]. Letters in Biotechnology, 2005, 16(2): 210-212. (in Chinese) 李洪淼, 王红宁, 许钦坤. 毕赤酵母高密度发酵研究进展[J]. 生物技术通讯, 2005, 16(2): 210-212. DOI:10.3969/j.issn.1009-0002.2005.02.030 |
| [8] |
Cai HY, Trish D, Zhang T, et al. Producing of Thermomyces lanuginosus lipase using high density fermentation of recombinant Pichia pastoris[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(7): 99-107. (in Chinese) 蔡海莺, Trish D, 张婷, 等. 毕赤酵母重组菌高密度发酵产疏绵状嗜热丝孢菌脂肪酶[J]. 中国食品学报, 2018, 18(7): 99-107. |
| [9] |
Hao D, You QQ, Hao W, et al. Study on the stability of growth differentiation factor (BMP11) recombinant plasmid in Escherichia coli[J]. Science and Technology of Food Industry, 2017, 38(19): 114-117, 124. (in Chinese) 郝丹, 尤倩倩, 郝伟, 等. 生长分化因子(BMP11)重组质粒在工程菌株中的稳定性研究[J]. 食品工业科技, 2017, 38(19): 114-117, 124. |
| [10] |
Li J, Fan CS, Zhu NS. Study on the genetic stability of the recombinant Pichia pastoris strain expressing HBsAg binding protein[J]. Pharmaceutical Biotechnology, 2014, 21(1): 18-21. (in Chinese) 李津, 范长胜, 朱乃硕. 表达乙肝表面抗原结合蛋白的毕赤酵母工程菌遗传稳定性研究[J]. 药物生物技术, 2014, 21(1): 18-21. |
| [11] |
Wuyundalai, Zhang BR, Guo XN, et al. Molecular cloning and expression of glutamic acid decarboxylase gene from Saccharomyces cerevisiae for biosynthesis of γ-aminobutyric acid[J]. Food Science, 2015, 36(13): 131-136. (in Chinese) 乌云达来, 张博润, 郭雪娜, 等. 生物合成γ-氨基丁酸酿酒酵母谷氨酸脱羧酶基因的克隆与表达[J]. 食品科学, 2015, 36(13): 131-136. DOI:10.7506/spkx1002-6630-201513025 |
| [12] |
Jiang XB. The study on high-level expression of XYL1 in Pichia pastoris based on industrial production[D]. Guangzhou: Doctoral Dissertation of South China University of Technology, 2013 (in Chinese) 江学斌.基于工业化生产的毕赤酵母高效表达木聚糖酶XYL1的研究[D].广州: 华南理工大学博士学位论文, 2013 |
| [13] |
Tang WH. Clone and expression of high yield recombinant β-mannanase in Pichia pastoris[D]. Jinan: Master's Thesis of Qilu University of Technology, 2013 (in Chinese) 唐卫华. β-甘露聚糖酶基因克隆及在毕赤酵母中的高效表达[D].济南: 齐鲁工业大学硕士学位论文, 2013 |
| [14] |
Cai HY, Zhao MJ, Li Y, et al. Screening and fatty acid profiling analysis of thermostable lipase producing strains from Chinese dumplings' steamer[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(4): 189-196. (in Chinese) 蔡海莺, 赵敏洁, 李杨, 等. 蒸笼垫中产高温脂肪酶菌株的筛选和脂肪酸谱分析[J]. 中国食品学报, 2017, 17(4): 189-196. |
| [15] |
Winkler UK, Stuckmann M. Glycogen, hyaluronate, and some other polysaccharides greatly enhance the formation of exolipase by Serratia marcescens[J]. Journal of Bacteriology, 1979, 138(3): 663-670. |
| [16] |
Hu JH. Quantitative analysis of intestinal flora status in different large intestinal segments of SD rats with hepatic injury by real-time PCR[D]. Chongqing: Doctoral Dissertation of Third Military Medical University, 2008 (in Chinese) 胡锦华.实时定量PCR分析肠道正常菌群及其在实验性肝损伤研究中的初步应用[D].重庆: 第三军医大学博士学位论文, 2008 |
| [17] |
Guo JX, He YF, Fan K. Detection of restructuring of transgenic copy number of Pichia engineering bacteria with fluorescence quantitative PCR method[J]. Journal of Chongqing University of Technology (Natural Science), 2016, 30(2): 77-83. (in Chinese) 郭晋霞, 何云凤, 范开. 荧光定量PCR法检测重组毕赤酵母工程菌的外源基因拷贝数[J]. 重庆理工大学学报:自然科学, 2016, 30(2): 77-83. DOI:10.3969/j.issn.1674-8425(z).2016.02.014 |
| [18] |
Waterham HR, Digan ME, Koutz PJ, et al. Isolation of the Pichia pastoris glyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter[J]. Gene, 1997, 186(1): 37-44. |
| [19] |
Wang YW, Zhang CM, Suo HY, et al. Isolation and identification of Pichia fermentans strains from traditional fermented yak yoghurt in the northwest of Sichuan province[J]. Science and Technology of Food Industry, 2014, 35(12): 184-187. (in Chinese) 王远微, 张诚民, 索化夷, 等. 川西北牧区传统发酵牦牛酸奶中发酵毕赤酵母菌的分离鉴定[J]. 食品工业科技, 2014, 35(12): 184-187. |
| [20] |
Damasceno LM, Huang CJ, Batt CA. Protein secretion in Pichia pastoris and advances in protein production[J]. Applied Microbiology and Biotechnology, 2012, 93(1): 31-39. |
| [21] |
Schwarzhans JP, Wibberg D, Winkler A, et al. Integration event induced changes in recombinant protein productivity in Pichia pastoris discovered by whole genome sequencing and derived vector optimization[J]. Microbial Cell Factories, 2016, 15: 84. DOI:10.1186/s12934-016-0486-7 |
| [22] |
Schwarzhans JP, Wibberg D, Winkler A, et al. Non-canonical integration events in Pichia pastoris encountered during standard transformation analysed with genome sequencing[J]. Scientific Reports, 2016, 6: 38952. DOI:10.1038/srep38952 |
| [23] |
Zhu TC, Guo MJ, Sun C, et al. A systematical investigation on the genetic stability of multi-copy Pichia pastoris strains[J]. Biotechnology Letters, 2009, 31(5): 679-684. DOI:10.1007/s10529-009-9917-4 |
| [24] |
Xie T, Wang HN. Research progress on expressing multicopies integration of foreign genes in Pichia pastoris[J]. Letters in Biotechnology, 2006, 17(3): 415-417. (in Chinese) 谢涛, 王红宁. 外源基因在巴斯德毕赤酵母中多拷贝整合的研究进展[J]. 生物技术通讯, 2006, 17(3): 415-417. DOI:10.3969/j.issn.1009-0002.2006.03.033 |
| [25] |
Vassileva A, Chugh DA, Swaminathan S, et al. Effect of copy number on the expression levels of hepatitis B surface antigen in the methylotrophic yeast Pichia pastoris[J]. Protein Expression and Purification, 2001, 21(1): 71-80. DOI:10.1006/prep.2000.1335 |
| [26] |
Wang QH, Liang L, Liu WC, et al. Enhancement of recombinant BmK AngM1 production in Pichia pastoris by regulating gene dosage, co-expressing with chaperones and fermenting in fed-batch mode[J]. Journal of Asian Natural Products Research, 2017, 19(6): 581-594. DOI:10.1080/10286020.2017.1311872 |
| [27] |
Hohenblum H, Gasser B, Maurer M, et al. Effects of gene dosage, promoters, and substrates on unfolded protein stress of recombinant Pichia pastoris[J]. Biotechnology and Bioengineering, 2004, 85(4): 367-375. DOI:10.1002/bit.10904 |
| [28] |
Sha C, Yu XW, Li F, et al. Impact of gene dosage on the production of lipase from Rhizopus chinensis CCTCC M201021 in Pichia pastoris[J]. Applied Biochemistry and Biotechnology, 2013, 169(4): 1160-1172. |
| [29] |
Camara E, Nils L, Sancho LR, et al. Investigating the physiological effect of increased heterologous gene dosage in Pichia pastoris using transcriptomics[J]. New Biotechnology, 2014, 31(S1): S59-S60. |
| [30] |
Zhu T, Guo M, Tang Z, et al. Efficient generation of multi-copy strains for optimizing secretory expression of porcine insulin precursor in yeast Pichia pastoris[J]. Journal of Applied Microbiology, 2009, 107(3): 954-963. DOI:10.1111/j.1365-2672.2009.04279.x |
| [31] |
Zhai CY, Xu Y, Nie Y, et al. Study on plasmid stability of recombinant Escherichia coli producing pullulanase[J]. Industrial Microbiology, 2015, 45(2): 13-20. (in Chinese) 翟成一, 徐岩, 聂尧, 等. 产普鲁兰酶重组大肠杆菌质粒稳定性的研究[J]. 工业微生物, 2015, 45(2): 13-20. DOI:10.3969/j.issn.1001-6678.2015.02.003 |
| [32] |
Fan CY, Wang X, Lang XL. The affect factors of the Pichia pastoris expression system in fermentation industry[J]. Hebei Chemical Industry, 2012, 35(7): 50-51, 57. (in Chinese) 樊春媛, 王雪, 郎晓磊. 发酵工业中毕赤酵母表达的影响因素[J]. 河北化工, 2012, 35(7): 50-51, 57. DOI:10.3969/j.issn.1003-5059.2012.07.019 |
| [33] |
Guo MJ, Zhu TC, Zhang M, et al. Influences of methanol utilization phenotype and gene dosage on heterologous protein expression in recombinant Pichia pastoris[J]. China Biotechnology, 2007, 27(7): 7-11. (in Chinese) 郭美锦, 朱泰承, 张明, 等. 重组毕赤酵母甲醇利用表型与基因拷贝数对外源基因表达的影响[J]. 中国生物工程杂志, 2007, 27(7): 7-11. |
 2019, Vol. 46
2019, Vol. 46