扩展功能
文章信息
- 李倜, 赵珂, 黄炎, 王梦婷, 李静, 张潇月, 李玥, 李德生
- LI Ti, ZHAO Ke, HUANG Yan, WANG Meng-Ting, LI Jing, ZHANG Xiao-Yue, LI Yue, LI De-Sheng
- 不同年龄大熊猫肠道可培养芽孢杆菌的多样性及部分功能特性分析
- Diversity and functional characteristics of Bacillus isolated from gut of giant panda (Ailuropoda melanoleuca) at different age
- 微生物学通报, 2019, 46(10): 2719-2729
- Microbiology China, 2019, 46(10): 2719-2729
- DOI: 10.13344/j.microbiol.china.180789
-
文章历史
- 收稿日期: 2018-10-12
- 接受日期: 2019-01-02
- 网络首发日期: 2019-01-07
2. 四川农业大学资源学院 四川 成都 611130;
3. 大熊猫国家公园珍稀动物保护生物学国家林业和草原局重点实验室 四川 都江堰 611830
2. College of Resource and Environment, Sichuan Agricultural University, Chengdu, Sichuan 611130, China;
3. Key Laboratory of National Forestry and Grassland Administration on Conservation Biology of Rare Animals in the Giant Panda National Park (CCRCGP), Dujiangyan, Sichuan 611830, China
大熊猫是我国特有的珍稀濒危动物,有“国宝”和“活化石”之称,属于哺乳动物纲食肉动物目,主要以竹子为食,较之其它草食动物,大熊猫具有典型的肉食性哺乳动物的消化系统,并形成了类似肉食性动物的肠道微生物种群结构[1]。随着对肠道微生物研究的深入,发现肠道内微生物不仅类群丰富,其种群结构在宿主年龄[2]、生存环境[3]、季节变化等因素的影响下还会发生动态变化[1]。芽孢杆菌包括能形成芽孢的杆菌或球菌,广泛分布于土壤、空气、水和动物肠道中。研究发现动物肠道中的芽孢杆菌不仅可以减弱病原菌带来的危害,促进宿主对食物的吸收和利用,改善肠道内微生物的失调,且具有耐高温、耐酸碱、易产生休眠体芽孢等特性,易制成益生菌制剂在动物肠道中发挥作用[4]。虽然目前对大熊猫肠道内芽孢杆菌种群的研究已有相关报道[5-6],但有关年龄对大熊猫肠道内可培养芽孢杆菌菌群的分布及影响还未见报道。因此,本研究以不同年龄阶段的大熊猫粪便为对象,分离其中的芽孢杆菌并分析其遗传多样性,比较不同大熊猫肠道芽孢杆菌分布的差异,检测菌株的生理特性,旨在了解大熊猫年龄对大熊猫肠道内芽孢杆菌菌群结构及其分布的影响,并为优良益生菌剂的开发提供菌种资源。
1 材料与方法 1.1 材料 1.1.1 样品来源2015年5月从中国大熊猫保护研究中心都江堰基地采集11只不同年龄大熊猫的新鲜粪便放于冰盒中,带回实验室立即进行分离(表 1)。11只大熊猫均生活于相同的环境中,食物结构相同,身体健康。
| 姓名 Name |
出生日期(年份) Date of birth (Year) |
性别 Gender |
成长阶段 Growth stage |
| Wuwen (W) | 2013 | Male | Sub adult |
| Susan (S) | 2011 | Female | Sub adult |
| Xianglin (X) | 2009 | Male | Adult |
| Meiqian (M) | 2006 | Female | Adult |
| Taishan (T) | 2005 | Male | Adult |
| Gege (G) | 2003 | Female | Adult |
| Pengpeng (E) | 1999 | Male | Adult |
| Daili (D) | 1999 | Male | Adult |
| Zixia (Z) | 1995 | Female | Elder |
| Yaoyuan (Y) | 1993 | Female | Elder |
| Panpan (P) | 1985 | Male | Elder |
普通营养培养基(g/L):蛋白胨5.00,牛肉膏3.00,酵母提取物1.00,CaCl2·2H2O 0.10,MgSO4·7H2O 0.50,MnSO4·H2O 0.05,琼脂18.00,pH 7.0−7.2;LB培养基(g/L):蛋白胨10.0,酵母提取物5.0,NaCl 10.0,琼脂18.0,pH 7.2−7.4。
抗生素药敏纸片,杭州微生物试剂有限公司;PCR Mix,大连宝生物工程有限公司。
恒温金属浴,上海生工生物科技有限公司;正置荧光显微镜,Carl Zeiss AG公司;涡旋匀仪,SCILOGEX公司;冷冻离心机,Eppendorf公司;PCR仪、凝胶成像仪,Bio-Rad公司。
1.2 方法 1.2.1 菌株分离与纯化采集到的新鲜大熊猫粪便样品用无菌水制成10-1、10-2、10-3菌悬液,80 ℃金属浴10 min后,涂布于普通营养培养基上,放置于37 ℃培养48 h,挑取单菌落在LB固体培养基上进行纯化,获得的纯化菌株保种于LB斜面,并于4 ℃保存。
1.2.2 形态学鉴定挑取菌落进行革兰氏染色后[7],在显微镜下观察芽孢杆菌的显微形态、是否产生芽孢等现象。
1.2.3 BOXA1R-PCR遗传多样性分析提取菌株基因组DNA[8],选取BOXA1R引物(5′-CTACGGCAAGGCGACGCTGACG-3′)进行PCR扩增[9]。PCR产物用2.0%琼脂糖凝胶电泳(80 V,90 min)检测。电泳结束后,使用凝胶成像系统扫描。将电泳图谱均一化处理后转化成计算机可以识别的数值“1”和“0”,通过NTSYS-pc2.1软件进行相似性分析,采用平均连锁法(UPGMA)聚类,最后获得菌株的聚类树状图[10]。
1.2.4 16S rRNA基因序列分析及系统发育树的构建根据BOXA1R-PCR遗传多样性分析挑选代表菌株,以细菌通用引物27F (5′-AGAGTTTGATC CTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTAC GACTT-3′)进行16S rRNA基因序列扩增。所得产物送至生工生物工程(上海)股份有限公司测序,测序结果在NCBI数据库中进行BLAST比对,在GenBank中寻找相似性最大菌株的基因序列,借助MEGA 6.0软件分析采用Neighbor-Joining法构建16S rRNA基因系统发育树[11]。
1.2.5 主成分分析根据序列比对,结合BOXA1R-PCR遗传多样性分析,将分离菌株在各样品的分布情况用Excel 2013软件进行整理,用CANOCO 5.0软件进行主成分分析(Principal component analysis,PCA)[12]。
1.2.6 抑菌试验指示菌株:肺炎克雷伯氏菌(Klebsiella pneumoniae)、金色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、肠球菌(Enterococcus sp.)、沙门氏菌(Salmonella sp.)由四川大学生命科学学院惠赠。菌株的抑菌实验采用对峙生长法[13]进行测试。
1.2.7 纤维素降解将代表菌株的菌饼接种于刚果红培养基上培养2−3 d,观察有无透明圈产生,有透明圈的为纤维素酶阳性[14],测量透明圈直径。
1.2.8 药敏试验选取从大熊猫粪便中分离出的代表菌株,采用药敏纸片琼脂扩散法[15],根据CLSI推荐方法进行操作。10种抗生素药敏纸片直径6 mm,37 ℃培养24 h后记录各药敏纸片的抑菌圈直径。根据CLSI(2011)标准判断敏感(S)、中介(I)和耐药(R),判定菌株的药敏性。
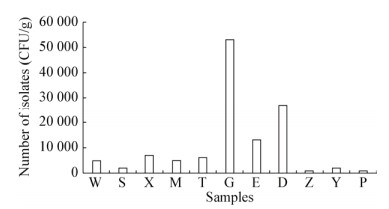
2 结果与分析 2.1 大熊猫中芽孢杆菌的分离纯化从11只大熊猫粪便样品中共分离获得了90株菌株,大多数细菌在LB固体培养基上呈现出菌落边缘不规则,表面有褶皱等典型的芽孢杆菌菌落特征,少数菌株菌落形状规则,表面光滑;菌落的颜色多为白色,少数为乳黄色,无色素产生。进一步显微镜观察结果表明,菌株的菌体形态主要为杆状,且都能产生芽孢(图 1),表明所分离获得的菌株均为芽孢杆菌。而不同年龄大熊猫粪便中分离得到的芽孢杆菌数量有明显差异,数量分布的总体趋势为成年>亚成年>老年,其中从成年大熊猫格格(G)中分离出的芽孢杆菌数量最多(图 2)。

|
| 图 1 菌株在固体培养基上及显微镜下形态 Figure 1 Morphological characteristics of isolates Note: A1, A2: Strain T-3; B1, B2: Strain D-5; C1, C2: Strain SW-4. |
|
|
|
| 图 2 不同年龄大熊猫肠道中芽孢杆菌数量 Figure 2 The number of Bacillus sp. isolated from giant panda gut of different ages Note: W: Wuwen; S: Susan; X: Xianglin; M: Meiqian; T: Taishan; G: Gege; E: Pengpeng; D: Daili; Z: Zixia; Y: Yaoyuan; P: Panpan. The same below. |
|
|
采用BOXA1R引物对供试菌株全基因组进行扩增,扩增的多态性条带均大于500 bp。90株菌的基因组被扩增出10条DNA条带,共有15种图谱类型。绝大部分菌株扩增条带的数目和大小均不同,说明大熊猫肠道芽孢杆菌存在明显的遗传多样性。通过UPGMA法对扩增片段进行聚类分析生成树状图谱(图 3)。由图 3可见,供试菌株在59%的相似性上聚在一起,在73%的相似水平上分成了8个遗传类型,菌株P-18单独成群,在8个遗传群上,群Ⅲ最大,有36株菌,其次为群Ⅰ和群Ⅳ,都有15株菌;此外,群Ⅶ仅包含从成年大熊猫肠道分离的芽孢杆菌,而从老年大熊猫肠道中获得的芽孢杆菌大多归属于群Ⅲ,从亚成体大熊猫肠道中获得的芽孢杆菌大多归属于群Ⅱ。结果表明,大熊猫肠道芽孢杆菌具有丰富的多样性,其遗传特性与大熊猫年龄有关。

|
| 图 3 不同年龄大熊猫肠道芽孢杆菌聚类分析 Figure 3 Cluster analysis of strains isolated from giant panda gut in different ages |
|
|
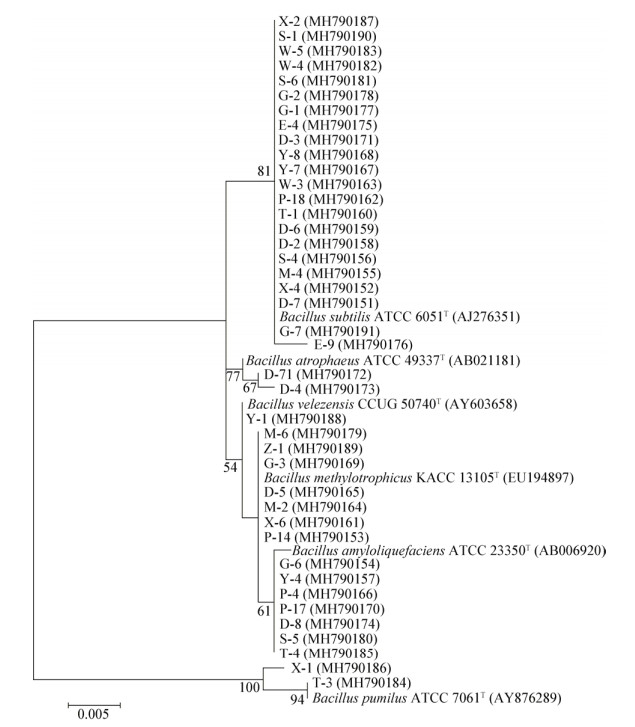
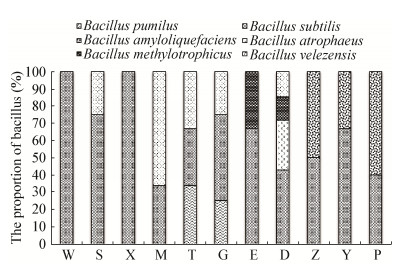
基于BOXA1R-PCR遗传图谱,从8个遗传群中选择41株代表菌株进行16S rRNA基因测序分析,测序结果在GenBank中用BLAST进行同源比对,选取相似性最高的序列构建系统发育树(图 4)。由系统发育树可知41株芽孢杆菌归属于6个种,分别是枯草芽孢杆菌(B. subtilis)、萎缩芽孢杆菌(B. atrophaeus)、贝莱斯芽孢杆菌(B. velezensis)、甲基营养型芽孢杆菌(B. methylotrophicus)、解淀粉芽孢杆菌(B. amyloliquefaciens)和短小芽孢杆菌(B. pumilus)。从不同类群芽孢杆菌在不同年龄大熊猫肠道分布情况来年,亚成年大熊猫(W、S)肠道共分离获得2种芽孢杆菌,成年大熊猫(X、M、T、G、E、D)肠道共获得5种芽孢杆菌,老年大熊猫(Z、Y、P)肠道共获得2种芽孢杆菌(图 5),其中枯草芽孢杆菌(B. subtilis)在所有样品中都有分布,短小芽孢杆菌(B. pumilus)、萎缩芽孢杆菌(B. atrophaeus)、甲基营养型芽孢杆菌(B. methylotrophicus)只在成年大熊猫样品中分离得到,而解淀粉芽孢杆菌(B. amyloliquefaciens)仅在老年大熊猫样品中分离得到。以上结果表明,不同年龄阶段的大熊猫肠道内的芽孢杆菌的多样性及种群组成具有较大的差异,成年大熊猫肠道中芽孢杆菌类群最丰富,而相较于成年大熊猫,亚成年和老年大熊猫肠道内的芽孢杆菌种类则较为单一。
|
| 图 4 基于邻近法构建芽孢杆菌16S rRNA基因序列系统发育树 Figure 4 Phylogenetic neighbor-joining tree based on 16S rRNA gene sequences of isolates 注:菌株名称后为标准菌株保藏中心,括号内为基因库中比对最相似序列登录号;菌株编号后括号内为分离得到的菌株在基因库中的登录号. Note: After the name of strain is the microbiological culture collection center of standard strain, in parentheses is the closest relative sequence in GenBank, after the number of strain in parentheses is the sequence of band in GenBank. |
|
|
|
| 图 5 不同种芽孢杆菌在不同年龄大熊猫肠道中的分布 Figure 5 The distribution of Bacillus genera in giant panda gut of different ages |
|
|
运用CANOCO软件对不同大熊猫肠道芽孢杆菌种群进行主成分分析,提取2个主成分因子作载荷图,结果如图 6所示。成分1和成分2分别解释了39.35%和28.93%的变量,各年龄段样品明显分散在不同区域。分属成年、亚成年和老年的各大熊猫样品都能较好地聚在一起,说明样品组内之间的相似性较高,但样品戴立(D)与所有样品的距离都较远,说明该品样与其它样品的差异性较大。主成分分析结果表明,大熊猫肠道内的芽孢杆菌在大熊猫不同成长阶段存在差异,亚成年、成年和老年大熊猫肠道中的芽孢杆菌类群组间差异明显,但不同年龄阶段大熊猫肠道中的芽孢杆菌类群组内的相似性较高。
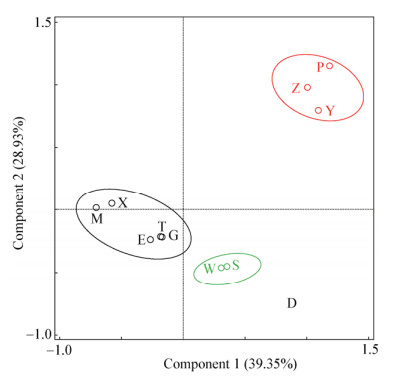
|
| 图 6 大熊猫肠道芽孢杆菌分布的主成分分析 Figure 6 Principal components analysis (PCA) of Bacillus communities in the gut of pandas |
|
|
41株供试菌株均能在刚红果培养基上形成透明圈,表明所有供试菌株都具有降解纤维素的潜力。分析发现,分离自成年大熊猫肠道菌株的纤维素水解能力普遍高于亚成年和老年大熊猫,说明年龄对菌株的功能有一定的影响(表 2)。
| 菌株编号 Strain No. |
抑菌圈直径 Inhibition zone diameter (d, mm) |
水解圈直径 Hydrolytic circle diameter (d, mm) |
||||
| 1 | 2 | 3 | 4 | 5 | ||
| X-1 | − | − | − | − | − | 7.3 |
| X-2 | 7.1 | − | − | − | − | 9.5 |
| X-4 | 9.2 | − | 5.5 | 6.3 | − | 6.1 |
| X-6 | − | − | − | − | − | 5.9 |
| Y-1 | 8.5 | − | − | 9.7 | − | 7.1 |
| Y-4 | 5.9 | − | 8.1 | 8.5 | − | 6.3 |
| Y-7 | 7.8 | − | − | − | − | 6.2 |
| Y-8 | 6.9 | − | − | − | − | 6.6 |
| D-1 | 8.4 | − | − | − | − | 9.8 |
| D-2 | 11.333 | − | 8.6 | 6.1 | − | 8.4 |
| D-3 | 8.2 | − | 5.3 | 9.2 | − | 13.6 |
| D-4 | 7.6 | − | − | − | − | 12.6 |
| D-5 | 8.1 | − | 9.2 | − | − | 8.4 |
| D-6 | 8.3 | − | 9.7 | 7.3 | − | 11.2 |
| D-7 | 12.4 | − | 9.3 | 6.9 | − | 15.6 |
| D-8 | 7.8 | − | − | 6.6 | − | 8.9 |
| E-4 | − | − | − | − | − | 17.4 |
| E-9 | 9.2 | − | − | − | − | 15.4 |
| G-1 | 6.5 | − | − | − | − | 9.1 |
| G-2 | 7.3 | − | − | − | − | 15.3 |
| G-3 | 8.6 | − | − | − | − | 12.5 |
| G-6 | 11.3 | − | − | − | − | 15.4 |
| G-7 | 10.1 | − | − | − | − | 8.5 |
| M-2 | 7.5 | − | − | 7.1 | − | 1.6 |
| M-4 | − | − | 77.9 | − | − | 8.8 |
| M-6 | − | − | − | − | − | 7.6 |
| P-4 | 8.6 | − | 8.3 | 9.6 | − | 5.1 |
| P-14 | 7.2 | − | − | 12.7 | − | 9.3 |
| P-17 | 8.8 | − | − | − | − | 9.2 |
| P-18 | 8.0 | − | − | 10.8 | − | 8.4 |
| S-1 | 6.9 | − | − | − | − | 4.6 |
| S-4 | 6.8 | − | − | 7.2 | − | 5.8 |
| S-5 | 8.0 | − | − | 13.9 | − | 6.5 |
| S-6 | − | − | − | − | − | 6.3 |
| SW-3 | 7.9 | − | 6.8 | − | 7.9 | |
| SW-4 | 11.9 | − | − | − | − | 9.7 |
| SW-5 | 9.4 | − | − | − | − | 7.3 |
| T-1 | 9.7 | − | − | − | − | 10.2 |
| T-3 | 5.6 | − | − | − | − | 15.6 |
| T-4 | 8.4 | − | 7.4 | 9.6 | − | 13.7 |
| Z-1 | 6.6 | − | − | 7.3 | − | 7.9 |
| 注:1:金色葡萄球菌;2:肠球菌;3:沙门氏菌;4:大肠杆菌;5:肺炎球菌. +:有活性;−:无活性. Note: 1: Staphylococcus aureus; 2: Enterococcus sp.; 3: Salmonella sp.; 4: Escherichia coli; 5: Klebsiella pneumonia. +: Activated; −: No activated. | ||||||
抑菌试验结果显示,所有供试菌株均不能抑制肠球菌和肺炎克雷伯氏菌的生长,但有83.37% (35株菌)的菌株能抑制金色葡萄球菌的生长,26.83% (11株菌)的菌株能抑制沙门氏菌的生长,39.02% (16株菌)的菌株能抑制大肠杆菌的生长(表 3)。其中,菌株X-4、Y-4、D-2、D-3、D-6、D-7、P-4、SW-3和T-4对金色葡萄球菌、沙门氏菌以及大肠杆菌均有抑菌效果,表现出较好的抗菌潜力。
| 属/种 Genus/Species |
菌株 Strain |
头孢唑林 CFZ |
丁胺卡那 AMK |
庆大霉素 GEN |
氯霉素 CHL |
红霉素 ERY |
氨苄西林 AMP |
青霉素 G |
复方新诺明 SMZ |
诺氟沙星 NOR |
环丙沙星 CIP |
| Bacillus amyloliquefaciens | G-6 | S | S | S | S | S | S | R | S | S | S |
| Y-4 | S | S | S | S | S | I | R | S | S | S | |
| P-4 | S | S | S | S | S | I | R | S | S | S | |
| P-17 | S | S | S | S | S | S | R | S | S | S | |
| D-8 | S | S | S | S | S | R | R | S | S | S | |
| S-5 | S | S | S | S | S | S | S | S | S | S | |
| T-4 | S | S | S | S | S | S | S | S | S | S | |
| Bacillus atrophaeus | D-1 | S | S | S | S | S | S | R | S | S | S |
| D-4 | S | S | S | S | S | S | S | S | S | S | |
| Bacillus methylotrophicus | D-5 | S | S | S | S | S | R | R | S | S | S |
| G-3 | S | S | S | S | S | S | S | S | S | S | |
| M-2 | S | S | S | S | S | R | R | S | S | S | |
| M-6 | S | S | S | S | S | S | R | S | S | S | |
| P-14 | S | S | S | S | S | S | R | S | S | S | |
| X-6 | S | S | S | S | S | S | R | S | S | S | |
| Z-1 | S | S | S | S | S | R | R | S | S | S | |
| Bacillus pumilus | T-3 | I | S | S | S | S | S | R | R | R | I |
| X-1 | S | S | S | S | S | I | R | S | S | S | |
| Bacillus subtilis | D-2 | S | S | S | S | S | R | R | S | S | S |
| D-3 | S | S | S | S | S | R | R | S | S | S | |
| D-6 | S | S | S | S | S | R | R | S | S | S | |
| D-7 | S | S | S | S | S | S | R | S | S | S | |
| E-4 | S | S | S | S | S | R | R | S | S | S | |
| E-9 | S | S | S | S | S | R | R | S | S | S | |
| G-1 | S | S | S | S | S | S | R | S | S | S | |
| G-2 | S | S | S | S | S | S | R | S | S | S | |
| G-7 | S | S | S | S | S | R | R | S | S | S | |
| M-4 | S | S | S | S | S | S | R | S | S | S | |
| P-18 | S | S | S | S | S | S | R | S | S | S | |
| S-1 | S | S | S | S | S | S | S | S | S | S | |
| S-4 | S | S | S | S | S | S | R | S | S | S | |
| S-6 | S | S | S | S | S | R | R | S | S | S | |
| W-3 | S | S | S | S | S | R | R | S | S | S | |
| W-4 | S | S | S | S | S | R | R | S | S | S | |
| W-5 | S | S | S | S | S | R | R | S | S | S | |
| T-1 | S | S | S | S | S | R | R | S | S | S | |
| X-2 | S | S | S | S | S | S | S | S | S | S | |
| X-4 | S | S | S | S | S | R | R | S | S | S | |
| Y-7 | S | S | S | S | S | R | R | S | S | S | |
| Y-8 | S | S | S | S | S | S | R | S | S | S | |
| Bacillus velezensis | Y-1 | S | S | S | S | S | R | R | S | S | S |
| 注:S:敏感;I:中度敏感;R:抗性. Note: S: Susceptible; I: Intermediate; R: Resistance. | |||||||||||
根据NCCLS(2011)标准对敏感或耐药的判断标准,所有供试菌株对丁胺卡那、庆大霉素、氯霉素、红霉素敏感,大部分菌株对头孢唑林、方新诺明、诺氟沙星、环丙沙星敏感,而几乎全部菌株对青霉素耐药,对氨苄西林表现出不同的药敏性。此外,从同一大熊猫粪便中分离获得的同一种芽孢杆菌对同一类抗生素的敏感性存在差异,如从戴立(D)样品中分离获得的菌株D6和D7同属枯草芽孢杆菌(B. subtilis),菌株D6对氨苄西林表现为抗性,菌株D7对氨苄西林表现为敏感;而从不同大熊猫粪便中获得的同种芽孢杆菌的抗性又存在相似性,如分离自大熊猫苏珊(S)和香林(X)粪便的枯草芽孢杆菌菌株S1和X2均对所有的供试抗生素敏感,说明不同菌株对各抗生素的抗性存在个体差异。
3 讨论芽孢杆菌具较强的抑菌和增加动物免疫力的作用,可被制成粉末作为动物的饲料添加剂即益生菌制剂,以调节肠道内微生物类群的平衡,抵抗病原菌的侵袭,从而对治疗动物肠道疾病有一定的效果,是一类很有潜力和应用前景的功能菌。基于肠道中芽孢杆菌对肠道健康的重要作用,对大熊猫肠道芽孢杆菌分离及益生特性的研究已受到越来越多学者的关注。周潇潇等从20份成年大熊猫粪便中分离获得7株芽孢杆菌,均具有纤维素降解活性,大多数菌株对病原菌表现出良好的抗菌活性,经鉴定这些菌株分别为枯草芽孢杆菌(B. subtilis)、短小芽孢杆菌(B. pumilus)和蜡样芽孢杆菌(B. cereus)[6];李进等对分离自大熊猫粪便的芽孢杆菌种类、纤维素分解能力、抗菌和对抗生素药敏性分析结果表明,分离获得的菌株均对纤维素具有降解潜力,对常用抗生菌耐受性低[15];樊程等从大熊猫粪便中分离获得了一株具有纤维素降解活性的解淀粉芽孢杆菌(B. amyloliquefaciens)[5]。综上,目前已报道的大熊猫肠道中可培养的芽孢杆菌类群主要有蜡样芽孢杆菌(B. cereus)、解淀粉芽孢杆菌(B. amyloliquefaciens)、多粘芽孢杆菌(B. polymyxa)、枯草芽孢杆菌(B. subtilis)、短小芽孢杆菌(B. pumilus)。本研究从11只大熊猫的粪便中共分离获得90株芽孢杆菌,经鉴定这些菌株分属于枯草芽孢杆菌(B. subtilis)、萎缩芽孢杆菌(B. atrophaeus)、贝莱斯芽孢杆菌(B. velezensis)、甲基营养型芽孢杆菌(B. methylotrophicus)、解淀粉芽孢杆菌(B. amyloliquefaciens)和短小芽孢杆菌(B. pumilus)。其中,短小芽孢杆菌(B. pumilus)、萎缩芽孢杆菌(B. atrophaeus)、甲基营养型芽孢杆菌(B. methylotrophicus)只在成年大熊猫粪便样品中分离得到,而萎缩芽孢杆菌(B. atrophaeus)、甲基营养型芽孢杆菌(B. methylotrophicus)和贝莱斯芽孢杆菌(B. velezensis)为首次从大熊猫肠道中分离获得。此外,本研究所获得的所有代表菌株均具有纤维素降解潜力,对动物健康具有较大危害的几种病原微生物也表现出较好的抑制菌效果,除了对青霉素表现出较强的耐菌性外,供试菌株对常用的抗生素都很敏感,可能是由于近年来治疗圈养大熊猫相关疾病时常用青霉素所致。
动物肠道是动物体内最大的微生态环境,通常有稳定的微生态,然而,随着宿主的生长发育及外界因素的影响,肠道微生物菌群也会发生动态变化。大量的研究表明,宿主的年龄是影响肠道菌群组成的重要因素之一[16]。简平等在川金丝猴肠道菌群的研究中发现其肠道中微生物随年龄增长,生物群落的多样性呈现先增加后减少的趋势[17]。对大熊猫肠道微生物菌群多样性研究表明大熊猫的肠道菌群多样性与年龄因素有关。崔明全等对圈养大熊猫粪便菌群多样性进行分析发现,随着成长阶段的变化呈现出先增加后降低[18];王晓艳发现成年大熊猫肠道菌群的多样性大于老年大熊猫[2];李静等对不同年龄、不同性别大熊猫肠道放线菌多样性及群落结构的研究结果表明,大熊猫肠道放线菌菌群结构与组成受年龄和性别的双重影响[19]。而作为大熊猫肠道菌群重要组成部分的芽孢杆菌[20],是否也存在相似的变化?本研究结果表明,不同年龄阶段大熊猫肠道中的芽孢杆菌种类存在较明显的差异,从成年大熊猫肠道中获得了枯草芽孢杆菌(B. subtilis)、萎缩芽孢杆菌(B. atrophaeus)、贝莱斯芽孢杆菌(B. velezensis)、甲基营养型芽孢杆菌(B. methylotrophicus)和短小芽孢杆菌(B. pumilus) 5种芽孢杆菌,类群最丰富,亚成年、老年大熊猫肠道中的芽孢杆菌类群组成相对单一,揭示了随着年龄的增长,大熊猫肠道芽孢杆菌的多样性呈现出亚成年大熊猫肠道中较少、成年大熊猫肠道中芽孢杆菌的多样性逐渐增加、到了老年其肠道中芽孢杆菌的多样性又减少的变化规律,说明大熊猫肠道内芽孢杆菌的种群组成存在明显的年龄差异。然而,由于纯培养技术的局限性以及肠道微生物难培养的特殊性,要全面了解大熊猫肠道中芽孢杆菌的分布与年龄的相关性,后续研究还应该采用免培养技术手段。
本研究结果不仅丰富了大熊猫肠道芽孢杆菌的种类,而且帮助我们进一步了解大熊猫肠道芽孢杆菌类群组成与年龄的相关性,为后续大熊猫肠道有益微生物菌剂的开发提供了理论依据和丰富的菌种资源。
| [1] |
Xue ZS, Zhang WP, Wang LH, et al. The bamboo-eating giant panda harbors a carnivore-like gut microbiota, with excessive seasonal variations[J]. mBio, 2015, 6(3): e00022-15. |
| [2] |
Wang XY. Analyze the intestinal flora of adult and elderly Panda by 16S rDAN-RFLP technology[D]. Ya'an: Master's Thesis of Sichuan Agricultural University, 2013 (in Chinese) 王晓艳.成年与老年大熊猫肠道菌群16S rDNA-RFLP技术分析[D].雅安: 四川农业大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10626-1014102951.htm |
| [3] |
Tan Z, Bao N, Lai Y, et al. The study on the normal intestinal microflora of the giant panda returned to wild and the giant panda in captivity[J]. Journal of Sichuan University (Natural Science Edition), 2004, 41(6): 1276-1279. (in Chinese) 谭志, 鲍楠, 赖翼, 等. 野外放归大熊猫和圈养大熊猫肠道正常菌群的研究[J]. 四川大学学报:自然科学版, 2004, 41(6): 1276-1279. |
| [4] |
Guo XH, Zhao ZD. Research progress on the application and mechanisms of Bacilli-derived probiotics[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(2): 27-31. (in Chinese) 郭小华, 赵志丹. 饲用益生芽孢杆菌的应用及其作用机理的研究进展[J]. 中国畜牧兽医, 2010, 37(2): 27-31. |
| [5] |
Fan C, Li SJ, Li CL, et al. Isolation, identification and cellulase production of a cellulolytic bacterium from intestines of giant panda[J]. Acta Microbiologica Sinica, 2012, 52(9): 1113-1121. (in Chinese) 樊程, 李双江, 李成磊, 等. 大熊猫肠道纤维素分解菌的分离鉴定及产酶性质[J]. 微生物学报, 2012, 52(9): 1113-1121. |
| [6] |
Zhou XX, He TM, Peng GN, et al. Isolation, identification and resistance analysis of 7 Bacillus strains from the intestinal tract of giant panda[J]. Chinese Veterinary Science, 2013, 43(11): 1115-1121. (in Chinese) 周潇潇, 何廷美, 彭广能, 等. 大熊猫肠道芽孢杆菌的分离鉴定及其抗逆性研究[J]. 中国兽医科学, 2013, 43(11): 1115-1121. |
| [7] |
Zhao B. Microbiology[M]. 2nd ed. Beijing: Science Press, 2014. (in Chinese) 赵斌. 微生物学实验[M]. 2版. 北京: 科学出版社, 2014. |
| [8] |
Liao YH, Ren WY, Sun BG, et al. Extraction of Bacillus cereus DNA in vinegar and the establishment of ERIC-PCR system[J]. Journal of Chinese Institute of Food Science and Technology, 2011, 11(4): 7-13. (in Chinese) 廖永红, 任文雅, 孙宝国, 等. 米醋中蜡状芽孢杆菌DNA提取及其ERIC-PCR体系建立[J]. 中国食品学报, 2011, 11(4): 7-13. DOI:10.3969/j.issn.1009-7848.2011.04.002 |
| [9] |
Gevers D, Huys G, Swings J. Applicability of rep-PCR fingerprinting for identification of Lactobacillus species[J]. FEMS Microbiology Letters, 2001, 205(1): 31-36. DOI:10.1111/j.1574-6968.2001.tb10921.x |
| [10] |
Gao JL, Terefework Z, Chen WX, et al. Genetic diversity of rhizobia isolated from Astragalus adsurgens growing in different geographical regions of China[J]. Journal of Biotechnology, 2001, 91(2/3): 155-168. |
| [11] |
Tamura K, Stecher G, Peterson D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 |
| [12] |
Šmilauer P, Lepš J. Multivariate Analysis of Ecological Data Using CANOCO 5[M]. 2nd ed. Cambridge: Cambridge University Press, 2014: 5.
|
| [13] |
Yang YL, Zhao C, Liao P, et al. Diversity and antimicrobial activity of endophytic actinobacteria from Glycyrrhizain flata Bat.[J]. Microbiology China, 2016, 43(10): 2138-2147. (in Chinese) 杨雅琳, 赵翀, 廖萍, 等. 塔里木盆地胀果甘草内生放线菌多样性及抗菌活性分析[J]. 微生物学通报, 2016, 43(10): 2138-2147. |
| [14] |
Li J, Zhang HN, Zhao C. Isolation and screening of cellulose decomposing microbe and the straw decomposing effect of complex microbial system[J]. Chinese Journal of Applied and Environmental Biology, 2016, 22(4): 689-696. (in Chinese) 李静, 张瀚能, 赵翀, 等. 高效纤维素降解菌分离筛选、复合菌系构建及秸秆降解效果分析[J]. 应用与环境生物学报, 2016, 22(4): 689-696. |
| [15] |
Li J, Zhong ZJ, Su HY, et al. Isolation, identification and partial biology research of Bacillus in giant panda intestines[J]. Microbiology China, 2016, 43(2): 351-359. (in Chinese) 李进, 钟志军, 苏怀益, 等. 大熊猫肠道芽孢杆菌的分离鉴定及部分生物学特性[J]. 微生物学通报, 2016, 43(2): 351-359. |
| [16] |
Yatsunenko T, Rey FE, Manary MJ, et al. Human gut microbiome viewed across age and geography[J]. Nature, 2012, 486(7402): 222-227. DOI:10.1038/nature11053 |
| [17] |
Jian P, Wang Q, Wang J, et al. Difference analysis of gut microbiome of Rhinopithecus roxellana in different ages[J]. Chinese Journal of Animal Nutrition, 2015, 27(4): 1302-1309. (in Chinese) 简平, 王强, 王剑, 等. 不同年龄段川金丝猴肠道菌群结构差异分析[J]. 动物营养学报, 2015, 27(4): 1302-1309. DOI:10.3969/j.issn.1006-267x.2015.04.037 |
| [18] |
Cui MQ, He TM, Zhong ZJ, et al. Analysis of characteristics of faecal flora pandas by ERIC-PCR fingerprinting and identification of the dominant flora[J]. Animal Husbandry & Veterinary Medicine, 2013, 45(9): 6-11. (in Chinese) 崔明全, 何廷美, 钟志军, 等. 大熊猫粪便菌群ERIC-PCR指纹图谱的分析及优势菌群的鉴定[J]. 畜牧与兽医, 2013, 45(9): 6-11. |
| [19] |
Li J, Zhang JY, Zhang Q, et al. Diversity and community structure of gut actinobacteria of giant panda[J]. Microbiology China, 2017, 44(5): 1138-1148. (in Chinese) 李静, 张金羽, 张琪, 等. 大熊猫肠道放线菌的种群组成及多样性分析[J]. 微生物学通报, 2017, 44(5): 1138-1148. |
| [20] |
Zhu LF, Wu Q, Dai JY, et al. Evidence of cellulose metabolism by the giant panda gut microbiome[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(43): 17714-17719. DOI:10.1073/pnas.1017956108 |
 2019, Vol. 46
2019, Vol. 46