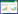扩展功能
文章信息
- 李欣, 钟永亮, 刘云宏, 张敏, 景浩楠, 马营超, 熊先烺, 庞新跃
- LI Xin, ZHONG Yong-Liang, LIU Yun-Hong, ZHANG Min, JING Hao-Nan, MA Ying-Chao, XIONG Xian-Lang, PANG Xin-Yue
- 胱氨酸/半胱氨酸调控活性氧代谢影响大肠杆菌耐药性
- Impact of cystine/cysteine on drug resistance of Escherichia coli by regulating ROS metabolisms
- 微生物学通报, 2019, 46(10): 2710-2718
- Microbiology China, 2019, 46(10): 2710-2718
-
文章历史
- 收稿日期: 2018-11-09
- 接受日期: 2019-03-15
- 网络首发日期: 2019-04-24
2. 河南科技大学微生物资源开发与利用重点实验室 河南 洛阳 471023;
3. 中国科学院沙漠与沙漠化重点实验室 甘肃 兰州 730000;
4. 河南科技大学医学技术与工程学院 河南 洛阳 471023
2. Key Laboratory of Microbial Resources Exploitation and Utilization, Henan University of Science and Technology, Luoyang, Henan 471023, China;
3. Key Laboratory of Desert and Desertification, Chinese Academy of Sciences, Lanzhou, Gansu 730000, China;
4. College of Medical Technology and Engineering, Henan University of Science and Technology, Luoyang, Henan 471023, China
抗生素在临床的广泛应用大大降低了人类和动物的细菌感染性疾病发病率和死亡率,但由于抗生素的不规范使用和过度使用,抗生素耐药性出现的速度越来越快,感染的预防和控制越来越难[1]。细菌耐药性的产生被称为21世纪危害人类健康的最主要问题之一[2]。
在贫硫环境中生长细菌的培养液中加入富硫的硫源胱氨酸(CySS)时,细胞将快速摄入大量的CySS,并将其还原为半胱氨酸(Cys),胞内的Cys库快速上升。Cys存在时可与铁离子协同,游离的Fe2+催化电子从Cys转移到H2O2,循环发生氧化还原反应并连续催化·OH的形成,从而造成细胞损伤[3]。已有的研究显示,大肠杆菌在被暴露于毫摩尔级浓度H2O2达15 min后仍有70%可存活[4]。但是,胞内Cys水平上升时,细胞变得对外部H2O2杀伤非常敏感:1 min内存活率下降至低于0.1%[3]。抗生素诱导细菌死亡途径中有可能存在由活性氧介导的共通反应机制[5-6]。Cys对活性氧的调控,将使细胞持续产生大量·OH,直接杀伤细胞[7-9];或是短暂产生少量·OH,使细菌通过造成自身的损伤完成遗传物质转移,潜在的可动遗传因子激活,或者自身DNA突变,从而逃避抗生素的抑杀,即形成耐药性[8, 10]。
由此可见,Cys在细菌耐药机制中很可能起到至关重要的作用。本实验采用贫硫培养基给细胞创造一个硫受限的生长环境,并通过在培养基中加入CySS来提高胞内的Cys水平。在用抗生素或H2O2对细胞造成损伤的过程中,不同浓度CySS处理引起胞内Cys库的变化体现在大肠杆菌对H2O2耐药性的影响。本研究对细菌Cys转运系统及其调控耐药性机制的研究将有助于我们理解细菌如何通过最基本的营养元素、利用简单氧化还原反应来应对环境胁迫。硫源的控制也许能够为我们寻找新的抗生素有效作用方式提供新的策略。
1 材料与方法 1.1 材料 1.1.1 菌株实验所用大肠杆菌野生型菌株MG1655、突变型菌株SSk226 (MG1655 alaE::kan)由美国伊利诺伊大学微生物系James A. Imlay教授馈赠。将冻存的大肠杆菌接种至LB液体培养基,37 ℃恒温培养过夜。
LB培养基(g/L):蛋白胨10.0,酵母粉5.0,氯化钠10.0,琼脂16.0;
MinA培养基(100 mL):MinA salts (K2HPO4 10.5 g,KH2PO4 4.5 g,(NH4)2SO4 1.0 g,柠檬酸钠0.5 g),10% MgSO4 0.2 mL,20%葡萄糖1 mL,50 mmol/L吲哚乙醇1 mL,0.5 g/L维生素B1 1 mL,1.6%琼脂。
1.1.2 主要试剂和仪器国产硫酸庆大霉素、诺氟沙星、氨苄青霉素、过氧化氢、CySS等试剂均购自生工生物工程(上海)股份有限公司。冷冻离心机,湖南湘仪离心机仪器有限公司;分光光度计,上海仪电科学仪器股份有限公司;RT-qPCR仪,Bio-Rad公司;LC-MS,Waters公司。
1.2 方法 1.2.1 抗生素处理琼脂扩散法(抑菌圈法):实验菌株在MinA液体培养基中37 ℃、150 r/min预培养过夜至浑浊,取200 μL菌液涂布于MinA固体平板,滤纸片上的加药量为30 μL。37 ℃恒温培养16−18 h,测量抑菌圈大小。
系列稀释法(液体法):将预培养过夜的菌液稀释至OD600=0.15,加入不同浓度的抗生素(硫酸庆大霉素:0.5、1.0、2.0 μg/mL;诺氟沙星:0.05、0.10、0.20、0.25 μg/mL;氨苄青霉素:0.5、1.0、2.0 μg/mL)或CySS,37 ℃恒温培养16−18 h,600 nm检测菌液的吸光值。
1.2.2 过氧化氢处理参照1.2.1中抗生素处理的方法,将H2O2加入滤纸片或液体培养的菌液中,抑菌圈法中,所用浓度为1 mol/L,液体法中所用浓度为2.5 mmol/L。
1.2.3 胱氨酸处理参照1.2.1中抗生素处理的方法,在待测的滤纸片或液体培养的菌液中加入不同浓度的CySS,处理5 min后加入不同浓度的抗生素或H2O2,37 ℃恒温培养16−18 h,测定抑菌圈直径或菌液600 nm的吸光值。抑菌圈法中CySS终浓度为:5、10、20 mmol/L;液体法中CySS终浓度为0.5、1.0、2.0 mmol/L。
1.2.4 转录组测序及基因表达水平分析贫硫环境中生长的菌细胞(对数期OD600为0.3−0.5),外加0.5 mmol/L CySS处理5 min。采用热苯酚抽提法分离RNA,使用Qiagen的RNA柱进行纯化。采用Illumina Hiseq测序平台的双端测序模式对CySS处理后及未处理对照样本进行高通量测序。在RNA-Seq分析中,可以通过定位到基因组区域测序序列(Reads)的计数来估计基因的表达水平,为了使不同基因、不同实验间估计的基因表达水平具有可比性,引入了RPKM (Reads per kilo bases per million reads)的概念,RPKM同时考虑了测序深度和基因长度对Reads计数的影响,是目前常用的基因表达水平估算方法[11]:

|
用RT-qRCR方法对目标基因的表达进行验证。取1.5 μg总RNA (与RNA-Seq建库时相同),用M-MLV逆转录酶合成cDNA第一链做模板(稀释10×),以2×SYBR-Green I作为荧光标记物,以tus作为内标基因进行PCR反应。PCR反应体系(20 µL):2×TransStart® Green qPCR SuperMix 10 µL,10 µmol/L引物1、2各0.4 µL;cDNA 0.5 µL,ddH2O 8.7 µL。引物信息:AlaE-F:5′-ATCAGATTAT GGCGGCGGTCAG-3′;AlaE-R:5′-AAACAGTCGG CGGCAATA-3′。PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,55−60 ℃ 20 s,72 ℃ 20 s;95 ℃ 15 s,55−60 ℃ 1 min,72 ℃ 15 s,40个循环。每个PCR反应3个平行。用2–∆∆CT公式计算基因的相对表达量[12],3次实验的平均标准差以误差棒表示。
1.2.5 外泌硫醇检测在硫酸盐培养基中预培养过夜的菌液稀释至OD600为0.01,然后在相同培养基中生长至OD600为0.2。菌液于4 500 r/min离心10 min后弃上清,将菌体沉淀重悬于37 ℃新鲜培养基中,培养基含0.2 mmol/L EDTA以抑制外泌硫醇的自氧化。加入0.5 mmol/L L-CySS后,在不同时间点取菌液用0.22 µm微孔滤膜过滤,0.5 mL滤液立刻与0.5 mL含0.3 mmol/L DTNB溶液的培养基混匀。硫醇化合物与DTNB反应,释放出的2-氮-5-硫代苯甲酸在412 nm的消光系数为13 L/(mmol·cm)[13]。
1.2.6 LC-MS分析为鉴定给予CySS的细胞外泌有机硫醇化合物,按1.2.5的方法培养并处理野生型菌株MG1655,用含EDTA的新鲜硫酸盐培养基重悬。加入L-CySS 5 min立刻收集样品,未加CySS为对照。过滤后在滤液中加入磺基水杨酸(终浓度0.5%)以抑制硫醇氧化,冻于干冰上,采用LC-MS进行样品有机硫醇定量检测。Cys标准品按相同方法准备[14]。
1.3 统计学分析用SPSS17 (SPSS Inc.,Chicago,IL)进行统计学分析。CySS及抗生素不同浓度组间由单因素方差分析(one-way ANOVA)及最小显著性差异法[post hoc (LSD) tests]进行差异显著性分析。P < 0.05和P < 0.01时具有显著和极显著的统计学意义。
2 结果与分析 2.1 胱氨酸对大肠杆菌抗生素及氧化损伤敏感性的影响图 1结果显示,与空白对照相同,5、10、20 mmol/L的CySS都未表现出抑菌效果(图 1A中C2−C4);当CySS与抗生素诺氟沙星(Nor)处理大肠杆菌细胞后,菌细胞对Nor的敏感性变化具有统计学意义;5 mmol/L的CySS使大肠杆菌对Nor的敏感性显著降低,抑菌圈的直径显著缩小(P < 0.05,P=0.036;图 1A中N2);CySS的浓度提高至10 mmol/L则使大肠杆菌对Nor的敏感性显著升高,抑菌圈直径显著增大(P=0.014 < 0.05;图 1A中N3,图 1B);20 mmol/L的CySS使大肠杆菌对Nor的敏感性极显著的升高,抑菌圈直径极显著增大(P < 0.01;图 1A中N4)。

|
| 图 1 胱氨酸对大肠杆菌MG1655的诺氟沙星和H2O2敏感性的影响 Figure 1 Effect of cystine on the sensitivity of Nor and H2O2 in E. coli strain MG1655 注:A:抑菌圈照片;B:抑菌圈直径柱状图.图A中部分抑菌圈形状不规则,图B为作者采用多点测量,取直径的平均值. C1:Control,等体积缓冲液的空白对照;C2:5 mmol/L的CySS处理;C3:10 mmol/L的CySS处理;C4:20 mmol/L的CySS处理. N1:25 μg/mL Nor;N2:5 mmol/L CySS加25 μg/mL Nor处理;N3:10 mmol/L CySS加25 μg/mL Nor处理;N4:20 mmol/L CySS加25 μg/mL Nor处理. H1:1 mmol/L H2O2处理;H2:5 mmol/L CySS加1 mmol/L H2O2处理;H3:10 mmol/L CySS加1 mmol/L H2O2处理;H4:20 mmol/L CySS加1 mmol/L H2O2处理. Note: A: Pictures of inhibition zone; B: Column Chart of inhibition zone diameters. The data showed in B was averaged from multi-point measurement of irregularly-shaped inhibition zone. C1: Control, control of equal column buffer; C2: 5 mmol/L CySS; C3: 10 mmol/L CySS; C4: 20 mmol/L CySS. N1: 25 μg/mL Nor; N2: 5 mmol/L CySS plus 25 μg/mL Nor; N3: 10 mmol/L CySS plus 25 μg/mL Nor; N4: 20 mmol/L CySS plus 25 μg/mL Nor.H1: 1 mmol/L H2O2; H2: 5 mmol/L CySS plus 1 mmol/L H2O2; H3: 10 mmol/L CySS plus 1 mmol/L H2O2; H4: 20 mmol/L CySS plus 1 mmol/L H2O2. |
|
|
类似地,5 mmol/L的CySS同样显著降低了大肠杆菌对外源H2O2氧化损伤的敏感性(P=0.042 < 0.05;图 1A中C2,图 1B),CySS的浓度提高至10 mmol/L对H2O2氧化损伤的敏感性影响没有统计学意义(P > 0.05;图 1A中C3,图 1B),而20 mmol/L的CySS则同样升高了其敏感性(P=0.016 < 0.05;图 1A中C4,图 1B)。说明同样浓度的CySS处理后,大肠杆菌对抗生素和H2O2的敏感性变化有所不同,很有可能胞内Cys库的细微波动都会对细菌的耐药性产生影响。
2.2 胱氨酸对大肠杆菌耐药性的影响未加抗生素的对照组中,当培养基中CySS浓度不超过1.0 mmol/L时,不影响大肠杆菌生长,CySS浓度为2.0 mmol/L时,大肠杆菌菌液浓度下降了14.4% (P < 0.01;图 2),这说明浓度较低的CySS ( < 1.0 mmol/L)自身并不影响大肠杆菌的生长。
|
| 图 2 胱氨酸对大肠杆菌MG1655生长情况的影响 Figure 2 Effect of cystine on the growth of E. coli strain MG1655 注:一直在硫酸盐(贫硫)培养基中生长的MG1655菌液,分别加入0.5、1.0、2.0 mmol/L CySS,5 min后分别加入不同浓度硫酸庆大霉素、诺氟沙星或氨苄青霉素. CN为硫酸庆大霉素处理组,浓度为0.5、1.0、2.0 μg/mL;Nor为诺氟沙星处理组,浓度为0.05、0.10、0.20 μg/mL;Amp为氨苄青霉素处理组,浓度为0.5、1.0、2.0 μg/mL. Note: Cyss (0.5, 1.0 or 2.0 mmol/L) was added in culture of MG1655 which growed in poor-sulfur (sulfate) media. After 5 min, gentamycin sulfate, norfloxacin or ampicillin with different concentration were added. CN: Gentamycin sulfate group (0.5, 1.0 or 2.0 μg/mL); Nor: Norfloxacin group (0.05, 0.10 or 0.20 μg/mL); Amp: Ampicillin group (0.5, 1.0 or 2.0 μg/mL). |
|
|
硫酸庆大霉素(CN)的抑菌作用受CySS影响不大,0.5 mmol/L CySS处理能够显著提高CN 2 μg/mL剂量组的细菌耐药性(P=0.033 63)。
诺氟沙星(Nor)的抑菌作用受CySS的影响具有极显著的统计学意义,0.5 mmol/L CySS处理后,细菌对0.1 μg/mL的Nor敏感性极显著增强(P=0.006 299),而1.0 mmol/L和2.0 mmol/L的CySS处理,极显著地提高了细菌对0.1 μg/mL的Nor的耐药性(P < 0.01)。
氨苄青霉素(Amp)的抑菌作用受CySS的影响同样极具统计学意义,但有效浓度与Nor有所区别。0.5 mmol/L CySS处理后,细菌对0.5 μg/mL的Amp耐药性极显著增强(P=0.002 905),2.0 mmol/LCySS处理更为显著地提高了细菌对0.5 μg/mL Amp的耐药性(增加了26.9%,P=0.000 142 1)。Amp浓度提高至2.0 μg/mL时,低浓度CySS也能够极显著地提高细菌对Amp的耐药性(与未处理的对照组相比,0.5 mmol/L CySS处理,P=0.000 167 7;1.0 mmol/L CySS处理,P=0.002 132;2.0 mmol/L CySS处理,P=0.002 838)。
2.3 半胱氨酸外排泵对大肠杆菌耐药性的影响 2.3.1 RNA-Seq分析及RT-qPCR验证采用RNA-Seq分析菌液中外加CySS的结果显示,Cys突然积累时,yhaOM被诱导了50–100倍(图 3A)。YhaO应是Cys的内向转运蛋白,YhaM是脱硫酶,能够把Cys降解为丙酮酸、氨盐和硫化物[15-16]。YdjN是大肠杆菌主要的CySS内向转运蛋白[10],处于过量CySS环境中,ydjN被下调了37倍。

|
| 图 3 胱氨酸内流的影响 Figure 3 Effect of cystine influx 注:A:CySS加入硫酸盐培养的细胞前和加入后5 min的RNA-Seq比对分析;B:目标基因alaE在CySS处理后的表达量RT-qPCR验证. Note: A: RNA-Seq analysis of cells before and 5 min after cystine addition to sulfate-grown cells; B: Gene expression of the target genes alaE were performed by RT-qPCR. |
|
|
RNA-Seq的结果显示,未知基因alaE的表达被上调了44倍,是yhaOM之外上调最为显著的基因(图 3A)。RT-qPCR的结果证实,CySS处理后,alaE的表达极显著上调(图 3B)。本实验室敲除了alaE基因,突变体具有胞内Cys库显著增大的两个表型:细胞变得极端的H2O2敏感,并且表现出短暂的ILe营养缺陷(未发表结果)。因此,AlaE应是大肠杆菌主要的外向转运蛋白。另一个功能未知的外向转运蛋白YjcB也被诱导了6倍(图 3),并且在alaE突变体中也被检测到具有较弱的Cys外排作用(未发表结果)。
DNA损伤对调节子各成员诱导的程度不同,recN是细菌SOS调节子最重要的成员,在本实验室CySS处理后的大肠杆菌细胞中这类受SOS调控的修复酶(recN)被诱导上调了8倍(图 3)。因此,微摩尔浓度水平的H2O2可能是自然条件下最主要的SOS系统激活因素。recN、sulA、umuCD等调控子成员(图 3),分别被上调了8、4和5倍,可温和地激活SOS系统调节子。此外,相关的调控基因还包括编码蛋氨酸硫氧化物还原酶(msrA,msrB)、周质防御系统(degP,cpxA,dsbB,ompF,skp)、受CysB调控的Cys合成途径(cysD,cysJ,cysL,cysP等)及受Fur调控的铁储存蛋白(ftn)、异分支酸合成酶(entC)和肠菌素的外向转运蛋白(entS)。RNA-Seq的结果证明了CySS内流对Fur、CysB和SOS均具有显著的调控作用(图 3)。
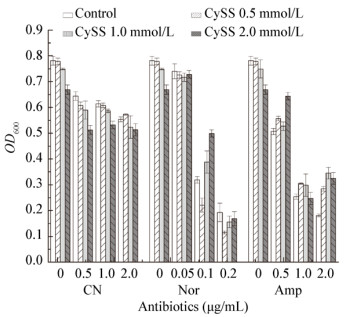
2.3.2 AlaE通过外向转运半胱氨酸实现对细胞的保护图 4结果显示,单独的CySS处理就可以引起大肠杆菌细胞浓度的降低,0.5 mmol/L的CySS使其降至94.3%,1.0 mmol/L和2.0 mmol/L的CySS使其分别降至79.8%和74.0%。单独用2.5 mmol/L的H2O2处理也有类似的效果,大肠杆菌的生长速率会降至75.1%。但贫硫环境中的大肠杆菌加入0.5 mmol/L的CySS为硫源,再用2.5 mmol/L的H2O2处理,生长速率极显著地降低为32.1%。1.0 mmol/L和2.0 mmol/L的CySS仅使H2O2处理的效果略微提高,大肠杆菌的浓度降至27.1%和27.9%。如图 4所示,无论是不同浓度的CySS处理还是H2O2处理,alaE缺失突变株的菌细胞数均高于野生型菌株(绝大多数浓度范围下表现出显著或极显著的差异),尤其是高浓度的CySS处理(1.0或2.0 mmol/L,P < 0.01,差异均为极显著),强烈暗示alaE的突变应对细胞具有一定的保护作用。
|
| 图 4 AlaE通过外向转运半胱氨酸实现对细胞的保护 Figure 4 AlaE protects cells by export of cysteine Note: Control: Blank; CySS1: 0.5 mmol/L CySS; CySS2: 1.0 mmol/L CySS; CySS3: 2.0 mmol/L CySS; H2O2: 2.5 mmol/L H2O2; H2O2+CySS1: 2.5 mmol/L H2O2+0.5 mmol/L CySS; H2O2+CySS2: 2.5 mmol/L H2O2+1.0 mmol/L CySS; H2O2+CySS3: 2.5 mmol/L H2O2+2.0 mmol/L CySS. *: P < 0.05, significantly different; **: P < 0.01, highly significantly different. |
|
|
硫醇外排的最大速率超过了所需Cys的30倍,显示了CySS的过量内向转运。CySS加入后,ydjN转录被抑制(图 3),随着细胞分裂,现存的YdjN被稀释,硫醇释放也相应逐步降低。
本研究发现,CySS的快速过量内向转运会被细胞快速纠正:被合成的Cys会被细胞直接泵出到胞外(图 5),且速度非常惊人。Cys进入并且离开胞质的速度是70 mmol/(L·min)。这一“进入-还原-泵出”循环消耗的ATP大约是细胞总能耗的10%,并且在此过程中由于CySS的还原作用消耗的NADPH与所有其他生物合成所需相同。因此Cys的外流应是针对过量内流这一问题极端耗费能量的修复过程[10]。

|
| 图 5 过量半胱氨酸的外流 Figure 5 Excessive flow of excess cysteine 注:A:中心散点图;B:箱式图. SO42– to CySS:硫源由SO42–变为CySS,硫酸盐中生长的细胞在加入CySS后会出现大量的Cys外流;LC-MS分析显示95%的硫醇信号来自Cys.余下为H2S. CySS:CySS中的持续生长抑制了CySS内向转运蛋白YdjN的表达,所以Cys外流显著降低. SO42–:持续在硫酸盐中生长的菌株既无Cys也无H2S释放. Note: A: Central scatter plot; B: box plot. SO42– to CySS: Cells grown in slufate released high amounts of cycteine after cystine is added. LC-MS analysis showed that 95% of the thiol signal represents cysteine, the remainder is sulfide. CySS: Continuous growth in cystine repressed expression of the cystine importer YdjN, so cysteine excretion is much lower. SO42–: Neither cysteine nor sulfide was released during constant growth on sulfate. |
|
|
为分析Cys外排泵AlaE调控胞内Cys浓度对大肠杆菌耐药性的影响,采用RNA-Seq分析得到的Cys外排泵AlaE的缺失突变菌株SSk226,分别采用单独抗生素Amp处理,以及抗生素与CySS协同处理,比较野生型菌株MG1655和SSk226的耐药性差异。
与图 4结果一致的是,Amp处理后,alaE突变株SSk226同样表现出对细胞损伤的保护作用,但此保护作用有一定的有效浓度范围(图 6)。当Amp浓度在1.0 μg/mL和2.5 μg/mL时,SSk226的细胞数均极显著高于野生型MG1655 (P=0.006 729和0.001 457),Amp达到5.0 μg/mL时,两菌株生长相近。Amp浓度更高时,alaE突变株甚至表现出受到更强的损伤(图 6A)。当Amp与CySS共同作用于大肠杆菌时,突变菌株与野生型的差异普遍增强,除Amp单独处理组和Amp与0.25 mmol/L CySS共同处理组为显著差异(P < 0.05),其他组均为极显著差异(图 6B,P < 0.01)。在同一Amp浓度下(1.0 μg/mL),0.25−0.5 mmol/L的CySS可增强alaE突变的细胞保护作用(图 6B)。

|
| 图 6 胱氨酸对野生型MG1655及alaE突变株SSk226耐药性的影响 Figure 6 Effect of cystine on the drug resistance of E. coli wildtype strain MG1655 and alaE mutant SSk226 Note:A: treatments with different concentration Amp; B: treatments with Amp plus CySS. Ctrl: blank; Amp alone: treated with 1.0 μg/mL Amp alone; Amp+CySS1: 0.25 mmol/L CySS+1.0 μg/mL Amp; Amp+CySS2: 0.5 mmol/L CySS+1.0 μg/mL Amp; Amp+CySS3: 1.0 mmol/L CySS+1.0 μg/mL Amp; Amp+CySS4: 2.0 mmol/L CySS+1.0 μg/mL Amp. |
|
|
氧化胁迫应是自然界生物体面临的最为常见的共同威胁。由于氧化抗性机制的不同,生物体可被清晰地分为需氧、微需氧或厌氧生物。迄今为止,我们对氧化物损伤细胞机制的理解并不清楚,生物体保护自身的防御机制尚未阐明[17]。
本实验的结果显示,在贫硫液体培养基中单独加入CySS对大肠杆菌的生长有轻微的抑制效果(较野生型相比生长速率降低至94.3%),并且抑制效果和CySS浓度呈正相关。当生长于贫硫环境中的大肠杆菌细胞先接触到0.5 mmol/L的CySS时,立即将其快速摄入并还原为Cys,若此时再用2.5 mmol/L的H2O2处理,生长速率极显著地降低为32.1%。但1.0 mmol/L和2.0 mmol/L的CySS仅使H2O2处理的效果略微提高至27.1%和27.9%。由此暗示,0.5 mmol/L的CySS能够引起大肠杆菌胞内的Cys库最为显著的提高。同时,也是在此浓度下,可以最大限度地增强其耐药性。随着CySS浓度的提高,这种效果越来越弱,在CySS浓度达到2.0 mmol/L时,表现为增强大肠杆菌对抗生素或H2O2的敏感型增强。抑菌圈法与液体培养的结果相类似,较低浓度(0.5 mmol/L)的CySS处理能够显著提高抗生素及H2O2的杀菌效果,而随着CySS浓度的提高,其对耐药性的增强效果越来越明显。
多年以来,很多实验室都已构建了可以大量生产氨基酸的工业菌种。当意外发现额外的氨基酸会被分泌到培养基中时,这一发现启发研究者开始探讨相应的外向转运系统。截至目前至少有6个转运蛋白已被报道能够外向转运Cys[12]。然而这些结果都是基于外向转运蛋白的过表达。所有情况下,转运蛋白结构基因的敲除并不影响Cys的外向转运。我们敲除了文献[12]中所有的这6个蛋白,不管是单独敲除还是组合敲除,都对外向转运的速率或者是胞内的Cys水平没有影响。为了解释这一问题,我们分析了外加CySS后细胞的RNA-Seq数据(图 3),并通过实验证实,外向转运蛋白AlaE能够在自然条件下将重要代谢物Cys运出胞外,并且极显著地影响了细菌对抗生素的敏感性(图 5)。
少量的CySS只能引起Cys库短时间的上升,造成有限的细胞损伤,从而利于耐药性的产生。随着CySS浓度升高,有更多的·OH持续产生,细胞损伤的程度超出了其自身的修复能力,也就导致了细胞的死亡。
因此,与之前本实验室的研究一致,H2O2的含量并不是细菌损伤的关键,关键在于H2O2的转化方向,即是否会继续生成·OH[18-19]。能够耐受高水平H2O2的菌株,是因为它们能够避免使H2O2持续生成·OH。本实验室通过在贫硫环境下控制细胞内Cys库的水平来控制内源H2O2的转化方向,结果显示低浓度的CySS确实有助于提高细菌的耐药性,该结果为细菌耐药性产生的机制提供了新的理论依据和研究方向。
| [1] |
Pang B, Du PC, Zhou ZM, et al. The transmission and antibiotic resistance variation in a multiple drug resistance clade of Vibrio cholerae circulating in multiple countries in Asia[J]. PLoS One, 2016, 11(3): e0149742. DOI:10.1371/journal.pone.0149742 |
| [2] |
Zhu Z, Cao MZ, Zhang JL, et al. Research progress on bacterial resistance[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(12): 3371-3376. (in Chinese) 朱阵, 曹明泽, 张吉丽, 等. 细菌耐药性研究进展[J]. 中国畜牧兽医, 2015, 42(12): 3371-3376. |
| [3] |
Park S, Imlay JA. High levels of intracellular cysteine promote oxidative DNA damage by driving the Fenton reaction[J]. Journal of Bacteriology, 2003, 185(6): 1942-1950. DOI:10.1128/JB.185.6.1942-1950.2003 |
| [4] |
Imlay JA, Linn S. Bimodal pattern of killing of DNA-repair-defective or anoxically grown Escherichia coli by hydrogen peroxide[J]. Journal of Bacteriology, 1986, 166(2): 519-527. DOI:10.1128/jb.166.2.519-527.1986 |
| [5] |
Kohanski MA, Dwyer DJ, Hayete B, et al. A common mechanism of cellular death induced by bactericidal antibiotics[J]. Cell, 2007, 130(5): 797-810. DOI:10.1016/j.cell.2007.06.049 |
| [6] |
Kohanski MA, Dwyer DJ, Collins JJ. How antibiotics kill bacteria: from targets to networks[J]. Nature Reviews Microbiology, 2010, 8(6): 423-435. DOI:10.1038/nrmicro2333 |
| [7] |
Becerra MC, Albesa I. Oxidative stress induced by ciprofloxacin in Staphylococcus aureus[J]. Biochemical and Biophysical Research Communications, 2002, 297(4): 1003-1007. DOI:10.1016/S0006-291X(02)02331-8 |
| [8] |
Ma LN, Mi HF, Xue YX, et al. The mechanism of ROS regulation of antibiotic resistance and antimicrobial lethality[J]. Hereditas (Beijing), 2016, 38(10): 902-909. (in Chinese) 马丽娜, 米宏霏, 薛云新, 等. ROS在细菌耐药及抗生素杀菌中的作用机制[J]. 遗传, 2016, 38(10): 902-909. |
| [9] |
Imlay JA. The molecular mechanisms and physiological consequences of oxidative stress: lessons from a model bacterium[J]. Nature Reviews Microbiology, 2013, 11(7): 443-454. DOI:10.1038/nrmicro3032 |
| [10] |
Wright GD. The antibiotic resistome: the nexus of chemical and genetic diversity[J]. Nature Reviews Microbiology, 2007, 5(3): 175-186. DOI:10.1038/nrmicro1614 |
| [11] |
Mortazavi A, Williams BA, McCue K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J]. Nature Methods, 2008, 5(7): 621-628. DOI:10.1038/nmeth.1226 |
| [12] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [13] |
Imlay KRC, Korshunov S, Imlay JA. Physiological roles and adverse effects of the two cystine importers of Escherichia coli[J]. Journal of Bacteriology, 2015, 197(23): 3629-3644. DOI:10.1128/JB.00277-15 |
| [14] |
Imlay JA, Fridovich I. Assay of metabolic superoxide production in Escherichia coli[J]. Journal of Biological Chemistry, 1991, 266(11): 6957-6965. |
| [15] |
Méndez J, Reimundo P, Pérez-Pascual D, et al. A novel cdsAB operon is involved in the uptake of L-cysteine and participates in the pathogenesis of Yersinia ruckeri[J]. Journal of Bacteriology, 2011, 193(4): 944-951. DOI:10.1128/JB.01058-10 |
| [16] |
Oguri T, Schneider B, Reitzer L. Cysteine catabolism and cysteine desulfhydrase (CdsH/STM0458) in Salmonella enterica serovar typhimurium[J]. Journal of Bacteriology, 2012, 194(16): 4366-4376. DOI:10.1128/JB.00729-12 |
| [17] |
Lobritz MA, Belenky P, Porter CBM, et al. Antibiotic efficacy is linked to bacterial cellular respiration[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(27): 8173-8180. DOI:10.1073/pnas.1509743112 |
| [18] |
Li X, Zhong YL, Feng YJ. Transformation of endogenous reactive oxygen species participates into bacterial antibiotic resistance[J]. Chinese Journal of Preventive Medicine, 2018, 52(4): 446-450. (in Chinese) 李欣, 钟永亮, 冯友军. 细菌耐药机制:内源活性氧分子的角色[J]. 中华预防医学杂志, 2018, 52(4): 446-450. DOI:10.3760/cma.j.issn.0253-9624.2018.04.022 |
| [19] |
Li X, Imlay JA. Improved measurements of scant hydrogen peroxide enable experiments that define its threshold of toxicity for Escherichia coli[J]. Free Radical Biology and Medicine, 2018, 120: 217-227. DOI:10.1016/j.freeradbiomed.2018.03.025 |
 2019, Vol. 46
2019, Vol. 46